一种DMD基因外显子拷贝数变异的检测方法及其应用与流程
一种dmd基因外显子拷贝数变异的检测方法及其应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种dmd基因外显子拷贝数变异的检测方法及其应用。
背景技术:
2.进行性肌营养不良(progressive muscular dystrophy)是一组以骨骼肌进行性无力萎缩为主要临床表现的异质性基因缺陷性疾病。可伴有中枢神经系统、心脏、骨骼、呼吸及胃肠道受累。不同类型起病时间、进展速度、受累范围、严重程度差异很大。杜氏肌营养不良症(duchenne muscular dystrophy,dmd),是最常见的进行性肌营养不良,新生男婴发病率为1/3500;贝氏肌营养不良症(becker muscular dystrophy,bmd),新生男婴发病率为1/30000。
3.dmd/bmd的致病基因为dmd基因,位于xp21.2,所编码的蛋白称为抗肌萎缩蛋白(dystrophin),分布于骨骼肌和心肌的细胞膜上,起支架作用,保护肌细胞膜在肌肉收缩时不受损伤。由于dmd基因缺陷,导致肌细胞膜上的抗肌萎缩蛋白功能异常,肌细胞受损伤,出现进行性坏死、萎缩等,临床出现肌无力的症状与体征。杜氏肌营养不良症(dmd)通常2~5岁发病,表现为运动发育轻度迟滞,骨骼肌进行性无力萎缩,影响肢体运动功能,逐渐出现步态异常、上肢活动受限,自然病程常在10岁左右丧失行走能力。此后出现脊柱侧弯、关节挛缩、呼吸肌无力、扩张性心肌病,20岁左右因呼吸衰竭、心功能衰竭死亡。查体可见双腓肠肌假肥大,同时可有双前臂及舌肌假肥大,gower’s征阳性,腰椎前凸等,约1/3患儿是智力低下。贝氏肌营养不良症(becker muscular dystrophy,bmd)发病较晚,症状较轻、进展缓慢,多在16岁之后靠轮椅生活,寿命可达40~50岁。因dmd基因功能未完全丧失,所以病情明显轻于杜氏肌营养不良症。可青年甚至成年起病,部分患者不影响生存期。假肥大体征明显,部分患者在肢体无力尚轻时,先出现明显的扩张性心肌病。
4.dmd基因是人类最大的基因之一,位于xp21,在基因组上跨越了2.5mb,基因包含79个外显子和78个内含子和8个启动子,其mrna序列全长1.4kb,主要要表达于骨骼肌、心肌,少量表达于脑组织。dmd基因突变形式多样,约60~70%的dmd/bmd患者是由于dmd基因的一个或多个外显子缺失突变而致病,约5
‑
10%为重复突变约,其余为微小突变(包括碱基的置换、小的缺失或插入、内含子突变、染色体重排等)。与缺失或重复突变不同,微小突变没有明显的分布热点,随机地分布于整个基因上。在dmd基因的致病性变异中,拷贝数变异的缺失或重复突变80%,是dmd/bmd的主要突变类型。
5.国际上,dmd/bmd最被认可的产品为mrc
‑
holland公司的多重连接探针扩增(multiple ligation
‑
dependent probeamplification,mlpa)检测技术。该方法可以快速同时鉴定几十个基因的缺失、插入和基因的拷贝数,目前已广泛应用于全世界900多个实验室,使用该技术发表的论文已近千篇。在dmd基因检测包含p034与p035探针组,检测dmd基因79个外显子与内参基因,以毛细管分析区分不同大小的片段长度,计算扩增产物片段所代表的dmd外显子pcr产物与内参基因pcr产物的丰度比率,判断dmd基因各外显子是否发生缺
失或重复,对dmd基因外显子的拷贝数进行半定量分析。但其检测方法繁琐,79个外显子需要两管与靶序列dna进行杂交、连接、pcr扩增,再进行两孔毛细管分析,需要两天的时间才能出结果。
6.有鉴于此,需要一种改良方法,以准确、专一并更快速的方式来检测一人类个体之dmd基因79个外显子拷贝数变异,确认大片段的缺失与重复突变,藉以决定该人类个体是否为杜氏/贝氏肌营养不良症患者、携带者或正常人。
技术实现要素:
7.本发明的目的在于针对上述问题,提供一种dmd基因外显子拷贝数变异的检测方法及其应用。
8.为实现前述发明目的,本发明采用如下技术方案:
9.一种dmd基因外显子拷贝数的pcr扩增反应检测方法:进行pcr扩增反应,同时扩增dmd基因79个外显子、内参基因与sry基因;其中用于扩增dmd基因79个外显子与内参基因的引物至少包含两种不同的引物;第一种引物黏合dmd基因79个外显子与内参基因的上游区域,同时第一种引物5’端含包含全部或部分的非人源性基因组序列引物seq id no.1;第二种引物黏合dmd基因79个外显子与内参基因的下游区域,同时第二种引物5’端包含全部或部分的非人源性基因组序列引物seq id no.2;其中用于扩增sry基因的引物至少包含两种不同的引物,第一种引物黏合sry基因的上游区域,第二种引物黏合sry基因的下游区域。
10.上述检测方法,所述内参基因选自gapdh、actb、hbb、cftr、hprt、rpp30或rpp40中的一种或几种。
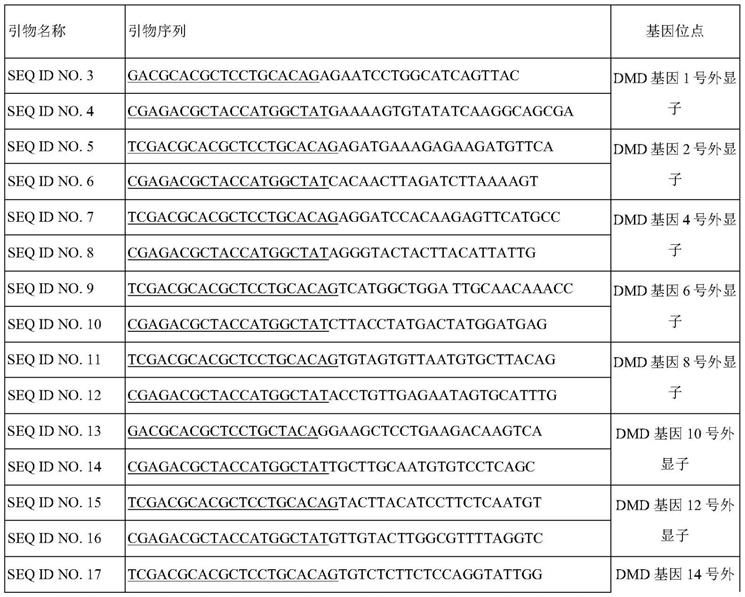
11.上述检测方法中用于扩增dmd基因79个外显子的引物包含如seq id no.3
‑
160所示序列。
12.上述检测方法中用于扩增sry基因的引物包含如seq id no.161
‑
162所示序列。
13.上述检测方法中在pcr扩增反应中,所述引物至少包含一种以上的荧光基团;所述荧光基团选自fam、vic、hex、joe、tmr、ned、pet、rox中的任意一种。
14.一种dmd基因拷贝数检测试剂盒,所述检测试剂盒,包括以下组分:dmd反应液、dmd引物混合液、dna聚合酶、dmd女性对照、dmd男性对照、dmd空白对照;
15.所述dmd引物混合液包括上述用于扩增dmd基因79个外显子与内参基因的引物和用于扩增sry基因的引物。
16.进一步的,所述dmd引物混合液包括引物seq id no.1/2seq id no.3
‑
160、seq id no.161/162、actb上/下游引物和hbb上/下游引物。
17.更进一步的,上述dmd引物混合液包括:dmd引物混合液1:引物seq id no.1
‑
84、seq id no.161/162、actb上/下游引物和hbb上/下游引物;dmd引物混合液2:引物seq id no.1/2、seq id no.85
‑
160、actb上/下游引物和hbb上/下游引物。
18.所述dmd反应液包括:终浓度1.5x的10x taq buffer;终浓度0.5mm的25mm mgcl2;终浓度0.5mm的datp/dttp/dgtp/dctp;终浓度2.0m的增强剂;所述增强剂包括甜菜碱、二甲基亚砜、甘油或乙二醇中的一种或多种。
19.上述检测试剂盒在检测dmd基因外显子拷贝数变异中的使用方法,包括以下步骤:
20.(1)处理样本;
21.(2)配制扩增试剂;
22.(3)pcr扩增与毛细管电泳仪分析;将dna待测样本进行pcr扩增反应产生的pcr产物,以毛细管电泳仪进行片段大小与丰度的分析;
23.(4)检测峰比值计算:反应程序结束后,对pcr扩增产物进行片段大小分析;待测样本与dmd女性对照的dmd基因79个外显子与两个内参基因的检测锋面积分别除以内参基因面积总合,再以待测样本除以dmd女性对照各位点对应的值,即为各位点的检测峰比值;
24.(5)结果判读:
25.(a)内参基因检测锋比值落于1.80
‑
2.38间;
26.dmd基因79个外显子检测峰比值:检测峰比值小于0.25,拷贝数0;检测峰比值0.25≤r<1.45,拷贝数1;检测峰比值1.45≤r<2.53,拷贝数2;检测峰比值2.53≤r<3.80,拷贝数3;
27.(b)检测型别判读:
28.若具有sry波锋,按男性样本判读型别:dmd外显子基因拷贝数0,男性样本为半合缺失型;dmd外显子基因拷贝数1,男性样本为正常型;dmd外显子基因拷贝数2,男性样本为半合重复型;
29.若无sry波锋,按女性样本判读型别:dmd外显子基因拷贝数1,女性样本为杂合缺失型;dmd外显子基因拷贝数2,女性样本为正常型;dmd外显子基因拷贝数3,女性样本为杂合重复型。
30.上述检测试剂盒在dmd基因检测中的应用。
31.表1.扩增组合物信息
32.33.34.35.[0036][0037]
其中画单线部分为非人源性基因组
[0038]
上述引物序列seq id no.1和seq id no.2如下:
[0039]
seq id no.1:tcgacgcacgctcctgcacag;
[0040]
seq id no.2:agcgagacgctaccatggctat;
[0041]
本发明的有益效果在于:
[0042]
(1)在检测时间方面,整个流程包含荧光pcr扩增、毛细管电泳片段分析,在4小时内可以出结果。本发明大幅缩短检测时间,检测技术流程简单,容易实现标准化。
[0043]
(2)在试剂性能方面,透过特殊的引物与pcr反应体系的设计,更可以达到以下更优越的性能表现:
[0044]
a:更全面的规格设计:一次pcr反应,搭配一孔毛细管电泳分析,检测dmd基因在1~79号外显子拷贝数,搭配男性性别决定基因sry基因判读型别,区分dmd基因外显子拷贝数正常、缺失突变和重复突变,并可提示小的缺失与突变,实现dmd正常人、携带者与患者的区分。
[0045]
b:更灵敏的检测结果:样本浓度低至15ng/ul,依旧能准确判读dmd基因外显子的拷贝数。
[0046]
c:合并两阶段扩增反应设计,增加扩增一致性,提供更准确的检测结果:在dmd基因79个外显子和内参基因的上下游引物5端设计非人源性基因组序列,包含两个阶段的pcr扩增反应。第一阶段扩增:第一种引物分别跟第二种引物扩增出5’端包含全部或部分非人源性基因组序列seq id no.1、3’端包含全部或部分非人源性基因组seq id no.2的dmd基因79个外显子和内参基因的扩增产物;第二阶段扩增:以第一阶段扩增出5’端包含全部或部分非人源性基因组序列seq id no.1、3’端包含全部或部分非人源性基因组seq id no.2的dmd基因79个外显子和内参基因的扩增产物为模板,以eq id nos 1和seq id no.2进行第二次扩增。以特殊的多重引物设计搭配非人源性基因组序列,解决多重pcr定量系统,扩增一致性问题,提高拷贝数相对定量的准确度。同时,pcr反应体系采用双基因内控,透过与dmd正常女性对照计算比值,可有效监控pcr扩增反应的效率。
[0047]
(3)dmd基因小的缺失与插入的突变提示:引物的设计涵盖dmd基因在1~79号外显子区域,透过毛细管电泳片段分析,当出现不符预期片段大小的扩增产物时,提示引物扩增区域内出现缺失或插入的罕见基因突变或基因多型性(polymorphism),可进一步搭配一代测序进行缺失或插入的序列确认。
[0048]
(4)用药指引:2016年9月19日,美国食品药品监督管理局(fda)批准了sarepta公司治疗杜氏肌营养不良症(dmd)患者的第一个药物exondys 51
tm
的加速上市申请。exondys 51
tm
适用于确认携带dmd基因第51号外显子跳跃突变的dmd患者,大概占所有dmd患者的13%,另外一个药物vyondys 53
tm
,也在fda获优先审批资格,vyondys 53
tm
适用于确认携带dmd基因第53号外显子跳跃突变的dmd患者,大概占所有dmd患者的8%,以上这些药物需要符合特定外显子缺失突变类型,才能选择合适的治疗药。故透过本发明的检测,可提供做为用药指引。
附图说明:
[0049]
图1为dmd男性正常个体电泳结果图,其根据本揭示内容实施例4绘示从男性正常个体提取之dna样品的分析结果。该分析结果呈现具sry检测锋,dmd基因外显子拷贝数皆为1拷贝,检测结果为正常型。
[0050]
图2为dmd女性正常个体结果图,其根据本揭示内容实施例4绘示从女性正常个体提取之dna样品的分析结果。该分析结果呈现无sry检测锋,dmd基因外显子拷贝数皆为2拷贝,检测结果为正常型。
[0051]
图3为dmd基因45
‑
47号外显子杂合缺失突变的携带者,其根据本揭示内容实施例4绘示从正常型杜氏/贝氏肌营养不良症携带者提取之dna样品的分析结果。该分析结果呈现无sry检测锋,dmd基因45
‑
47号外显子拷贝数皆为1拷贝,其余外显子为2拷贝,检测结果为45
‑
47号外显子杂合缺失型。
[0052]
图4为dmd基因45
‑
50号外显子半合缺失突变的患者,其根据本揭示内容实施例4绘示从正常型杜氏/贝氏肌营养不良症患者提取之dna样品的分析结果。该分析结果呈现无有sry检测锋,dmd基因45
‑
50号外显子拷贝数皆为0拷贝,其余外显子为1拷贝,检测结果为45
‑
50号外显子半合缺失型。
[0053]
图5为dmd基因2号外显子半合重复突变的患者,其根据本揭示内容实施例4绘示从正常型杜氏/贝氏肌营养不良症患者提取之dna样品的分析结果。该分析结果呈现无有sry检测锋,dmd基因2号外显子拷贝数皆为2拷贝,其余外显子为1拷贝,检测结果为2号外显子半合重复型。
具体实施方式:
[0054]
实施例1引物设计
[0055]
根据ncbi数据库,查找dmd基因79个外显子、sry、actb与hbb基因,设计特异引物。其中以sry基因作为男女样本判读,两个内参基因(actb与hbb)用于pcr效率的监控。
[0056]
dmd反应液与dmd引物混合液配制
[0057]
表2 dmd反应液组分配制表
[0058]
组分每反应终浓度10x taq buffer(thermo)1.5x25mm mgcl20.5mmdatp/dttp/dgtp/dctp各0.5mm甜菜碱2.0m
[0059]
表3 dmd引物混合液1组分配制表
[0060][0061][0062]
表3中seq id no.1和seq id no.161的5’端修饰fam荧光基团。
[0063]
表4 dmd引物混合液2组分配制表
[0064]
引物名称终浓度(μm)引物名称终浓度(μm)引物名称终浓度(μm)seq id no.13.00seq id no.1110.57seq id no.1390.50seq id no.23.00seq id no.1120.57seq id no.1400.50seq id no.850.47seq id no.1130.53seq id no.1410.57seq id no.860.47seq id no.1140.53seq id no.1420.57seq id no.870.33seq id no.1150.47seq id no.1430.47seq id no.880.33seq id no.1160.47seq id no.1440.47seq id no.890.40seq id no.1170.53seq id no.1450.40
seq id no.900.40seq id no.1180.53seq id no.1460.40seq id no.910.43seq id no.1190.60seq id no.1470.30seq id no.920.43seq id no.1200.60seq id no.1480.30seq id no.930.57seq id no.1210.73seq id no.1490.60seq id no.940.57seq id no.1220.73seq id no.1500.60seq id no.950.67seq id no.1230.40seq id no.1510.27seq id no.960.67seq id no.1240.40seq id no.1520.27seq id no.970.53seq id no.1250.37seq id no.1530.40seq id no.980.53seq id no.1260.37seq id no.1540.40seq id no.990.47seq id no.1270.50seq id no.1550.67seq id no.1000.47seq id no.1280.50seq id no.1560.67seq id no.1010.50seq id no.1290.47seq id no.1570.63seq id no.1020.50seq id no.1300.47seq id no.1580.63seq id no.1030.53seq id no.1310.47seq id no.1590.33seq id no.1040.53seq id no.1320.47seq id no.1600.33seq id no.1050.47seq id no.1330.57actb上游引物*0.48seq id no.1060.47seq id no.1340.57actb下游引物*0.48seq id no.1070.47seq id no.1350.37hbb上游引物*0.37seq id no.1080.47seq id no.1360.37hbb下游引物*0.37seq id no.1090.43seq id no.1370.40
ꢀꢀ
seq id no.1100.43seq id no.1380.40
ꢀꢀ
[0065]
表4中seq id no.1的5’端修饰ned荧光基团。
[0066]
上述dmd引物混合液1和2中,所述:
[0067]
actb上游引物序列:
[0068]
tgaccgtctgcgcctcgttccatgtacgttgctatccaggc,
[0069]
actb下游引物序列:
[0070]
tcgacgcacgctcctgctacagctcattgccaatggtgatgac,
[0071]
hbb上游引物序列:
[0072]
tgaccgtctgcgcctcgttcacacaactgtgttcactagc,
[0073]
hbb下游引物序列:
[0074]
tcgacgcacgctcctgctacatggtctccttaaacctgtcttg。
[0075]
其余引物序列见表1。
[0076]
实施例2 pcr扩增与结果分析
[0077]
1、样本处理:核酸提取仪(magcore)以及核酸提取试剂盒(magcore genomic dna wholeblood kit)提取人类基因组dna用于后续的pcr反应,dna浓度为2.5ng/ul~60ng/ul,od
260
nm/od
280
nm的比值在1.6
‑
2.0之间。
[0078]
2、扩增试剂配制:
[0079]
(1)从试剂盒取出dmd反应液、dmd引物混合液1和dmd引物混合液2,于室温解冻,上下颠倒混匀后,用微量离心机短暂离心,使所有液体沉降于管底。
[0080]
(2)扩增试剂配制:按下表5配制扩增试剂
[0081]
表5扩增试剂配制表
[0082]
扩增试剂1扩增试剂2每反应体积dmd反应液dmd反应液14.5μldmd引物混合液1dmd引物混合液23μldna聚合酶dna聚合酶0.5μl总体积总体积18μl
[0083]
为了减少分液误差,建议在配制扩增试剂时根据样本数量(n)分别取(n+1)份的反应液和混合酶。n=待测样本数+dmd空白对照1份+dmd女性对照1份。
[0084]
(3)在pcr反应管中分别加入18μl配制好的扩增试剂,转移到样本处理区加样。
[0085]
3、加样:在对应的含有18μl的扩增试剂的pcr反应管中分别加入2μl待测样本基因组dna、dmd女性对照及dmd空白对照,盖上pcr反应管盖后,短
[0086]
暂离心。
[0087]
4、pcr扩增与毛细管电泳仪分析:
[0088]
(1)将pcr反应管放入pcr仪设定反应程序(95℃/5min;95℃/30s,57℃/30s,72℃/1min,25cycles;72℃/30min;4℃/o/n),反应体积设定:20μl;
[0089]
(2)毛细管电泳分析pcr扩增产物:采用abi3130、abi3730、abi3500dx、或abi seqstudio geneticanalyzer毛细管基因分析仪进行检测,取1μl扩增产物1、1μl扩增产物2、10μl 1%genescan 500liz size standard(以10μl genescan 500liz size standard加990μlhi
‑
di formamide配制,即为1vol%genescan 500 liz size standard),95℃变性3分钟,立即放冰上2分钟,上机检测。
[0090]
5、软件分析:
[0091]
反应程序结束后,以genemapper软件对pcr扩增产物进行片段大小分析,分析所需的analysis method、panel与size standard文件可从网站下载,数据导入、分析参数设置和结果分析具体信息请参见genemapper用户手册。
[0092]
6、检测峰比值计算:待测样本与dmd女性对照的dmd基因79个外显子与两个内参基因的检测锋面积分别除以内参基因面积总和,再以待测样本除以dmd女性对照各位点对应的值,即为各位点的检测峰比值(r)。
[0093]
7、结果判读:
[0094]
(1)内参基因检测锋比值(r)落于1.80
‑
2.40间,dmd基因79个外显子检测峰比值按下表进行拷贝数判读
[0095]
拷贝数判读检测峰比值(r)范围0r≤0.2510.25≤r<1.4521.45≤r<2.5332.53≤r<3.80
[0096]
(2)若检测锋比值落于检测峰比值范围外,需要重新检测,检测结果按上表判读。
[0097]
(3)检测型别按下表判读,若具有sry波锋,按男性样本判读型别;若无sry波锋,按女性样本判读型别。
[0098][0099][0100]
(4)若引物扩增区域内出现缺失或插入的罕见基因突变或基因多型性(polymorphism),可并入检测峰比值计算,进行拷贝数判读,进一步的突变或基因多态性信息应结合临床症状采用测序或者其他检测方法确认。
[0101]
实施例3试剂性能验证
[0102]
1、评估本发明试剂的诊断准确度
[0103]
检测9份准确性参考品,如下表,分别检测高、中、低浓度,样本浓度分别为60ng/ul、25ng/ul、15ng/ul,各浓度进行三重复测试,检测三批试剂,dmd基因外显子拷贝数符合要求。
[0104]
表6准确性参考品dmd基因外显子突变类型
[0105][0106]
2、特异性参考品符合率
[0107]
检测4份缺失参考品,如下表,分别检测高、中、低浓度,样本浓度分别为60ng/ul、25ng/ul、15ng/ul,各浓度进行三重复测试,检测三批试剂,检测结果特异性符合率为100%。
[0108]
表7特异型参考品dmd基因外显子突变类型
[0109][0110]
3.重复性
[0111]
检测2份重复性参考品,各浓度进行十次重复检测,检测三批试剂,拷贝数判断皆正确,检测结果皆符合。
[0112]
表8重复性参考品dmd基因外显子突变类型
[0113][0114]
4、检测限
[0115]
检测13份检测限参考品,如下表,样本浓度分别稀释至20ng/μl、15ng/μl,各进行20次重复测试,检测三批试剂,检测结果重复数皆符合要求。
[0116]
表9检测限参考品dmd基因外显子突变类型
[0117][0118]
5、国家参考品检测
[0119]
检测一套46支国家参考品,符合试剂检测范围内的缺失、重复突变结果,如表10,检测结果符合国家参考品型别要求。
[0120]
表10
[0121]
[0122][0123]
实施例4
[0124]
1.收集150例edta抗凝全血样本,采用荷兰mrc
‑
holland公司研制的probemix p034和probemix p035作为参比方法,验证结果之间的一致性。
[0125]
2.收集edta抗凝全血样本采用核酸提取仪(magcore)以及核酸提取试剂盒(magcore genomic dna wholeblood kit)提取人类基因组dna,用微量分光亮度计检测dna的浓度与纯度,150例样本浓度为15ng/ul
‑
60ng/ul,od
260nm
/od
280nm
的比值在1.6
‑
2.0之间。
[0126]
3.按照实施例2的步骤,进行dna加样,以pcr仪进行反应,
[0127]
4.按实施例2的步骤,进行结果分析,结果如下表,皆符合dmd外显子拷贝数要求,其中dmd患者检测51例样本、dmd携带者检测22例样本、dmd正常个体检测77例样本,共检测150例样本(表11)。
[0128]
表11 150例样本检测结果
[0129]
[0130]
[0131]
[0132]
[0133][0134]
*mlpa:多重连结探针扩增法,其作为本揭示内容之正控制组。
[0135]
依据表10及1图到4图之结果,本发明可以精确测定人类个体dmd基因外显子的拷贝数,进而鉴定杜氏/贝氏肌营养不良症患者、杜氏/贝氏肌营养不良症携带者及正常个体应当理解的是,前述对实施方式的描述仅是以实施例的方式给出,且本领域所属技术领域中具有通常知识者可进行各种修改。以上说明书、实施例及实验结果提供本发明之例示性实施方式之结构与用途的完整描述。虽然上文实施方式中揭露了本发明的各种具体实施例,然其并非用以限定本发明,本发明所属技术领域中具有通常知识者,在不悖离本发明之原理与精神的情形下,当可对其进行各种更动与修饰,因此凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1