一种水稻育性调控基因GMS3及其突变体与应用的制作方法
一种水稻育性调控基因gms3及其突变体与应用
技术领域
1.本发明属于生物技术领域,具体地涉及一个植物育性调控基因gms3、gms3编码蛋白、gms3的辐射诱变和基因敲除突变体,以及gms3基因、蛋白和突变体在杂交育种中的应用。
背景技术:
2.杂交水稻是父母本杂交后获得的子一代,其产量往往比常规稻亲本提高15%以上,抗性和适应性也远胜于亲本。因此,应用和推广杂交水稻是提高水稻产量的一个重要途径。
3.雄性不育系是杂交水稻育制种技术的关键节点。雄性不育系是指雄配子发育异常而丧失生育能力,雌配子发育正常的植物株系。它只能作为母本接受父本的花粉,自交不能结实。目前杂交水稻生产上应用的雄性不育系有核质互作型和光温敏型两种。核质互作型雄性不育系的不育基因在细胞质中,细胞核中没有育性恢复基因。当细胞核中有育性恢复基因的恢复系与其配组杂交时可以生产可育的子一代杂交种,当细胞核中没有育性恢复基因而细胞质中也没有不育基因的保持系与其杂交时可以繁殖不育系种子。由于需要不育系、保持系和恢复系三系配套,这种杂交水稻育制种技术常被称为“三系法”。一些控制核质互作型不育及相应育性恢复的基因已经被克隆(chen and liu,2014,male sterility and fertility restoration in crops,annu rev plant biol,65:579-606)。核质互作型不育系是杂交水稻育制种中第一种大规模应用的不育系,为杂交水稻产业的建立和发展奠定了材料基础。然而由于核质互作型不育系的组配受到恢复系基因型的限制,导致只有约5%的种质资源能被利用。而细胞质的不育基因有导致米质差、特定病虫害流行的潜在风险。
4.光温敏型雄性不育系是一种育性受光温环境调控的不育系。在一定的光温条件下这种不育系保持不育,可用于组配杂交。当条件改变时不育系恢复育性,可用于不育系繁殖。由于光温敏雄性不育系实现了不育系和保持系的合二为一,只需要父本与其配组生产子一代杂交种,因此相应的育制种技术常被称为“两系法”。调控光温敏雄性不育的基因在细胞核中,目前已经克隆的基因包括pms3、tms5、csa和tms10(chen and liu,2014,male sterility and fertility restoration in crops,annu rev plant biol,65:579-606;zhou h,et al,2014,rnase zs1 processes ubl40 mrnas and controls thermosensitive genic male sterility in rice,nature communications,5:4884-4892)。与核质互作型不育系相比,光温敏型不育系繁殖程序简单,配组因恢复基因广泛存在而更自由。光温敏不育系的大规模应用极大地巩固和推动了杂交水稻产业发展。然而,由于该型不育系的育性受光温环境影响,也导致制种风险高,制种地域受到限制。
5.为了克服目前杂交水稻育制种技术中存在的关键性缺陷,创造和利用新类型的不育系将是重要的突破口。本发明提供了一种作物育性基因及基于该基因突变所产生的隐性核不育类型的雄性不育系。该不育系育性稳定,只受核编码的单基因调控,不受光温环境的影响。该不育系的育性恢复基因广泛存在于水稻种质资源中,也可以通过转野生型基因恢
复育性。该基因和该基因突变产生的不育系为研发水稻新型杂交育制种技术提供了元件,为解决现有技术存在的问题奠定了基础。
技术实现要素:
6.本发明提供一种育性相关基因及其核苷酸和蛋白序列,还包括通过操作该基因在调控植株雄性生育力中的应用。下文描述的任何方法都可与本发明所提供的相应核苷酸序列一起使用,例如,将所述育性基因的突变体序列引入植株以导致植株雄性不育、使植株内源序列突变、向植株中引入该序列的反义序列、使用发卡形式、或将其与其它核苷酸序列连接起来调控植株的表型,或者是本领域技术人员己知的可用于影响植株的雄性生育力的多种方法中的任一方法。
7.本发明第一个方面是提供一个花粉发育调控基因gms3。gms3位于水稻第3号染色体上,其在粳稻中的基因组核苷酸序列如seq id no:1所示,cds序列如seq id no:2所示,氨基酸序列如seq id no:3所示。在籼稻中其基因组核苷酸序列如seq id no:4所示,其cds和氨基酸序与粳稻相同。在山羊草(aegilops tauschii)中该育性基因的基因组核苷酸序列如seq id no:22所示,cds序列如seq id no:23所示,氨基酸序列如seq id no:24所示;在二穗短柄草(brachypodium distachyon)中该育性基因的基因组核苷酸序列如seq id no:25所示,cds序列如seq id no:26所示,氨基酸序列如seq id no:27所示;高粱(sorghum bicolor)中该育性基因的基因组核苷酸序列如seq id no:28所示,cds序列如seq id no:29所示,氨基酸序列如seq id no:30所示;玉米(zeamays)中该育性基因的基因组核苷酸序列如seq id no:31所示,cds序列如seq id no:32所示,氨基酸序列如seq id no:33所示;小米(setaria italica)中该育性基因的基因组核苷酸序列如seq id no:34所示,cds序列如seq id no:35所示,氨基酸序列如seq id no:36所示:图小麦(triticum aestivum)中该育性基因的基因组核苷酸序列如seq id no:37所示,cds序列如seq id no:38所示,氨基酸序列如seq id no:39所示;短药野生稻(oryza brachyantha)中该育性基因的基因组核苷酸序列如seq id no:40所示,cds序列如seq id no:41所示,氨基酸序列如seq id no:42所示;非洲栽培稻(oryza glaberrima)中该育性基因的基因组核苷酸序列如seq id no:43所示,cds序列如seq id no:44所示,氨基酸序列如seq id no:45所示。
8.上述所述育性基因,可从各种植物中分离获得。本领域技术人员应该知晓,本发明所述的育性恢复基因包括与gms3基因高度同源,并且具有同样的育性调控功能的高度同源的功能等价序列。所述高度同源的功能等价序列包括在严谨条件下能够与本发明所公开的gms3基因的核苷酸序列杂交的dna序列。本发明中所使用的“严谨条件”是公知的,包括诸如在含400mm nacl、40mm pipes(ph6.4)和l mm edta的杂交液中于60℃杂交12-16小时,然后在65℃下用含0.1%sds、和0.1
×
ssc的洗涤液洗涤15-60分钟。
9.功能等价序列还包括与本发明所公开的gms3基因所示的序列有至少85%、90%、95%、96%、97%、98%、或99%序列相似性,且具有育性调控功能的dna序列,可以从任何植物中分离获得。其中,序列相似性的百分比可以通过公知的生物信息学算法来获得,包括myers和miller算法(bioinformatics,4(1):1117,1988)、needleman-wunsch全局比对法(j mol biol,48(3):443-453,1970)、smith-waterman局部比对法(j mol biol,147:195-197,1981)、pearson和lipman相似性搜索法(pnas,85(8):2444-2448,1988)、karlin和altschul
的算法(altschul等,j mol biol,215(3):403-410,1990;pnas,90:5873-5877,1993)。这对于本领域技术人员来说是熟悉的。
10.基于本发明的上述发现,本发明一种具有调控植物雄性育性功能的dna片段,其序列为以下任一:
11.1)具有seq id no:1或2所示的核苷酸序列;
12.2)具有seq id no:4或2所示的核苷酸序列;
13.3)具有seq id no:22或23所示的核苷酸序列;
14.4)具有seq id no:25或26所示的核苷酸序列;
15.5)具有seq id no:28或29所示的核苷酸序列;
16.6)具有seq id no:31或32所示的核苷酸序列;
17.7)具有seq id no:34或35所示的核苷酸序列;
18.8)具有seq id no:37或38所示的核苷酸序列;
19.9)具有seq id no:40或41所示的核苷酸序列;
20.10)具有seq id no:43或44所示的核苷酸序列;
21.11)在严格条件下能够与(1)-(10)之任一序列的dna杂交的dna片段;或
22.12)与(1)-(11)之任一所述序列互补的dna片段;或
23.13)在(1)-(11)之任一所述序列的基础之上,经过一至数个碱基替换和/或一至数个碱基的插入和/或缺失以及大片段的核苷酸序列插入/缺失/易位/倒位所形成能够影响植物花粉生育能力的dna片段;或
24.14)与(1)-(11)之任一所述序列的dna片段具有85%、90%、92%、95%、96%、97%、98%、99%以上的同一性且编码水稻雄性育性相关蛋白的dna片段。
25.上述dna片段为gms3基因或其特异性片段。
26.本发明提供了所述dna片段编码的蛋白,为如下1)或2)所述的蛋白:
27.1)seq id no:3、24、27、30、33、36、39、42或45所示的氨基酸序列组成的蛋白;
28.2)将seq id no:3、24、27、30、33、36、39、42或45经过一个或若干个氨基酸残基的取代和/或缺失和/或添加且具有调控植物雄性育性活性的蛋白。
29.本发明提供一种生物材料,含有上述的dna序列,所述生物材料为表达盒,表达载体、工程菌、转基因植物或转基因细胞系。所述转基因细胞系为不能繁殖为植物的细胞系。
30.本发明所述的dna片段可以从任何植物中分离获得,包括但不限于芸苔属、玉米、小麦、高梁、短药野生稻、非洲栽培稻、短柄草属、两节荠属、白芥、草麻子、芝麻、棉籽、亚麻子、大豆、拟南芥属、菜豆属、花生、茵宿、燕麦、油菜籽、大麦、燕麦、黑麦(rye)、小米、蜀黍、小黑麦、单粒小麦、斯佩尔特小麦(spelt)、双粒小麦、亚麻、格兰马草(gramma grass)、摩擦禾、假蜀黍、羊茅、多年生麦草、甘廉、红莓苔子、番木瓜、香蕉、红花、油棕、香瓜、苹果、黄瓜、石角斗、剑兰、菊花、百合科、棉花、校、向日葵、芸苔、甜菜、咖啡、观赏植物和松类等。优选地,植物包括玉米、小米、拟南芥、二穗短柄草、大豆、红花、芥菜、小麦、大麦、黑麦、短药野生稻、非洲栽培稻、棉花和高粱。
31.本发明的第二方面是提供了通过影响gms3的核苷酸序列或者通过调控gms3基因的转录表达从而影响植株育性的方法。所述影响植株育性是指通过调控gms3基因的表达,从而使所述植株的育性发生改变,如导致植株雄性不育。具体地,取决于实际应用需求,可
以通过多种方法来影响gms3基因在植物体内的表达,从而达到调控植株雄性育性的效果。更具体地,调控gms3基因的表达可以使用许多本领域普通技术人员可获得的工具进行,例如,通过理化诱变、插入突变、基因打靶敲除、反义基因的转入、共抑制或发夹结构的引入等,都可以用于破坏gms3基因的正常表达,从而获得雄性不育的植株。另一方面,本发明还包括通过将野生型gms3的核苷酸序列引入植株来恢复gms3表达被破坏的植株的雄性生育力。
32.本发明的第三方面提供了一种dna分子,其含有所述dna片段,并在所述dna片段中插入、和/或缺失、和/或取代若干个核苷酸从而导致水稻雄性育性发生改变。
33.进而本发明提供一种gms3基因的不育突变体序列及其雄性不育突变体材料。所述雄性不育突变体材料是由核苷酸序列的突变所造成,含有该突变后核苷酸序列的植株表现为雄性不育,所述核苷酸序列如seq id no:1、2、4、22、23、25、26、28、29、31、32、34、35、37、38、40、41、43或44任一所示,所述的突变为点突变、dna缺失、插入或取代突变、反义基因的转入、共抑制或发夹结构的引入或通过基因沉默手段产生的突变。
34.具体地,所述雄性不育突变体材料是通过突变水稻内源的gms3基因,或突变与其高度同源的基因的核苷酸序列,使该植物体丧失雄性育性的过程。所述“突变”包括但不限于以下方法,如用物理或化学的方法导致的基因突变,所述突变可以是点突变,也可以是dna缺失或插入突变。突变还可以是通过rnai、crspr-cas9、人工核酸酶、定点突变等基因沉默手段产生。
35.在本发明的一个优选的实施方案中,所述的突变体材料为采用crispr-cas9方法,以序列gcctcctcgccttcgccgc(靶位点1)和/或序列cgctgtacgccgcctgcgg(靶位点2)为靶位点,使靶位点或靶位点及相邻核苷酸序列突变后得到的植物。
36.所述植物包括但不限于芸苔属、玉米、小麦、高梁、短药野生稻、非洲栽培稻、短柄草属、两节荠属、白芥、草麻子、芝麻、棉籽、亚麻子、大豆、拟南芥属、菜豆属、花生、茵宿、燕麦、油菜籽、大麦、燕麦、黑麦(rye)、小米、蜀黍、小黑麦、单粒小麦、斯佩尔特小麦(spelt)、双粒小麦、亚麻、格兰马草(gramma grass)、摩擦禾、假蜀黍、羊茅、多年生麦草、甘廉、红莓苔子、番木瓜、香蕉、红花、油棕、香瓜、苹果、黄瓜、石角斗、剑兰、菊花、百合科、棉花、校、向日葵、芸苔、甜菜、咖啡、观赏植物和松类等。优选地,包括玉米、小米、拟南芥、二穗短柄草、大豆、红花、芥菜、小麦、大麦、黑麦、短药野生稻、非洲栽培稻、棉花和高粱。
37.在本发明的优选实施例中,所述的突变体材料为水稻突变体材料,在水稻基因组所述靶位点1和靶位点2或靶位点及相邻区域内具有以下1)和/或2)中的1种或多种突变,如2种、3种、4种突变:
38.1)在靶位点1或靶位点1及相邻序列内发生了g碱基缺失突变,或g、t碱基插入突变,或从tcgccttcgccgccg到acggc或从g到c序列替换突变;
39.2)在靶位点2或靶位点2及相邻序列内发生了g、t或a碱基插入突变,或从ga到g或从gccgcctgcggaggcctccgccctggagg到ctt序列替换突变。
40.进一步,本发明提供了一种适用于crispr/cas9系统对植物gms3基因进行定向敲除的靶位点,其为gcctcctcgccttcgccgc(靶位点1)和/或序列cgctgtacgccgcctgcgg(靶位点2)。
41.本发明还提供了一种特异性靶向上述靶位点1或靶位点2的sgrna。
42.含有上述sgrna的dna序列的crispr/cas9打靶载体属于本发明的保护范围。
43.更具体地,本发明提供了一种水稻雄性不育突变体,其在3号染色体上含有一个3867745个碱基序列的倒位片段。该倒位造成两端的核苷酸序列发生重组,其中一端的重组位于bgiosga010102基因内部,所述的两端重组位点的侧翼核苷酸序列如seq id no:5和seq id no:6所示。重组后的水稻雄性不育基因的基因组核苷酸序列如seq id no:64所示,cds序列如seq id no:65所示,氨基酸序列如seq id no:66所示。对野生型和突变体序列进行比对发现,在第3号染色体的第26091933位碱基到第29959677位碱基的序列发生倒位,造成位于第29958173位碱基到第29960719位碱基的bgiosga010102基因发生撕裂并重组,使bgiosga010102基因的转录框改变。本领域技术人员应该知晓,可以将所述倒位片段通过杂交或回交的方法导入受体植物中,从而获得新的雄性不育突变体材料。
44.本发明提供了gms3基因或其编码蛋白或含有其的生物材料或其突变体材料在调控植物雄性育性活性中的应用。所述生物材料为含有gms3基因的表达盒、表达载体、工程菌、转基因植物或转基因细胞系,所述转基因细胞系不能繁殖为植物品种。
45.其中所述gms3基因用于恢复作物植株雄性不育,以便导入外源基因以获得优质的转基因作物。
46.提供上述gms3基因用于转基因改良作物的用途。
47.所述改良包括产量提高、品质提高、抗病虫害、抗逆、抗倒伏等生长性状的改良。
48.在另一具体实施方案中,所述作物是自花授粉或异花授粉作物。
49.在一个更加具体的实施方案中,所述作物包括但不限于玉米、小麦、高梁、小米、水稻。
50.本发明还提供了所述的gms3基因或其编码蛋白或含有其的生物材料或dna分子或上述任一种突变体材料在转育带有纯合gms3突变基因的隐性核不育系中的应用。
51.本发明还提供了一种在其它植物中获取gms3基因的直系同源基因的方法,以及利用该方法获得高粱、小米、短柄草、水稻同源gms3的氨基酸序列。
52.本发明提供了一种在其它植物中获取gms3基因的直系同源基因的方法包括:
53.1)使用前述gms3基因的dna片段在核苷酸数据库中进行blastx搜索;
54.2)所有identities大于或等于35%、positives大于或等于50%即为与所述dna片段直系同源的基因片段。
55.本发明提供了一种用于检测gms3基因突变体材料的分子标记,通过核苷酸序列如seq id no:7-9所述的引物扩增得到。
56.用seq id no:7-9所示引物扩增待测水稻基因组dna时,若只能扩增出167bp一条带,则待测水稻为gms3基因突变体。
57.含有核苷酸序列如seq id no:7-9所述的引物的检测试剂或试剂盒属于本发明的保护范围。
58.进一步本发明提供了上述分子标记或上述检测试剂或试剂盒在检测水稻gms3基因突变体中的应用。
59.本发明提供了上述分子标记或上述检测试剂或试剂盒在筛选或培育雄性不育水稻突变体中的应用。
60.与现有技术相比,本发明具有如下有益效果:本发明提供的基因gms3直接参与花
粉发育调控,该基因被敲除或表达受到抑制后,花粉完全不育。gms3不育突变体与现有三系和两系不育系相比不育性状稳定,不受环境条件影响。通过植物生物技术途径,本发明在农作物的杂种优势利用和不育化杂交种制种生产中都将发挥重要作用。
附图说明
61.图1灌浆期野生型(左)和gms3突变体(右)的植株形态。
62.图2野生型(左)和gms3突变体(右)的去掉外颖小穗形态。
63.图3野生型(左)和gms3突变体(右)的花药形态。
64.图4 gms3突变体花粉碘染。
65.图5野生型花粉碘染。
66.图6为gms3基因图位克隆图。
67.图7染色体倒位引起gms3基因撕裂重组示意图。
68.图8 gms3基因核苷酸序列在9311(9311-01)、zh11(zh11-02)、日本晴(rbq-03)间的序列差异。有差异的地方用黑色背景突出。每行最后一个碱基在整个序列中的位置标示在行末。
69.图9 gms3杂合株后代基因型鉴定。上带大小253bp,下带大小167bp。
70.图10 gms3在水稻不同组织中的表达量。
71.图11 pc9m-gms3载体示意图。t1代表靶位点1,t2代表靶位点2。
72.图12转基因植株pc9m-1199-1在靶位点1处的测序峰图。箭头指向碱基替换位点。
73.图13转基因植株pc9m-1199-2在靶位点2处的测序峰图。箭头指向碱基插入位点。
74.图14 gms3野生型(左)、敲除植株pc9m-1199-1(右)的植株形态。
75.图15 gms3野生型(左)、敲除植株pc9m-1199-1(右)的小穗形态。
76.图16 gms3野生型(左)、敲除植株pc9m-1199-1(右)的去掉外颖的小穗形态。
77.图17 gms3野生型(左)、敲除植株pc9m-1199-1(右)的花粉碘染图。
78.图18 pc1300-1199-p2k-cds-t500载体示意图。
79.图19 gms3突变植株(左)和互补植株(右)的植株形态。
80.图20水稻gms3基因编码蛋白与其他物种基因组中的同源蛋白的序列比对图。山羊草(aegilops tauschii)蛋白、二穗短柄草(brachypodium distachyon)蛋白、高粱(sorghum bicolor)蛋白、玉米(zea mays)蛋白、小米(setaria italica)蛋白、短药野生稻(oryza brachyantha)蛋白、非洲栽培稻(oryza glaberrima)蛋白。
具体实施方式
81.以下的实施例便于更好地理解本发明,但并不限定本发明的应用范围。下述实施例中的所有技术和科学术语,如无特殊说明,均为本发明所属领域普通技术人员通常所理解的相同含义。除非有相反指明,本发明所使用或提及的技术均为本领域普通技术人员公认的标准技术。所述试验材料,如无特别注明,均为本发明领域通用的试验材料。下述实施例中所用的试验试剂,如无特殊说明,均为自常规生化试剂商店购买得到的。
82.本发明所述的雄性不育,特指由植物细胞核基因发生功能变化导致植物雄性生殖器官发育出现异常(无法产生正常雄蕊、花药或者正常的雄性配子体)并出现育性的丧失,
即通常所说的雄性核不育(genic male sterility)而非细胞质核不育(cytoplasmic male sterility)。雄性生殖器官育性的异常和恢复均由细胞核内的基因加以控制。
83.因此,本发明也包括利用序列表所述序列调控植株的雄配子生育能力,即利用本发明提供的基因序列在基因组、和/或转录组、和/或蛋白质组水平影响其它植物中相同或同源基因的功能从而达到控制雄性生殖器官育性的目的。例如,下述方法但不限于下述方法:通过天然序列的变异导致基因表达抑制或蛋白质功能的丧失、通过向植物中转入所述基因的反义序列或引入发卡结构、或将所述基因与其它序列(dna或rna)相结合产生新的具有功能活性的dna或rna链,来影响或改变植物基因的功能。或其它本领域技术人员己知的可用于影响植物雄花育性的技术方法中的任何一种技术方法。
84.本发明包括水稻gms3基因,其显性等位基因对植物雄花育性具有关键作用,功能缺失性的隐性等位基因会导致雄性不育。该基因位于水稻3号染色体,其基因具体位置如图6、图7所示。
85.该基因序列及其同源序列可从各种植物中获得,包括但不限于山羊草(aegilops tauschii)、卷柏(selaginella moellendorffii)、毛果杨(populus trichocarpa)、芜菁(brassica rapa)、琴叶拟南芥(arabidopsis lyrata)、拟南芥(arabidopsis thaliana)、大豆(glycine max)、茄属马铃薯(solanum tuberosum)、葡萄(vitis vinifera)、图小麦(triticum aestivum)、小果野芭蕉(musa acuminata)、小米(setaria italica)、高粱(sorghum bicolor)、玉米(zea mays)、二穗短柄草(brachypodium distachyon)、大麦(hordeum vulgare)、短药野生稻(oryza brachyantha)、非洲栽培稻(oryza glaberrima)、籼稻(oryza sativa indica group)、粳稻(oryza sativa japonica group)、小立碗藓(physcomitrella patens)等。获得方法包括但不限于:通过水稻gms3基因序列利用blastx、blastn或通过氨基酸序列利用blastp从其它植物的基因组序列数据库、和/或cdna序列数据库、和/或蛋白质序列数据库中调取;以水稻gms3基因的dna或cdna或rna序列为参考序列设计引物,从其它植物的基因组dna或cdna或rna中利用pcr的方法直接获得:以水稻gms3的基因序列设计探针,利用核酸杂交的方法从基因组文库中分离含有同源基因序列的dna或cdna或rna片段。
86.gms3基因同源序列指在与seq id no:3的氨基酸序列进行blastx比较分析后,identities大于或等于35%、positives大于或等于50%的植物基因的dna序列。进行blastx时,所有参数均遵照http://blast.ncbi.nlm.nih.gov/所示的默认设置进行。
87.下文通过说明和阐述提供了更为详细的描述,但这并非意欲对本发明的范围加以限制。
88.实施例1水稻雄性不育突变体gms3的筛选
89.将10千克籼稻93-11干种子送至湖南省农业科学院用钴60进行辐射,辐射总剂量为250伦琴(gy),得到m0代并种植于临高新盈基地,成熟后分单株收种,共获得m1代材料约6000份。将种子数超过100粒的m1代材料种植成株系,共计3500份,每个株系种50个单株。分别在分蘖期、孕穗期、抽穗期、开花期、灌浆期筛选株型、穗型、育性、产量等各种类型突变体,并收种保存。其中一个突变体1199表现为雄性不育,被命名为gms3。
90.实施例2水稻雄性不育突变体gms3的表型分析
91.与野生型相比,gms3突变体植株(图1)和小穗(图2)形态正常,花期稍迟。体式显微
镜下观察突变体小花形态,发现gms3的花药比野生型瘦小,颜色较浅(图3)。用碘-碘化钾溶液(0.6%ki,0.3%i2,w/w)溶液对花粉进行染色,突变体花粉粒小、少、不规则并且不能被染色(图4),而野生型花粉粒大而圆并且被染成蓝黑色(图5)。同一家系野生型植株套袋自交后正常结实,而gms3突变体不结实。而以水稻品种93-11为父本给gms3突变体授粉则可以结实。这表明该突变体为雄性不育突变体。
92.实施例3水稻雄性不育突变体gms3的遗传分析
93.在m4代种植gms3的分离群体1321株,其中996株育性正常,325株不育,可育与不育株分离比符合3:1(χ2=0.08,p《0.05)。用gms3与明恢63杂交,f1代植株全部可育。在f3代种植gms3的分离群体861株,其中631株育性正常,230株不育,可育与不育株分离比符合3:1(χ2=1.06,p《0.05)。上述结果表明gms3的不育性状是由隐性单基因控制。
94.实施例4水稻雄性不育基因gms3的克隆
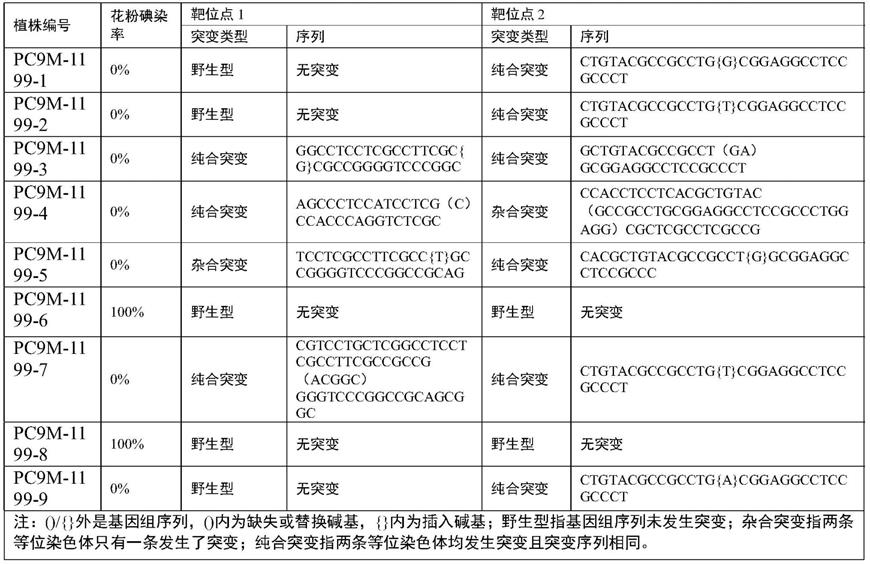
95.使用图位克隆的方法对gms3基因进行定位。以zh11为父本与gms3突变体杂交构建了一个包含623个单株的bc2f2群体。利用该群体将gms3定位于3号染色体的两个in/del标记3.1830和3.2725之间,且与3.2513标记共分离。gms3基因与上述三个标记之间的交换单株分别为17个,0个,25个(图6)。利用共分离标记挑选bc2f2群体中的gms3杂合单株,发展了另一个包含1321个单株的bc2f3群体。使用位于3.1830与3.2725标记间的6个indel标记3.2245、3.235、3.240、3.245、3.250、3.255检测bc2f3群体,分别检测到2个,0个,0个,0个,0个,0个交换单株。分析和比较93-11和日本晴基因组在3.2245与3.235之间和3.255与3.2725之间的序列,分别开发新的indel标记3.2239、3.2245、3.2249及3.2611、3.2615、3.2624、3.2631。用这些标记检测bc2f3群体,分别检测到3个,0个,0个;及0个,1个,6个,19个交换单株(图6)。综上,推测突变体在3.2245到3.2615标记间存在染色体倒置。随后利用染色体步移方法,在3.2611与3.2615间设计均分布的引物组合,分别扩增93-11和gms3突变体,结果显示引物组合f1510/r1810无法在gms3突变体中扩增出pcr产物,而在野生型93-11中能扩增出一段300bp的核苷酸序列,表明倒置位点极有可能在此区间内。参考93-11基因组的列,在f1510上游设计一组热不对称pcr引物,分离gms3突变体在f1510处的侧翼dna序列。
96.用于扩增f1处的侧翼序列引物对序列见下表1:
97.表1用于扩增f1处的侧翼序列引物对序列
98.引物对名称引物序列1199sp1_fggtcgattttgattcctttctctggatgt1199sp2_facgatggactccagtct agctgatcttgtggttattgctcgaag1199sp3_fccagcaacgtatagatctatagtggtgt1199ac1_racgatggactccagag1199lad1_racgatggactccagagcggccgcvnnnggaa1199lad2_racgatggactccagagcggccgcvvnvnnnccaa
99.pcr反应体系为:1μl 10
×
反应缓冲液,0.25μl dntp,0.25μl正向引物和0.25μl反向引物,0.5u taq酶,1μl 10ng/μl模板dna,加超纯水将总体积补至10μl。pcr反应分三步进行:第一步使用引物对1199sp1_f和1199ac1_r,模板dna为gms3基因组dna,反应程序为:93℃预热2min,95℃变性1min,然后执行以下循环:94℃变性30s,60℃复性1min,72℃延伸
3min,10个循环;接着94℃变性30s,20℃复性2min,72℃延伸3min,再执行以下循环:94℃变性20s,58℃复性1min,72℃延伸3min,25个循环;循环结束后72℃补充延伸5min,结束反应。第二步使用引物对1199sp2_f和1199ad1_r,模板dna为反应1产物40倍稀释液,反应程序为:执行以下循环94℃变性20s,65℃复性1min,72℃延伸3min,1个循环,然后再执行以下循环:94℃变性20s,68℃复性1min,72℃延伸3min,94℃变性20s,68℃复性1min,72℃延伸3min,94℃变性20s,50℃复性1min,72℃延伸3min,13个循环;循环结束后72℃补充延伸5min,结束反应。第三步使用引物对1199sp3_f和1199ad2_r,模板dna为反应1产物10倍稀释液,反应程序为:94℃变性20s,68℃复性1min,72℃延伸3min,94℃变性20s,68℃复性1min,72℃延伸3min,94℃变性20s,50℃复性1min,72℃延伸3min,6-7个循环;循环结束后72℃补充延伸5min,结束反应。配置1.5%琼脂糖凝胶,在5v/cm电场下电泳30min;采用市面dna凝胶回收试剂盒回收反应2和反应3的pcr产物。
100.将回收所得的反应2和反应3的pcr产物dna采用abi3730测序仪进行测序,测序引物分别使用正向引物与反向引物。使用常见dna序列分析软件dnaman6.0对双向测序结果进行拼接;拼接后的序列在ncbi中应用blastn比对水稻基因组序列,gms3突变体在第3号染色体第26091933位碱基到第29959677位碱基的序列发生倒位,造成位于第29958173位碱基到第29960719位碱基的bgiosga010102基因发生撕裂并重组,导致bgiosga010102基因的转录框改变(图7)。该倒置点两边的侧翼核苷酸序列如seq id no.5和seq id no.6所示。
101.参考水稻基因组版本asm465v1序列设计引物对loc_os03g46110基因在93-11、zh11、rbq中的等位基因进行扩增和测序,引物序列如表2所示。所有pcr扩增均使用kod fx dna polymerase(toyobo co.,ltd.life science department,osaka,japan),并按照产品说明的反应体系和条件,在thermo scientific arktik thermal cycler上进行pcr扩增。pcr产物送往南京金斯瑞生物科技有限公司进行测序。测序结果用dnaman 6.0进行拼接。93-11、zh11、rbq中的loc_os03g46110基因分别记为9311-01(序列如seq id no:4),zh11-02,rbq-03(序列如seq id no:1)。
102.表2用于扩增loc_os03g46110的引物对序列
103.引物对名称正向引物反向引物loc_os03g46110_1tgcgaggtcggctgctaagatcagatgccccaaattcataloc_os03g46110_2catggctgtggcccctttgctcgtttctttcctatgccttttccloc_os03g46110_3gagggaaaaggcataggaaaaggtatgcaaatcaacaagcloc_os03g46110_4atactatggcttttgggatgaaatagtggatgaagtcgttgcloc_os03g46110_5ggcagcaacaactgaccttttcacaagaaagcaacatctcaagtcaloc_os03g46110_6aatctttggcagagcatgggagtttaagggttggttc
104.对9311-01、zh11-02和rbq-03进行多序列比对,结果如图8所示。9311-01与zh11-02和rbq-03除在第1个内含子上存在一段位于第397位碱基处的(ct)
19
缺失和位于第820位碱基的g-a的替换外,编码区序列完全一致。这表明loc_os03g46110基因在水稻中高度保守,其核苷酸序列即使在籼、粳亚种间也只在非编码区存在两处碱基的差异,而蛋白质序列则没有差异。在93-11中loc_os03g46110的cds核苷酸序列如seq id no:2所示,编码蛋白序列如seq id no:3。
105.基于gms3突变位点的测序结果,设计3条基因特异引物:正向引物1199_f1,其核苷
酸序列如seq id no.7所示;反向引物1199_r1,其核苷酸序列如seq idno.8和1199_r2,其核苷酸序列如seq id no.9所示。其中1199_r1位于倒置片段上。当用1199_f1、1199_r1和1199_r2组合扩增野生型基因组时产生253bp条带,扩增突变型基因组时产生167bp条带。使用1199_f1、1199_r1和1199_r2组合对24株gms3的m3分离群体进行基因型检测。如图11所示,野生型要么扩增出167bp和253bp两条带,要么扩增出253bp一条带,而不育突变体均只能扩增出167bp一条带(图9)。这说明突变基因型与不育表型共分离,loc_os03g46110就是gms3基因。
106.实施例5 gms3基因的表达分析
107.取93-11各时期组织提取总rna,反转录成cdna。根据gms3的基因组和编码区核苷酸序列设计跨内含子的引物1199_rtf:gttgccatcaccctcatc(seq id no:10)和1199_rtr:aaaatactgcgaacgaat(seq id no:11),同时以水稻gadph基因作为内参对照设计引物gadph-acf1:gaatggctttccgtgtt(seq id no:12)和gapdh-acr1:caaggtcctcctcaacg(seq id no:13)。采取实时定量pcr方法进行表达量分析。如图10所示,gms3基因在水稻的根、茎、叶和种子中几乎不表达,而在花器官中高表达。在一期到八期幼穗中,gms3的表达量逐渐升高,然后在九期幼穗中直线下降。
108.实施例6gms3基因敲除株系的获得及表型分析
109.利用crispr/cas9系统对gms3基因进行定向敲除。为了提高敲除效率,选择两个靶位点同时进行敲除。靶位点1位于第一外显子的正链上,序列为gcctcctcgccttcgccgc(seq id no:1序列的第132位至第150位),靶位点2位于第二外显子的负链上,序列为cgctgtacgccgcctgcgg(seq id no:1序列的第399位至第417位)。根据ma等(ma x,et al.a robust crispr/cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants.mol plant,2015,8:1274-84)的方法将靶位点1和靶位点2连入载体pc9m中,获得载体pc9m-gms3(图11)。有pc9m-gms3的大肠杆菌被命名为e.coli-pc9m-gms3。将pc9m-gms3通过电击转人农杆菌菌株eh105中,得到的菌株命名为ab-pc9m-gms3。
110.利用重组农杆菌ab-pc9m-gms3侵染粳稻中花11愈伤组织,经潮霉素抗性筛选、分化、生根获得再生转基因株系40株。提取上述植株叶片的总dna,利用引物sp1:cttagccagacgagcgggttc(seq id no:14)和sp2:gcttctgcgggcgatttgt(seq id no:15)做阳性检测,共鉴定出转基因阳性植株31株。随机选取7株阳性株,用靶位点1两侧的引物靶1-f:ccctagagtaggaagcg(seq id no:16)和靶1-r:cagaagagcgagacctg(seq id no:17)以及靶位点2两侧的引物靶2-f:ccacccaggtctcgctct(seq id no:18)和靶2-r:cgcacgtaaacactgaaccac(seq id no:19)。扩增基因组dna,扩增产物测序后与基因组进行比对。结果显示7株阳性株的基因组dna至少在靶位点1和靶位点2中的一处两条等位染色体均发生了突变(表3)。例如植株pc9m-1199-7在靶位点1处发生了tcgccttcgccgccg到acggc的序列替换(图12)。植株pc9m-1199-1在靶位点2处发生了g碱基插入的纯合突变(图13)。发生在靶位点1或靶位点1及相邻序列内的突变还包括g碱基缺失突变,或g、t碱基插入突变,或从tcgccttcgccgccg到acggc或从g到c序列替换突变(表3)。发生在靶位点2或靶位点2及相邻序列内的突变还包括g、t或a碱基插入突变,或从ga到g或从gccgcctgcggaggcctccgccctggagg到ctt序列替换突变。
111.开花后对上述8株阳性株进行表型分析。与野生型zh11相比,gms3敲除植株pc9m-1199-1在株叶(图14)和小穗形态(图15)上并无明显差别。但gms3敲除植株的花药明显更加瘦小(图16)。花粉碘染结果表明,野生型zh11的花粉大而圆,可以被染色,而gms3敲除植株的花粉小而皱缩,不能被染色(表3和图17)。gms3敲除植株的表型与gms3突变体的表型一致。
112.表3利用crispr/cas9系统对gms3进行基因敲除后靶位点序列分析
[0113][0114]
实施例7gms3突变体转基因互补株系的获得及表型分析
[0115]
以9311的基因组dna为模板,用引物3900hb-f:cgcgtttcgaaattttccaggaattccgtt(seq id no:20)和3900hb-r:gtcgcgatcgcatgctgcagagttcacccagaatt(seq id no:21)扩增获得带有gms3起始密码子atg上游2000bp和终止密码子tag下游500bp的基因全长片段。将该片连入pc1300获得质粒pc1300-1199-p2k-cds-t500(图18)。有pc1300-1199-p2k-cds-t500的大肠杆菌被命名为e.coli-pc2300-870-genome。将pc1300-1199-p2k-cds-t500通过电击转人农杆菌菌株eh105中,得到的菌株命名为ab-pc1300-1199-p2k-cds-t500。利用重组农杆菌ab-pc1300-1199-p2k-cds-t500侵染gms3突变体愈伤组织,经抗性筛选、分化、生根共获得转基因阳性植株25株,均使gms3突变体的育性恢复正常(图19)。这进一步证明gms3基因调控花粉发育,该基因突变会导致花粉败育。
[0116]
实施例8gms3基因编码蛋白与植物基因组中预测同源蛋白的序列比对
[0117]
利用blastx工具在ncbi的genbank数据库中对水稻gms3基因编码蛋白的氨基酸序列进行同源性搜索,得到了山羊草(aegilops tauschii)、二穗短柄草(brachypodium distachyon)、高粱(sorghum bicolor)、玉米(zea mays)、小米(setaria italica)、短药野生稻(oryza brachyantha)、非洲栽培稻(oryza glaberrima)基因组中预测的同源蛋白,将这些蛋白序列进行比对分析,结果显示来自不同植物的同源蛋白都具有非常相似的保守序列,彼此之间同源性很高(图20),表明该蛋白在植物花的雄性器官发育过程中生物学功能
保守,起着非常重要的作用。
[0118]
在山羊草(aegilops tauschii)中该育性基因的基因组核苷酸序列如seq id no:22所示,cds序列如seq id no:23所示,氨基酸序列如seq id no:24所示;在二穗短柄草(brachypodium distachyon)中该育性基因的基因组核苷酸序列如seq id no:25所示,cds序列如seq id no:26所示,氨基酸序列如seq id no:27所示;高粱(sorghum bicolor)中该育性基因的基因组核苷酸序列如seq id no:28所示,cds序列如seq id no:29所示,氨基酸序列如seq id no:30所示;玉米(zea mays)中该育性基因的基因组核苷酸序列如seq id no:31所示,cds序列如seq id no:32所示,氨基酸序列如seq id no:33所示;小米(setaria italica)中该育性基因的基因组核苷酸序列如seq id no:34所示,cds序列如seq id no:35所示,氨基酸序列如seq id no:36所示:图小麦(triticum aestivum)中该育性基因的基因组核苷酸序列如seq id no:37所示,cds序列如seq id no:38所示,氨基酸序列如seq id no:39所示;短药野生稻(oryza brachyantha)中该育性基因的基因组核苷酸序列如seq id no:40所示,cds序列如seq id no:41所示,氨基酸序列如seq id no:42所示;非洲栽培稻(oryza glaberrima)中该育性基因的基因组核苷酸序列如seq id no:43所示,cds序列如seq id no:44所示,氨基酸序列如seq id no:45所示。
[0119]
实施例9转育带有gms3基因的隐性核不育系
[0120]
用gms3突变体与育性正常的受体,如h28b,进行杂交、回交和自交,并在此过程中用分子标记进行gms3基因和遗传背景选择,最终获得h28b背景下带有纯合gms3突变基因的隐性核不育系。具体实施步骤如下:
[0121]
1、以受体亲本,如h28b,为父本与gms3杂交获得f1。
[0122]
2、以f1为母本与受体亲本,如h28b,回交获得bc1f1。
[0123]
3、种植bc1f1,使用引物1199_f1:agatctatagtggtgttgtgctt(seq id no:7)、1199_r1:gccagttcaacaccaaatccg(seq id no:8)和1199_r2:ggtagtcgccgtacaccat(seq id no:11)检测gms3基因型。选择gms3杂合基因型,即同时能扩增出167bp和253bp条带的植株。
[0124]
4、使用一组基因型(例如100个,或200个等)在gms3突变体和轮回亲本基因组之间存在多态性,且分布均匀的分子标记(可以是但不限于ssr、snp、indel、est、rflp、aflp、rapd、scar等类型标记),对步骤3中选出的单株进行遗传背景鉴定,选取与轮回亲本基因型相似度高(如大于88%相似度,或2%中选率等)的植株。
[0125]
5、用步骤4中选出的植株与受体亲本,如h28b,回交获得bc2f1。
[0126]
6、种植bc2f1,重复步骤3和步骤4,选出gms3基因型杂合,遗传背景回复率高(如大于98%,或2%中选率等)的植株,收自交种bc2f2。
[0127]
7、种植bc2f2,重复步骤3和步骤4,选出gms3基因型杂合,遗传背景纯合率最高的植株,收自交种bc2f3。bc2f3后代中分离的gms3杂合株即gms3隐性核不育系,bc2f3用于保存gms3隐性核不育系种质资源。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1