基因表达盒、慢病毒载体及其在治疗β地中海贫血症的应用的制作方法
基因表达盒、慢病毒载体及其在治疗
β
地中海贫血症的应用
技术领域
1.本发明涉及生物医疗领域,具体而言,涉及一种基因表达盒、慢病毒载体及其在治疗β地中海贫血症的应用。
背景技术:
2.β地中海贫血症是由于编码β珠蛋白的基因出现突变而导致的隐性遗传性血液疾病。不同基因型β
‑
地中海贫血患者的症状严重程度不同,无法产生任何β珠蛋白的基因称为β0基因,携带两个β0基因拷贝的患者症状最为严重。为了存活,输血依赖性β型地中海贫血症(tdt)患者需要终生频繁输血和铁螯合疗法排铁,tdt患者面临着因铁过量引起的进行性多器官衰竭等并发症的风险。目前,能够治愈tdt的治愈性疗法是进行异体造血干细胞移植(hsct),但hsct很难找到合适的hla配型,而且存在包括由治疗而导致的死亡、移植物衰竭、移植物抗宿主疾病和机会性感染等并发症的风险,特别是由非直系血亲提供的hsct。因此,现有的疗法或者无法一次性治愈tdt患者,极大地影响了患者的生活质量,增加患者和国家的医疗负担;或者很难找到合适的hla配型,只有很少的患者能够从中受益;即使找到了合适的hla配型,也冒着多种并发症的风险。
3.理论上从基因层面增加细胞正常β
‑
珠蛋白的表达,患者将获得终身的治疗。此外,提高患者体内γ
‑
珠蛋白的表达,也可取得功能上代偿β珠蛋白生成不足的效果。目前获批的或者研究中的基因疗法通常采用在造血干细胞(hsc)中过表达正常β
‑
珠蛋白/γ
‑
珠蛋白的方法或者表达促进γ
‑
珠蛋白表达的基因的方法,使患者的hsc可适宜的表达β
‑
珠蛋白/γ
‑
珠蛋白,从而部分治愈β
‑
地中海贫血症患者或缓解β
‑
地中海贫血症的症状,很大程度上提高了患者的生活质量。但仍无法一次性治愈重型β
‑
地中海贫血症患者。
4.在生物体内,β
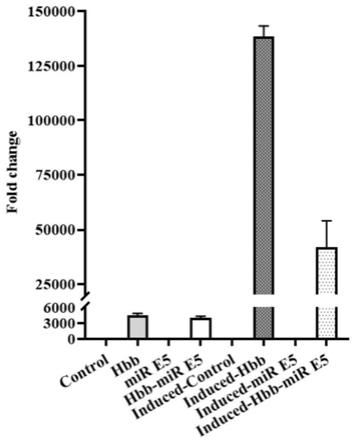
‑
珠蛋白的表达具有红系特异性,研究表明β
‑
lcr(locus control region)控制着包括β
‑
珠蛋白在内的一系列珠蛋白的时间和空间特异性表达。胎儿在出生6个月后,胎儿型hbf(α2γ2)的量小于总血红蛋白的5%,到两岁时小于1%。β
‑
珠蛋白基因及调控γ
‑
珠蛋白表达的基因bcl11a在hsc中组成性表达会损害hsc的功能及分化。因此,外源基因需要置于lcr的调控之下,抑制bcl11a基因的表达将有利于γ
‑
珠蛋白的表达。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的第一目的在于提供一种基因表达盒,其包括顺次连接的启动子、β珠蛋白基因、intron
‑
bcl11a
‑
shrnamir以及多腺苷酸化信号;
7.所述β珠蛋白基因的核苷酸序列如seq id no:1所示;
8.所示intron
‑
bcl11a
‑
shrnamir的核苷酸序列如seq id no:2所示;
9.所述启动子为红系细胞特异性的ii型启动子。
10.可选的,如上所述的基因表达盒,所示启动子的上游还具有增强子。
11.可选的,如上所述的基因表达盒,所述增强子为来自β珠蛋白的lcr的hs3与hs2增
强子,其中hs3位于hs2的上游。
12.在一些实施方式中,hs3的核苷酸序列如seq id no:6所示。
13.在一些实施方式中,hs2的核苷酸序列如seq id no:7所示。
14.可选的,如上所述的基因表达盒,所述启动子的核苷酸序列如seq id no:3所示。
15.可选的,如上所述的基因表达盒,所述多腺苷酸化信号的核苷酸序列如seq id no:4所示。
16.本发明的第二目的在于提供一种包含如上所述的基因表达盒的载体。
17.本发明的第三目的在于提供一种慢病毒包装载体,沿病毒基因组表达方向设置有位于上游的5’ltr和位于下游的3’ltr,所述基因表达盒反向插入所述5’ltr和所述3’ltr之间。
18.可选的,如上所述的慢病毒包装载体,所述慢病毒包装载体具有seq id no:5所示的核苷酸序列。
19.本发明的第四目的在于提供一种慢病毒包装载体系统,其能产生只有一次感染能力而无复制能力的hiv载体颗粒,其特征在于,包含如上所述的慢病毒包装载体。
20.可选的,如上所述的慢病毒包装载体系统,所述慢病毒包装载体系统为二质粒、三质粒或四质粒包装系统。
21.本发明的第五目的在于提供如上所述的慢病毒包装载体系统包装得到的慢病毒颗粒。
22.本发明的第六目的在于提供药物组合物,其包括如上所述的慢病毒包装载体系统和/或如上所述的慢病毒颗粒,以及药学上可接受的载体。
23.本发明的第七目的在于提供一种如上所述的慢病毒包装载体系统和/或如上所述的慢病毒颗粒在制备用于治疗β地中海贫血症的药物中的应用。
24.与现有技术相比,本发明的有益效果为:
25.本发明构建的基因表达盒,可在红系细胞中特异性的上调β珠蛋白和γ
‑
珠蛋白的表达,两种机理协同作用,治疗效果显著增强。在表达外源性β珠蛋白的同时,使用嵌合于内含子的基于mirna骨架的shrna表达技术表达bcl11a的shrna,使shrna像内源性mirna一样受控于ii型启动子,跟hbb基因一起实现红细胞特异性的表达,可用于治疗β0/β0重型地贫患者,具有潜在的巨大经济效益和社会效益。
附图说明
26.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
27.图1为本发明一个实施例中红系特异性表达的“all
‑
in
‑
one”载体结构示意图;
28.图2为本发明一个实施例中所使用的β珠蛋白的结构示意图;
29.图3为本发明一个实施例中本发明所使用的慢病毒表达载体结构示意图;a.pcdh
‑
mir e5
‑
hs2
‑
hs3;b.pcdh
‑
βglobin
‑
hs2
‑
hs3;c.pcdh
‑
intron
‑
mir e5
‑
βglobin
‑
hs2
‑
hs3;
30.图4为本发明一个实施例中各组诱导分化后细胞沉淀的颜色;
31.图5为本发明一个实施例中各处理组鼠bcl11a mrna和鼠γ
‑
globin mrna的表达情况;
32.图6为本发明一个实施例中各处理组人β
‑
globin mrna的表达情况。
具体实施方式
33.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
34.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
35.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
36.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
37.本发明涉及一种基因表达盒,其包括顺次连接的启动子、β珠蛋白基因、intron
‑
bcl11a
‑
shrnamir以及多腺苷酸化信号;
38.所述β珠蛋白基因的核苷酸序列如seq id no:1所示;
39.所示intron
‑
bcl11a
‑
shrnamir的核苷酸序列如seq id no:2所示;
40.所述启动子为红系细胞特异性的ii型启动子。
41.lcr的全长超过15kb,现有且常用的慢病毒载体容量有限,无法携带复杂的lcr序列,而且较长的调控序列会导致病毒滴度和基因表达水平降低,容易发生基因重排现象。因此,需要对lcr区域的序列进行优化精简,但不能损害lcr的功能。
42.shrna在生物实验中广泛应用,其可在细胞中大量表达,高效敲降目的基因。shrna的表达通常由iii型rna聚合酶(pol iii)启动转录,mirna的表达由pol ii启动转录。转录因子bcl11a对于多种类型的细胞都是十分重要的,去除bcl11a可能会引发不可想象的后果(比如白血病),因此,靶向bcl11a必须限定于红系细胞中,只能采用可细胞组织特异性表达的ii型启动子控制的mirna进行bcl11a的敲降。此外,持续的外源mirna的高表达会对内源rnai造成很大的不利影响,对细胞产生一定的毒性。为了实现同时调控表达外源性的β
‑
globin和bcl11ashrna,需要将二者构建于同一个启动子的的控制下,由于mirna的加工机制,会造成β
‑
globin
‑
bcl11a shrna mrna的不稳定,对β
‑
globin的表达影响非常大。因此,该问题也需要妥善解决。
43.本发明构建的基因表达盒,可在红系细胞中特异性的上调β珠蛋白和γ
‑
珠蛋白的表达,两种机理协同作用,治疗效果显著增强。
44.本发明的一个优点在于,采用intron
‑
shrnamir系统(嵌合于内含子的基于mirna的shrna表达技术),将β珠蛋白基因和intron
‑
bcl11ashrnamir基因置于红系细胞的组织特
异性ii型启动子的控制下,构建“all
‑
in
‑
one”表达载体,可在红系细胞中特异性同时表达外源性β珠蛋白和bcl11a shrna。
45.本发明的一个优点在于,优化精简了β
‑
lcr,优化精简后的lcr大小适合于慢病毒的包装生产,且功能正常。lcr使其下游基因在红系细胞中特异性表达,避免了外源基因在不适宜的时间表达对细胞造成的不利影响。
46.本发明的一个优点在于,利用mirna的加工机制,将shrna嵌合于mirna的框架中,即shrnamir,使shrna能够像mirna一样由ii型启动子控制表达,构建红系特异性的表达载体,避免了外源mirna持续高表达对内源rnai的干扰,且高效敲降bcl11a的表达,显著提高γ珠蛋白的表达。
47.本发明的一个优点在于,利用内含子的加工剪接机制,将shrnamir置于内含子中,即intron
‑
bcl11a
‑
shrnamir技术,减小bcl11a
‑
shrnamir的表达对其上游β珠蛋白的表达的影响,从而实现真正的“all
‑
in
‑
one”载体。
48.在本发明中,术语“红系细胞”指有核细胞,其能发育为红细胞,包括但不限于:红系定向祖细胞、原红细胞、早幼红细胞、中幼红细胞、晚幼红细胞和网织红细胞。
49.在一些实施方式中,所示启动子的上游还具有增强子。
50.增强子包括但不限于gata
‑
1、i8、hs增强子及其组合。在一些实施方式中,所述增强子为来自β珠蛋白的lcr的hs3与hs2增强子,其中hs3位于hs2的上游。
51.在一些实施方式中,hs3的核苷酸序列如seq id no:6所示。
52.β珠蛋白的lcr包括5个dnase i hypersensitive sites(hss),其中hs2、hs3和hs4有比较强的增强子活性。本发明所采用的hs3和hs2组合可驱动下游基因的高表达。
53.在一些实施方式中,hs2的核苷酸序列如seq id no:7所示。
54.红系细胞特异性的ii型启动子包括但不限于α
‑
spectrin启动子、ankyrin
‑
1启动子、ζ
‑
globin启动子、β
‑
globin启动子;在一些实施方式中,所述启动子为来自β
‑
lcr(β
‑
locus control regions)的启动子,进一步地,所述启动子的核苷酸序列如seq id no:3所示。
55.在一些实施方式中,所述多腺苷酸化信号的核苷酸序列如seq id no:4所示。
56.本发明还请求保护包含如上所述的基因表达盒的载体。
57.在本发明中术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。用于外源dna转移的常规的基于病毒的系统包括逆转录病毒、慢病毒、腺病毒、腺相关和单纯疱疹病毒载体;上述病毒通常是复制缺陷的。在一些实施方式中,本发明所述载体中包含基因工程中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(ires)和其他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚u序列等)。
58.本发明还涉及一种慢病毒包装载体,沿病毒基因组表达方向设置有位于上游的5’ltr和位于下游的3’ltr,所述基因表达盒反向插入所述5’ltr和所述3’ltr之间。
59.在一些实施方式中,所述慢病毒包装载体为pcdh。
60.在一些实施方式中,所述慢病毒包装载体具有seq id no:5所示的核苷酸序列。
61.另外,需要说明的是,在一个方面,本发明中所涉及的有用的序列包括与seq id no:1~10所示的核酸片段具有大于60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
62.术语“%同一性”在两个或更多个核苷酸序列或氨基酸序列的上下文中,指的是相同或具有特定百分比的相同氨基酸残基或核苷酸的两个或多个序列或子序列,当比较和比对以用于最大对应时,如使用以下序列比较算法之一或通过目视检查来测量的。例如,%同一性是相对于要比较的序列的编码区域的整个长度。
63.对于序列比较,通常一个序列用作参考序列,测试序列与该序列进行比较。当使用序列比较算法时,测试序列和参考序列被输入到计算机中,如果需要,指定子序列坐标,并且指定序列算法程序参数。然后,序列比较算法根据指定的程序参数计算测试序列相对于参考序列的百分比序列同一性。可使用搜索算法例如blast和psi
‑
blast(altschul etal.,1990、j mol biol 215:3,403
‑
410;altschul et al.,1997,nucleic acids res25:17,3389
‑
402)确定百分比同一性。
64.此外,本发明所涉及的基因或蛋白通常来着哺乳动物,例如大鼠、小鼠,优选灵长类动物,更优选人。
65.本发明还涉及一种慢病毒包装载体系统,其能产生只有一次感染能力而无复制能力的hiv载体颗粒,其特征在于,包含如上所述的慢病毒包装载体。
66.在一些实施方式中,所述慢病毒包装载体系统为二质粒、三质粒或四质粒包装系统。
67.根据本发明的再一方面,本发明还涉及如上所述的慢病毒包装载体系统包装得到的慢病毒颗粒。
68.用于包装慢病毒颗粒的宿主细胞通常为哺乳动物细胞或禽类动物细胞。
69.在一些实施方式中,所述宿主细胞为啮齿类动物细胞,例如大鼠、小鼠、仓鼠。
70.在一些实施方式中,所述宿主细胞为灵长类动物细胞,优选为人。
71.在一些实施方式中,所述宿主细胞为细胞系;
72.常见的细胞系例如:
73.来源于人的细胞系:
74.293、imr
‑
90、w1
‑
38、a549、a431、bhl
‑
100、bewo、caco
‑
2、chang、hct
‑
15、hela、hep
‑
g2、hep
‑
2、ht
‑
1080、ht
‑
29、jeg
‑
2、mcf7、kb、saos
‑
2、wi
‑
38、wish、ws1、huvec、eb
‑
3、raji、im
‑
9、daudi、h9、hl
‑
60、jurkat、k
‑
562、u937、kg
‑
1;
75.来源于小鼠的细胞系:
76.mccoy、balb/3t3、3t6、a9、att
‑
20、clone m
‑
3、i
‑
10、y
‑
1、wehi
‑
3b、es
‑
d3、f9;
77.来源于仓鼠的细胞系:
78.bhk
‑
21、hak、cho
‑
k1;
79.来源于大鼠的细胞系:
80.ar42j、brl3a、clone 9、h4
‑‑ⅱ‑
e
‑
c3、gh1、gh3、iec
‑
6、l2、xc、llc
‑
wrc 256、jensen、rat2(tk
‑
)、pc12、l6;
81.来源于其他动物的细胞系:
82.d
‑
17、bt、marc
‑
145、cv
‑
1、cos
‑
1、cos
‑
3、cos
‑
7、vero、b95
‑
8、crfk。
83.根据本发明的再一方面,本发明还涉及药物组合物,其包括如上所述的慢病毒包装载体系统和/或如上所述的慢病毒颗粒,以及药学上可接受的载体。
84.根据本发明的再一方面,本发明还涉及如上所述的慢病毒包装载体系统和/或如上所述的慢病毒颗粒在制备用于治疗β地中海贫血症的药物中的应用。
85.下面将结合实施例对本发明的实施方案进行详细描述。
86.实施例1
87.载体构建
88.由广州艾基生物技术有限公司分别合成hs3
‑
hs2
‑
promoter dna序列、mir e5(e5
‑
shrnamir)dna序列和intron
‑
mir e5 dna序列;并连接构建至慢病毒载体中。本发明所涉及的主要序列为下表所示:
89.名称长度序列hs31202bpseq id no:6hs21411bpseq id no:7βglobin promoter265bpseq id no:3shrnamir316bpseq id no:8polya395bpseq id no:4β
‑
globin基因1052bpseq id no:1intron
‑
shrnamir356bpseq id no:2pcdh
‑
mir e5
‑
hs2
‑
hs39597bpseq id no:9pcdh
‑
βglobin
‑
hs2
‑
hs310369bpseq id no:10pcdh
‑
inron
‑
mir e5
‑
βglobin
‑
hs2
‑
hs310757bpseq id no:5βglobin蛋白147aaseq id no:11
90.e5
‑
shrna的序列为:passenger strand(gcgcgatcgagtgttgaataa),guide strand(ttattcaacactcgatcgcgc)。
91.实施例2
92.慢病毒包装采用四质粒系统,具体步骤如下:
93.(1)四质粒系统分别表达慢病毒载体包装所需的gag/pol、rev、vsv
‑
g及本发明构建的e5
‑
shrnamir表达载体:将四质粒进行瞬时转染293t细胞,dna含量为2μg/ml;
94.(2)将上述质粒与pei转染试剂混合,加入至一定体积的无血清的dmem中,混匀后放置15分钟,将上述混合液加入至铺有293t细胞的细胞的t75培养瓶中,轻轻混匀,于37℃、5%co2细胞培养箱培养6h;
95.(3)6h后更换新鲜培养基,继续进行培养,并且加入10mm的丁酸钠溶液,72小时后收集慢病毒的培养上清进行纯化检测。
96.(4)使用慢病毒滴度(hiv p24)elisa检测试剂盒(北京博奥龙,货号bf06203)检测病毒滴度。
97.实施例3
98.e5
‑
shrnamir慢病毒感染mel细胞
99.1.小鼠murine erythroleukemia(mel细胞),培养于完全培养基(1640+10%fbs+1%p/s)中,每2
‑
3天以1:5~1:10的比例进行传代。
100.2.200g离心5
‑
10min收集细胞,用含200nm的感染增强剂b的完全培养基重悬细胞,于培养箱中孵育2h。
101.3.2h后,200g离心5
‑
10min收集细胞,用完全培养基重悬细胞,调整密度为5
×
106个/ml,接种100ul(5
×
105个/孔)至48孔板中。
102.4.加入适量的慢病毒,使moi为15,然后加入感染增强剂a,使感染增强剂a的终浓度为10um,然后轻轻混匀细胞。
103.5.将细胞放入培养箱过夜培养。
104.6.将过夜培养的细胞用pbs洗2遍。
105.7.然后将细胞用完全培养基重悬,接种至新的48孔板,进行扩增。
106.实施例4
107.mel的诱导分化
108.1.e5
‑
shrnamir慢病毒感染的mel细胞扩增后,200g离心5
‑
10min收集细胞。
109.2.用红系诱导分化培养基(1640+10%fbs+1%p/s+2%dmso)重悬细胞。
110.3.诱导分化期间,每2
‑
3天进行以1:2的比例进行传代。
111.4.诱导分化7天后,可进行相应的检测。
112.5.将细胞收集至1.5ml离心管中,200g离心5min,然后用pbs洗一遍;
113.6.拍照观察细胞沉淀的颜色。
114.结果如图4所示,诱导分化组的细胞沉淀呈现泛红色,而未进行诱导分化的细胞沉淀均为淡黄色。
115.从图可知,各组mel细胞经过7天的诱导分化培养,成功分化为红系细胞。
116.实施例5
117.rt
‑
qpcr检测鼠bcl11a mrna、鼠γ珠蛋白mrna和人β
‑
珠蛋白mrna的表达水平
118.按照rna提取试剂盒rnaeasy mini kit(qiagen,货号74104)的操作步骤,提取各组细胞的总rna。然后于微量分光光度计上检测rna的浓度。接着使用one step tbprimescript
tm
rt
‑‑
pcr kit i ii(perfect real time)(takara,货号rr86a)进行rt
‑
qpcr,鼠gapdh作为内参基因,检测鼠bcl11a mrna、鼠γ珠蛋白mrna和人β
‑
珠蛋白mrna的表达量。简单的操作如下:
119.pcr反应体系的配制(一次反应用量):
120.试剂使用量终浓度2x one step tb green rt
‑
pcr buffer 410ul1xprimescript 1 step enzyme mix 20.8ul pcr forward primer(10μm)0.8ul0.4umpcr reverse primer(10μm)0.8ul0.4umtotal rna2.5ul rnase free dh2o5.1ul 总计20ul 121.配制好反应体系后,于荧光定量pcr仪(biorad)上进行检测。
122.设置反应程序如下:
[0123][0124]
反应结束后,使用采用比较ct法(δδct)计算表达差异。实验使用的特异性引物如下表所示:
[0125][0126][0127]
从图5a可知,未诱导分化的各组bcl11a的表达没有显著差异,而诱导分化的induced
‑
control和induced
‑
hbb组bcl11a的表达与未诱导分化的各组相比也没有显著差异。但是induced
‑
mir e5和induced
‑
hbb
‑
mir e5组bcl11a的表达显著下调。这些结果提示bcl11a shrna只在诱导分化的mel细胞中表达,且能够高效敲降bcl11a的表达。
[0128]
从图5b可知,对于鼠γ
‑
globin mrna,未诱导分化的各组与对照组相比均无显著差异。诱导分化的各组中,鼠γ
‑
globin mrna的表达均显著上调,其中induced
‑
mir e5和induced
‑
hbb
‑
mir e5组鼠γ
‑
globin mrna的表达量比其他组的更高。这些结果提示mir e5和hbb
‑
mir e5可特异性地在红系诱导分化的mel细胞中敲降bcl11a,从而提高γ
‑
珠蛋白的表达。
[0129]
从图6中可知,induced
‑
hbb和induced
‑
hbb
‑
mir e5组人β
‑
globin的表达量远远高于其他组。这些结果提示hbb和hbb
‑
mir e5可特异性地在红系诱导分化的mel细胞中表达,从而大量表达正常的人β珠蛋白。
[0130]
综上所述,本发明利用内含子剪接加工机制、mirna表达机制以及β珠蛋白的控制表达机制所构建的bcl11a shrna和β珠蛋白同时表达的“all
‑
in
‑
one”载体可特异性的在红系细胞中表达治疗基因,显著提高红细胞中β珠蛋白和γ珠蛋白的表达,将有更大的希望一次性治愈β0/β0重型β
‑
地中海贫血症患者。
[0131]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0132]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并
不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1