呕吐毒素特异性核酸适配体及应用的制作方法
1.本发明属于食品安全检测技术领域,具体地说,涉及呕吐毒素特异性核酸适配体及应用。
背景技术:
2.脱氧雪腐镰刀菌烯醇(deoxynivalenol,don),又名呕吐毒素,是最常见的真菌毒素之一,具有较高的污染率,广泛存在于小麦、大麦、玉米、燕麦等粮食作物中。don具有广泛的毒性作用,对细胞周期和细胞凋亡、机体生化反应、消化和免疫系统等均有毒害效应,还有一定的胚胎毒性和致畸性。世界各国及组织都对食品中don的含量做了限定,我国国家标准gb 2761
‑
2017中规定玉米、玉米面(渣、片)、大麦、小麦、麦片、小麦粉中don的限量为1000μg/kg。
3.目前,don的检测方法主要有薄层色谱法、液相色谱法及色谱质谱联用技术、酶联免疫法和胶体金免疫层析法等,这些方法检测限低、精密度高,但是操作复杂、检测成本高。因此亟需建立一种快速、简单、低成本的don检测方法。
4.核酸适配体是通过指数富集配体系统进化技术(systematic evolution of ligands by exponential enrichment,selex)从随机核酸文库中筛选得到的一段具有高亲和力与特异性识别作用的单链dna/rna寡核苷酸(10
‑
100nt)片段。适配体可以自身折叠成复杂的二级或三级结构,如茎、环、凸、假结体、四角环、发卡结构和g
‑
四链体等,实现与特定靶标的高特异性和高亲和力地识别,从而结合形成靶标
‑
适配体的稳定复合物。适配体与抗体相比具有明显的优势,适配体不仅具有尺寸小、生产成本低、稳定性高、无免疫原性、容易化学合成、适于开发多样化的检测方法等优点,而且更容易用荧光染料、酶和生物素等标记。
技术实现要素:
5.本发明的目的是提供一组呕吐毒素特异性核酸适配体及应用。。
6.为了实现本发明目的,第一方面,本发明提供呕吐毒素特异性核酸适配体,所述核酸适配体的序列如seq id no:1所示,命名为do8。
7.本发明的don核酸适配体是基于核酸适配体的体外selex筛选技术获得的,其以don为靶标,筛选可与靶标特异结合的核酸适配体,以达到快速、准确诊断粮食作物中don的目的。
8.所述核酸适配体的5'端或3'端可进行生物素、荧光素、氨基、巯基、纳米发光材料或地高辛化学修饰。
9.第二方面,本发明提供所述核酸适配体在呕吐毒素的分离、富集和检测中的应用(含非诊断和治疗目的)。
10.第三方面,本发明提供所述核酸适配体在制备呕吐毒素检测试剂或试剂盒中的应用。
11.第四方面,本发明提供呕吐毒素核酸适配体试纸条,包括样品吸收垫、硝酸纤维素膜、吸水垫和底板,所述样品吸收垫、硝酸纤维素膜和吸水垫依次粘贴在底板上。
12.所述样品吸收垫包被有检测探针,所述检测探针为荧光素标记的呕吐毒素适配体,适配体的核苷酸序列如seq id no:2所示。
13.所述硝酸纤维素膜上设有检测线和质控线,所述检测线包被有don
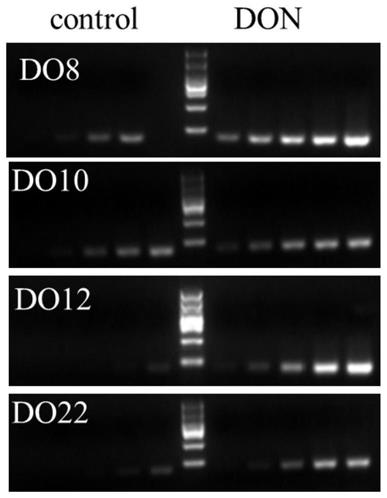
‑
载体蛋白偶联物,所述载体蛋白可以是牛血清白蛋白、卵清蛋白(ova)、血蓝蛋白、甲状腺蛋白或人血清白蛋白。
14.所述检测线包被有序列cs1:5
’‑
agtcgggcagactccgtgcc
‑3’
(适配体的互补序列,seq id no:3)。
15.所述质控线包被有序列cs2:5
′‑
tttttttttttttttttt
‑3′
(适配体连接臂的互补序列,seq id no:4)。
16.序列cs1的5
′
端标记生物素,且通过链霉亲和素与生物素偶联形成共价键包被在硝酸纤维素膜上。
17.所述荧光素为cy5或量子点等。
18.所述检测探针的制备方法如下将荧光素标记的适配体用结合缓冲液溶解至0.01μm;所述结合缓冲液的成分为:10mm tris,120mm nacl,5mm kcl,200mm mgcl2,50mm cacl2,5%v/v甲醇,1%peg 20000,2%蔗糖,0.1%v/v tween
‑
20,ph为7.4。
19.所述质控线的制备方法如下:将生物素标记的序列cs1用水配制成浓度为3μm,取350μl与50μl的1mg/ml链霉亲和素溶液于室温下孵育2h,得到生物素
‑
链霉亲和素偶联物;将偶联物固定到硝酸纤维素膜上的质控线处,检测线和质控线之间间隔5mm。
20.第五方面,本发明提供所述核酸适配体试纸条在粮食、饲料及食品中呕吐毒素检测中的应用(含非诊断和治疗目的)。
21.第六方面,本发明提供所述核酸适配体试纸条的使用方法:将待测样品粉碎,向5g样品中加入80%v/v的甲醇水溶液25ml,混匀,振荡提取30min,然后在10000rpm转速下离心10min,将上清液用水稀释,使稀释液中甲醇的终浓度为20%~30%v/v,得到待测样品溶液;将待测样品溶液滴加到所述试纸条的样品垫上进行检测,根据检测线和质控线的荧光强度的比值与标准曲线进行对比,计算得到实际样品中呕吐毒素的含量。
22.本发明以don为靶标,利用竞争selex技术制备获得了一组与don高特异性高亲和力结合的核酸适配体。该核酸适配体经修饰后可直接用于荧光、化学发光或变色方法检测don,也可用于开发试纸条或便携式小型仪器以实现农产品中污染don快速检测,可在食品安全检测领域得到广泛应用。
附图说明
23.图1为本发明较佳实施例中核酸适配体do8的二级结构示意图。
24.图2为本发明较佳实施例中通过pcr法测定核酸适配体与don亲和力的变性page电泳图。
25.图3为本发明较佳实施例中基于do8核酸适配体的纳米金比色法测定don的实验结果图。
26.图4为本发明较佳实施例中应用do8适配体的sers检测呕吐毒素的线性范围图。
27.图5为本发明较佳实施例中don特异性检测结果图。
具体实施方式
28.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
29.实施例1 呕吐毒素特异性核酸适配体的筛选
30.1、体外化学合成初始随机单链dna(ssdna)文库及引物,序列如下:5
’‑
atccagagtgacgcagca
‑
40n
‑
tggacacggtggcttagt
′
(40n代表40个随机核苷酸)
31.上游引物:5
’‑
atccagagtgacgcagca
‑3’
[0032]5’
磷酸化下游引物:5
’‑
p
‑
actaagccaccgtgtcca
‑3’
[0033]
将随机ssdna文库和引物均用te缓冲液配制成100μm贮存液,于
‑
20℃备用。
[0034]
2、筛选所用靶标的获取与处理
[0035]
取5mg don中加入1ml 50%n,n
‑
二甲基甲酰胺(dmf)溶解,使之终浓度5mg/ml。然后取两份sapharose 6b(琼脂糖6b),每份0.2g。一份中加入500μl don溶液,另一份中加入500μl 50%dmf。两份sapharose 6b分别加入10μl 10m naoh。30℃孵育过夜。随后使用50%dmf洗一次,弃上清。加入1ml 1m乙醇胺溶液,45℃孵育过夜。交替使用乙酸缓冲液和pbs缓冲液洗涤sapharose 6次。最后加入800μl wb试剂(100mm tris
‑
hcl,4%sds(w/v),0.2%溴酚蓝(w/v),20%甘油(v/v),200mm dtt),200μl乙醇保存。一份用于正筛,一份用于反筛。
[0036]
3、selex筛选7轮
[0037]
第一轮筛选时,溶解初始库至终浓度20nm,95℃水浴复性5min。立即置于冰上,静置5min。冰浴完毕后取出管中的初始库50μl,加入450μl结合缓冲液(2mm kh2po4,8mm na2hpo4,136mm nacl,2.6mm kcl,5mm mgcl2,1μg/ml trna,0.02%tween
‑
20),室温静置5min。取反筛sapharose 100μl,加入筛选库,室温孵育30min。离心取上清,加入正筛sapharose 100μl,室温孵育30min。分别使用1ml洗涤缓冲液洗涤两份sapharose三次(2mm kh2po4,8mm na2hpo4,136mm nacl,2.6mm kcl,5mm mgcl2,0.02%tween
‑
20)。洗涤完毕后吸干管中液体。加入200μl去离子水,然后在95℃水浴锅中放置5min,立即置于冰上,静置5min,取出上清液体待用,将多次上清液汇集在一管中混匀作为pcr扩增的模板dna。预扩增10个循环,扩增产物合并收集至一个干净的离心管中。循环数梯度pcr,设置6、8、10、12、14个循环各一管。选取最合适的循环数,对筛选库进行大量扩增。纯化柱回收双链产物,使用thermonanodrop2000超微量分光光度计测定仪测定产物浓度。
[0038]
pcr反应体系为:单链dna解离液5μl,上游引物及磷酸化下游引物(20μm)各1μl,含mg
2+
的dntps 1μl(25mm),10
×
pcr缓冲液5μl,taq dna聚合酶(5u/μl)1μl,加灭菌超纯水至50μl。反应程序为:95℃5min;95℃30s;57℃30s;72℃30s,25个循环;72℃5min。第1
‑
7轮筛选的pcr产物,均通过非变性8%聚丙烯酰胺凝胶电泳验证扩增效果,然后将pcr总体积扩大为100μl/管进行大批量扩增纯化,并用λ
‑
核酸外切酶消化法制备单链次库作为下一轮selex筛选投入的次库。
[0039]
进行第2~7轮筛选时,取上一轮制备的dsdna产物,使用λ
‑
外切酶消化30min,95℃水浴复性5min,立即置于冰上,静置5min。冰浴完毕后加入450μl结合缓冲液,室温静置5min。加入100μl反筛sapharose,杂交炉中室温孵育30min。离心取上清,加入100μl正筛
sapharose,杂交炉中室温孵育30min。使用1ml洗涤缓冲液洗涤正筛与反筛sapharose六次,最后一次洗涤后尽量吸干管中液体。加入200μl去离子水,95℃水浴锅中放置5min。立即置于冰上,静置5min。取出上清液体待用。将多次上清液汇集在一管中混匀作为扩增模板进行pcr扩增(非变性8%page电泳验证),核酸纯化;λ
‑
外切酶消化30min制备单链次库,核酸纯化后thermonanodrop 2000超微量分光光度计测定ssdna浓度计算下一轮文库投入体积。之后每轮selex筛选均按照类似操作进行,但随着筛选的推进,解离前bb洗涤靶标琼脂糖
‑
ssdna复合物的次数由6次增加到9次。同时,为了筛选到富集快速且亲和力高的寡核苷酸适配体序列,在随后的筛选中逐渐缩短孵育时间及减少对解离ssdna的扩增循环次数。
[0040]
4、高通量测序及序列分析
[0041]
将第7轮筛选得到的寡核苷酸适配体扩增产物,进行高通量测序,测序结果显示,共有22条候选适配体序列。其中4条高频适配体(do8、do10、do12和do22)对呕吐毒素有较高的亲和力。利用pcr法测定核酸适配体与don亲和力,如图2所示,do8和do12与呕吐毒素的亲和力较高。因此,后续只选do8和do12适配体进行亲和常数的测定。
[0042]
两条核酸适配体的序列如下:
[0043]
do8(5
’‑3’
):ggcacggagtctgcccgactggggaccctaggatcactta
[0044]
do12(5
’‑3’
):ctctccgcagcccaacctgtcggcccatcccctccctcta
[0045]
5、don核酸适配体亲和力分析
[0046]
将sensor chip sa芯片使用50mm naoh,1m nacl冲洗三次,每次60s。然后将候选序列do8、do12溶于hbs
‑
ep缓冲液(0.01m hepes(ph7.4),0.15m nacl,3mm edta,0.005%surfactant p20),配制终浓度为1μm,在95℃水浴锅中孵育5min后置于冰上5min,最后室温静置5min。do8和do12进样速度30μl/min,进样900s。don分子稀释成一系列浓度(12.5
‑
400nm),进样速度30μl/min,温度为25℃。样品之间使用0.5%sds再生。利用graphpad prism 5软件计算各寡核苷酸适配体的解离常数k
d
值。do8和do12寡核苷酸适配体代表序列的k
d
值见表1:
[0047]
表1 适配体代表序列的k
d
值
[0048]
寡核苷酸适配体编号解离常数k
d
值(nm)do840.51do1284.49
[0049]
核酸适配体do8的二级结构示意图见图1。
[0050]
实施例2 don核酸适配体的亲和力评价
[0051]
为评价筛选的do8核酸适配体与已报道的适配体亲和力差异,利用纳米金比色法对核酸适配体do8和已报道的适配体don1和don2进行比较:
[0052]
don1:gcccggatcgagcagatatcaagcgcatgggc;
[0053]
don2:cgacttcctatagggcgacatatgatcgatgatatcccatgggcg。
[0054]
先制备平均粒径大小约13nm的纳米金,将1%的柠檬酸三钠溶液1ml加入0.01%的氯金酸溶液100ml中,在搅拌的情况下煮沸并保持15分钟,停止加热继续搅拌冷却至室温。然后对nacl体积进行优化,将50μl超纯水与50μl平均粒径为13nm的纳米金均匀混合,加入5~12μl不同体积的0.4m nacl,观察不同nacl体积下,纳米金的颜色变化,结果表明,加入9μl 0.4m nacl可使纳米金变色。随后对适配体浓度进行优化,加入不同浓度适配体25μl,与
25μl超纯水混合后,再加入50μl平均粒径为13nm的纳米金,室温孵育10分钟后,加入9μl 0.4m的nacl溶液混匀,5分钟后观察颜色变化,确定do8、don1和don2最优适配体浓度分别为0.05μm、0.1μm和0.05μm。
[0055]
然后将0.05μm do8、0.1μm don1和0.05μm don2适配体各25μl,分别与25μl的0、0.1、0.2、0.5和1mg/l don混合,室温孵育10分钟后,再加入50μl平均粒径为13nm的纳米金,室温孵育5分钟后加入优化好的nacl,观察不同浓度的don时,纳米金的颜色变化。结果显示,do8对don的亲和力优于其他适配体。如图3所示,当do8适配体与0.1mg/l don共孵育时,加入nacl可使纳米金颜色发生变化。而don1使纳米金变色需要don的量为0.5mg/l,don2使纳米金变色所需don的量为1.0mg/l。
[0056]
本发明利用selex技术筛选出的核酸适配体对don的亲和力高、特异性强。该核酸适配体可以大量人工制备、无需动物体内免疫、稳定性好、制备方法简单、成本低廉,相对于抗体的优势显而易见,因此后续基于该核酸适配体的检测技术可以实现食品中don的快速检测;核酸适配体do8的特异性、亲和力及灵敏度鉴定,确保了对食品中呕吐毒素污染的检测结果准确性。基于核酸适配体的检测方法无需繁琐的样品前处理步骤,可特异性识别样品中don,提高检测结果的可靠性。
[0057]
实施例3 don适配体在sers检测中的应用
[0058]
1、适配体检测探针及其互补链的制备
[0059]
设计合成巯基修饰的检测探针及其互补链,其中检测探针为呕吐毒素的核酸适配体序列do8
‑
1(5
’‑
sh
‑
ggcacggagtctgcccgactggggaccctaggatcactta
‑3’
),互补链序列cdna(5
’‑
taagtgatcctaggg
‑
sh
‑3’
)。
[0060]
2、金磁纳米颗粒的制备和适配体do8
‑
1的修饰
[0061]
(1)金磁纳米颗粒的制备
[0062]
首先通过改良溶剂热反应法合成粒径约为150nm的fe3o4磁性纳米颗粒作为核。将0.324g无水fecl3溶解于20ml乙二醇中,再加入0.200g na3cit和11.811g naac,充分搅拌至完全溶解。将上述溶液转移至50ml高压釜中,置于200℃鼓风烘箱中反应10h,自然冷却并收集产物,以超纯水和无水乙醇分别洗涤3次,50℃真空干燥后待用。
[0063]
然后通过金种子生长法在fe3o4磁性纳米颗粒表面合成金壳。利用聚乙烯亚胺(pei)作为中间层,在超声条件下将20nm和3nm的金纳米颗粒(aunps)依次组装在10mg磁珠表面,之后将该产物分散于100ml 0.3mmol/l的haucl4溶液中。在30℃超声下迅速加入1ml 100mg/ml的nh2oh
·
hcl溶液,5min后加入300mg聚乙烯吡咯烷酮(pvp),继续超声10min,产物磁分离并用超纯水洗涤2次,分散于水中,得到fe3o4‑
20/3au@au分散液。其中,20nm aunps的制备方法为:将100ml 0.01%的haucl4溶液在磁力搅拌(700r/min)的条件下加热至微沸,一次性快速加入4ml 1%的na3cit溶液(柠檬酸钠),煮沸15min后自然冷却至室温。3nm aunps的制备方法为:在磁力搅拌(700r/min)的条件下,向50ml超纯水中加入0.5ml 24.3mmol/l的haucl4溶液,再加入1.5ml 1%na3cit溶液,1min后逐滴加入0.5ml 0.075%的nabh4溶液,磁力搅拌(800r/min)12h。
[0064]
(2)适配体do8
‑
1的修饰
[0065]
将fe3o4‑
20/3au@au分散于1ml的pbs缓冲液(0.01mol/l,ph 7.2~7.4)中,加入10μl浓度为10μm的经三(2
‑
羧乙基)膦(tcep)活化巯基的do8
‑
1适配体溶液,37℃摇动16h。加入
1ml 2%的bsa溶液,继续摇动1h,磁分离洗涤2次,再分散于1ml pbs缓冲液中,得到fe3o4‑
20/3au@au
‑
apt。
[0066]
3、银纳米颗粒的制备及dtnb和互补链cdna的修饰
[0067]
(1)银纳米颗粒(agnps)的制备
[0068]
向烧杯中加入17mg agno3和100ml超纯水,磁力搅拌(700r/min),待溶液沸腾时一次性加入2ml 1%的na3cit溶液,加热15min,自然冷却至室温。
[0069]
(2)5,5
’‑
二硫代双(2
‑
硝基苯甲酸)(dtnb)的修饰
[0070]
取2ml浓缩的agnps,加入40μl 10mmol/l的dtnb乙醇溶液,超声2h,离心(8000r/min,10min)去除多余的dtnb,加水复溶。
[0071]
(3)cdna的修饰
[0072]
取0.5ml agnps
‑
dtnb,加入10μl浓度为10μm的经tcep活化巯基的cdna溶液,37℃摇动22h。离心(8000r/min,10min)多次去除过量的cdna,加水复溶,得到agnps
‑
dtnb/cdna。
[0073]
4、基于磁珠
‑
适配体的呕吐毒素sers检测方法
[0074]
在离心管中加入50μl的fe3o4‑
20/3au@au
‑
apt,再加入150μl的agnps
‑
dtnb/cdna,37℃孵育1h,磁分离用添加100mmol/l na
+
和2mmol/l mg
2+
的pbs缓冲液(0.01mol/l,ph 7.2~7.4)洗涤2次,再分散于50μl该缓冲液中。分别加入浓度为0、10、20、50、100、200、500、1000、2000、5000和10000ng/ml的呕吐毒素don标准溶液,37℃孵育2h,磁分离洗涤2次,再分散。将颗粒分散液滴在包覆铝箔纸的载玻片上,待液滴晾干后测定拉曼光谱(sers),每个样品测定5次,计算1331cm
‑1处的特征峰信号相对强度。
[0075]
结果表明,沉淀颗粒的sers信号相对强度随don浓度的增大而降低,对二者均取对数后,符合线性相关关系。如图4所示,sers检测don的线性范围为10
‑
10000ng/ml,r2为0.9985。基于磁珠
‑
适配体的呕吐毒素sers检测定量限为10ng/ml。
[0076]
5、sers检测don的特异性考察
[0077]
分别配置浓度为50ng/ml的黄曲霉毒素b1(afb1)、赭曲霉毒素a(ota)、3
‑
乙酰脱氧雪腐镰刀菌烯醇(3
‑
acdon)、15
‑
乙酰脱氧雪腐镰刀菌烯醇(15
‑
acdon)、t
‑
2毒素和伏马毒素b1(fb1)等毒素的标准品溶液,用don核酸适配体试纸条进行测定。用荧光定量读数仪测定核酸适配体试纸条的t线和c线的荧光强度。检测结果如图5所示,afb1、ota、3
‑
acdon、15
‑
acdon、t2毒素和fb1均不能引起sers强度的明显变化,说明该方法对呕吐毒素具有良好的特异性。
[0078]
实施例4 don适配体试纸条的制备
[0079]
1、检测探针的制备
[0080]
设计合成荧光素标记的检测探针,其中检测探针为呕吐毒素的核酸适配体序列seq id no:2(polya
‑
do8,5
’‑
cy5
‑
aaaaaaaaaaaaagtgacgactggggaccctaggatcact
‑3’
),标记的荧光素为但不限于cy5。
[0081]
将荧光素标记的适配体polya
‑
do8(seq id no:2)用结合缓冲液(10mm tris,120mm nacl,5mm kcl,200mm mgcl2,50mm cacl2,5%v/v甲醇,1%peg 20000,2%蔗糖,0.1%v/v tween
‑
20,ph为7.4)溶解至0.05μm。将适配体检测探针包被于样品吸收垫。
[0082]
2、检测线和质控线的制备
[0083]
所述检测线包被有序列cs1:5
’‑
biotin
‑
agtcgggcagactccgtgcc
‑3’
(适配体
polya
‑
do8的互补序列,seq id no:3)。
[0084]
所述质控线包被有序列cs2:5
’‑
biotin
‑
tttttttttttttttttt
‑3′
(适配体连接臂的互补序列,seq id no:4)。
[0085]
将生物素标记的适配体互补序列cs1
‑
cs2用水配制成浓度为6μm,取350μl与50μl 1mg/ml的链霉亲和素于室温下孵育2h,形成生物素
‑
链霉亲和素偶联物。使用三维喷膜仪将制备好的互补序列cs1
‑
cs2生物素
‑
链霉亲和素偶联物分别固定到硝酸纤维素膜上的检测线t线和质控线c线处,每两条线的间隔为5mm。t线包被polya
‑
do8的互补序列cs1,c线包被适配体连接臂的互补序列cs2,其中适配体连接臂为非识别序列poly a。
[0086]
3、试纸条的组装
[0087]
将样品吸收垫、硝酸纤维素膜、吸水垫依次固定在底板上,硝酸纤维素膜被样品吸收垫和吸水垫分别覆盖约3mm。将组装好的试纸条放在37℃烘1h后取出,切成4mm宽的小条置于干燥环境中保存备用。
[0088]
4、适配体试纸条检测呕吐毒素的灵敏度
[0089]
取60μl呕吐毒素标准品溶滴加到试纸条的样品吸收垫上,10min后放入适配体试纸条检测仪器esequant
‑
lr3中检测,分别测定检测线(t线)和质控线(c线)的荧光强度;计算检测线的荧光信号强度(t)与质控线的荧光信号强度(c)的比值。随着呕吐毒素的浓度增加,t线的荧光强度逐渐变弱。利用荧光强度t/c比值与呕吐毒素浓度的对数绘制标准曲线,结果表明,核酸适配体试纸条检测呕吐毒素的检测限为200ng/ml,线性范围为200
‑
5000ng/ml,r2为0.9928(表2)。
[0090]
表2 荧光相对强度与don浓度的关系
[0091]
呕吐毒素浓度(ng/ml)t/c值01.382001.145000.9810000.8320000.7150000.59
[0092]
5、实际样品检测
[0093]
向空白样品小麦和玉米中加入500ng/ml、1000ng/ml和1500ng/ml呕吐毒素,称取5g(5
±
0.005g)已加入don的小麦和玉米样品,加入体积浓度为80%的甲醇水溶液25ml,混匀,在常温下振荡提取30min,然后在10000rpm转速下离心10min,将上清液用水稀释,使稀释液中甲醇的终体积浓度为20%~30%,得到待测样品溶液。将待测样品溶液滴加到所述试纸条的样品垫上进行检测,根据检测线和质控线的荧光强度的比值与标准曲线进行对比,计算得到实际样品中呕吐毒素含量。结果表明小麦和玉米中呕吐毒素的回收率为83.7%
‑
105.6%,相对标准偏差(rsd)为1.9%至7.8%,说明此方法可以用于实际粮食样品中呕吐毒素的检测。
[0094]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1