一种NCL全长蛋白及表达工程菌的制备方法与流程
一种ncl全长蛋白及表达工程菌的制备方法
技术领域
1.本发明属于生物技术领域,更具体地,本发明涉及一种ncl全长蛋白及表达工程菌的制备方法。
背景技术:
2.核仁素(又称c23)是目前发现的271种核仁蛋白质中含量最多的一种,约占核仁蛋白质总量的10%。核仁素主要存在于真核细胞核仁的致密纤维组分与颗粒区,具有多种生物学功能,包括调控核糖体的生物合成与成熟,调控细胞增殖、生长、胚胎发生、胞质分裂、染色质复制与核仁的发生等过程,并具有抗细胞凋亡作用。近年研究表明核仁素可作为多功能穿梭蛋白穿梭于细胞浆与细胞核之间,甚至表达在细胞膜表面作为多种蛋白分子、细菌、病毒的受体或配体。多种生物学配体与细胞膜上的核仁素结合后可以被转运人细胞内.表明核仁素在此过程中起分子伴侣作用。因此核仁素的生物学功能除了与其在细胞内表达有关外,还与其在细胞膜上的表达有重要的关系。
3.核仁素主要分布于真核细胞核仁的致密纤维组分与颗粒区,少量存在于核基质、细胞质以及细胞膜表面。在增殖活跃的细胞特别是肿瘤细胞中核仁素表达较高,细胞膜和细胞质核仁素的表达量与恶性肿瘤的预后呈负相关,可以作为肿瘤恶性度分级的有效指标。在肿瘤细胞中,细胞膜表面的核仁素可以作为多种配体的受体,多种肿瘤生长因子、促血管生成因子与细胞膜上的核仁素结合后可以被转运入细胞内发挥生物学功能,促进肿瘤的发生和发展。目前乳腺癌、肝癌、结肠癌、肺癌、黑色素瘤细胞中都发现了核仁素的高表达,核仁素的高表达可以作为细胞癌变的早期信号。总的来说,核仁素在肿瘤细胞中总体表达量增高,且有向细胞质和细胞膜转移的倾向。细胞质和细胞膜核仁素表达量越高,肿瘤的预后越差。
4.然而目前市面上仅有截短型的核仁素(ncl)重组蛋白,且没有活性评估的产品。截短型核仁素(ncl)重组蛋白,不具有核仁素(ncl)蛋白的完整构象,在蛋白的活性、作用研究及相应药物筛选等方面有很大的缺陷。全长核仁素(ncl)重组蛋白具有核仁素(ncl)蛋白的完整构象,对于蛋白的活性及作用研究更具有说服力,对于相关药物筛选能起到更好的协助作用。然而目前市场上无论是截短型核仁素(ncl)重组蛋白还是全长蛋白都处于一个空缺阶段,说明目前体外表达核仁素(ncl)重组蛋白具有一定的困难性。
5.因此迫切需要开发一种体外表达核仁素(ncl)重组蛋白,对目前核仁素(ncl)重组蛋白的相关病理研究、诊断及治疗等提供一定的帮助。
技术实现要素:
6.本发明的目的是:为了解决上述技术问题,本发明的目的在于提供一种ncl全长蛋白及表达工程菌的制备方法。
7.为了达到上述目的,本发明所采用的技术是:
8.一种ncl全长蛋白及表达工程菌的制备方法,其特征在于,包括:
9.(1)根据人核仁素氨基酸序列,针对原核表达系统优化并合成huncl蛋白全长的基因编码序列,并通过酶切连接的方式将这两种片段插入pet28a(+)原核表达载体;
10.(2)将测序验证正确的重组质粒转化到bl21(de3)表达宿主菌,进行诱导表达;
11.(3)通过ni离子亲和层析获得huncl全长蛋白。
12.进一步的,步骤(1)具体包括:首先,针对原核表达系统优化并合成huncl基因编码序列;然后,将合成的基因片段通过nde i和xho i酶切位点插入pet28a(+)表达载体,该表达载体nde i酶切位点的上游包含6个组氨酸(his)的密码子,因此,诱导表达蛋白的n端携带6
×
his tag。
13.进一步的,步骤(2)具体包括:将构建正确的pet28a-huncl表达载体转化e.coli bl21(de3)菌株,涂布kan抗性平板,过夜培养后,挑取单克隆进行诱导表达。
14.进一步的,步骤(3)具体包括:诱导表达的huncl蛋白的n端融合了6
×
his tag,因此,采用ni离子亲和层析进行目的蛋白的纯化,诱导表达后的菌体重悬于lysis buffer,经超声波破碎,收集破胞液的上清(supernatant,简称s)过镍柱进行亲和层析纯化。取破胞液上清过柱子后的流穿液(flow through,简称f),梯度洗脱的蛋白溶液(elution,简称e)分别进行sds-page电泳分析,获得huncl蛋白。
15.本发明的有益效果是:本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
16.本发明提供的一种ncl全长蛋白及表达工程菌的制备方法,本发明首次体外制备得到了ncl全长蛋白,所述ncl全长蛋白包含跨膜区,且经过elisa验证具有与天然蛋白相似的结构,所述方法制备得到的ncl全长蛋白高产量、高纯度并具有结构活性。
附图说明
17.图1为本发明实施例的huncl蛋白表达sds-page分析。
18.图2为本发明实施例的蛋白质纯化sds-page电泳分析。
19.图3为本发明实施例的huncl蛋白样品的nanodrop检测结果。
具体实施方式
20.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
21.实施例本实施例涉及以下三方面内容:
22.(1)人源核仁素huncl片段编码序列的密码子优化及合成;
23.(2)huncl原核表达载体构建;
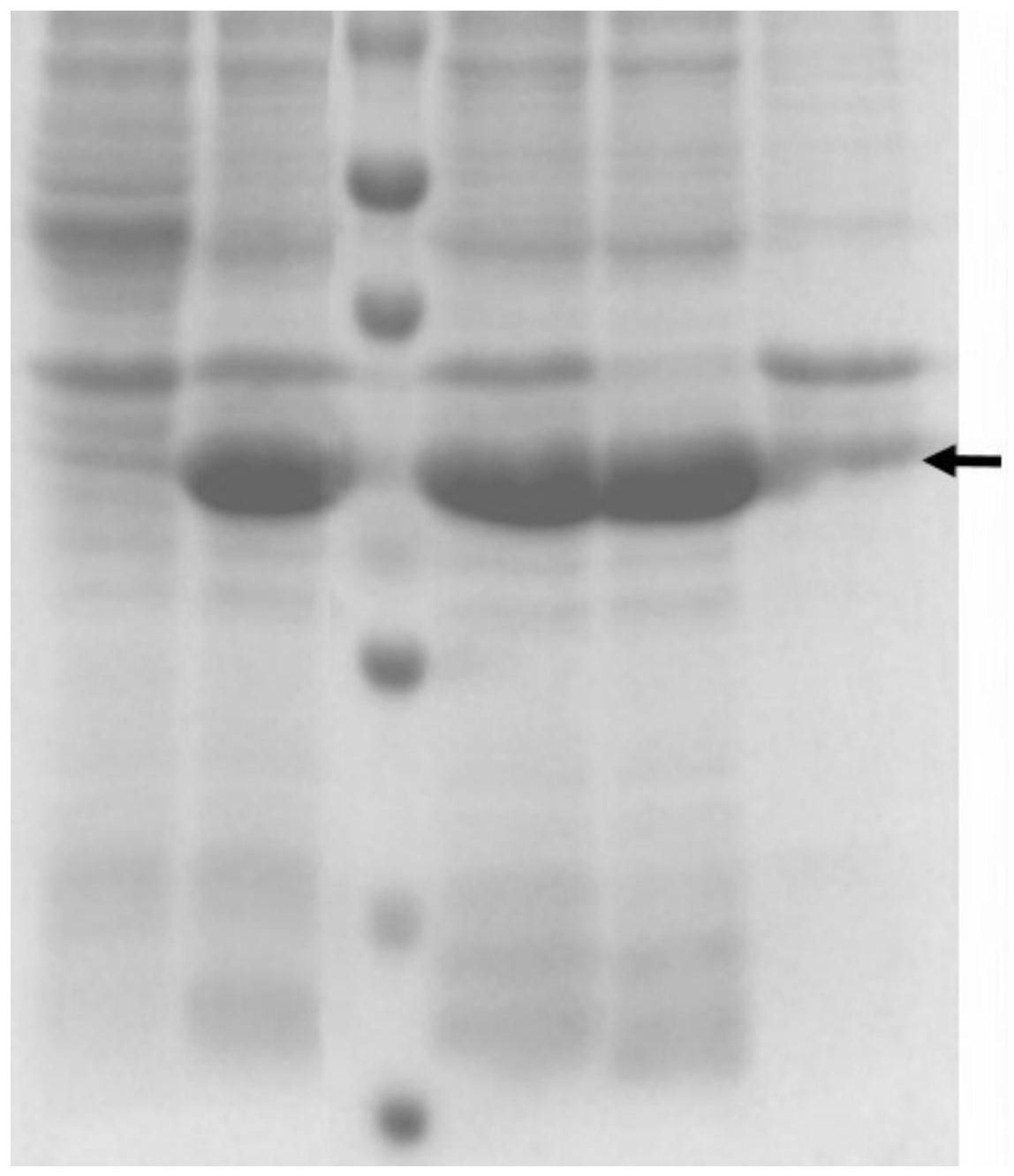
24.(3)huncl蛋白的诱导表达及纯化。
25.本实施例旨在制备人源核仁素huncl片段。首先,针对原核表达系统优化并合成huncl基因编码序列。然后,将合成的基因片段通过nde i和xho i酶切位点插入pet28a(+)表达载体。该表达载体nde i酶切位点的上游包含6个组氨酸(his)的密码子,因此,诱导表达蛋白的n端携带6
×
his tag。最后,将构建正确的表达载体转化bl21(de3)菌株,诱导表
达,并使用ni柱从胞浆中纯化目的蛋白。
26.实验材料:
27.1)pcr扩增、限制性内切酶、t4 dna连接酶等试剂盒和工具酶主要购自thermo scientific和new england biolabs等公司;
28.2)pet28a(+)、e.coli bl21(de3)等实验材料由本公司保存;
29.3)纯化柱、填料等实验材料购自ge公司,其它试剂均购自国药。
30.将上述构建正确的pet28a-huncl表达载体转化e.coli bl21(de3)菌株,涂布kan抗性平板,过夜培养后,挑取单克隆进行诱导表达。
31.表达鉴定:分别取未诱导对照菌与表达菌进行破胞处理,取破胞液进行sds-page电泳分析。结果如图所示,诱导表达样品的sds-page凝胶电泳结果,与未诱导对照菌相比,表达菌在约77kda附近有一条过表达蛋白条带,表明huncl蛋白成功诱导表达。
32.可溶性鉴定:取适量表达菌的破胞液(全菌样品,记作w),高速离心后分别收集上清(可溶成分,记作s)与沉淀,沉淀经pbs洗涤后,加入8m尿素溶解(不可溶成分,记作i)。三种样品分别取10μl电泳。结果如图1所示,huncl蛋白大部分为可溶性表达。
33.ni柱纯化huncl蛋白
34.诱导表达的huncl蛋白的n端融合了6
×
his tag。因此,采用ni离子亲和层析进行目的蛋白的纯化。诱导表达后的菌体重悬于lysis buffer,经超声波破碎,收集破胞液的上清(supernatant,简称s)过镍柱进行亲和层析纯化。取破胞液上清过柱子后的流穿液(flow through,简称f),梯度洗脱的蛋白溶液(elution,简称e)分别进行sds-page电泳分析,结果如图2所示:获得了huncl蛋白,其纯度均大于90%;流穿液中任存在较多的目的蛋白,可能的原因是蛋白表达量较高,破胞液中的蛋白含量超过ni柱的最大负载。
35.使用nanodrop光谱仪对纯化后的样品进行检测,发现huncl蛋白样品的吸收峰均为od
260
(图3),表明外源表达的huncl拥有核酸结合活性。最后,使用bca法测定纯化后蛋白的浓度,纯化后每升培养物得到得到8.8mg huncl蛋白。
36.本实施例根据人核仁素氨基酸序列,针对原核表达系统优化并合成了huncl蛋白全长的基因编码序列,并通过酶切连接的方式将这两种片段插入pet28a(+)原核表达载体。将测序验证正确的重组质粒转化到bl21(de3)表达宿主菌,进行诱导表达,经sds-page分析表明两种蛋白均能够被诱导表达,且为可溶性表达。通过ni离子亲和层析获得了8.8mg huncl蛋白,其纯度大于90%。使用nanodrop检测发现,蛋白样品的最大吸收峰均在od
260nm
,表明外源表达的huncl结合了大量核酸,具有核酸结合活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1