制备二苯并呋喃和二苯并噻吩的方法与流程
1.本发明涉及由四氟化的联苯通过碱诱导的亲核芳族取代制备4,6-二氟化的二苯并呋喃或者二苯并噻吩的方法。
背景技术:
2.文献ep 2921487公开了4,6-二氟二苯并呋喃化合物,其被证实为液晶混合物的非常有用的组分。相应的有利的4,6-二氟二苯并噻吩化合物公开于文献ep 2937342 a1中。此后发表了大量具有这些化合物的液晶混合物和这些化合物的其他变体。
3.这些化合物的合成根据文献通常通过下式的中间体来进行
4.或者
5.其中,r
1/2
各自表示h或者有机基团,和r3表示有机基团。
6.然而,这些合成通常是耗费的并且经过许多反应步骤,这导致低的收率。有机基团r2通常仅在闭环之后才引入。因此,在提供联苯前体之后,还需要大约四个反应步骤。
技术实现要素:
7.因此,本发明的任务在于提供制备4,6-氟化的二苯并呋喃和二苯并噻吩的方法,其以高的收率和纯度产生期望的产物并且优选避免了已知方法的不利之处。
8.令人惊讶地发现,这些以及其他没有明确提到的,但可由本文开篇讨论的上下文中容易地推导或推断的任务通过具有权利要求1的全部特征的制备二苯并呋喃和二苯并噻吩的方法得以解决。根据本发明的方法的有用变型在引用权利要求1的从属权利要求中得到保护。
9.尤其是发现,二苯并呋喃和二苯并噻吩能够有效地和以高的收率在几个步骤中,特别优选以一锅法或在一个单独的步骤中由氟化的联苯制备。
10.因此,本发明的主题是制备式(i)的化合物的方法
[0011][0012]
其中,
[0013]
x表示o或s,
[0014]
n表示0、1或2,优选0或1,特别优选0,
[0015][0016]
z表示单键、-ch2o-、-cf2o-或-ch2ch
2-,优选单键或-ch2o-,特别优选单键,
[0017]
r1和r2彼此独立地表示h、f、cl、或具有1至15个c原子的烃基或烃氧基基团,其中在这些基团中,一个或更多个ch2基团也可以各自彼此独立地被-c≡c-、-cf2o-、-ocf
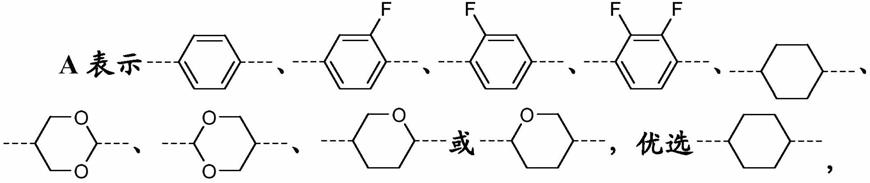
2-、-ch=ch-、、-o-、-s-、-co-o-或-o-co-如此替代以使得o原子不直接彼此相连,和其中一个或更多个h原子也可以被卤素替代,优选各自独立地表示具有1至8个c原子的烃基或烃氧基基团、环戊基、环戊基甲基、3-甲基环戊基或环丙基甲基,特别优选各自独立地表示具有1至7个c原子的烃氧基基团,
[0018]
和
[0019]
l1、l2、l3、l4各自彼此独立地表示h、f、cl、或直链或支链烃基、烃氧基、烃基羰基、烃氧基羰基、烃基羰基氧基或烃氧基羰基氧基,其中一个或更多个h原子也可以被f或cl替代,优选表示h、甲基、乙基、f或cl,
[0020]
所述方法包括式(ii)的反应物与对于x=o而言的含氧化合物或者对于x=s而言的含硫化合物反应
[0021][0022]
其中,l
1-l4、r1和r2具有上文所述的含义。
[0023]
根据本发明的方法能够简略地、非常有效地和通用地获得式(i)的4,6-氟化的二苯并呋喃和二苯并噻吩。该合成不需要具有复杂取代模式的芳族化合物。式ii的联苯可由相应的二氟苯化合物相对简单地通过交叉偶联(kreuzkopplung)(例如铃木交叉偶联,suzuki-kreuzkopplung)制备。可以在交叉偶联之前或之后将基团r1和r2引入至二氟苯化合物上,例如通过氟代芳族化合物的邻位金属化和随后与亲电体(酯、酮、醛、硼酸三烃基酯、碘等)反应。这些用于制备起始化合物的常见反应是由各种出版物已知的。
[0024]
按照根据本发明的方法可获得的二苯并呋喃和二苯并噻吩以高的纯度和良好的纯产物收率获得。此外可以总体上成本低地和没有环境危害地获得产物。
[0025]
该反应适合于其中r1和r2与亲核芳族取代的条件相容的所有基团。
[0026]
在本发明上下文中,用语“烃基(alkyl)”表示直链或支链的、饱和或不饱和的,优选饱和的脂族烃基团,其具有1至15个(即1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个)碳原子,其也可以包括完整或部分环状要素(环烃基)。
[0027]
如果烃基基团为饱和的基团,则其也可以被称为“烷基”。烃氧基(alkoxy)被理解为o-烃基基团,其中氧原子直接与被该烃氧基基团取代的基团或取代的环连接并且烃基如上文所定义;优选地,烃基则为烷基或烯基。优选的烃氧基基团为甲氧基、乙氧基、丙氧基、
丁氧基、戊氧基、己氧基、庚氧基和辛氧基,其中这些基团的每一个也可以被取代,更确切地讲优选被一个或更多个氟原子取代。烃氧基特别优选地为-och3、-oc2h5、-o-n-c3h7、-o-n-c4h9、-o-t-c4h9、-ocf3、-ochf2、-ochf或-ochfchf2。
[0028]
在本发明上下文中,用语“氧杂烃基”表示其中至少一个非末端ch2基团被-o-替代而不存在相邻杂原子(o、s)的烃基基团。优选地,氧杂烃基包括式cah
2a+1-o-(ch2)
b-的直链基团,其中a和b各自彼此独立地表示1、2、3、4、5、6、7、8、9或10;特别优选地,a为1至6的整数和b为1或2。
[0029]
在本发明上下文中,用语“烯基”表示其中存在一个或更多个-ch=ch基团的如上文定义的烃基基团。如果两个-ch=ch基团存在于该基团中,则也可以将其称为“二烯基”。烯基基团可以含有2至15个(即,2、3、4、5、6、7、8、9、10、11、12、13、14或15个)碳原子并且是支链或优选直链的。该基团是未取代的或一次或多次相同或不同地尤其被f、cl、br、i和/或cn取代。此外,一个或更多个ch2基团可以各自彼此独立地被-o-、-s-、-c≡c-、-co-o-、-oc-o-如此替代以使得杂原子(o、s)不彼此直接连接。如果ch=ch基团在两个碳原子上带有不是氢的其他基团,如当其为非末端基团时,则该ch=ch基团可以以两种构造,即作为e异构体和作为z异构体存在。通常,e异构体(反式)是优选的。优选地,烯基基团含有2、3、4、5、6或7个碳原子并且优选表示乙烯基、1e-丙烯基、1e-丁烯基、1e-戊烯基、1e-己烯基、1e-庚烯基、2-丙烯基、2e-丁烯基、2e-戊烯基、2e-己烯基、2e-庚烯基、3-丁烯基、3e-戊烯基、3e-己烯基、3e-庚烯基、4-戊烯基、4z-己烯基、4e-己烯基、4z-庚烯基、5-己烯基和6-庚烯基。特别优选的烯基基团为乙烯基、1e-丙烯基和3e-丁烯基。
[0030]
如果在烃基基团中,一个或更多个ch2基团被-c≡c-替代,则存在炔基基团。一个或更多个ch2基团被-co-o-或-o-co-替代也是可能的。在这种情况下,下述这些基团是优选的:乙酰氧基、丙酰氧基、丁酰氧基、戊酰氧基、己酰氧基、乙酰氧基甲基、丙酰氧基甲基、丁酰氧基甲基、戊酰氧基甲基、2-乙酰氧基乙基、2-丙酰氧基乙基、2-丁酰氧基乙基、2-乙酰氧基丙基、3-丙酰氧基丙基、4-乙酰氧基丁基、甲氧基羰基、乙氧基羰基、丙氧基羰基、丁氧基羰基、戊氧基羰基、甲氧基羰基甲基、乙氧基羰基甲基、丙氧基羰基甲基、丁氧基羰基甲基、2-(甲氧基羰基)乙基、2-(乙氧基羰基)乙基、2-(丙氧基羰基)-乙基、3-(甲氧基羰基)丙基、3-(乙氧基-羰基)丙基或4-(甲氧基羰基)丁基。
[0031]
在本发明的上下文中,用语“环烃基”表示具有3至16个碳原子的环状脂族(脂环族)基团,其为饱和的或部分不饱和的并且是未取代的或一次或更多次被烷基取代,其中多取代可以用相同的或用不同的取代基进行。优选地,环烃基基团是未取代的并且具有3、4、5、6或7个碳原子。环烃基尤其表示环戊基基团。
[0032]
在本发明的上下文中,用语“亚烃基(alkylene)”表示在链中具有1、2、3、4、5、6、7、8个碳原子的二价脂族烃基团,其任选地也可以一次或多次被卤素、cn、羧基、硝基、烷基、烃氧基-nh2或被-n(烷基)2取代,其中多取代可以用相同的或不同的取代基进行。优选地,“亚烃基”表示直链、未取代的或被甲基单取代的或二取代的、直链脂族基团,其具有1、2、3、4、5、6个碳原子,尤其表示-ch2ch2ch
2-和-ch2c(ch3)2ch
2-。
[0033]
在本发明的上下文中,“卤素”表示氟、氯、溴或者碘。
[0034]
根据式(i)或者(ii)的基团r1和r2各自独立地优选表示选自下述的基团:烃基、烃氧基、环烃基、环烃氧基、烃基环烃基、环烃基烃基、环烃基烃氧基和烃基环烃基烃氧基,其
中环烃基环包括3、4或5个c原子。如果ch2基团被环烃基基团、-ch=ch-或-c≡c-替代,则也可以替代末端ch2基团(h-ch
2-)。
[0035]
在式(i)或者(ii)中,基团l1至l4优选独立地表示h或甲基,特别优选h。特别优选地,l1至l4同时为h或该基团之一表示甲基并且其余的表示h。
[0036]
通过本发明的方法可获得的特别优选的式(i)的化合物选自下述优选的结构:
[0037][0038][0039][0040][0041][0042][0043][0044][0045]
[0046][0047]
其中,
[0048]
烃基和烃基'独立地表示具有1至7个c原子的烃基基团、环戊基、3-甲基环戊基、环丁基、环丙基、甲基环丙基、环戊基甲基、环丁基甲基或环丙基甲基。
[0049]
特别优选地,式(ii)的反应物选自下述结构:
[0050][0051][0052]
其中,
[0053]
烃基和烃基'独立地表示具有1至7个c原子的烃基基团、环戊基、2-甲基环戊基、环丁基、环丙基、甲基环丙基、环戊基甲基、环丁基甲基或环丙基甲基。
[0054]
用于上述式(ii)的反应物和式(i)的产物的根据本发明的方法的相应实施方案代表本发明的优选实施方案。
[0055]
基团x优选为s。
[0056]
制备二苯并呋喃化合物的优选的含氧化合物为选自下述物质的氧化物和氢氧化物,尤其是氧化物:碱金属和碱土金属,尤其是锂、钠、钾、铯或钙。特别优选的是li2o和na2o。或者进行与有机醇盐或酚盐的反应,随后醚裂解和环合成目标化合物。
[0057]
用于制备二苯并噻吩化合物的优选的含硫化合物为选自下述的硫氢化物和硫化物,尤其是氧化物的含硫化合物:钠、锂、钾、铯或钙。特别优选的是na2s和k2s。或者使用有机硫醇盐或其他硫亲核试剂,例如硫脲并且任选地在裂解硫醚之后环合。
[0058]
优选地,基于式(ii)的芳族反应物计,以1至10当量,优选1.5至4当量的量使用含氧化合物或含硫化合物。
[0059]
待使用的碱优选选自布朗斯特碱或路易斯碱,如烃基胺、氢氧化钠、氢氧化钾、甲醇钠、乙酸钠、氟化钾、磷酸钾、碳酸钾、氢氧化钙和氧化钙。特别优选使用碱金属磷酸盐作为碱,例如磷酸三钾。
[0060]
该方法优选在使用溶剂的情况下进行。这意味着反应物优选以均质相溶解形式存在和消耗(abreagieren)。优选的溶剂是非质子溶剂,此外优选的是极性溶剂。溶剂优选是无水的。
[0061]
优选的溶剂尤其包括极性非质子溶剂,例如n,n'-二甲基丙烯基脲(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮,dmpu)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、四甲基脲(tmu)、环丁砜、碳酸亚乙酯和碳酸亚丙酯。特别优选为dmpu。
[0062]
反应混合物优选在介于60℃与120℃之间的温度,特别优选在80-90℃进行。在优选的实施方案中,在分子筛(例如沸石,约)存在下进行该方法。
[0063]
该方法和随后的反应混合物的后处理可以原则上作为间歇反应或以连续反应方式进行。连续反应方式例如包括在连续反应釜反应器、搅拌釜级联、环流或错流反应器、流动管中或在微反应器中的反应。可选地进行反应混合物的后处理,这取决于需求,通过经固相过滤、色谱法、在不可混合的相之间进行分离(例如萃取)、吸附在固体载体上、蒸除溶剂和/或共沸混合物、选择性蒸馏、升华、结晶、共结晶或通过在膜上的纳米过滤来进行。
[0064]
本发明的实施方案和变体的另外的组合由权利要求得出。
[0065]
另外的优选的方法变体能够从实施例中得出,其细节也根据一般技术知识概括,代表根据本发明的方法及其产物的优选实施方案。
[0066]
本发明在下文借助示例性实施例更详细地进行阐述,但不限于此。
具体实施方式
[0067]
实施例
[0068]
根据已知的合成方法制备起始化合物。制备2,2’,3,3
’‑
四氟联苯的多种合适的方法尤其示于文献ep 2886627 a1中。
[0069]
实施例1.制备4,6-二氟二苯并噻吩衍生物
[0070][0071]
将2g 4-丁氧基-2,2’,3,3
’‑
四氟-4
’‑
丙氧基-1,1
’‑
联苯(cas1214733-49-9)与580mg硫化钠、1.4g磷酸三钾溶于30ml n,n'-二甲基丙烯基脲(dmpu)中并且在80℃加热过夜。在常规的后处理之后,获得800mg(40%)无色固体状目标化合物(熔点85℃)。
[0072]1h nmr(400mhz,氯仿-d)δ7.67(dd,j=8.6,1.1hz,2h),7.10(dd,j=8.6,7.6hz,2h),4.12(dt,j=16.3,6.6hz,4h),1.99
–
1.67(m,4h),1.53(dq,j=14.7,7.4hz,4h),1.07(t,j=7.4hz,3h),0.99(t,j=7.4hz,3h)。
[0073]
实施例2.制备4,6-二氟二苯并噻吩衍生物
[0074][0075]
将50g(146mmol)2,2’,3,3
’‑
四氟-4-乙氧基-4
’‑
丁氧基-1,1
’‑
联苯溶于450ml dmpu中。添加19.8g(220mmol)叔丁硫醇和40.3g(190mmol)k3po4和将反应混合物在75℃搅拌16h。向混合物添加300ml水和300ml庚烷和分离有机相,用水洗涤并且浓缩至干。将残余物
在150ml甲苯中提取。添加9.6g(72mmol)alcl3。将获得的黄色溶液在室温搅拌2h,然后将其倾倒在20ml hcl(10%)上。将有机相分离并且用水洗涤。将56g(231mmol)k3po4添加至甲苯相和将悬浮液在80℃搅拌过夜。在添加200ml水之后,将有机相分离,经硫酸钠干燥并且除去溶剂。获得42.5g由3-乙氧基-4,6-二氟-7-丁氧基-二苯并噻吩组成的几乎无色的残余物(纯度:86%hplc)。可以将粗产物以色谱法以及随后从热乙醇中重结晶进行纯化。
[0076]
实施例3.实施例2的替代性制备
[0077]
使用叔丁硫醇钠替代根据实施例2的由硫醇和k3po4组成的混合物。在该情况下,反应可以在至多50℃进行16h。
[0078]
实施例4.制备4,6-二氟二苯并呋喃衍生物
[0079][0080]
400mg(1.12mmol)4-丁氧基-2,2',3,3'-四氟-4'-丙氧基-1,1'-联苯溶于6ml dmpu中并且混入310mg磷酸钾一水合物以及40mg氧化锂。在120℃搅拌过夜并且以常规方式后处理。获得280mg无色固体状3-丁氧基-4,6-二氟-7-丙氧基二苯并[b,d]呋喃(0.837mmol,75%)(熔点68℃)。
[0081]1h nmr(500mhz,氯仿-d)δ7.50(dd,j=8.5,1.5hz,2h),7.01(dd,j=8.5,6.8hz,2h),4.14(dt,j=20.3,6.6hz,4h),2.12
–
1.72(m,4h),1.71
–
1.43(m,3h),1.11(t,j=7.4hz,3h),1.03(t,j=7.4hz,3h)。
[0082]
类似地制备:
[0083][0084]
熔点57℃
[0085][0086]
熔点82℃
[0087][0088]
熔点77℃
[0089]
[0090]
熔点104℃
[0091][0092]
熔点146℃
[0093][0094]
熔点212℃
[0095][0096]
熔点150℃
[0097][0098]
熔点170℃
[0099][0100]
熔点122℃。
[0101]
此外,根据本发明制备下述化合物:
[0102]
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1