空间育种酿酒酵母及其在酿造葡萄酒方面的应用的制作方法
1.本发明涉及发酵工程领域,具体涉及一株空间育种酿酒酵母及在酿造葡萄酒方面的应用。
背景技术:
2.酿酒酵母(saccharomyces cerevisiae)是葡萄酒酿造过程中采用的重要菌种,其不仅可以发酵产生酒精,在发酵过程中还可以产生多种发酵香气物质,赋予葡萄酒独特而又复杂的风味。葡萄酒的品质和风味,以及生产工艺均与采用的酿酒酵母有关。然而,目前我国葡萄酒生产过程中采用的酿酒酵母大多是进口商业活性干酵母,使得我国葡萄酒生产很大程度上受制于人,十分不利于产业自主发展。而且,我国酿酒葡萄产区与国外酿酒葡萄产区在地理位置、气候以及土壤条件等方面均有所不同,进口酵母虽然经过改良和筛选,但仍不能完全适合我国葡萄酒的酿造需要,并且存在使得不同产区葡萄酿造的葡萄酒趋于同质化的问题。
3.我国幅员辽阔,拥有多个适合酿酒葡萄种植的葡萄产区,其中,贺兰山东麓产区位于贺兰山冲击倾斜平原与黄河冲击平原交汇地带,具有昼夜温差大、日照时间长、土质优沃等适合酿酒葡萄种植的特点。但是,贺兰山东麓产区夏季气候炎热,强烈的阳光照射使得葡萄中糖含量高,酸度低,糖酸比的不平衡会对葡萄酒的品质造成不良影响。随着国内葡萄酒产业的发展,亟需开发适用于糖含量高且酸度低(糖酸比不平衡)的葡萄的葡萄酒酿造工艺,提高以该类葡萄酿造的葡萄酒的品质。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的现有商业活性干酵母无法保证由糖含量高且酸度低(糖酸比不平衡)的葡萄酿造的葡萄酒的品质的问题,提供一株空间育种酿酒酵母及其在酿造葡萄酒方面的应用。本发明提供的酿酒酵母具有发酵速度快、产酸量高、产香特性突出等优点,尤其适合酸度低、糖度高的葡萄进行高品质葡萄酒酿造使用。
5.为了实现上述目的,本发明一方面提供一株酿酒酵母,所述酿酒酵母为保藏编号为cgmcc no.20563的酿酒酵母。
6.本发明第二方面提供如上所述的酿酒酵母在酿酒中的应用。
7.本发明第三方面提供一种酿造葡萄酒的方法,所述方法包括将如前所述的酿酒酵母接种至葡萄汁中,在酿酒条件下进行发酵,获得葡萄酒。
8.本发明第四方面提供根据如上所述的方法制备获得的葡萄酒。
9.通过上述技术方案,本发明能够取得如下有益效果:(1)本发明提供的酿酒酵母具有较高的抗胁迫能力,乙醇、糖、二氧化硫、ph、温度等方面的耐受性均较强,并且还能够在低温下(例如10℃)启动发酵,适用范围广,有利于大规模推广应用;(2)本发明提供的酿酒酵母发酵速度快,5
‑
10天即可使葡萄原料的还原糖含量<
4g/l;并且在发酵过程中对葡萄酒风味不利的代谢产物产量较低,总酯类等葡萄酒香味物质产量高,具有独特而突出的产香性能,适合高品质葡萄酒酿造使用;(3)本发明提供的酿酒酵母产酸量高,特别适合酸度低、糖度高的葡萄(如贺兰山东麓产区的葡萄)进行葡萄酒酿造使用;(4)本发明提供的酿酒酵母能够替代现有菌株使用,为葡萄酒酿造提供更多的菌株选择,有助于打破目前国内葡萄酒产业采用的核心菌株受国外垄断限制的局面,完善产业链,降低生产成本。
10.生物保藏本发明提供的酿酒酵母(saccharomyces cerevisiae),已于2020年08月28日保藏于中国微生物菌种保藏委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.20563。
附图说明
11.图1是实施例1中采用ypd培养基对htzl05
‑
1进行培养时的菌落特征图;图2是实施例1中采用wl培养基对htzl05
‑
1进行培养时的菌落特征图;图3为实施例2中绘制的htzl05
‑
1的乙醇耐受性曲线图;图4为实施例2中绘制的htzl05
‑
1的葡萄糖耐受性曲线图;图5为实施例2中绘制的htzl05
‑
1的二氧化硫耐受性曲线图;图6为实施例2中绘制的htzl05
‑
1的ph耐受性曲线图;图7为实施例2中绘制的htzl05
‑
1的温度耐受性曲线图;图8为实施例4中采用htzl05
‑
1和xr酿造的贺兰山东麓产区赤霞珠干红葡萄酒的感官评价结果对比图。
具体实施方式
12.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
13.本发明中,未做特殊说明的情况下,“(本发明提供的)酿酒酵母”和“酿酒酵母htzl05
‑
1”均指本发明提供的酿酒酵母cgmcc no.20563。
14.诱变筛选是工业化菌株筛选育种的常用手段,常用的诱变方式主要包括物理诱变和化学诱变两大类,其中传统的物理诱变包括紫外诱变、电离辐射诱变、离子注入诱变、激光诱变、微波诱变等方式。然而,对于酿酒酵母而言,传统诱变育种技术得到的菌株生产性能已经达到诱变筛选的瓶颈,很难得到较大的突破。随着科技水平的提高,航天育种(又称空间育种)近年来受到广泛关注,借由太空环境中的微重力效应、极端温差、高真空环境、高能粒子辐射和弱磁场等可以对微生物产生诱变作用,显著提高基因突变频率,从而有望突破传统诱变育种的瓶颈,选育出性能更加优越的酿酒酵母。
15.本发明的发明人在研究的过程中,将自然发酵葡萄醪中分离筛选获得的的酿酒酵母菌株经太空诱变,而后筛选获得一株酿酒酵母(saccharomyces cerevisiae),其具有发
酵速度快、产香特性突出、产酸量高等特点,尤其适用于采用酸度低、糖度高的酿酒葡萄进行葡萄酒酿造使用。
16.本发明第一方面提供一株酿酒酵母(saccharomyces cerevisiae),所述酿酒酵母为保藏编号为cgmcc no.20563的酿酒酵母。
17.本发明第二方面提供如上所述的酿酒酵母在葡萄酒酿造中的应用。
18.本发明第三方面提供一种酿造葡萄酒的方法,其特征在于,所述方法包括将如前所述的酿酒酵母接种至葡萄汁和/或葡萄果浆中,在酿酒条件下进行发酵,获得葡萄酒。
19.本发明提供的方法中,对于用于葡萄酒酿造的原料(酿酒葡萄)来源没有特别限制,任意可以用于葡萄酒酿造的葡萄制成的葡萄汁或葡萄果浆均可适用于本发明提供的方法。由于本发明提供的酿酒酵母cgmcc no.20563在葡萄酒酿造过程中的产酸量高,因此,特别适合以酸度较低,糖度较高的酿酒葡萄为原料进行葡萄酒酿造(例如产自贺兰山东麓产区的葡萄)。
20.根据本发明的优选实施方式,其中,用于制备所述葡萄汁和/或葡萄果浆中的还原糖含量与总酸含量之间的比值大于15,更优选为30
‑
50。其中,还原糖含量与总酸含量(以酒石酸计)分别可以采用斐林试剂法和滴定法测得。
21.本发明提供的方法可以采用任意品种的具有上述特征的酿酒葡萄为原料进行葡萄酒酿造。根据本发明的优选实施方式,其中,用于制备所述葡萄汁和/或葡萄果浆的葡萄品种选自赤霞珠、马瑟兰、梅鹿辄、品丽珠、西拉、黑比诺、丹菲特、长相思、贵人香和霞多丽中的至少一种。用于制备所述葡萄汁和/或葡萄果浆的葡萄品种例如为产自贺兰山东麓产区的葡萄。
22.任意采用如上所述特征的酿酒葡萄制成的葡萄汁或葡萄果浆均可适用于本发明提供的方法,对于其中的成分没有特别限制。根据本发明的优选实施方式,其中,所述葡萄汁和/或葡萄果浆中还原糖的含量为150
‑
300g/l,总酸含量为4
‑
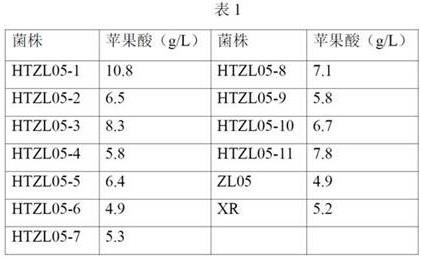
10 g/l。
23.优选地,所述葡萄汁和/或葡萄果浆中还原糖的含量为190
‑
290g/l,总酸含量为4.5
‑
6.5 g/l。
24.更优选地,所述葡萄汁和/或葡萄果浆中还原糖的含量为240
‑
260g/l,总酸含量为5.5
‑
6.5 g/l。
25.本发明提供的方法中采用的葡萄汁或葡萄果浆可以采用任意本领域现有方法制备获得,也可以直接从商购途径购买获得,只要其原料符合前述特征即可。
26.本发明提供的方法中,对于酿酒酵母的接种量没有特别限制,可以根据实际情况(例如原料来源、发酵条件、产品要求等)进行调整。根据本发明的优选实施方式,其中,所述酿酒酵母的接种量为106‑
10
10 cfu/ml。所述106‑
10
10 cfu/ml是指接种后发酵体系中酿酒酵母的含量在106‑
10
10 cfu/ml的数量级水平,例如10
6 cfu/ml的数量级水平代表的是大于等于1
×
10
6 cfu/ml至小于1
×
10
7 cfu/ml的范围,也即,如1
×
10
6 cfu/ml、5
×
10
6 cfu/ml、9.9
×
10
6 cfu/ml等均属于10
6 cfu/ml的数量级水平。因此,本发明提供的方法中,酿酒酵母的接种量在大于等于1
×
10
6 cfu/ml至小于1
×
10
11 cfu/ml的范围内。
27.优选地,所述酿酒酵母的接种量为106‑
10
8 cfu/ml。
28.任意本领域现有的适用于葡萄酒酿造的酿酒条件均可适用于本发明提供的方法。为了进一步适应糖含量高且酸度低的酿酒葡萄的特点,提高葡萄酒品质,根据本发明的优
选实施方式,其中,所述酿酒条件包括:温度10
‑
30℃(优选为12
‑
28℃,更优选为25
‑
28℃),时间5
‑
10天。
29.本发明提供的方法中,出于提升葡萄酒品质的目的,在酿造葡萄酒的原料(即葡萄汁和/或葡萄果浆)中还可以添加辅料,例如,用于帮助酵母发酵的辅料等。根据本发明的优选实施方式,其中,所述葡萄汁和/或葡萄果浆中还包括果胶酶、单宁、氮源、酵母多糖和橡木制品中的至少一种。本发明提供的方法中对于所述辅料的用量没有特别限制,可以根据实际情况(例如原料特性、辅料特性、产品需要等)进行调整。氮源可以为本领域常见的氮源,例如蛋白胨、酵母提取物等。橡木制品用于进一步改善葡萄酒的香气和风味。
30.本发明的方法中,在发酵前还可以采用常规的方法对菌株进行活化。活化的条件可以包括:温度为20
‑
25℃,时间可以为20
‑
30h。
31.本发明第四方面提供根据如上所述的方法制备获得的葡萄酒。
32.任意根据本发明提供的上述方法制备获得的葡萄酒均属于本发明的内容,对于其中的具体成分没有特别限制。
33.由于葡萄酒的成分与酿酒原料和酿酒条件等均有关联,因此,采用不同来源和品种的酿酒葡萄,或采用不同的酿酒条件获得的葡萄酒中的成分均会有所差别。
34.根据本发明的一种优选实施方式,葡萄酒为采用还原糖的含量为240
‑
250g/l,总酸含量为5.6
‑
6.3g/l的赤霞珠葡萄汁为原料,采用如前所述的酿酒条件酿造获得的葡萄酒,其中,所述葡萄酒中含有:乙醇12
‑
16体积%,高级醇200
‑
300 mg/l,酯类物质60
‑
80 mg/l,酸类香气物质100
‑
150mg/l。所述“酸类香气物质”指的是葡萄酒中的挥发性香气物质中的酸类物质,例如,己酸、辛酸、癸酸、异戊酸等。
35.优选地,所述葡萄酒中含有:乙醇12
‑
16体积%,高级醇240
‑
270 mg/l,酯类物质70
‑
80 mg/l,酸类香气物质130
‑
150 mg/l。
36.以下将通过实施例对本发明进行详细描述。应当能够理解的是,以下实施例仅用于示例性地进一步解释和说明本发明的内容,而不用于限制本发明。
37.以下实施例中采用的化学品均购自正规化学品供应商,纯度为化学纯。
38.以下实施例中采用的培养基制备方法如下:wl培养基:酵母浸粉4g/l,氯化铁0.0025g/l,葡萄糖50g/l,硫酸锰0.0025g/l,氯化钾0.425g/l,溴甲酚绿0.022g/l,氯化钙0.125g/l,硫酸镁0.125g/l,酸水解酪蛋白5g/l,磷酸二氢钾0.55g/l。按照上述用量称取试剂,溶于去离子水中,调节ph至5.5
±
0.2,即得液体wl培养基。按照20g/l的比例在液体wl培养基中加入琼脂,即得固体wl培养基。
39.将获得的培养基121℃高压灭菌15min,冷却后备用。
40.将灭菌后的固体wl培养基冷却至不烫手(约50℃),倒入平板培养皿中,冷却凝固后即得wl培养平板。
41.ypd培养基:酵母提取物10g/l,葡萄糖20g/l,蛋白胨20g/l。按照上述用量称取试剂,溶于去离子水中,无需调节ph,即得液体ypd培养基。按照1.5g/l的比例在液体ypd培养基中加入琼脂,即得固体ypd培养基。
42.将获得的培养基121℃高压灭菌15min,冷却后备用。
43.将灭菌后的固体ypd培养基冷却至不烫手(约50℃),倒入平板培养皿中,冷却凝固后即得ypd培养平板。
44.高产酸筛选培养基:酵母提取物10g/l,葡萄糖20g/l,蛋白胨20g/l,溴甲酚绿1g/l。按照上述用量称取试剂,溶于去离子水中,调节ph至6,即得液体高产酸筛选培养基。按照1.5g/l的比例在液体高产酸筛选培养基中加入琼脂,即得固体高产酸筛选培养基。
45.将获得的培养基121℃高压灭菌15min,冷却后备用。
46.将灭菌后的固体高产酸筛选培养基冷却至不烫手(约50℃),倒入平板培养皿中,冷却凝固后即得高产酸筛选培养平板。
47.葡萄汁模拟培养基:葡萄糖100g/l,果糖100g/l,酒石酸3 g/l,柠檬酸0.3 g/l,l
‑
苹果酸0.3 g/l,硫酸铵0.3 g/l,天冬酰胺0.6 g/l,一水合硫酸锰4 mg/l,一水合硫酸锌4 mg/l,磷酸二氢钾2 g/l,五水合硫酸铜1 mg/l,碘化钾1 mg/l,硼酸1 mg/l,(nh4)6mo7o
24
·
4h2o 1 mg/l,cocl2·
6h2o 0.4 mg/l,肌醇0.3 g/l,生物素0.04 mg/l,维生素b1 1 mg/l,维生素b6 1 mg/l,烟酸1 mg/l,泛酸1 mg/l,对氨基苯甲酸1 mg/l。按照上述用量称取试剂,溶于去离子水中,调节ph至5.8,过滤除菌即得葡萄汁模拟培养基。
48.实施例1本实施例用于说明本发明提供的酿酒酵母cgmcc no.20563的获得和保藏。
49.(一)菌种诱变从贺兰山东麓产区自然发酵的酿酒葡萄醪中纯化培养获得一株酿酒酵母zl05(保藏于中粮营养健康研究院酒业技术中心微生物菌种库),将其搭载于经长征五号b运载火箭首飞发射的新一代载人飞船试验船中,进行太空诱变。
50.(二)菌种纯化和筛选将冻存于
‑
80℃的太空诱变菌株的甘油保存管于4℃缓冻,于无菌工作台内以2体积%的接种量接种至wl培养平板中,30℃培养24h,随机挑取单菌落,划线分离纯化3次,获得若干单个纯种菌落。
51.初筛:采用点接法,用无菌接种针将分离纯化获得的菌落依次点接于高产酸筛选培养平板中,每个菌落设置三个平行。30℃培养48h,观察菌落周围出现的黄色圈,从中筛选出11株产酸性能较好的菌株,依次编号为htzl05
‑
1至htzl05
‑
11。
52.复筛:将htzl05
‑
1至htzl05
‑
11分别采用ypd液体培养基进行传代,再采用ypd培养平板对传代后的菌株进行培养,从ypd培养平板上挑取菌株,分别接种至装在250ml锥形瓶中的ypd液体培养基(100ml)中,摇床(180rpm,30℃)培养24h,作为种子液。
53.采用zl05和常用进口商业酿酒酵母xr(购自法国lamothe
‑
abiet公司)作为对照,采用相同的方法制备种子液。
54.采用500ml锥形瓶,按照106cfu/ml的接种量将htzl05
‑
1至htzl05
‑
11、zl05和xr的种子液接种至300ml葡萄汁模拟培养基中,初始总还原糖浓度200g/l,以发酵栓液封,25℃静置培养10
‑
14天(至还原糖含量<4g/l终止发酵)。采用液相色谱仪(安捷伦公司hplc 1200 系列)对发酵产物中的苹果酸含量进行检测,结果详见表1。
55.由表1中的数据可以看出,相较起始菌株酿酒酵母zl05而言,大部分空间诱变菌株的苹果酸产量均有所提高,与进口商业菌株xr相比也更高。其中,htzl05
‑
1的产酸能力最强,产酸量为地面菌株的2.2倍,进口商业菌株xr的2.1倍。
56.(三)菌株鉴定形态学鉴定:将试验(二)中获得的htzl05
‑
1种子液划线接种于ydp培养平板和wl培养平板,30℃培养48h,观察获得的菌落特征。
57.ypd培养平板培养结果:菌落为乳白色,圆形,有光泽,边缘整齐,粘稠,易挑起(如图1所示)。
58.wl培养平板培养结果:菌落为奶油色,呈球形突起,表面光滑,不透明,奶油状(如图2所示)。
59.5.8s
‑
its rdna基因测序鉴定:取菌株htzl05
‑
1总dna(采用百泰克公司的试剂盒dp6201,按照其说明书内容进行提取)为模板,按照表2的pcr体系和表3中的扩增程序进行its rdna扩增。
[0060]60.将扩增产物送至生工生物工程(上海)有限公司进行测序,获得如下菌株htzl05
‑
1的its rdna序列(seq id no:1):ccccggtatgcttagtacggcgagtgaagcggcaaaagctcaaatttgaaatctggtaccttcggtgcccgagttgtaatttggagagggcaactttggggccgttccttgtctatgttccttggaacaggacgtcatagagggtgagaatcccgtgtggcgaggagtgcggttctttgtaaagtgccttcgaagagtcgagttgtttgggaatgcagctctaagtgggtggtaaattccatctaaagctaaatattggcgagagaccgatagcgaacaagtacagtgatggaaagatgaaaagaactttgaaaagagagtgaaaaagtacgtgaaattgttgaaagggaagggcatttgatcagacatggtgttttgtgccctctgctccttgtgggtaggggaatctcgcatttcactgggccagcatcagttttggtggcaggataaatccataggaatgtagcttgcctcggtaagtattatagcctgtgggaatactgccagctgggactgaggactgcgacgtaa
gtcaaggatgctggcataatggttatatgccgcccgtcttgaaccacggacca将上述测序结果与ncbi中数据进行比对,发现菌株htzl05
‑
1与saccharomyces cerevisiae具有100%的同源性,结合以上形态学鉴定结果和生理生化鉴定结果,综合认定其为酿酒酵母(saccharomyces cerevisiae)。
[0061]
(四)菌株保藏于2020年08月28日,将酿酒酵母(saccharomyces cerevisiae)保藏于中国微生物菌种保藏委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.20563。保藏证明中的菌株bc60260即本实施例中筛选获得的菌株htzl05
‑
1。
[0062]
实施例2本实施例用于说明本发明提供的酿酒酵母cgmcc no.20563的抗胁迫能力。
[0063]
采用实施例1中的方法制备htzl05
‑
1种子液。采用96孔板,将该种子液按照3体积%的接种量接种到含有不同浓度胁迫物的ypd液体培养基中,检测该菌株的抗胁迫能力。
[0064]
(一)乙醇耐受性将htzl05
‑
1种子液分别接种到含有6体积%、8体积%、10体积%、12体积%、14体积%、16体积%、18体积%浓度乙醇的液体ypd培养基中,每个浓度做3个平行复孔(每孔总体积约为1ml)。30℃下,200rpm振荡培养过夜(约18h),采用酶标仪检测od
600nm
值,以确定htzl05
‑
1的乙醇耐受性。
[0065]
图3为根据检测结果绘制的htzl05
‑
1的乙醇耐受性曲线图。
[0066]
(二)糖耐受性将htzl05
‑
1种子液分别接种到含有20重量%、30重量%、40重量%、50重量%、60重量%浓度葡萄糖的液体ypd培养基中,每个浓度做3个平行复孔(每孔总体积约为1ml)。30℃下,200rpm振荡培养过夜(约18h),采用酶标仪检测od
600nm
值,以确定htzl05
‑
1的糖耐受性。
[0067]
图4为根据检测结果绘制的htzl05
‑
1的葡萄糖耐受性曲线图。
[0068]
(三)二氧化硫耐受性将htzl05
‑
1种子液分别接种到含有150mg/l、200mg/l、250mg/l、300mg/l、350mg/l浓度二氧化硫的液体ypd培养基中,每个浓度做3个平行复孔(每孔总体积约为1ml)。30℃下,200rpm振荡培养过夜(约18h),采用酶标仪检测od
600nm
值,以确定htzl05
‑
1的二氧化硫耐受性。
[0069]
图5为根据检测结果绘制的htzl05
‑
1的二氧化硫耐受性曲线图。
[0070]
(四)ph耐受性(酸耐受性)将htzl05
‑
1种子液分别接种到ph为1.5、2、2.5、3、3.5、4、4.5、5的液体ypd培养基中,每个ph做3个平行复孔(每孔总体积约为1ml)。30℃下,200rpm振荡培养过夜(约18h),采用酶标仪检测od
600nm
值,以确定htzl05
‑
1的ph耐受性。
[0071]
图6为根据检测结果绘制的htzl05
‑
1的ph耐受性曲线图。
[0072]
(五)温度耐受性将htzl05
‑
1种子液接种到液体ypd培养基中,每孔总体积约为1ml。将接种后的96孔板置于10℃、13℃、18℃、32℃、40℃下,200rpm振荡培养过夜(约18h),每个温度做3组平行实验,采用酶标仪检测od
600nm
值,以确定htzl05
‑
1的温度耐受性。
[0073]
图7为根据检测结果绘制的htzl05
‑
1的温度耐受性曲线图。
[0074]
图3
‑
7中,od
600nm
值(纵坐标)大于20%即说明菌株可正常生长发酵。根据以上实验结果可以看出,本发明提供的酿酒酵母htzl05
‑
1能够在16体积%乙醇、600g/l葡萄糖、ph1.5、40℃、350mg/l二氧化硫条件下均可正常生长发酵,且该菌株可在低温(10℃)下启动发酵。说明该菌株的抗逆性好,对于酿酒原料和工艺条件的适用范围广。
[0075]
实施例3本实施例用于说明本发明提供的酿酒酵母cgmcc no.20563的发酵效果和产香性能。
[0076]
采用实施例1中的方法进行酿酒酵母htzl05
‑
1和进口商业酿酒酵母xr的种子液制备。
[0077]
采用500ml锥形瓶,按照106cfu/ml的接种量,分别将酿酒酵母htzl05
‑
1和xr种子液接种至300ml葡萄汁模拟培养基中,以发酵栓液封,25℃下静置发酵培养10天(至还原糖含量<4g/l终止)。
[0078]
采用液相色谱法(gb/t 15038
‑
2006)对发酵产物中的乙醇、果糖、葡萄糖、甘油、乙酸、柠檬酸、苹果酸和琥珀酸含量进行检测,检测结果详见表4。
[0079]
采用agilent 6890 气相色谱(gc)和agilent 5975 质谱(ms)联用仪(agilent,美国)检测发酵产物中挥发性香气物质进行检测。具体条件:毛细管柱hp
‑
innowax polyethylene glycol 60 m
×
0.25 mm
×
0.25 μm(j&w scientific,美国)载气为高纯氦气,流速1 ml/min;顶空固相微萃取手动进样,采用不分流模式,插入气相色谱的进样口,进样口温度250℃,热解析25 min。柱温箱的升温程序是:40℃保持5 min,然后以3℃/min的速度升温至200℃,保持2 min。质谱接口温度为280℃,离子源温度为230℃,电离方式ei,离子能量70 ev,质量扫描范围20
‑
450 amu。检测结果详见表5。
[0080]
*表5中的高级醇含量是指表5中所示醇类物质的总量,酯类含量是指表5中所示酯类物质的总量,酸类含量是指表5中所示酸类物质的总量。
[0081]
根据表4和表5的数据可以看出,本发明提供的酿酒酵母htzl05
‑
1发酵过程中酸类的含量更高,例如其中苹果酸的含量达到进口商业酿酒酵母xr的2.1倍,即,酿酒酵母htzl05
‑
1在进行葡萄酒酿造时,能够显著提高葡萄酒的酸度,达到较好的增酸效果。因此,采用糖度高、酸度低的葡萄作为原料进行葡萄酒酿造时,相比于商业菌株,酿酒酵母htzl05
‑
1能够获得品质更高的葡萄酒。
[0082]
根据表5中的数据可以看出,htzl05
‑
1酿造获得的葡萄酒中的香气成分中,高级醇、总酯等产量明显高于商业酵母,且高级醇的含量并未超过不亮风味最高值(400mg/l),说明该菌株具有更强的产香能力。尤其是htzl05
‑
1酿造获得的葡萄酒中的乙酸异戊酯(具有香蕉味)、2
‑
乙酸苯乙酯(具有果香和玫瑰花香)和乳酸乙酯(具有清甜的菠萝和乳脂味
道)的含量更高,属于高产酯类的菌株,能够为葡萄酒带来独特且丰富的风味。
[0083]
而且,从本实施例中的实验内容还可以看出,本发明提供的酿酒酵母htzl05
‑
1能够快速完成葡萄酒(干红葡萄酒)的酿造过程,获得符合国家标准的葡萄酒产品,并且能够有效提高葡萄酒的酸度,增加葡萄酒的香气浓郁性和复杂性,从而使得葡萄酒品质得以提升。
[0084]
实施例4本实施例用于说明采用本发明提供的酿酒酵母cgmcc no.20563酿造获得的葡萄酒的感官评价效果。
[0085]
采用实施例1中的方法进行酿酒酵母htzl05
‑
1和进口商业酿酒酵母xr的种子液制备。
[0086]
采用产自贺兰山东麓产区的赤霞珠葡萄汁作为原料,进行葡萄酒酿造。赤霞珠葡萄汁的制备方法为:将葡萄经机械除梗破碎后出汁,经巴氏杀菌(65
°
c,30 min)后澄清,取清汁备用,从获取的清汁中取样涂布检测确认葡萄汁为无菌状态即可使用。经检测,该葡萄汁中还原糖含量(以葡萄糖计)为245.01
±
4.17g/l,总酸量(以酒石酸计)为5.94
±
0.33g/l。
[0087]
分别将htzl05
‑
1和xr种子液按照106cfu/ml的接种量接种至10l赤霞珠葡萄汁中,20℃静置24h,回温至22℃后得到htzl05
‑
1和xr的活化液。
[0088]
分别将htzl05
‑
1和xr的活化液移入100l发酵罐(华强中天流体设备(北京)有限公司,hcht
‑
100l*8)进行发酵,发酵条件为:27
±
1℃发酵,每日早中晚3次压帽,确保浸湿皮帽。发酵液中还原糖浓度<4g/l时结束发酵,获得葡萄酒。htzl05
‑
1和xr的发酵时间均为10天。
[0089]
邀请十位评定人员对采用上述方法酿造获得的葡萄酒进行感官评价,受邀的十位评定人员包括五位来自企业的国家级葡萄酒品酒师,两位国内高校中从事葡萄酒研究的教授和副教授,三位葡萄酒专业的硕士和博士研究生。感官评价项目包括:澄清度、色泽、纯正度、浓郁度、优雅度、酸度、甜度、平衡性、持续性等,并根据对葡萄酒的整体感受评定综合评分,各感官评价项目对应的总分详见表6。每项取各位评定人员评分的平均值,结果详见图8(注:图8中的分值为以10分为总分进行标准化处理后的数值)。
[0090]
根据图8中的感官评价分数对比可以看出,采用htzl05
‑
1酿造的赤霞珠干红葡萄酒具有更高的优雅度和浓郁度,香味特性更好,并且显著提高了葡萄酒的酸度,进而提高了平衡性,较好地改善了贺兰山东麓产区干红葡萄酒酸度不足的缺陷,提高了该产区葡萄酒的品质。
[0091]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1