一种将木质纤维素水解液回用于发酵生产纤维素酶液的方法
1.本发明涉及一种将木质纤维素水解液回用于发酵生产纤维素酶液的方法,属于发酵生物技术领域。
背景技术:
2.纤维素酶是可以将纤维素降解为葡萄糖的一类酶的统称,在饲料、纺织、造纸、食品等领域有广泛的应用价值。在资源、环境问题日益严峻的当今社会,利用纤维素酶将秸秆、木材等木质纤维素原料降解为葡萄糖,并通过发酵或化学方法将葡萄糖转化为乙醇、有机酸等燃料和化学品,对社会的可持续发展具有重要意义。然而,用于纤维素降解的纤维素酶价格较贵,降解过程用量大,导致使用成本过高,使得乙醇、有机酸等化学物质的生产无法具备良好的经济效益,限制了木质纤维素资源的大规模利用。
3.丝状真菌是纤维素酶发酵生产的主要微生物,其纤维素酶的合成通常依赖于纤维素的诱导。目前,丝状真菌中最常用于生产纤维素酶的是里氏木霉(trichoderma reesei),里氏木霉可依赖乳糖、槐糖等诱导纤维素酶的合成。因此,纤维素酶的工业生产中通常使用上乳糖、槐糖或纤维素诱导性碳源中的一种或者将几种组合后进行发酵(如专利文献cn201010040047.2通过将不溶性碳源纤维素粉、纸浆和可溶性碳源葡萄糖、槐糖有机结合,协同诱导纤维素酶基因的表达,cn202010823783.9则是利用纤维素材料和葡萄糖,经过酶解反应生成寡糖混合物作为复合型诱导碳源)。然而,上述碳源用于纤维素酶发酵生产仍均存在不足:(1)秸秆等纤维素类原料不溶于水,补料发酵操作难度较大,且存在发酵液粘度增大、纤维素酶无效吸附等问题(et al.biotechnol biofuels,2017,10:30);(2)乳糖价格较高,不利于纤维素酶的廉价生产;(3)以葡萄糖为原料,基于β
‑
葡萄糖苷酶的糖苷合成反应制备得到的含有槐糖的混合糖液可用于纤维素酶的流加补料发酵,但是这种糖液中含有大量阻遏纤维素酶合成的葡萄糖,对流加补料要求严格(li et al.bioresource technology,2016,216:503
–
510),因此增大了实际发酵生产控制的难度。葡萄糖是工业发酵最常用的可溶性廉价碳源。使用葡萄糖代替纤维素、乳糖、槐糖等诱导性碳源进行纤维素酶发酵,有利于解决上述诱导性碳源使用中存在的问题,然而,丝状真菌中纤维素酶的合成通常受到葡萄糖等速效碳源的阻遏,一般菌株无法利用葡萄糖为唯一碳源高效合成纤维素酶,并且购买高纯度的葡萄糖仍然需要占用一部分原料成本。
4.因此,利用廉价可溶性碳源发酵生产纤维素酶,实现其经济化生产,对于纤维素酶解糖化具有重要意义。
技术实现要素:
5.针对目前纤维素酶使用价格昂贵、纤维素酶生产过程中碳源成本高、补料发酵难度大等现状,本发明提供了一种将木质纤维素水解液回用于发酵生产纤维素酶液的方法。
6.为实现上述目的,本发明提供了如下方案:
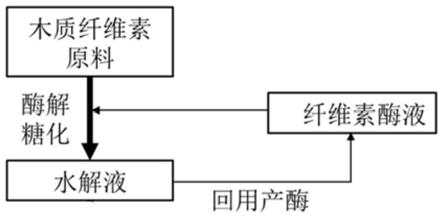
7.本发明提供了一种木质纤维素水解液回用于生产纤维素酶的方法,所述方法利用
纤维素酶液降解木质纤维素原料,得到木质纤维素水解液,以所述木质纤维素水解液为碳源,利用里氏木霉菌株h61进行发酵,生产出纤维素酶液,将所述纤维素酶液继续回用于木质纤维素原料的降解,形成循环工艺。
8.进一步地,所述循环工艺之前,需用市售的纤维素酶对木质纤维素原料进行酶解处理,将酶解处理生成的木质纤维素水解液作为培养基的碳源,利用里氏木霉菌株h61进行发酵,生产出纤维素酶液,将所述纤维素酶液继续回用于木质纤维素原料的降解,从而实现工艺的循环;或者用市售的纯葡萄糖作为培养基的碳源,利用里氏木霉菌株h61进行发酵生产出纤维素酶液,将所述纤维素酶液用于木质纤维素原料的酶解处理,生成木质纤维素水解液,以木质纤维素水解液为培养基的碳源培养里氏木霉菌株h61进行发酵,实现工艺的循环。
9.进一步地,所述木质纤维素水解液通过离心、过滤得到。
10.进一步地,所述培养基可用于分批发酵、分批补料发酵和补料发酵。
11.进一步地,所述里氏木霉菌株h61,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号,保藏日期为2021年8月11日,保藏编号为cgmcc no.23207,拉丁文名称为trichoderma reesei。
12.进一步地,所述里氏木霉菌株h61能够以葡萄糖为唯一碳源生产纤维素酶液。本发明所述方法中使用的菌株为能够以葡萄糖为唯一碳源生产纤维素酶的真菌菌株,该菌株是将里氏木霉qm9414(美国模式菌种收集中心保藏号atcc 26921)中pyr4基因敲除得到尿嘧啶营养缺陷型菌株qmp,然后将转录因子持续激活突变体xyr1
a824v
的基因表达盒转入qmp菌株得到菌株px3,再转入ace2和bgla的基因表达盒得到的。经过对转录因子编码基因xyr1表达量和序列的遗传改造,里氏木霉菌株能够突破葡萄糖对纤维素酶表达的阻遏效应,纤维素酶的合成不需要专门的诱导物,具有在以纯葡萄糖或木质纤维素水解液为碳源的培养基上生产纤维素酶的能力。
13.进一步地,所述木质纤维素原料为经预处理的木材和/或秸秆,优选为经过预处理的玉米秸秆,预处理过的玉米秸秆经纤维素酶水解后,水解液含有充足浓度的葡萄糖,可以替代纯葡萄糖进行纤维素酶的发酵生产。
14.进一步地,所述木质纤维素水解液为培养基的唯一碳源,不需加入其他种类的碳源。
15.进一步地,所述配制的培养基中葡萄糖的浓度为20g/l。
16.本发明公开了以下技术效果:
17.本发明通过对转录因子编码基因xyr1表达量和序列的遗传改造,使得里氏木霉菌株能够突破葡萄糖对纤维素酶表达的阻遏效应,纤维素酶的合成不需要专门的诱导物,具有在以纯葡萄糖或木质纤维素水解液为碳源的培养基上生产纤维素酶的能力。构建得到的里氏木霉菌株h61可以利用葡萄糖为唯一碳源高效合成纤维素酶,在以木质纤维素水解液为培养基碳源进行发酵的过程中,无需再添加其他碳源,实现了碳源成本的节约。
18.通过将木质纤维素酶解得到的富含葡萄糖的可溶性糖的水解液作为碳源少量回用于纤维素酶的就地发酵生产,同时将发酵得到的粗纤维素酶液直接用于原料的糖化,可以节省酶的浓缩、包装、运输费用,降低纤维素酶的使用成本,实现木质纤维素原料糖化过程和纤维素酶生产过程的整合,在工厂内部形成部分闭环循环工艺。在实现高水平纤维素
酶发酵的同时,解决了以纤维素、乳糖、含有槐糖的混合糖液等为碳源的发酵方法中存在的问题,有效节省了纤维素酶发酵的碳源成本,有利于提高木质纤维素降解转化企业的整体经济效益。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
20.图1为木质纤维素水解液回用于生产纤维素酶液的循环工艺图;
21.图2为在以纯葡萄糖为唯一碳源的分批培养条件下,qmp、px3、h61三种里氏木霉菌株的胞外滤纸酶、木聚糖酶和β
‑
葡萄糖苷酶活力图;
22.图3为以纯葡萄糖为唯一碳源的补料分批培养条件下,里氏木霉菌株h61的胞外滤纸酶活力、β
‑
葡萄糖苷酶活力、ph以及葡萄糖浓度图;
23.图4为以纯葡萄糖为唯一碳源培养里氏木霉菌株h61所产的粗纤维素酶液水解蒸汽爆破预处理玉米秸秆后葡萄糖产量图;
24.图5为将蒸汽爆破预处理玉米秸秆水解液回用作为唯一碳源与用纯葡萄糖为碳源,分别培养里氏木霉菌株h61时的胞外滤纸酶活力图;
25.图6为使用蒸汽爆破预处理玉米秸秆水解液为唯一碳源培养里氏木霉菌株h61所产的粗纤维素酶液,水解蒸汽爆破预处理玉米秸秆的葡萄糖产量图。
具体实施方式
26.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
27.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
28.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
29.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
30.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
31.实施例所用培养基及储备液:
32.生孢培养基(马铃薯葡萄糖琼脂,pda):称取去皮土豆200g,切碎后,加入不超过1l的水煮沸30min,经8层纱布过滤,取滤液加20g葡萄糖,定容1l,添加2%(w/v)琼脂粉,115℃灭菌30min。
33.种子培养基(/l):葡萄糖20g、(nh4)2so
4 5g、kh2po
4 15g、mgso4·
7h2o 0.6g、cacl
2 0.6g,蛋白胨2g,10000
×
微量元素母液100μl,115℃灭菌30min。
34.10000
×
微量元素母液(/l):feso4·
7h2o 50g、mnso4·
h2o 17g、znso4·
2h2o 14g、cocl2·
6h2o 20g。
35.实施例中培养尿嘧啶缺陷型菌株的培养基中均加入浓度为1g/l的尿嘧啶。
36.实施例所用试剂:
37.南京诺唯赞公司max super
‑
fidelity dnapolymerase、2
×
taq master mix;sigma公司细胞壁裂解酶lysing enzymes;omega公司琼脂糖胶回收试剂盒;鼎国昌盛生物科技有限公司goldview
tm
核酸染料。其他常规生化试剂购自国药集团化学试剂有限公司等单位。
38.实施例所用仪器:
39.超净工作台(airtech)、pcr仪(biorad)、层析实验冷柜(yc
‑
1型)、电磁炉、电泳仪(dyy
‑
11b)、霉菌培养箱(mjx智能型)、叠加式震荡培养箱、高压灭菌锅(德强仪器)、电热鼓风干燥箱(gfl
‑
125)、超微分光光度计、酶标仪、电子分析天平、大型冷冻离心机(eppendorf centrifuge 5804r)、小型台式离心机(eppendorf centrifuge minispin)、酸度计、蓝光/紫外凝胶成像仪、蓝光透射切胶仪、卤素水分测定仪、液相色谱仪等。
40.本发明滤纸酶活力测定、木聚糖酶活力测定和β
‑
葡萄糖苷酶活力测定方法均为本领域的常规技术手段,且并非发明要点,在此不做赘述。
41.本发明使用了基因工程和微生物学领域常规的技术和方法。本领域的技术人员可以在本发明提供的实施方式的基础上采用本领域其它常规技术、方法和试剂,而不限于本发明具体实施例的限定。
42.下述具体实施例阐述了将粗纤维素酶液水解木质纤维素原料所得的水解液回用于纤维素酶分批发酵的方法。在实际应用中,所使用的发酵方法不限于分批发酵,还包括补料分批发酵和连续发酵。
43.下述具体实施例阐述了将粗纤维素酶液水解蒸汽爆破预处理的玉米秸秆所得的水解液回用于纤维素酶发酵的方法。考虑到不同植物来源、不同预处理方法得到的木质纤维素原料均含有可被纤维素酶水解为葡萄糖的纤维素组分,本方法实际应用中所使用的原料不局限于玉米秸秆,所使用的预处理方法不局限于蒸汽爆破。
44.本发明以市售的纯葡萄糖作为培养基的碳源,利用里氏木霉菌株h61进行发酵生产出纤维素酶液,将纤维素酶液用于木质纤维素原料,酶解处理生成木质纤维素水解液,以木质纤维素水解液为培养基的碳源培养里氏木霉菌株h61进行发酵,实现工艺的循环;另外以市售的纤维素酶对木质纤维原料进行酶解处理作为开端实现循环工艺的方案与以市售的纯葡萄糖作为培养基的碳源作为开端实现循环工艺的方案类似,在此不做过多赘述。
45.以下通过实施例对本发明的技术方案做进一步说明。
46.实施例1里氏木霉菌株h61的构建
47.菌株:里氏木霉qmp,该菌株为实验室在里氏木霉qm9414(美国模式菌种收集中心保藏号atcc 26921)中敲除pyr4基因得到的尿嘧啶营养缺陷型菌株。在此基础上构建得到的里氏木霉菌株h61已于2021年8月11日在中国微生物菌种保藏管理委员会普通微生物中心(china general microbiological culture collection center)进行保藏,保藏号cgmcc no.23207。
48.1.纤维素酶和半纤维素酶转录激活因子xyr1的持续激活突变体xyr1
a824v
基因表达盒的构建
49.用cdna1
‑
f/cdna1
‑
r引物对在qm9414基因组dna中扩增出1.2kb大小的cdna1基因启动子片段pcdna1,该启动子片段pcdna1序列表如seq id no.1所示。
50.用xyr1
‑
f/xyr1
‑
r
‑
sur引物对扩增出xyr1持续激活突变体基因及终止子片段,该转录因子突变体xyr1
a824v
的基因序列表如seq id no.2所示。
51.利用sur
‑
f
‑
xyr1/sur
‑
r引物对扩增磺酰脲抗性基因sur表达盒(appl microbiol biotechnol,2010,87:1151
–
1156),作为筛选标记基因。
52.上述片段扩增的程序为:95℃预热3min;95℃变性15s,58℃退火15s,72℃延伸30
‑
60sec/kb,循环32次;72℃彻底延伸10min。
53.使用重叠延伸pcr方法将扩增得到的cdna1基因启动子片段和xyr1持续激活突变体基因及终止子片段融合在一起。片段融合的pcr程序为:95℃预热3min;95℃变性15s,58℃退火10min,72℃延伸30
‑
60sec/kb,循环18次;72℃彻底延伸10min。最终使用重叠延伸pcr的产物为模板,使用cdna1
‑
nf/sur
‑
cr两条引物扩增得到持续激活突变体xyr1
a824v
基因表达盒,使用片段回收试剂盒对所得到的基因表达盒进行纯化、回收。
54.上述扩增过程使用的引物序列为(5'
‑
3'):
55.cdna1
‑
f:gaattcggtctgaaggacgtggaatgatggacttaatgac
56.cdna1
‑
r:gttgagagaagttgttggattgatcaaaaag
57.xyr1
‑
f:ccaacaacttctctcaacatgttgtccaatcctctccg
58.xyr1
‑
r
‑
sur:
59.tggcgttggcacgtcgacaccgacacgcgtcaccctcaattt
60.sur
‑
f
‑
xyr1:
61.aaattgagggtgacgcgtgtcggtgtcgacgtgccaacgcca
62.sur
‑
r:ggaattgcatgctctcacgtcgac
63.cdna1
‑
nf:tggtacatggatctcgaactga
64.sur
‑
cr:aattgattattgcacgggaatt
65.2.持续激活突变体xyr1
a824v
基因表达盒转入qmp菌株制备表达菌株(命名为:里氏木霉菌株px3)
66.原生质体转化缓冲液:
67.转化液s1:1.2m山梨醇,0.1m kh2po4,ph调至8.0。
68.转化液s2:1m山梨醇,50mm cacl2,10mm tris
‑
hcl,ph调至7.5。
69.转化液s3:25%(w/v)peg6000,50mm cacl2,10mm tris
‑
hcl,ph调至7.5。
70.以上转化缓冲液均需灭菌备用。
71.转化上层培养基(/l):山梨醇182g、葡萄糖10g、柠檬酸三钠二水3g、(nh4)2so
4 6g、
mgso4·
7h2o 1g、kh2po
4 10g、琼脂糖0.6%、10000
×
微量元素母液100μl。115℃灭菌30min。
72.转化下层培养基(/l):葡萄糖10g、柠檬酸三钠二水3g、(nh4)2so
4 6g、mgso4·
7h2o 1g、1.2%(w/v)琼脂粉、10000
×
微量元素母液100μl。115℃灭菌30min。
73.a.原生质体的制备
74.1)倒pda平板,等其凝固后铺上一层玻璃纸(灭菌),然后吸取100μl(约107)新鲜的孢子悬液加到玻璃纸上,均匀涂布后,30℃静置培养12
‑
15h。待玻璃纸上面长出菌丝,玻璃纸由透明转变成半透明。
75.2)菌丝裂解液配制。在超净台中称取适量的裂解酶加入到转化液s1中,充分溶解后得到5
‰
(w/v)的菌丝裂解液。
76.3)菌丝裂解。吸取2.5ml菌丝裂解液加入到无菌平板中,然后将带有菌丝的玻璃纸放到装有裂解液的平板中,长有菌丝的一面朝上,玻璃纸与玻璃纸之间加有2.5ml的菌丝裂解液,最后一层玻璃纸长有菌丝的一面朝下,之后将培养皿用封口膜封好,将平板置于30℃条件下,裂解1h。
77.4)原生质体的获取。将装有裂解后菌丝的平板取出,用镊子将菌丝从玻璃纸上刮入裂解液中,然后用转化液s1冲洗玻璃纸上残余菌丝。
78.5)用灭菌的放有5层擦镜纸的漏斗过滤裂解液,将得到的滤液移入50ml离心管中,4℃,2500rpm,离心10min。
79.6)离心完成后,弃上清,用5ml预冷的转化液s2缓慢吹打使沉淀重悬,4℃,2500rpm离心10min。
80.7)保留200μl上清体系,缓慢吹打使沉淀重悬,置于冰上备用,即为原生质体。
81.8)取样在显微镜下镜检,可以看到呈圆形、半透明的原生质体。
82.b.原生质体的转化
83.1)依次加入200μl原生质体,10μl xyr1
a824v
基因表达盒和25μl转化液s3,用移液器缓慢混匀以上三者,放置于冰上反应20min。
84.2)将加热好的下层培养基倒入平板中,冷却凝固。
85.3)冰上反应结束后,向反应体系中加入2ml转化液s3,轻轻晃动离心管使溶液充分混匀,室温静置5min。加入2ml转化液s2并充分混匀,终止反应。
86.4)微波炉加热融化转化上层培养基,待其冷却至50℃左右时,将转化体系转移至上层培养基中混匀,加入终浓度为2μg/ml的磺酰脲抗生素,倒入提前准备好的加有下层培养基的平板中。待转化上层凝固后,用封口膜封住平板,30℃静置培养5至7天,即可得到转化子。
87.c.里氏木霉菌株px3的制备
88.将得到的转化子在筛选培养基平板上划线,纯化单孢形成的菌落,然后小量提取里是木霉基因组dna。
89.里氏木霉基因组dna提取的方法:
90.1)从筛选培养基的菌落中取适量孢子或菌丝接入装有800μl液体基本培养基的1.5ml离心管中,200rpm,30℃,培养24至36h。
91.2)之后在12000rpm,4℃,离心10min,吸干液体培养基。
92.3)加入适量石英砂涡旋振荡2min,加入500μl基因抽提缓冲液涡旋振荡2min;65℃
水浴10min。
93.4)加入200μl 10m乙酸铵,颠倒混匀,冰浴10min,12000rpm,4℃,离心10min。
94.5)收集上清至新的1.5ml离心管中,加入0.6倍体积的异丙醇,混匀后
‑
20℃放置20min,12000rpm,4℃,离心10min,弃上清。
95.6)加入200μl 70%乙醇洗涤沉淀,加入30μl ddh2o溶解沉淀,
‑
20℃储存。
96.使用cdna1
‑
nf/sur
‑
cr引物对扩增并进行dna电泳,确认转化子基因组中含有xyr1
a824v
表达盒,将所得到的里氏木霉菌株命名为px3。
97.3.ace2和bgla的基因表达盒的构建
98.为进一步提高里氏木霉菌株px3的纤维素酶产量,在该菌中对纤维素酶转录因子ace2进行过表达。此外,为弥补里氏木霉所产纤维素酶液中β
‑
葡萄糖苷酶不足的缺陷,在里氏木霉菌株px3中使用强启动子pcdna1表达来自黑曲霉的β
‑
葡萄糖苷酶bgla。β
‑
葡萄糖苷酶不足时,纤维素的降解产物纤维二糖积累,不仅无法被酿酒酵母等发酵微生物利用,还可反馈抑制纤维素酶的活性。通过高表达β
‑
葡萄糖苷酶,所产酶液可以将纤维二糖等纤维寡糖水解为葡萄糖,有助于实现木质纤维素原料的彻底降解。
99.以质粒pan7
‑
1为模板,以gpda
‑
f/gpda
‑
r
‑
ace2为引物对,得到1.3kb大小的构巢曲霉gpda基因启动子。以qm9414基因组dna为模板,以ace2
‑
f
‑
gpda/ace2
‑
r为引物对,得到大小为2.0kb的ace2编码区和终止子区,将获得的两个片段进行融合,以gpda
‑
nf/ace2
‑
nr为巢氏引物,对上述融合片段进行巢氏扩增,切胶回收得到ace2表达盒。
100.以bgl
‑
f
‑
cdna1/anbgl
‑
r引物对在黑曲霉基因组dna中扩增出β
‑
葡萄糖苷酶基因bgla的编码区和终止子区,切胶回收得到3.3kb大小的bgla基因片段。将cdna1
‑
f/cdna1
‑
r引物对扩增得到的cdna1基因启动子片段与上述bgla片段进行pcr融合,最后再以cdna1
‑
nf/anbgl
‑
nr为引物对,通过巢氏pcr得到bgla基因表达盒。
101.上述扩增过程使用的引物及序列为(5'
‑
3'):
102.gpda
‑
f:gtaaggatttcggcacggctacg
103.gpda
‑
r
‑
ace2:
104.gatcacatgcttgccggaggtccatggtgatgtctgctcaagcggggtag
105.ace2
‑
f
‑
gpda:
106.ctaccccgcttgagcagacatcaccatggacctccggcaagcatgtgatc
107.ace2
‑
r:gctgttggacggcgatagtggat
108.gpda
‑
nf:acggctacggaagacggagaagc
109.ace2
‑
nr:tgatgacttcaagacatgcaggt
110.bgl
‑
f
‑
cdna1:
111.tcaatccaacaacttctctcaacatgaggttcactttgatcgaggcgg
112.anbgl1
‑
r:gtgggtggagggtgctggaaccg
113.cdna1
‑
nf:tggtacatggatctcgaactga
114.anbgl
‑
nr:taatttatttcgttgtagtg
115.4.里氏木霉菌株h61的制备
116.将ace2和bgla的基因表达盒与潮霉素磷酸转移酶基因(hph)表达盒混合,通过原生质体转化方法共同转入px3菌株中,使用终浓度350μg/ml的潮霉素b进行转化子筛选。按
照构建px3菌株时所述的方法进行原生质体转化及转化子分纯和pcr验证。将两种表达盒同时转入px3菌株后得到的菌株命名为里氏木霉菌株h61。
117.实施例2里氏木霉菌株以葡萄糖为唯一碳源生产纤维素酶能力的评价
118.摇瓶分批发酵方法如下:
119.葡萄糖发酵培养基(/l):葡萄糖20g、cacl
2 1g、mgso4·
7h2o 0.6g、kh2po45g、(nh4)2so
4 5g、玉米浆20g。115℃灭菌30min。
120.将里氏木霉菌株qmp及实施例1中得到的菌株px3和h61的孢子接种到pda固体平板中,涂布均匀,封口膜封口,置于霉菌培养箱中30℃培养5至7天。待产生大量翠绿色孢子后,平板中加入4至5ml孢子洗脱液,用接种环轻轻划取,收集洗脱液。接种新鲜孢子于50ml种子培养基中至终浓度为106/ml,200rpm,30℃培养30至36h,吸取10%(v/v)接种孢子的培养基转接于装有50ml葡萄糖发酵培养基的300ml摇瓶中,200rpm,30℃培养7至10天。定时取发酵液,经12000rpm,4℃离心10min后测定上清液中的酶活力,测定结果见图2。
121.由图2可知,在以纯葡萄糖为唯一碳源的摇瓶分批发酵条件下,出发菌株qmp的滤纸酶活力几乎为0,木聚糖酶活力也很低,而px3菌株纤维素酶与木聚糖酶的合成则突破了葡萄糖阻遏及对诱导物的依赖,第5天的滤纸酶活力达到了1.87u/ml。与px3相比,里氏木霉菌株h61的纤维素酶和木聚糖酶产量进一步提高,第9天的滤纸酶活力达到了3.7u/ml。出发菌株qmp与px3菌株的胞外β
‑
葡萄糖苷酶活力都较低,而表达了黑曲霉β
‑
葡萄糖苷酶bgla的里氏木霉菌株h61中β
‑
葡萄糖苷酶活力显著提升,第7天达到了15u/ml。以上结果说明经过对转录因子编码基因xyr1表达量和序列的遗传改造,里氏木霉菌株能够突破葡萄糖对纤维素酶表达的阻遏效应,纤维素酶的合成不需要专门的诱导物,具有在以纯葡萄糖或木质纤维素水解液为碳源的培养基上生产纤维素酶的能力。
122.在摇瓶分批发酵基础上,进一步进行摇瓶补料分批发酵,方法如下:
123.葡萄糖发酵培养基(/l):葡萄糖20g、cacl
2 1g、mgso4·
7h2o 0.6g、kh2po45g、(nh4)2so
4 5g、玉米浆20g。使用ph 6.0的0.2m磷酸氢二钠
‑
柠檬酸缓冲液定容。115℃灭菌30min。
124.补料培养基(/l):葡萄糖500g、(nh4)2so
4 50g,该培养基使用ph 6.0的0.2m磷酸氢二钠
‑
柠檬酸缓冲液配制。115℃灭菌30min。
125.摇瓶补料分批发酵的培养方法与摇瓶分批发酵方法一致,其区别仅在于在转接于葡萄糖发酵培养基后,每24h先取样1ml用于分析,再加入1ml补料培养基以补充碳源和氮源。
126.以纯葡萄糖为唯一碳源的补料分批培养条件下,里氏木霉菌株h61的胞外滤纸酶活力、β
‑
葡萄糖苷酶活力、ph以及葡萄糖浓度见图3,里氏木霉菌株h61在第5天时滤纸酶活力达到最高,为12.0u/ml。发酵第7天,β
‑
葡萄糖苷酶活力最高,达到30.2u/ml。与分批发酵条件相比,补料发酵的最高滤纸酶活提高了224%。
127.以上结果说明,经过遗传改造的里氏木霉菌株h61具有以纯葡萄糖为唯一碳源合成纤维素酶的能力,可以以富含葡萄糖的木质纤维素水解液、粗淀粉水解液等作为碳源进行纤维素酶的发酵生产。
128.实施例3粗纤维素酶液用于玉米秸秆的水解
129.将实施例2中里氏木霉菌株h61经摇瓶分批发酵7天后得到的发酵液于12000rpm,4
℃离心10min后,取上清液制得粗纤维素酶液,将秸秆原料在115℃灭菌30min,然后在无菌条件下加入粗纤维素酶液。在50℃,150rpm的摇床中孵育,在一定时间取样离心获得上清,使用高效液相色谱对上清中的水解产物进行分析。高效液相色谱的条件为:使用shimadzu lc
‑
10ad系统,色谱柱选择hpx
‑
87p柱(bio
‑
rad),以超纯水为流动相进行分离,柱温78℃,流速为0.5ml/min。
130.酶解体系为50ml,其中含有绝干固体含量为10%(w/v)的经水洗的蒸汽爆破玉米秸秆,以及用量为每克底物10个滤纸酶活单位(fpu)的粗纤维素酶液。使用终浓度为0.05m的柠檬酸
‑
柠檬酸钠缓冲液控制体系的ph为4.8。
131.使用以纯葡萄糖为唯一碳源培养里氏木霉菌株h61所产的粗纤维素酶液水解蒸汽爆破预处理玉米秸秆后葡萄糖产量见图4,由图4可知,利用里氏木霉菌株h61所产粗纤维素酶液水解蒸汽爆破玉米秸秆72小时后,产生了35.20g/l的葡萄糖,说明以纯葡萄糖为碳源生产的纤维素酶液具有较高的酶解效率。
132.实施例4玉米秸秆水解液作为唯一碳源回用生产纤维素酶
133.以实施例3中里氏木霉菌株h61所产纤维素酶液水解蒸汽爆破玉米秸秆72小时后的水解液作为唯一碳源,配制发酵培养基用于产酶。每100ml培养基中加入实施例3中的玉米秸秆水解液57ml,使得培养基中葡萄糖的浓度为20g/l,培养基中其他组分含量与实施例2中分批发酵所用的葡萄糖发酵培养基相同,115℃灭菌30min。按照实施例2所述的分批发酵方法,使用里氏木霉菌株h61进行产酶发酵。另外设置对照组,以20g/l纯葡萄糖为碳源配制发酵培养基用于产酶,培养基中其他组分含量与实施例2中分批发酵所用的葡萄糖发酵培养基相同,115℃灭菌30min。按照实施例2所述的分批发酵方法,使用里氏木霉菌株h61进行产酶发酵。
134.将蒸汽爆破预处理玉米秸秆水解液回用作为唯一碳源与用纯葡萄糖为碳源,分别培养里氏木霉菌株h61时的胞外滤纸酶活力如图5所示。由图5可以看出,发酵第7天时,以秸秆水解液为碳源的培养基中胞外滤纸酶活力达到6.05u/ml,而作为对照的以20g/l纯葡萄糖为碳源的培养基中胞外滤纸酶活力为3.49u/ml。这一现象的原因是秸秆水解液中除了含有葡萄糖外,还含有纤维二糖、木糖等其它糖类以及无机盐、蛋白质等营养组分,可能有助于纤维素酶的生产。
135.使用以秸秆水解液为碳源生产出的粗纤维素酶液,按照实施例3中所述的方法,对蒸汽爆破玉米秸秆进行酶解。以蒸汽爆破预处理玉米秸秆水解液为唯一碳源培养里氏木霉菌株h61所产的粗纤维素酶液,水解蒸汽爆破预处理玉米秸秆的葡萄糖产量见图6。由图6可以看出,反应72h时,体系中葡萄糖含量达到35.19g/l,与实施例3中以纯葡萄糖为碳源生产出的粗纤维素酶液降解玉米秸秆产生的葡萄糖浓度相当。这一结果说明,里氏木霉菌株h61不仅能够以葡萄糖作为唯一碳源生产纤维素酶液,并且本发明的秸秆水解液可以替代纯葡萄糖为唯一碳源,生产出具有高效酶解效率的粗纤维素酶液。使用本发明提供的方法,将少量木质纤维素水解液回用于纤维素酶的发酵生产,有利于降低酶的生产成本,在木质纤维素原料的降解转化中具有良好的应用前景。
136.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1