具有防治老年痴呆功效的橙盖鹅膏菌多糖及制备方法
1.本发明公开一种橙盖鹅膏菌多糖及其结构,具有神经保护及防治老年痴呆功效,同时还提供了一种防治老年痴呆的橙盖鹅膏菌多糖的制备方法,属于医药技术领域。
背景技术:
2.阿尔茨海默氏病(ad)会导致记忆力和其他方面的认知能力下降,这是60%以上的痴呆症病例的原因。全世界有超过5000万的痴呆症患者被诊断为ad,根据预测,这一数字到2050年将增加到近1.52亿。ad的发病机制至今仍不明确,影响ad的因素众多,包括年龄、性别、生活环境、遗传背景等。越来越多研究表明,ad的产生并非一个因素单方面影响,而是多方面的协同作用导致认知障碍的产生,故目前发病机制并无明确解释,其中涉及假说包括兴奋性氨基酸毒性、胆碱能损伤假说、神经炎症假说、基因突变假说、ca
2+
平衡失调学说等。其针对发病机理进行药物研发困难重重。
3.目前使用的治疗ad的药物主要适用于轻中度神经元结构完整的老年痴呆症患者,包括胆碱酯酶抑制剂如多奈哌齐、卡巴拉汀、加兰他敏等及谷氨酸受体拮抗剂如美金刚等。且阿尔兹海默症目前临床诊断方法仍主要依靠行为症状判断为主,发现病程大部分已处于中后期,病人的认知功能受损,出现进行性认知障碍或神经行为改变,且ad的病程具有进行性和不可逆性,由于尚无特效药,主要治疗方法仍为家人的陪护治疗,由此对家庭及社会造成较大压力,据统计,目前ad的年度社会和经济成本估计为1万亿美元,若没有缓解办法,2030年该数据有望翻一番。从中医角度来说,ad属于“善忘”、“文痴”症状,治疗方法分为单味中药治疗及复方中药治疗。据记载,具有改善记忆力及神经系统功能的中药包括人参、银杏叶、葛根、淫羊藿等。
4.橙盖鹅膏菌是鹅膏菌属中最著名的食用菌之一,广泛分布于欧洲,北美洲和亚洲。因罗马帝国凯撒大帝喜欢食用此菌,固有凯撒蘑菇(caesadrs mushroom)之称。在我国,橙盖鹅膏菌主要分布于四川、云南、等地的高海拔地区,进一步研究发现,橙盖鹅膏菌中的过氧麦角甾醇成分能显著的抑制人卵巢癌细胞a2780s的增殖。研究表明,橙盖鹅膏多糖在体外具有抗氧化活性,但并未在生物体内得到明确证实且目前未见以橙盖鹅膏菌成分为治疗或保健的药品上市。
技术实现要素:
5.本发明公开了一种防治老年痴呆功效的橙盖鹅膏菌多糖及制备方法,以橙盖鹅膏菌子实体为原料,通过提取、分离得到一种橙盖鹅膏菌多糖,对其进行结构表征及神经保护及防治老年痴呆活性进行探究。
6.本发明提供一种橙盖鹅膏菌多糖,其特征在于:分子量为10-30 kda,由d-半乳糖、d-葡萄糖和d-甘露糖三种单糖组成,其摩尔比为(0.1-0.5):(0.2-0.6):(0.15-0.45)。
7.以神经保护活性为评价标准,更优的橙盖鹅膏菌多糖:分子量为16.6 kda,由d-半
乳糖、d-葡萄糖和d-甘露糖组成,其摩尔比为0.37:0.33:0.30,结构可表示为
→
[6)-α-d-manp-(1]7
→
6)-α-d-galp-(1
→
6)-β-d-galp-(1
→
6)-β-d-galp-(1
→
6)-β-d-galp
ꢀ‑
(1
→
作为主链和α-d-manp-(1
→
2)-α-d-galp-(1
→
2)-和β-d-glcp-(1
→
3)-β-d-galp
ꢀ‑
(1
→
3)-作为分支。
[0008]
本发明提供一种橙盖鹅膏菌多糖的制备方法,步骤如下:第一步:橙盖鹅膏菌子实体经超微粉碎后进行过筛,热水浸提,离心后取上清进行透析浓缩,sevag法去蛋白,醇沉后收集沉淀后冻干即获得橙盖鹅膏菌粗多糖;第二步:将获得的橙盖鹅膏菌粗多糖使用去离子水进行溶解,通过离子交换层析柱后使用氯化钠溶液进行洗脱,苯酚-硫酸法测定多糖含量,收集主峰,经过醇沉、冻干后通过凝胶过滤层析,以蒸馏水为洗脱液进行洗脱,收集主峰,4℃过夜醇沉后离心取上清,冻干即得橙盖鹅膏菌多糖(acps)。多糖产率大于90%。
[0009]
本发明所述的一种橙盖鹅膏菌多糖的制备方法,包括以下步骤:(1)橙盖鹅膏菌子实体超微粉碎成粉末,过80-200目筛;(2)加入质量20-50倍质量的去离子水,于60-90℃恒温水浴中提取2-4小时,提取两次,合并溶液;(3)冷却后8000rpm离心10分钟,取上清,旋转蒸发浓缩至1/5-1/10体积,sevag法去蛋白,旋蒸除去残留的有机试剂后,透析袋透析12-48 h,浓缩至适当浓度;(4)调节乙醇终浓度至40-80%(v/v)进行沉淀,4℃过夜,离心收集沉淀,进行冻干,即获得橙盖鹅膏菌粗多糖;(5)将橙盖鹅膏菌粗多糖用去离子水溶解,上样于deae
−
52阴离子交换柱(4
×
60cm,c8930)层析:以0.1-0.5%的nacl溶液洗脱,流速为0.1-1.0 ml / min,以每8min转换一管的速度收集洗脱液,将收集到的糖采用硫酸-苯酚法进行检测,绘制出洗脱曲线,将峰值糖进行合并,浓缩,冻干,备用。
[0010]
(6)将通过deae-52凝胶柱获得的橙盖鹅膏菌多糖冻干粉末溶于去离子水,上样于sephadex g200或g75(10x300mm)层析:以蒸馏水洗脱,流速为0.1-1.0 ml / min,将自动收集器设置为每5min转换一管的速度,采用苯酚-硫酸法测定多糖含量,收集主峰,旋转蒸发浓缩至1/6-1/10体积,4℃下60-80%(v/v)醇沉过夜,收集沉淀,进行冻干即获得橙盖鹅膏菌多糖(acps)。
[0011]
本发明所述的橙盖鹅膏菌多糖在制备防治老年痴呆疾病药物中的用途。
[0012]
本发明所述的橙盖鹅膏菌多糖在制备神经保护药物中的用途。
[0013]
一种药物制剂以本发明所述的防治老年痴呆的橙盖鹅膏菌多糖为活性成分,同时含有一种或多种药学上可接受的载体物质和/或辅剂。
[0014]
本发明的积极效果在于;提供一种高神经保护活性的橙盖鹅膏菌多糖,具有神经保护作用,能够缓解神经细胞凋亡,具有减缓其老年痴呆症状及改善脑内相关生化指标作用,可以用于制备神经保护及防治老年痴呆症药品及保健品。
附图说明
[0015]
图1:橙盖鹅膏菌粗多糖deae-52洗脱曲线;
图2:橙盖鹅膏菌多糖洗脱曲线;图3:橙盖鹅膏菌多糖紫外扫描光谱图;图4:橙盖鹅膏菌多糖红外光谱图;图5:橙盖鹅膏菌多糖的单糖组分分析图;图6:橙盖鹅膏菌多糖分子构型分析图;图7:橙盖鹅膏菌多糖nmr的1h谱图;图8:橙盖鹅膏菌多糖nmr的
13
c谱图;图9:橙盖鹅膏菌多糖nmr的dept谱图;图10:小鼠海马区aβ
1-42
免疫组化结果图;图11小鼠海马区tau(phospho s396)免疫组化结果图。
具体实施方式
[0016]
下面结合实施例对本发明作进一步说明。这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。说明书及实施例中采用的化学试剂、层析柱等,如无特殊说明均按常规实验条件下进行操作,或按供应商提供的说明进行操作。
[0017]
本发明中得到一种新的橙盖鹅膏菌多糖,以橙盖鹅膏菌子实体为原料,通过热水浸提、醇沉、浓缩、冻干等步骤,获得橙盖鹅膏菌粗多糖;粗多糖经过deae-52及sephadex g200及冻干后获得橙盖鹅膏菌多糖,通过使用紫外光谱、hplc、红外光谱、凝胶渗透色谱、gc-ms及核磁共振对橙盖鹅膏菌多糖进行结构表征。通过细胞及动物实验考察其神经保护及防治老年痴呆症的作用。
[0018]
本发明中使用的橙盖鹅膏菌子实体购买自云南裕菌隆商贸有限公司。
[0019]
实施例 1 :1)橙盖鹅膏菌子实体超微粉碎成粉末,过150目筛;2)加入菌粉质量40倍质量的去离子水,于80℃恒温水浴中提取2小时,提取2次,合并溶液;3)冷却后8000 rpm离心10分钟,取上清,旋转蒸发浓缩至1/10体积,sevag法去蛋白,旋蒸后透析过夜;4)调节乙醇终浓度至80%(v/v)进行醇沉,4℃过夜,离心收集沉淀,进行冻干,即获得橙盖鹅膏菌粗多糖-1;实施例2 :1)橙盖鹅膏菌子实体超微粉碎成粉末,过150目筛;2)加入菌粉质量30倍质量的去离子水,于80℃恒温水浴中提取3小时,提取2次,合并溶液;3)冷却后8000rpm离心10分钟,取上清,旋转蒸发浓缩至1/10体积,sevag法去蛋白,旋蒸后透析过夜;4)调节乙醇终浓度至80%(v/v)进行醇沉,4℃过夜,离心收集沉淀,进行冻干,即获得橙盖鹅膏菌粗多糖-2;
实施例3:1)将实施例1中得到的橙盖鹅膏菌粗多糖-1用去离子水溶解,上样于deae
−
52阴离子交换柱(4
×
60cm,c8930)层析。以双蒸水洗脱,流速为1.0ml/min,以每8min转换一管的速度收集洗脱液,将收集到的糖采用硫酸-苯酚法进行检测,绘制出洗脱曲线,将峰值糖进行合并,浓缩,冻干,备用。
[0020]
2)将通过deae-52凝胶柱获得的橙盖鹅膏菌多糖冻干粉末溶于去离子水,上样于sephadexg200或g75(10x300mm)层析。以蒸馏水洗脱,流速为1.0ml/min,将自动收集器设置为每5min转换一管的速度,采用苯酚-硫酸法测定多糖含量,收集主峰,旋转蒸发浓缩至1/10体积,4℃下60%(v/v)醇沉过夜,收集沉淀,进行冻干即获得橙盖鹅膏菌多糖(acps-1)。
[0021]
实施例4:1)将实施例1中得到的橙盖鹅膏菌粗多糖-1用去离子水溶解,上样于deae
−
52阴离子交换柱(4
×
60cm,c8930)层析。以0.2%的nacl溶液洗脱,流速为1.0ml/min,以每8min转换一管的速度收集洗脱液,将收集到的糖采用硫酸-苯酚法进行检测,绘制出洗脱曲线,将峰值糖进行合并,浓缩,冻干,备用。
[0022]
2)将通过deae-52凝胶柱获得的橙盖鹅膏菌多糖冻干粉末溶于去离子水,上样于sephadexg200或g75(10x300mm)层析。以蒸馏水洗脱,流速为0.5ml/min,将自动收集器设置为每5min转换一管的速度,采用苯酚-硫酸法测定多糖含量,收集主峰,旋转蒸发浓缩至1/10体积,4℃下80%(v/v)醇沉过夜,收集沉淀,进行冻干即获得橙盖鹅膏菌多糖(acps-2)。
[0023]
实施例5:1)将实施例2中得到的橙盖鹅膏菌粗多糖-2用去离子水溶解,上样于deae
−
52阴离子交换柱(4
×
60cm,c8930)层析。以0.2%的nacl溶液洗脱,流速为1.0ml/min,以每8min转换1管的速度收集洗脱液,将收集到的糖采用硫酸-苯酚法进行检测,绘制出洗脱曲线,结果如图1,将峰值糖进行合并,浓缩,冻干,备用。
[0024]
2)将通过deae-52凝胶柱获得的橙盖鹅膏菌多糖冻干粉末溶于去离子水,上样于sephadexg200或g75(10x300mm)层析。以蒸馏水洗脱,流速为0.5ml/min,将自动收集器设置为每5min转换一管的速度,采用苯酚-硫酸法测定多糖含量,收集主峰,将收集到的糖采用硫酸-苯酚法进行检测,绘制出洗脱曲线,结果如图2,旋转蒸发浓缩至1/10体积,4℃下80%(v/v)醇沉过夜,收集沉淀,进行冻干即获得橙盖鹅膏菌多糖(acps-3)。
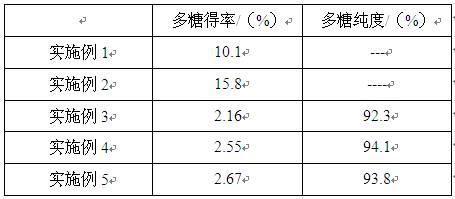
[0025]
测试例1:橙盖鹅膏菌多糖得率及纯度检测(1)试验材料实施例3-5获得的橙盖鹅膏菌多糖。
[0026]
(2)试验方法使用苯酚-硫酸法测试多糖含量,按浓度梯度配置葡萄糖标曲溶液,分别称取各实施例中50mg多糖样本,用2ml蒸馏水溶解,然后加入6%苯酚1.0ml及浓硫酸5.0ml,摇匀静置30分钟,于490nm检测各组吸光度值,通过各浓度梯度葡萄糖溶液读数结果绘制标曲,计算各实施例多糖纯度及得率,计算公式分别为:多糖得率=橙盖鹅膏菌多糖质量/橙盖鹅膏菌粉总质量
×
100%
多糖纯度=橙盖鹅膏菌多糖质量/样本称量质量
×
100%(3)试验结果结果见表1,实施例1和2多糖得率均超过10%,其中实施例2多糖提取效果更好。实施例5橙盖鹅膏菌多糖得率为2.67%,高于实施例3和实施例4,实施例3-5所获得的多糖纯度都达到了92%以上。
[0027]
表1橙盖鹅膏菌多糖得率结果比较测试例2:橙盖鹅膏菌多糖结构特征分析(1)试验材料实施例5获得的橙盖鹅膏菌多糖。
[0028]
(2)试验方法及结果紫外及红外光谱分析:紫外:适量蒸馏水溶解实施例5中获得的橙盖鹅膏菌多糖,置于200~600nm全波长扫描。紫外光谱分析结果如图3所示,实施例5获得的橙盖鹅膏菌多糖在260、280nm处无吸收峰,说明该多糖中不含蛋白质和核酸。
[0029]
红外:将实施例5获得的橙盖鹅膏菌多糖冻干粉与在100℃高温微波条件下烘干的溴化钾(质量比1:200)混合压片,进行红外光谱扫描。扫描结果如图4所示,在500~4000cm-1
扫描波长的区间内,橙盖鹅膏菌多糖在3409cm-1
为o-h伸缩振动吸收峰,是糖类的特征峰。在2927cm-1
处有一个吸收峰,这归因于c-h伸缩振动。1639cm-1
处的吸收峰可能归因于结晶水。在1402cm-1
处有一个吸收峰,这归因于c-o伸缩振动。在1382cm-1
处有一个吸收峰,这归因于c=o对称伸缩振动。在1074cm-1
处有一个吸收峰,这归因于o-h变角振动。831cm-1
处有吸收峰,可能是α-端基差向异构的c-h变角振动,但不能完全确定多糖为α-端构型。
[0030]
单糖组分分析:准确称取橙盖鹅膏菌多糖20.0mg,用5mol/l的硫酸溶解,105℃条件下密闭水解6h。冷却后用碳酸钡将ph调整为7.0。离心取上清液用0.22
µ
m滤膜过滤。通过高效液相色谱(hplc)/蒸发光散射检测器(elsd)进行分析。采用lc-10atvphplc系统联合alltech2000es蒸发光检测器,色谱柱使用prevailtmes糖柱(250
×
4.6mm),流动相为80%乙腈,流速1.0ml/min,柱温35℃,漂移管温度82℃,载气量2.1l/min,进样量20
µ
l。结果如图5所示,橙盖鹅膏菌多糖主要由四种单糖组成,其种类及摩尔比为:d-半乳糖(gal):d-葡萄糖(glc):d-甘露糖(man)=0.37:0.33:0.30。
[0031]
分子量和均一性分析:配备凝胶排阻色谱柱(ohpaksb-805hq,300
×
8mm)、差分
检测器(optilab t-rex)和激光的凝胶色谱-微分-多角度激光光散射系统光散射检测器(dawn heleos 2)用于评估橙盖鹅膏菌的均匀性和分子量。检测条件为:流动相为0.1 m nano3,进样量为100 μl,流速为0.4 ml / min,柱温箱温度为45 ℃。通过结果分析可得实施例5获得的橙盖鹅膏菌多糖具有均匀的单峰,表明其均一性好,分子量为16.6 kda,结果如图6,rg对mw(rms)构象图显示该多糖的分子构型为不规则卷曲,表明存在分支。
[0032]
甲基化及乙酰化分析:为了确定多糖的键合结构,进行甲基化和乙酰化反应。制备的样品通过气相色谱-质谱仪 (gc-ms)进行分析。通过其典型的保留时间和电子撞击曲线来确定衍生物类型。步骤如下:甲基化反应:整个反应均在20℃,n2保护下进行。分别取10mg干燥的橙盖鹅膏菌多糖及其糖酸还原产物加入到圆底烧瓶中,加2ml dmso超声溶解后加入30mg干燥的naoh粉末反应3h,沿壁缓慢滴加1ml ch3i,避光超声反应2h,保持实验在冰水浴下进行,反应结束时加3ml水终止反应,等比例加入chci3萃取,收集有机相,重复3次,干燥后重复甲基化至ir扫描图谱中没有羟基峰。后续反应:向甲基化后的样品中加4ml 2mol/l的tfa,于110℃下水解5h,水解后加入4ml甲醇旋干除去多余的tfa,重复3次,再加0.5ml蒸馏水溶解;取0.2ml水解液,加30mg nabh4室温下反应3h,反应过程中间断性震荡,结束后滴加25%冰乙酸,直至无气泡产生,加2ml甲醇旋干,重复3次;向还原产物中加1.5ml乙酸,于100℃下反应1h后,加2ml甲苯旋干,重复3次以除去多余的乙酸酐;向乙酰化产物中各加2ml氯仿和水,振荡,静置,收集下层有机相,用lml水洗涤3次,再加少量无水硫酸钠除水,待gc-ms分析。
[0033]
色谱系统采用安捷伦气相色谱系统(agilent 7890a)。质谱系统采用美国安捷伦公司的四极质谱检测系统(agilent 5977b),配有电子碰撞离子源(ei)和masshunter工作站。色谱柱:hp-5ms毛细管柱(30m
×
250pm
×
0.25umd);载气:he;加热器温度:250℃:程序升温条件为:初始温度140℃/min升至200℃,保持5min,再以8℃/min升至240℃:分流比:50∶1;进样量:5μl。使用ei,以全扫描模式检测分析物,质量扫描范围(m / z):30-600。根据现有数据库对甲基化多糖的特征片段进行比较确认键合方法。
[0034]
根据保留时间和复杂碳水化合物研究中心(ccrc)光谱数据库中部分甲基化糖醇乙酸酯(pmaa)的标准数据,橙盖鹅膏菌多糖主要由8个糖苷片段组成(表2)。 t-man(p) 和 t-glc(p) 的非还原末端的摩尔比分别达到7.237% 和 26.247%,表明可能存在分支残基。
[0035]
表2 实施例5获得的橙盖鹅膏菌多糖的甲基化分析结果
链接阶段甲基化糖分子量(da)相对摩尔比/(%)t-glc(p)1,5-di-o-acetyl-2,3,4,6-tetra-o-methylglucitol32326.247t-man(p)1,5-di-o-acetyl-2,3,4,6-tetra-o-methylmannitol3237.2376-man(p)1,5,6-tri-o-acetyl-2,3,4-tri-o-methylmannitol35130.1502-gal(p)1,2,5-tri-o-acetyl-3,4,6-tri-o-methylglucitol3512.2313-gal(p)1,3,5-tri-o-acetyl-2,4,6-tri-o-methylgalactitol3519.0076-gal(p)1,5,6-tri-o-acetyl-2,3,4-tri-o-methylgalactitol35110.0003,6-gal(p)1,3,5,6-tetra-o-acetyl-2,4-di-o-methylgalactitol3795.9872,6-gal(p)1,2,5,6-tetra-o-acetyl-3,4-di-o-methylgalactitol3794.186
核磁共振(nmr)分析:取适量实施例5中获得的橙盖鹅膏菌多糖,溶于0.5ml d2o中,使用bruker avance av600 nmr光谱仪进行nmr分析。图7、8、9分别为橙盖鹅膏菌多糖核磁共振1h谱图、
13
c谱图及dept135谱图。质子光谱信号的主要质子峰δ5.21、5.05、5.01、
5.00、4.89、4.85、4.47、4.46、4.44、4.40主要集中在3.0~5.5ppm范围内。(图7)。碳谱分析在13cnmr(201mhz,d2o)(图8)中进行:核磁碳谱信号主要集中在60-120ppm之间。通过观察碳谱可以看出,主要的异头碳信号峰δ108.80、108.60、104.69、104.48、103.84、103.43、101.89、100.83、99.62和959.69之间,主要位于异头碳区域。dept135光谱分析,70.20、64.00、70.76、62.26、62.16、67.20、61.67和68.09ppm峰是倒置峰,表明c6的化学位移(图9)。结合异核单量子关系(hsqc)、多键碳氢关系(hmbc)、氢氢关系(h-hcosy)推测橙盖鹅膏菌多糖的连接方式,结果见表3,结构可表示为
→
[6)-α-d-manp-(1]7
→
6)-α-d-galp-(1
→
6)-β-d-galp-(1
→
6)-β-d-galp-(1
→
6)-β-d-galp-(1
→
作为主链和α-d-manp-(1
→
2)-α-d-galp-(1
→
2)-和β-d-glcp-(1
→
3)-β-d-galp-(1
→
3)-作为分支。
[0036]
表3实施例5中获得的橙盖鹅膏菌多糖的1h和13cnmr化学位移信息测试例3:橙盖鹅膏菌多糖神经保护效果检测(1)试验材料试验药物为实施例3、4、5中获得的橙盖鹅膏菌多糖;本实验采用的小鼠细胞系为小鼠海马神经元细胞系(ht22;bncc;337709)购自北纳创联生物公司;其他化学试剂为细胞培养及活力测试常用试剂如l-谷氨酸、mtt、dmso等必要试剂。
[0037]
(2)试验方法选用l-谷氨酸诱导的ht22小鼠海马神经元细胞凋亡模型,考察实施例3-5获得的橙盖鹅膏菌多糖损伤的ht22细胞的神经保护作用。ht22细胞在培养至生长对数期时进行细胞铺板,5%co2,37℃恒温培养箱培养12-14h至细胞贴壁,空白组及对照组给药无菌pbs,实验组分别给药配置成浓度为1mg/ml和2.5mg/ml的剂量预处理细胞3小时,然后倾倒培养液后,加入终浓度为25mm的l-谷氨酸(l-glu)对细胞进行建模处理,给药方式同上,共
同孵育24小时。96孔板中避光加入mtt的pbs溶液,20μl/孔,避光孵育4h后,用dmso溶解沉淀,于490nm下检测其吸光度,分析细胞活力的变化。以空白组存活率为100%,计算各组存活率。实验数据按平均值
±
标准差(mean
±
s.d.)表示。统计学上显著性差异根据ibmspssstatistics24软件的单因素anova分析检验组间差异(事后进行dunn's检验),p《0.05认为组间差异显著,具有统计学意义。
[0038]
(3)试验结果表4结果为实施例3、4、5中获得的橙盖鹅膏菌多糖对ht22细胞神经保护作用结果,对照组细胞活力下降至62.3%,实施例3、实施例4和实施例5获得的橙盖鹅膏菌多糖均具有显著提高ht22细胞活力的效果(p《0.05),且均具有一定的剂量依赖性。其中实施例5获得的橙盖鹅膏菌给药浓度为2.5mg/ml时达到神经保护效果最好(p《0.01),达到96.3%的细胞存活率,与对照组相比提高了34%。
[0039]
表4橙盖鹅膏菌粗多糖对ht22细胞神经保护作用结果注:与空白组相比,
##
p《0.01代表极显著;与对照组相比*p《0.05代表具有显著性,**p《0.01代表极显著。
[0040]
测试例5:橙盖鹅膏菌多糖防治老年痴呆症活性研究(1)试验材料药物:生理盐水、实施例5获得的橙盖鹅膏菌多糖。
[0041]
动物:吉林大学机构动物伦理委员会批准了动物实验(sy201905024),按照机构指南进行。36只app/ps1雄性小鼠(8周龄,spf级)和12只野生型(wt)小鼠(8周龄,spf级))购自南京大学-南京生物医学研究所[scxk(su)2015-0001]。将所有小鼠饲养在温度为23
±1°
c,湿度为50%至60%的环境中。保持12小时照明时间,均匀地照射自然光,小鼠可以自由摄取食物和水。
[0042]
(2)试验方法及结果小鼠分组及给药:将喂养24周(死亡率约16.7%)的app/ps1小鼠随机分为3组,每组10只小鼠,对照组灌胃给予10ml/kg生理盐水;给药组给予实施例5获得的橙盖鹅膏菌多糖2.5mg/kg和5mg/kg,空白组为wt小鼠,灌胃给药10ml/kg生理盐水,持续8周。
[0043]
动物行为学测试:通过morris水迷宫测试考察橙盖鹅膏菌多糖对app/ps1小鼠的认知和记忆能力的影响。
[0044]
wt及app / ps1小鼠给药第8周开始进行水迷宫训练,训练时间为4天。首先将水温调整到25℃,并使用白色粉末使整个水迷宫颜色变为白色,水位没过平台1.5cm左右即可。随后将小鼠适当标记后,放于水迷宫内,使用仪器开始计时,2分钟内若小鼠未能自己找到平台,则使用工具将小鼠引导至水迷宫内的平台上,将此过程重复4天,使小鼠记忆形成。于第5天通过水迷宫监测系统记录小鼠找到平台的时间及运动距离。
[0045]
在最后一次行为测试后,将小鼠禁食12小时。从尾静脉取样血液,并将其储存在-80
°
c的冰箱中。然后通过腹膜内注射100 mg / kg戊巴比妥钠使小鼠安乐死。快速收集大脑组织。
[0046]
脑内aβ
1-42
、tau(phospho s396)免疫组化染色: 大脑组织于10%福尔马林溶液中固定后,转入30%蔗糖的pbs溶液中孵育,低温下将大脑切成20 μm的切片,pbs洗涤两次,每次5 min。切片放入3%过氧化氢的pbs溶液中孵育20min以终止内源过氧化物酶的活性后pbs洗涤两次,每次5 min。将脑切片在5% bsa溶液中封闭1小时,并在4
°
c下与一抗抗体孵育过夜。所使用的的抗体及稀释比例为aβ1-42(稀释比例1:300), tau(phospho s396, 稀释比例1:500)。与一抗一起孵育后,pbs洗涤脑切片3次,每次10 min。洗涤后,将脑切片与igg二抗(稀释比例1:500)在室温下孵育90 min。通过dab染液染色10 min后,将脑切片在同梯度乙醇中逐级脱水,二甲苯透明,用中性树胶封片剂封片,在光学显微镜下进行镜检。
[0047]
(3)试验结果动物行为学实验结果:由表5可以看出在morris水迷宫测试中,与空白组相比,app / ps1小鼠找寻平台时间增加了160.6%,证明其记忆力减退,而橙盖鹅膏菌多糖显著缩短了app / ps1小鼠找寻平台的潜伏时间(p 《0.01),尤其是5 mg/kg给药组小鼠找寻平台时间及运动距离分别降低20.2%及51.4%,表明ad小鼠的长期记忆得到了改善。
[0048]
表5 实施例5获得橙盖鹅膏菌多糖对小鼠morris水迷宫实验影响注:数据表示为平均值
±
标准差。(n = 10 /组)。
[0049]
p 《 0.01代表极显著,对照组与空白组进行比较,多糖组与对照组进行比较。
[0050]
海马内aβ
1-42
、tau(phospho s396)免疫组化染色结果:aβ过度累积和p-tau的表达增多是ad病理过程中两个严重的诱导因素,能够显著地恶化ad。通过免疫组化对小鼠大脑内相关蛋白表达进行分析,海马中aβ
1-42
、tau(phospho s396)免疫组化结果如图10和图11。在app / ps1小鼠的海马中,acps改善了aβ
1-42
的沉积。与对照组相比,橙盖鹅膏菌多糖给药降低了aβ
1-42
沉积(图10)、抑制了小鼠海马中磷酸化的tau斑块的数量(图11)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1