一组用于检测稻曲病菌交配型的引物组、试剂或试剂盒及其应用和方法
1.本发明涉及植物保护技术领域,特别是涉及一组用于检测稻曲病菌交配型的引物组、试剂或试剂盒及其应用和方法。
背景技术:
2.稻曲病由villosiclava virens(无性态ustilaginoidea virens(cooke)takahashi)侵染水稻穗部引起,是我国水稻生产上的重大病害。近年来,稻曲病在全球各水稻产区发生越来越严重,在我国也呈现不断加重的趋势,已经从次要病害上升为主要病害,严重制约了我国水稻安全生产。
3.稻曲病菌以菌核和厚垣孢子越冬,菌核萌发产生的子囊孢子(有性生殖产生)和厚垣孢子(无性繁殖产生)均能产生次生分生孢子,均可作为稻曲病菌的侵染源。其中菌核抗逆性极强,据调查显示我国浙江省部分地区田间菌核量高达225万个/hm2。菌核萌发产生的子囊孢子更高达65亿个/hm2,覆盖水稻整个孕穗期。可见有性生殖在稻曲病流行中具有重要地位。稻曲病菌有性生殖为二极性异宗配合,由一对决定其交配型的基因位点mat1
‑
1和mat1
‑
2组成。mat1
‑
1位点含有3个基因:mat1
‑1‑
1、mat1
‑1‑
2和mat1
‑1‑
3;mat1
‑
2位点含有2个基因:mat1
‑2‑
1和mat1
‑2‑
8。
4.对稻曲病菌交配型进行监测能够及时预测田间稻曲病菌有性生殖发生情况,为稻曲病菌的流行预警提供重要的参考价值。
5.近年来,相继有研究者用常规pcr或者多重pcr对稻曲病菌的交配型基因进行了扩增。这些方法相对传统,不仅需要昂贵的pcr仪,且存在灵敏度低、特异性低等缺点。
技术实现要素:
6.为了解决上述问题,本发明提供了一组用于检测稻曲病菌交配型的引物组、试剂或试剂盒及其应用和方法。利用本发明所述引物组能够快速检测稻曲病菌交配型基因的分子生物学方法,具有灵敏度高、特异性强等优势。
7.为了实现上述目的,本发明提供如下技术方案:
8.本发明提供了一组用于检测稻曲病菌交配型的引物组,所述引物组包括第一引物组和第二引物组;
9.所述第一引物组包括mat1
‑1‑
2外引物组和mat1
‑1‑
2内引物组;所述mat1
‑1‑
2外引物组包括mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3;所述mat1
‑1‑2‑
f3的核苷酸序列如seq id no.1所示;所述mat1
‑1‑2‑
b3的核苷酸序列如seq id no.2所示;
10.所述mat1
‑1‑
2内引物组包括mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip;所述mat1
‑1‑2‑
fip的核苷酸序列如seq id no.3所示;所述mat1
‑1‑2‑
bip的核苷酸序列如seq id no.4所示;
11.所述第二引物组包括mat1
‑2‑
1外引物组和mat1
‑2‑
1内引物组;所述mat1
‑2‑
1外引物组包括mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3;所述mat1
‑2‑1‑
f3的核苷酸序列如seq id no.5所
示;所述mat1
‑2‑1‑
b3的核苷酸序列如seq id no.6所示;
12.所述mat1
‑2‑
1内引物组包括mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip;所述mat1
‑2‑1‑
fip的核苷酸序列如seq id no.7所示;所述mat1
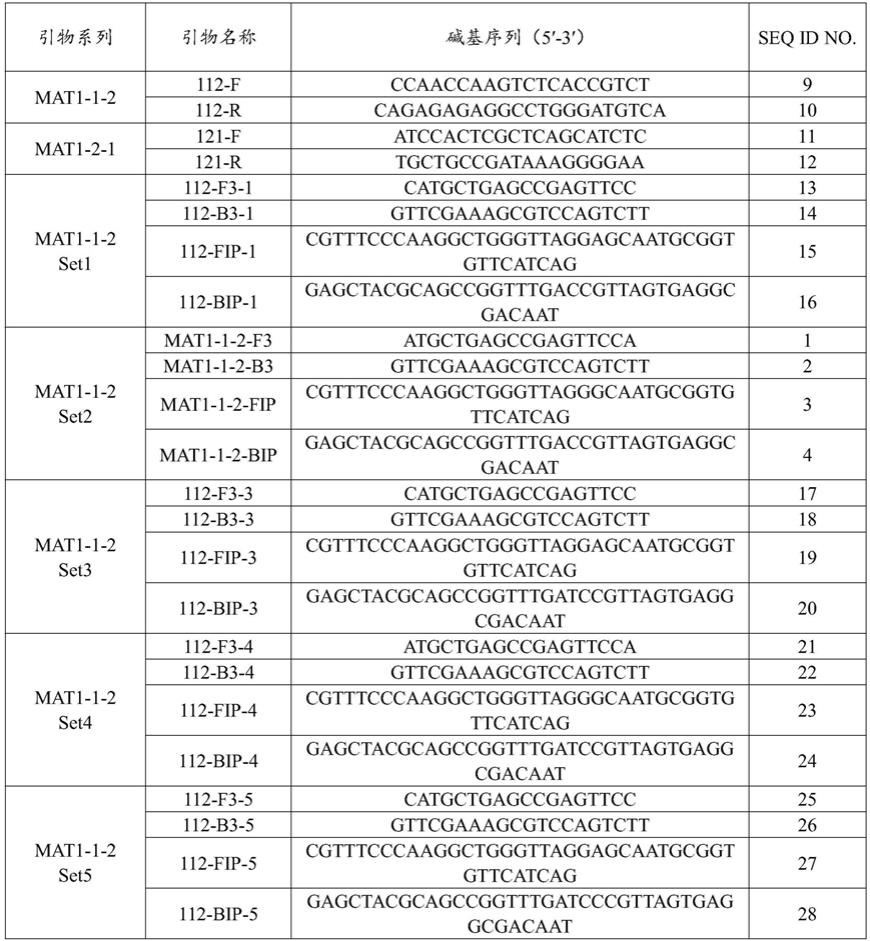
‑2‑1‑
bip的核苷酸序列如seq id no.8所示。
13.本发明提供了上述的引物组在制备检测或辅助检测稻曲病菌交配型的工具中的应用。
14.本发明提供了一种用于检测稻曲病菌交配型的试剂或试剂盒,所述试剂或试剂盒包括上述技术方案所述的引物组。
15.本发明提供了上述的引物组或上述的试剂或试剂盒在检测或辅助检测稻曲病菌交配型中的应用。
16.本发明提供了一种检测稻曲病菌交配型的方法,包括以下步骤:
17.以待测样品的dna为模板dna,与上述的引物组中的第一引物组或上述的试剂盒中的第一引物组混合后进行lamp扩增;
18.以待测样品的dna为模板dna,与上述的引物组中的第二引物组或上述的试剂盒中的第二引物组混合后进行lamp扩增;
19.如果采用所述第一引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
1交配型菌株;
20.如果采用所述第二引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
2交配型菌株;
21.第一引物组进行lamp扩增和第二引物组进行lamp扩增的顺序没有时间限定。
22.优选的,若用第一引物组扩增产物显示为蓝色,则表明该待测样品为mat1
‑
1交配型菌株;若用第二引物组扩增产物显示为蓝色,则表明该待测样品为mat1
‑
2交配型菌株。
23.优选的,若用第一引物组扩增产物的电泳图谱为梯形条带,则表明该待测样品该稻曲病菌为mat1
‑
1交配型菌株;若用第二引物组扩增产物的电泳图谱为梯形条带,则表明该稻曲病菌为mat1
‑
2交配型菌株。
24.优选的,当采用第一引物组进行lamp扩增时,所述lamp扩增的反应体系以10μl计,包括模板dna 0.9μl、bst dna聚合酶0.2μl、dntp 1.0μl、betaine 1.2μl、mat1
‑1‑2‑
f3 0.5μl、mat1
‑1‑2‑
b3 0.5μl、mat1
‑1‑2‑
fip 0.4μl、mat1
‑1‑2‑
bip 0.4μl、mg
2+
0.4μl、hnb 1.0μl、10
×
thermopol buffer 1.0μl和无菌水;
25.当采用第二引物组进行lamp扩增时,所述lamp扩增的反应体系以10μl计,包括dna模板0.9μl、bst dna聚合酶0.2μl、dntp 1.0μl、betaine 1.2μl、mat1
‑2‑1‑
f3 0.5μl、mat1
‑2‑1‑
b3 0.5μl、mat1
‑2‑1‑
fip 0.4μl、mat1
‑2‑1‑
bip 0.4μl、mg
2+
0.4μl、hnb 1.0μl、10
×
thermopol buffer 1.0μl和余量的无菌水;
26.所述lamp扩增的反应程序为61.6~63.7℃扩增45~90min。
27.优选的,所述bst dna聚合酶的工作浓度为0.16u
·
μl
‑1;所述dntp的工作浓度为1.0mmol
·
l
‑1;所述betaine的工作浓度为0.6mol
·
l
‑1;所述内引物中引物的工作浓度为1.6μmol
·
l
‑1;所述外引物中引物的工作浓度为0.5μmol
·
l
‑1;所述mg
2+
的工作浓度为4.0mmol
·
l
‑1;所述hnb的工作浓度为150μmol
·
l
‑1;所述10
×
thermopol buffer的工作浓度为1
×
;所述dna的浓度为>20μg
·
ml
‑1。
28.优选的,所述待测样品包括菌丝或菌核。
29.有益效果:本发明提供了一组用于检测稻曲病菌交配型的引物组,所述引物组包括第一引物组和第二引物组;所述第一引物组包括mat1
‑1‑
2外引物组和mat1
‑1‑
2内引物组;所述mat1
‑1‑
2外引物组包括mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3;所述mat1
‑1‑2‑
f3的核苷酸序列如seq id no.1所示;所述mat1
‑1‑2‑
b3的核苷酸序列如seq id no.2所示;所述mat1
‑1‑
2内引物组包括mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip;所述mat1
‑1‑2‑
fip的核苷酸序列如seq id no.3所示;所述mat1
‑1‑2‑
bip的核苷酸序列如seq id no.4所示;所述第二引物组包括mat1
‑2‑
1外引物组和mat1
‑2‑
1内引物组;所述mat1
‑2‑
1外引物组包括mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3;所述mat1
‑2‑1‑
f3的核苷酸序列如seq id no.5所示;所述mat1
‑2‑1‑
b3的核苷酸序列如seq id no.6所示;所述mat1
‑2‑
1内引物组包括mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip;所述mat1
‑2‑1‑
fip的核苷酸序列如seq id no.7所示;所述mat1
‑2‑1‑
bip的核苷酸序列如seq id no.8所示。本发明所述引物组是针对稻曲病菌mat1
‑
1位点基因mat1
‑1‑
2以及mat1
‑
2位点基因mat1
‑2‑
1设计引物,具有灵敏度高的优势,其检测dna的灵敏度是传统pcr的100倍,而且此引物组特异性强,通过第一引物组和第二引物组能够特异性识别靶标基因上的6个独立区域,大大降低了假阳性出现的概率。
30.而且,本发明所述引物组具有省时省力的优势。
31.另外,本发明通过对所述引物组建立了稳定的lamp反应体系,通过颜色判断即可鉴定稻曲病菌交配型;该方法重复性好、操作简便,对田间采集分离的12株稻曲病菌单孢菌株进行lamp交配型检测,其结果与传统pcr结果完全吻合。本发明所述方法具有快捷、灵敏度高、特异性强等优势,对稻曲病菌群体发展动态快速检测及稻曲病的流行预警具有重要的现实意义。
32.普通pcr反应需要pcr仪,且产物必须进行琼脂糖凝胶电泳检测,相对繁琐耗,而本发明所述检测方法在水浴锅中进行恒温反应,通过颜色判断即可鉴定稻曲病菌交配型。可见,本发明所述方法具有操作简便的优势。
附图说明
33.图1为lamp扩增反应组分优化,其中a为不同bst dna聚合酶浓度下lamp反应产物颜色变化,b为不同甜菜碱(betaine)浓度下lamp反应产物颜色变化,c为不同羟基萘酚蓝(hnb)浓度下lamp反应产物颜色变化;
34.图2为不同lamp引物筛选及特异性检测,其中a为交配型基因mat1
‑1‑
2 lamp各引物反应产物颜色变化,b为交配型基因mat1
‑1‑
2 lamp各引物反应产物电泳图谱,c为交配型基因mat1
‑2‑
1 lamp引物反应产物颜色变化,d为交配型基因mat1
‑2‑
1 lamp引物反应产物电泳图谱;
35.图3为lamp扩增反应温度优化,其中a为交配型基因mat1
‑1‑
2 lamp温度梯度反应产物颜色变化及电泳图谱,b为交配型基因mat1
‑2‑
1 lamp温度梯度反应产物颜色变化及电泳图谱;
36.图4为lamp反应时间优化,其中a为交配型基因mat1
‑1‑
2 lamp时间梯度反应产物颜色变化及电泳图谱,b为交配型基因mat1
‑2‑
1 lamp时间梯度反应产物颜色变化及电泳图谱;
37.图5为lamp的灵敏度检测图,其中a为交配型基因mat1
‑1‑
2 lamp检测mat1
‑
1型稻
曲病菌基因组dna浓度梯度反应产物颜色变化及电泳图谱,b为交配型基因mat1
‑2‑
1 lamp检测mat1
‑
2型稻曲病菌基因组dna浓度梯度反应产物颜色变化及电泳图谱,c为交配型基因mat1
‑1‑
2传统pcr检测mat1
‑
1型稻曲病菌基因组dna浓度梯度反应产物的电泳图谱,d为交配型基因mat1
‑2‑
1传统pcr检测mat1
‑
2型稻曲病菌基因组dna浓度梯度反应产物的电泳图谱;
38.图6为lamp的重复性检测,其中a为用第一引物组对12株稻曲病菌单孢菌株进行lamp检测所得反应产物颜色变化,b为用第一引物组对12株稻曲病菌单孢菌株进行lamp检测所得反应产物颜色变化,c为用传统pcr对12株稻曲病菌单孢菌株进行检测所得反应产物的电泳图谱。
具体实施方式
39.本发明提供了一组用于检测稻曲病菌交配型的引物组,所述引物组包括第一引物组和第二引物组;所述第一引物组包括mat1
‑1‑
2外引物组和mat1
‑1‑
2内引物组。
40.在本发明中,所述mat1
‑1‑
2外引物组包括mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3;所述mat1
‑1‑2‑
f3的核苷酸序列如seq id no.1所示:atgctgagccgagttcca;所述mat1
‑1‑2‑
b3的核苷酸序列如seq id no.2所示:gttcgaaagcgtccagtctt;所述mat1
‑1‑
2内引物组包括mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip;所述mat1
‑1‑2‑
fip的核苷酸序列如seq id no.3所示:cgtttcccaaggctgggttagggcaatgcggtgttcatcag;所述mat1
‑1‑2‑
bip的核苷酸序列如seq id no.4所示:gagctacgcagccggtttgaccgttagtgaggcgacaat。
41.在本发明中,所述第二引物组包括mat1
‑2‑
1外引物组和mat1
‑2‑
1内引物组;所述mat1
‑2‑
1外引物组包括mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3;所述mat1
‑2‑1‑
f3的核苷酸序列如seq id no.5所示:gtgtttttctgggggctcc;所述mat1
‑2‑1‑
b3的核苷酸序列如seq id no.6所示:cctggattcgcctctttgac;所述mat1
‑2‑
1内引物组包括mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip;所述mat1
‑2‑1‑
fip的核苷酸序列如seq id no.7所示:ttgtttccgaacggacgatccaggatgcggcatgattcttca;所述mat1
‑2‑1‑
bip的核苷酸序列如seq id no.8所示:agacgacgaaaattccccgtccattatgtcgctccttgcgg。
42.本发明所述引物组是针对稻曲病菌mat1
‑
1位点基因mat1
‑1‑
2以及mat1
‑
2位点基因mat1
‑2‑
1设计引物,具有灵敏度高的优势,其检测dna的灵敏度是传统pcr的100倍,而且此引物组特异性强,通过本发明所述引物能够特异性识别靶标基因上的6个独立区域,大大降低了假阳性出现的概率。而且,本发明所述引物组具有省时省力的优势。因此,本发明所述引物组能够用于制备检测或辅助检测稻曲病菌交配型的工具。
43.本发明提供了上述的引物组在制备检测或辅助检测稻曲病菌交配型的工具中的应用,进一步优选为检测或辅助检测稻曲病菌交配型的试剂或试剂盒。
44.本发明提供了一种用于检测稻曲病菌交配型的试剂或试剂盒,所述试剂盒或试剂包括上述的引物组;所述试剂或试剂盒优选还包括模板dna、bst dna聚合酶、dntp、betaine、mg
2+
、hnb、10
×
thermopol buffer和无菌水。利用本发明所述引物组制备的得到的试剂盒或试剂能够特异性强且灵敏度高的检测目标基因,因此,本发明所述引物组或含有所述引物组的试剂盒能够检测或辅助检测稻曲病菌交配型。
45.本发明提供了上述的引物组或上述的试剂或试剂盒在检测或辅助检测稻曲病菌
交配型中的应用。采用本发明所述试剂或试剂盒相比常规的试剂盒灵敏度提高了10~100倍,且能特异性的扩增出目的条带。
46.本发明提供了一种检测稻曲病菌交配型的方法,包括以下步骤:
47.以待测样品的dna为模板dna,与上述的引物组中的第一引物组或上述的试剂盒中的第一引物组混合后进行lamp扩增;
48.以待测样品的dna为模板dna,与上述的引物组中的第二引物组或上述的试剂盒中的第二引物组混合后进行lamp扩增;
49.如果采用所述第一引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
1交配型菌株;
50.如果采用所述第二引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
2交配型菌株;
51.第一引物组进行lamp扩增和第二引物组进行lamp扩增的顺序没有时间限定。
52.在本发明中,所述待测样品的dna的提取方法优选包括以下步骤:利用dna提取试剂盒提取待测样品的dna;本发明对所述试剂盒的来源没有特殊限定,在本发明具体实施例中,所述试剂盒优选为新型植物基因组dna提取试剂盒,购买于上海浦迪生物。在本发明中,所述待测样品优选为菌丝或菌核。本发明对待测样品的来源没有特殊要求,任意需要确定稻曲病菌交配型的均可。
53.所述提取前,本发明优选包括对待测样品进行破碎;所述破碎优选在球磨仪中进行;所述球磨仪的转速优选为1600rpm;所述球磨仪的时间程序优选为运行10s,间隔3s,循环10次。
54.本发明提取得到待测样品的dna后,优选将待测样品的dna于
‑
20℃保存备用。
55.在本发明中,所述菌丝的培养方法优选包括以下步骤:将从稻曲球上的菌组织进行单孢分离后进行培养,得菌丝。在本发明中,所述培养的时间优选为7d;所述培养的温度优选为28℃;所述培养用培养基优选为马铃薯蔗糖固体培养基(psa固体培养基);所述psa固体培养基中各组分的用量以每升psa固体培养基计,优选包括去皮马铃薯200g、蔗糖20g和琼脂粉15g。
56.本发明所述单孢分离的具体步骤优选为:将从稻曲球上的菌组织进行培养,得孢子液;将孢子液进行涂布处理。在本发明中,所述培养包括第一培养和第二培养;所述第一培养的温度优选为28℃,所述第一培养的时间优选为5~7d;所述第一培养所用培养基优选为含有抗生素的马铃薯蔗糖固体培养基(psa固体培养基),进一步第一培养所用培养基的组分优选以每升psa固体培养基计,优选包括去皮马铃薯200g、蔗糖20g和琼脂粉15g,还优选包括50~100μg
·
ml
‑1抗生素;所述抗生素优选包括卡那霉素和氨苄。在本发明中,当所述含有抗生素的马铃薯蔗糖固体培养基中含有卡那霉素时,所述卡那霉素的浓度优选为50μg
·
ml
‑1,当所述含有抗生素的马铃薯蔗糖固体培养基中含有氨苄时,所述氨苄的浓度优选为100μg
·
ml
‑1。在本发明中,所述第二培养的具体方法优选为挑取第一培养后所得菌丝进行的培养;所述第二培养的温度优选为28℃;所述第二培养的时间优选为3d;所述第二培养的方式优选为摇床培养;所述第二培养的转速优选为160rpm。在本发明中,所述第二培养所用培养基优选为psb液体培养基,所用psb液体培养基中各组分的用量以每升psb液体培养基计,优选包括去皮马铃薯200g和蔗糖20g。
57.本发明所述涂布处理的具体步骤优选为将孢子液与无菌水混合后涂布与psa平板;所述孢子液和无菌水的体积比优选为10:100;所述涂布处理的时间优选为3d。
58.本发明根据扩增结果确定所测定菌株的交配型:如果采用所述第一引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
1交配型菌株;如果采用所述第二引物组能够实现以所述dna为模版的特异性扩增,则待测样品取自mat1
‑
2交配型菌株。
59.在本发明中,lamp扩增的扩增结果优选为:若用第一引物组扩增产物显示为蓝色,则表明该待测样品为mat1
‑
1交配型菌株;若用第二引物组扩增产物显示为蓝色,则表明该待测样品为mat1
‑
2交配型菌株。或,若用第一引物组扩增产物的电泳图谱为梯形条带,则表明该待测样品该稻曲病菌为mat1
‑
1交配型菌株;若用第二引物组扩增产物的电泳图谱为梯形条带,则表明该稻曲病菌为mat1
‑
2交配型菌株。
60.进一步优选为:若用第一引物组扩增产物显示为蓝色,且用第二引物组扩增产物显示为紫色,则表明该待测样品为mat1
‑
1交配型菌株;若用第二引物组扩增产物显示为蓝色,且第一引物组扩增产物显示为紫色,则表明该待测样品为mat1
‑
2交配型菌株。或,若用第一引物组扩增产物的电泳图谱为梯形条带,且用第二引物组扩增产物的电泳图谱无扩增条带,则表明该待测样品该稻曲病菌为mat1
‑
1交配型菌株;若用第二引物组扩增产物的电泳图谱为梯形条带,且第一引物组扩增产物的电泳图谱无扩增条带,则表明该稻曲病菌为mat1
‑
2交配型菌株。
61.更优选为:若用第一引物组扩增产物显示为蓝色、电泳图谱为梯形条带,且用第二引物组扩增产物显示为紫色、电泳图谱无扩增条带,则表明该稻曲病菌为mat1
‑
1交配型菌株;若用第二引物组扩增产物显示为蓝色、电泳图谱为梯形条带,且第一引物组扩增产物显示为紫色、电泳图谱无扩增条带,则表明该稻曲病菌为mat1
‑
2交配型菌株。
62.在本发明中,所述lamp扩增的反应程序优选为61.6~63.7℃扩增45~90min,更优选为63.7℃扩增45min;利用本发明所述反应程序能够达到节约时间和成本的作用。
63.本发明当采用第一引物组进行lamp扩增时,所述lamp扩增的反应体系以10μl计,优选包括模板dna 0.9μl、bst dna聚合酶0.2μl、dntp 1.0μl、betaine(甜菜碱)1.2μl、mat1
‑1‑2‑
f3 0.5μl、mat1
‑1‑2‑
b3 0.5μl、mat1
‑1‑2‑
fip 0.4μl、mat1
‑1‑2‑
bip 0.4μl、mg
2+
0.4μl、hnb 1.0μl、10
×
thermopol buffer 1.0μl和余量的无菌水。在本发明中,当采用第二引物组进行lamp扩增时,所述lamp扩增的反应体系以10μl计,优选包括dna模板0.9μl、bst dna聚合酶0.2μl、dntp 1.0μl、betaine 1.2μl、mat1
‑2‑1‑
f3 0.5μl、mat1
‑2‑1‑
b3 0.5μl、mat1
‑2‑1‑
fip 0.4μl、mat1
‑2‑1‑
bip 0.4μl、mg
2+
0.4μl、hnb 1.0μl、10
×
thermopol buffer 1.0μl和余量的无菌水。
64.在本发明中,优选的:所述bst dna聚合酶的工作浓度为0.16u
·
μl
‑1;所述dntp的工作浓度为1.0mmol
·
l
‑1;所述betaine的工作浓度为0.6mol
·
l
‑1;所述内引物中引物的工作浓度为1.6μmol
·
l
‑1;所述外引物中引物的工作浓度为0.5μmol
·
l
‑1;所述mg
2+
的工作浓度为4.0mmol
·
l
‑1;所述hnb的工作浓度为150μmol
·
l
‑1;所述10
×
thermopol buffer的工作浓度为1
×
;所述dna的浓度为>20μg
·
ml
‑1。本发明所述bst dna聚合酶是较为昂贵的试剂之一,采用本发明所述bst dna聚合酶的用量能够降低检测成本;所述甜菜碱(betaine)不仅能够保持lamp反应中酶活的稳定性,还能促进dna双螺旋结构的解链,提高靶序列的特异性;所述hnb是lamp反应中重要的金属离子指示剂,能够直观的判定lamp反应结果。本发明
具体实施例对lamp扩增反应体系中的bst dna聚合酶、betaine和hnb的浓度进行了优化,进一步保证了实验结果。
65.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一组用于检测稻曲病菌交配型的引物组、试剂或试剂盒及其应用和方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
66.实施例1
67.分离培养稻曲病菌及提取基因组dna
68.从江苏省各地采集稻曲球,切开后挑取稻曲球内菌丝组织于含有50μg
·
ml
‑1卡那霉素的马铃薯蔗糖固体培养基(psa固体培养基,每升psa固体培养基计,为去皮马铃薯200g、蔗糖20g和琼脂粉15g)上,28℃培养5d;待其长出菌丝组织后,挑取菌丝组织于psb液体培养基(psb液体培养基,每升psb液体培养基计,为去皮马铃薯200g和蔗糖20g)中,28℃、160rpm摇培3d,显微镜下观察孢子浓度,并调节孢子浓度至40倍镜视野下约10个孢子,得孢子液。
69.取上述孢子液10μl与无菌水100μl混合均匀后涂布于psa平板上,3d后在显微镜下观察,并挑取萌发后的单孢菌株菌丝组织于新的psa平板上,得单孢菌株菌丝,继续于28℃培养7d。
70.刮取米粒大体积的上述单孢菌株的菌丝于2ml离心管中,放入钢珠后用球磨仪(1600rpm,运行10s,间隔3s,循环10次),将菌丝打碎,采用新型植物基因组dna提取试剂盒(浦迪生物,上海)提取稻曲病菌uv1
‑
56(已鉴定为mat1
‑
1型菌株)、uv2
‑
51(已鉴定为mat1
‑
2型菌株)以及12株田间采集后单孢分离菌株的基因组dna,
‑
20℃保存备用,得基因组dna,即模板dna;其中菌株uv1
‑
56和uv2
‑
51基因组dna用于实施例1~5,菌株uv1
‑
56和uv2
‑
51已公开于《mat1
‑1‑
3,a mating type gene in the villosiclava virens,is required for fruiting bodies and sclerotia formation,asexual development and pathogenicity》(yong m,yu j,pan x,et al.frontiers in microbiology,2020,11:1337);12株田间采集后单孢分离菌株基因组dna用于实施例6。
71.实施例2
72.lamp扩增的反应体系的优化
73.1、bstdna聚合酶酶活力的优化:
74.反应体系:
75.处理1中bstdna聚合酶的酶活力为0.8u,用量为0.1μl,处理2中bst dna聚合酶的酶活力为1.6u,用量为0.2μl,处理3中bst dna聚合酶的酶活力为2.4u,用量为0.3μl,处理4中bst dna聚合酶的酶活力为3.2u,用量为0.4μl,处理5中bstdna聚合酶的酶活力为4.0u,用量为0.5μl;
76.处理1~5其余组分相同,均为1.0μl dntp(工作浓度为1.0mmol
·
l
‑1)、1.5μl甜菜碱(工作浓度为0.75mol
·
l
‑1)、0.4μl内引物中引物(工作浓度为1.6μmol
·
l
‑1)、0.5μl外引物中引物(工作浓度为0.5μmol
·
l
‑1)、0.4μl mg
2+
(工作浓度为4.0mmol
·
l
‑1)、2.0μl hnb(工作浓度为300μmol
·
l
‑1)、1.0μl 10
×
thermopol buffer(工作浓度为1
×
),之后用无菌水补足至10μl。
77.反应程序:63℃,1h;
78.将实施例1提供稻曲病菌mat1
‑
1型菌株uv1
‑
56模板dna与第一引物组(mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3,mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip,详见表1)混合后进行lamp扩增。将实施例1提供稻曲病菌mat1
‑
2型菌株uv2
‑
51模板dna与第一引物组(mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3、mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip,详见表1)混合后进行lamp扩增。
79.不同bstdna聚合酶反应体系,扩增结果如图1中a所示,由其可知,采用第一引物组进行检测时,bst dna聚合酶用量为1.6、2.4、3.2和4.0u时,lamp反应产物颜色变化均为明显的蓝色。采用第二引物组进行检测时,bst dna聚合酶用量为1.6、2.4、3.2和4.0u时,lamp反应产物颜色变均为明显的蓝色;因bst dna聚合酶是较为昂贵的试剂之一,因此筛选出最低但能完成lamp反应的bst dna聚合酶使用量为1.6u,在lamp反应中,采用本发明所述bst dna聚合酶的用量能够降低检测成本。
80.表1引物的序列
81.引物具体信息seq id no.mat1
‑1‑2‑
f35
’‑
atgctgagccgagttcca
‑3’
1mat1
‑1‑2‑
b35
’‑
gttcgaaagcgtccagtctt
‑3’
2mat1
‑1‑2‑
fip5
’‑
cgtttcccaaggctgggttagggcaatgcggtgttcatcag
‑3’
3mat1
‑1‑2‑
bip5
’‑
gagctacgcagccggtttgaccgttagtgaggcgacaat
‑3’
4mat1
‑2‑1‑
f35
’‑
gtgtttttctgggggctcc
‑3’
5mat1
‑2‑1‑
b35
’‑
cctggattcgcctctttgac
‑3’
6mat1
‑2‑1‑
fip5
’‑
ttgtttccgaacggacgatccaggatgcggcatgattcttca
‑3’
7mat1
‑2‑1‑
bip5
’‑
agacgacgaaaattccccgtccattatgtcgctccttgcgg
‑3’882.2、甜菜碱(betaine)浓度的优化:
83.反应体系:
84.处理1中betaine的浓度为2.0m,处理2中betaine的浓度为4.0m,处理3中betaine的浓度为6.0m,处理4中betaine的浓度为8.0m,处理5中betaine的浓度为12.0m,用量均为1.2μl;
85.处理1~5其余组分相同,均为0.2μlbstdna聚合酶(工作浓度为0.16u
·
μl
‑1)、1.0μl dntp(工作浓度为1.0mmol
·
l
‑1)、0.4μl内引物中引物(工作浓度为1.6μmol
·
l
‑1)、0.5μl外引物中引物(工作浓度为0.5μmol
·
l
‑1)、0.4μl mg
2+
(工作浓度为4.0mmol
·
l
‑1)、2.0μl hnb(工作浓度为300μmol
·
l
‑1)、1.0μl 10
×
thermopol buffer(工作浓度为1
×
),之后用无菌水补足至10μl。
86.反应程序:63℃,1h;
87.将实施例1提供稻曲病菌mat1
‑
1型菌株uv1
‑
56模板dna与第一引物组(mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3,mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip,详见表1)混合后进行lamp扩增。将实施例1提供稻曲病菌mat1
‑
2型菌株uv2
‑
51模板dna与第一引物组(mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3、mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip,详见表1)混合后进行lamp扩增。
88.不同甜菜碱反应体系,扩增结果如图1中b所示,由其可知,采用第一引物组进行检测时,甜菜碱用量为2.0、4.0、6.0和8.0m时,lamp反应产物颜色变化均为明显的蓝色。采用第二引物组进行检测时,甜菜碱用量为6.0m时,lamp反应产物颜色变化最明显;因此,本发明筛选出最适甜菜碱用量为6.0m。采用本发明提供的甜菜碱(betaine)的用量不仅能够保
持lamp反应中酶活的稳定性,还能促进dna双螺旋结构的解链,提高靶序列的特异性,还能避免出现高浓度的甜菜碱抑制lamp扩增反应正常进行的情况。
89.3、羟基萘酚蓝(hnb)浓度的优化:
90.反应体系:处理1中hnb的浓度为0mm,处理2中hnb的浓度为0.5mm,处理3中hnb的浓度为1.0mm,处理4中hnb的浓度为1.5mm,处理5中hnb的浓度为2.0mm,处理6中hnb的用量为2.5mm,用量均为1.0μl;
91.处理1~5其余组分相同,均为0.2μl bst dna聚合酶(工作浓度为0.16u
·
μl
‑1)、1.0μl dntp(工作浓度为1.0mmol
·
l
‑1)、1.2μl甜菜碱(工作浓度为0.6mol
·
l
‑1)、0.4μl内引物中引物(工作浓度为1.6μmol
·
l
‑1)、0.5μl外引物中引物(工作浓度为0.5μmol
·
l
‑1)、0.4μl mg
2+
(工作浓度为4.0mmol
·
l
‑1)、1.0μl 10
×
thermopol buffer(工作浓度为1
×
),之后用无菌水补足至10μl。
92.反应程序:63℃,1h;
93.将实施例1提供稻曲病菌mat1
‑
1型菌株uv1
‑
56模板dna与第一引物组(mat1
‑1‑2‑
f3和mat1
‑1‑2‑
b3,mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip,详见表1)混合后进行lamp扩增。将实施例1提供稻曲病菌mat1
‑
2型菌株uv2
‑
51模板dna与第一引物组(mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3、mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip,详见表1)混合后进行lamp扩增。
94.不同羟基萘酚蓝反应体系,扩增结果如图1中c所示,可知,采用第一引物组进行检测时,hnb用量为0.5、1.0、1.5、2.0和2.5mm时,lamp反应产物颜色变化均为蓝色,但在1.5、2.0和2.5mm时为明显的蓝色。采用第二引物组进行检测时,hnb用量为0.5、1.0、1.5、2.0和2.5mm,lamp反应产物颜色变均为蓝色,但在1.5、2.0和2.5mm时为明显的蓝色;本发明筛选出了最适hnb用量为1.5mm。利用本发明筛选出来的最适hnb用量,能够使其作为重要的金属离子指示剂能直观的判定lamp反应结果,达到节约成本的作用。
95.优化后的lamp体系为:0.2μl bst dna聚合酶(工作浓度为0.16u
·
μl
‑1)、1.0μl dntp(工作浓度为1.0mmol
·
l
‑1)、1.2μl甜菜碱(工作浓度为0.6mol
·
l
‑1)、内引物中两条引物各0.4μl(两条引物的工作浓度均为1.6μmol
·
l
‑
1,
)、外引物中两条引物各0.5μl(两条引物的工作浓度均为0.5μmol
·
l
‑1)、0.4μl mg
2+
(工作浓度为4.0mmol
·
l
‑1)、1.0μl hnb(工作浓度为150μmol
·
l
‑1)、1.0μl 10
×
thermopol buffer(工作浓度为1
×
),之后用无菌水补足至10μl。为了便于后续引用,此处命名为lamp体系。
96.实施例3
97.交配型基因mat1
‑1‑
2和mat1
‑2‑
1的lamp扩增引物筛选及特异性检测
98.用primerexplorer 5分别对稻曲病菌交配型基因mat1
‑1‑
2(蛋白登录号:ake48502.1)和mat1
‑2‑
1(蛋白登录号:ake48513.1)进行lamp引物设计。
99.根据针对mat1
‑1‑
2设计的引物系列1~5(mat1
‑1‑
2 set1~mat1
‑1‑
2 set5,序列见表2),分别对稻曲病菌mat1
‑
1型菌株uv1
‑
56基因组dna进行lamp扩增,lamp扩增反应产物颜色和电泳图谱结果如图2中的a所示,均能检测到梯形扩增条带,且lamp反应产物均为蓝色;但是引物系列3对mat1
‑
2型基因组dna也有少量扩增,特异性较差;引物系列4和5梯形条带丰度不如引物系列2,且引物系列2对mat1
‑
2型基因组dna无扩增,特异性强。因此本发明选用引物系列2进行mat1
‑
1型检测。
100.针对mat1
‑2‑
1设计的引物系列1
‑
5(mat1
‑2‑
1 set1~mat1
‑2‑
1 set5,序列见表
2),对稻曲病菌mat1
‑
2型菌株uv2
‑
51基因组dna进行lamp扩增,根据lamp扩增反应产物颜色和电泳图谱可知,lamp扩增结果如图2中的b所示,引物系列1反应产物为蓝色,并且能检测到梯形扩增条带;引物系列1对mat1
‑
1型基因组dna无扩增,特异性强。因此本发明选用引物系列1进行mat1
‑
2型检测。
101.其中lamp扩增所用体系为在实施例2所得lamp体系,且50μg
·
ml
‑1(浓度)基因组dna 0.9μl(用量);反应程序为63℃,1h。
102.表2序列的具体信息
103.0.9
·
μl(用量);反应温度为63.7℃,反应时间设置分别为15min、30min、45min、60min、75min和90min;结果见图4。
116.由图3和图4可知,根据图3中的a和图4中的a,针对mat1
‑1‑
2基因进行的lamp反应条件优化,在反应温度为58.0~65.3℃、反应时间为45~90min的条件下,lamp反应产物显示为天蓝色,电泳图谱为梯形条带;根据图3中的b和图4中的b,针对mat1
‑2‑
1基因进行的lamp反应条件优化,在反应温度为58.0~65.3℃、反应时间为45~90min的条件下,电泳图谱均有梯形扩增条带,但是只有61.6~63.7℃时,lamp反应产物颜色显示为天蓝色。综上,为节省时间,本发明确定最佳反应温度为63.7℃,时间为45min。
117.实施例5
118.lamp扩增的灵敏度检测
119.为了明确本发明中lamp反应的最低检测基因组dna的浓度,以及比较本发明与传统pcr的扩增效率,本发明设置mat1
‑
1型稻曲病菌uv1
‑
56基因组dna的浓度梯度为200ng、20ng、2ng、0.2ng、0.02ng、0.002ng、0.0002ng和0.00002ng,设置mat1
‑
2型稻曲病菌uv2
‑
51基因组dna的浓度梯度为200ng、20ng、2ng、0.2ng、0.02ng、0.002ng和0.0002ng,以稀释后的梯度dna作为模板,分别进行lamp检测和传统pcr扩增。lamp扩增反应体系见实施例2,反应条件为63.7℃,45min。
120.其中,传统pcr扩增:引物对112
‑
f/r(112
‑
f和112
‑
r,详见表2)和121
‑
f/r(121
‑
f和121
‑
r,详见表8)分别用green taq mix(诺唯赞,南京)进行mat1
‑1‑
2和mat1
‑2‑
1基因pcr扩增,扩增体系(15.0μl)为:green taq mix 7.5μl,引物(10μm)各2.0μl,dna 1.0μl,dd h2o补足至15μl。pcr反应程序:预变性95℃,3min;变性95℃,15s;退火60℃,15s,延伸72℃,60s;35个循环,彻底延伸72℃,5min。pcr扩增电泳结果同样如图5中c所示。
121.对比结果如图5所示,根据图5中a可以得出,针对mat1
‑1‑
2基因进行的lamp扩增反应,通过颜色和电泳图谱判断lamp可检测的最低基因组dna量分别为2pg和0.2pg,而传统pcr检测的最低基因组dna量为20pg;根据图5b可以得出,针对mat1
‑2‑
1基因进行的lamp扩增反应,通过颜色和电泳图谱判断lamp可检测的最低基因组dna量均为200pg,而传统pcr检测的最低基因组dna量为20000pg;综上,本发明中lamp扩增反应对稻曲病菌基因组dna的检测灵敏度为传统pcr的10~100倍。
122.实施例6
123.以田间分离采集的12株稻曲病菌单孢菌株基因组dna为模板dna进行lamp检测(具体步骤详见实施例1);
124.用针对mat1
‑1‑
2基因设计的外引物组(mat1
‑1‑2‑
f3和、mat1
‑1‑2‑
b3)和内引物组(mat1
‑1‑2‑
fip和mat1
‑1‑2‑
bip)分别对上述12份模板dna进行lamp扩增,lamp扩增反应体系和程序与实施例2相同;
125.用针对mat1
‑2‑
1基因设计的外引物组(mat1
‑2‑1‑
f3和mat1
‑2‑1‑
b3)和内引物组(mat1
‑2‑1‑
fip和mat1
‑2‑1‑
bip)分别对上述12份模板dna进行扩增lamp扩增,lamp扩增反应体系和程序与实施例2相同;
126.传统pcr检测:采用引物对112
‑
f/r(112
‑
f和112
‑
r,详见表2)和121
‑
f/r(121
‑
f和121
‑
r,详见表8)分别用green taqmix(诺唯赞,南京)对上述12份模板dna进行mat1
‑1‑
2和mat1
‑2‑
1基因pcr扩增,扩增体系(15.0μl)为:green taq mix 7.5μl,引物(10μm)各2.0μl,
dna 1.0μl,dd h2o补足至15μl。
127.pcr反应程序:预变性95℃,3min;变性95℃,15s;退火60℃,15s,延伸72℃,60s;35个循环,彻底延伸72℃,5min。pcr扩增所得产物电泳结果如图6中c所示。
128.结果见图6,12个样品中有5个样品(菌株1、3、8、11和12)的第一引物组lamp反应产物为蓝色,对应的,这几个样品通过第一引物组扩增,仍显示紫色,可确定其为mat1
‑
1型;有7个样品(菌株2、4、5、6、7、9和10)的第二引物组lamp反应产物为天蓝色,对应的,这几个样品通过第二引物组引物扩增,仍显示紫色,可确定其为mat1
‑
2型。该检测结果与传统pcr检测结果完全一致,表明本发明中的lamp检测方法结果可靠,重复性好,而且采用本发明中的lamp检测方法只需要观察颜色,也能获得结果,具有方便快捷的优势。
129.由上述实施例记载的可知,本发明所述引物组是针对稻曲病菌mat1
‑
1位点基因mat1
‑1‑
2以及mat1
‑
2位点基因mat1
‑2‑
1设计引物,具有灵敏度高的优势,其检测dna的灵敏度是传统pcr的100倍,而且此引物组特异性强,通过本发明引物组能够特异性识别靶标基因上的6个独立区域,即本发明引物组对应的6个核酸序列区域,大大降低了假阳性出现的概率。而且,本发明所述引物组具有成本低、省时省力的优势。
130.另外,本发明通过对所述引物组建立了稳定的lamp反应体系,通过颜色判断即可鉴定稻曲病菌交配型;该方法重复性好、操作简便,对田间采集分离的12株稻曲病菌单孢菌株进行lamp交配型检测,其结果与传统pcr结果完全吻合。本发明所述方法具有快捷、灵敏度高、特异性强等优势,对稻曲病菌群体发展动态快速检测及稻曲病的流行预警具有重要的现实意义。
131.虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1