布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒及其使用方法
1.本发明涉及细菌检测技术领域,具体为布鲁氏菌病疫苗株与野毒株现场快速鉴别诊断试剂盒及使用方法。
背景技术:
2.布鲁氏菌病(brucellosis),简称布病,是由布鲁氏菌(brucella)引起的一种人兽共患传染病,以发热和流产为主要特征,流行于170多个国家和地区,对畜牧业发展和人畜健康构成较大威胁,我国将其列为二类动物疫病。近年来,随着我国家畜饲养量的增加,我国人间和畜间布病发病数均呈快速上升趋势。
3.布病的防控坚持免疫预防为主的策略,但现有的a19、s2、rb51等弱毒疫苗各有优缺点,且疫苗免疫会干扰后期实验室诊断,无法区分疫苗免疫和野毒感染,给养殖场的布病防控和净化带来很大麻烦,在此形势下新的基因缺失标记疫苗应运而生。由天康生物股份有限公司、新疆畜牧科学院兽医研究所联合研发的新型基因标记疫苗——布鲁氏菌病活疫苗(a19
‑
δvirb12株),商品名康布净,已获得农业农村部颁发的新兽药证书,标志着布病防治取得突破性进展。牛布鲁氏菌病a19
‑
δvirb12活疫苗是以a19株为亲本株,缺失布鲁氏菌iv型分泌系统中virb12基因的基因缺失疫苗。根据其缺失的virb12基因设计引物,扩增缺失基因的一部分或全部片段,能有效扩增的为布鲁氏菌野毒株,不能扩增的为基因缺失疫苗株,便可有效区分疫苗免疫和野毒感染,在只免疫a19
‑
δvirb12活疫苗的养殖场检测出布病野毒感染动物,以控制和净化养殖场中存在的布病野毒,减少布病带来的经济损失,保障人员安全。因此根据a19
‑
δvirb12活疫苗缺失的virb12基因建立快速、特异、适合布病基层防控的鉴别诊断方法对布鲁氏菌病的防控至关重要。
4.根据动物布鲁氏菌病诊断技术国家标准(gb/t 18646
‑
2018),可用于布鲁氏菌诊断的技术方法有:虎红平板凝集试验和间接酶联免疫吸附试验,适用于动物布鲁氏菌病的初筛;乳牛全乳环状试验,适用于泌乳母牛布鲁氏菌病的初筛;试管凝集试验、补体结合试验和竞争酶联免疫吸附试验适用于牛种、羊种和猪种布鲁氏菌病的血清学确诊;病原的鉴定和pcr适用于动物布鲁氏菌病的病原学确诊。近年来,基于pcr的病原检测方法研究和应用较为广泛,然而,在实际应用中,还存在一定不足:(1)布鲁氏菌dna的制备耗时费力,详见国标gb/t 18646
‑
2018“4.13.1”;(2)检测流程复杂需要专业人员操作;(3)存在非特异性扩增和灵敏度低的问题。
技术实现要素:
5.本发明的目的在于提供布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒及其使用方法,解决现有技术pcr的病原检测过程中存在的布鲁氏菌dna的制备耗时费力、检测流程复杂、需要专业人员操作及非特异性扩增和灵敏度低的问题。
6.本技术根据a19
‑
δvirb12活疫苗缺失的virb12基因实现区分疫苗免疫和野毒感
染,实现从生鲜乳中一步扩增目标基因的目的。
7.为实现上述目的,本发明提供如下技术方案:布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒,包括如表1所示的组分:
8.表1布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒组分
9.编号名称数量备注1样品采集管6个常温保存2阳性膜片1管常温保存3阴性膜片1管常温保存4扩增检测管1个塑封包装、常温保存5复溶液1管常温保存620μl定量吸管1个常温保存72μl定量吸管8个常温保存8一次性手套1双常温保存9说明书1份常温保存
10.进一步的,所述扩增检测管为8连排检测管,所述扩增检测管预装检测试剂和冻干保护剂,其中,检测试剂为:5g聚合酶、ung酶、10
×
qpcr buffer以及如表2所示的布鲁氏菌virb12基因的特异性引物和taqman探针,所述10
×
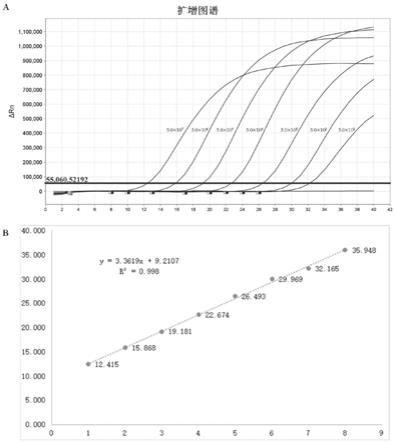
qpcr buffer内含浓度为0.4mm da/c/gtp、0.8mm dutp和8mm mgso4;冻干保护剂包括海藻糖和牛血清白蛋白,冻干前检测试剂中海藻糖的质量浓度为0.10
‑
0.15g/ml,牛血清白蛋白的质量浓度为 0.01
‑
0.02g/ml;
11.表2布鲁氏菌virb12基因的特异性引物序列和taqman探针
[0012][0013]
进一步的,所述阳性膜片为经fta elute cards,whatman滴加1μl阳性质粒 pmd18
‑
virb12制得,所述阳性质粒pmd18
‑
virb12质量浓度5
×
103copies/μl,所述阳性膜片直径为2mm;表2中taqman探针浓度0.2μm,引物浓度0.4μm。
[0014]
所述复溶液为ddh2o。
[0015]
布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒的检测量为6个样本使用量,样本量可以扩大到24t、48t及以上。
[0016]
布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒的使用方法,具体包括如下步骤:
[0017]
s1样品富集:取用样品采集管收集的生鲜乳,置于离心机,离心后弃上清;
[0018]
s2扩增检测:取出扩增检测管,开盖后采用20μl定量吸管向扩增检测管的孔依次滴加复溶液,向装有阳性膜片、阴性膜片离心管中同样添加20μl复溶液;然后,采用2μl 定量吸管分别吸取富集后的样品沉淀以及阳性膜片、阴性膜片离心管中液体依次加入扩增检
测管各管中,盖盖后用手指轻弹管底3~5下,置于便携式荧光定量pcr仪中,选取预设检测程序,进行扩增检测;
[0019]
s3结果判读:反应结束后,阳性对照呈现“s”峰,即具有相应ct值;样品检测结果的根据ct值进行判定:ct值≤32.0判定该样品为布鲁氏菌感染且为强阳性,32.0<ct值<36.0 判定该样品为布鲁氏菌感染且为弱阳性,36.0≤ct值<40.0判定该样品为布鲁氏菌疑似感染;
[0020]
阴性对照不起峰,即无相应ct值,判定为布鲁氏菌阴性;否则判定试验结果无效。
[0021]
进一步的,便携式荧光定量pcr仪的预设检测程序为:防污染37℃2分钟;预变性 95℃5分钟;变性95℃10秒,退火/延伸60℃20秒,共40个循环。
[0022]
进一步的,步骤s1中离心机的转速为12000转/分钟,离心时间为1分钟。
[0023]
进一步的,所述布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒的检测量为6 个样本使用量,样本量可以扩大到24t、48t及以上。
[0024]
进一步的,步骤s2中,定量吸管分别吸取2μl富集后的样品沉淀
[0025]
与现有技术相比,本发明的有益效果是:
[0026]
(1)简单、快速:免去移液器的复杂转液操作和样品核酸提取纯化步骤,真正实现从样品进到结果出的一步扩增,全流程约30分钟。
[0027]
(2)高灵敏高特异:检测体系添加了ung酶,能够有效去除气溶胶的污染防止非特异性扩增;该试剂盒对目标基因的检测标准曲线为y=3.3619x+9.2107,r2=0.998,灵敏度为50copies/μl。
[0028]
(3)诊断特异性、诊断灵敏性、重复性极好:本发明通过对virb12基因特异性引物和探针及其浓度的筛选优化,与国标gb/t 18646
‑
2018所述pcr方法对比,本发明的试剂盒的诊断特异性(dsp)为100%,诊断灵敏性(dse)为100%,kappa值为1.00。
[0029]
(4)常温运输常温保存:检测体系采用全体系冻干,阳性标准质粒吸附于膜片上,二者室温保存一年内对qpcr的ct值及荧光信号值无影响。
[0030]
(5)提供就业广度:降低操作能力减少企业高学历人员投入的同时保证试验质量。
附图说明
[0031]
图1是实施例1中的布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒对目标基因virb12的检测标准曲线;
[0032]
图2是实施例2中的布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒对临床样本测试量的确定;
[0033]
其中a:强阳性奶牛;b:弱阳性奶牛。
具体实施方式
[0034]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0035]
下述实施例中所述实验方法,如无特殊说明,均为常规方法;实施例中未注明具体
技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行;所述试剂和材料,均采用分析纯试剂,如无特殊说明,均可从商业途径获得。所采用溶液均为灭菌、失活降解酶的去离子水配制。
[0036]
virb12基因阳性质粒构建:从ncbi(genbank:lt671513.1)选取virb12基因序列片段,由生工生物工程(上海)股份有限公司进行全基因合成并克隆到pmd18
‑
t载体上,构建pmd18
‑
virb12重组质粒。相关特异性引物和taqman探针均由生工生物工程(上海) 股份有限公司代为合成。
[0037]
toroivd 5g聚合酶(无甘油)、100mm mgso4、da/c/gtp以及dutp溶液,购自天筛(上海)科技有限公司。
[0038]
南极热敏udg酶,购自neb。
[0039]
膜片:fta elute cards,whatman购自美国ge healthcare公司,经打孔器制作成直径 2mm。
[0040]
布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒的组装:包括盒体、盒体内的试剂和耗材,说明书。盒体内的试剂分别为预装250μl的复溶液管和预装检测试剂的扩增检测管,经冻干处理,铝箔袋塑封包装;盒体内的耗材分别为样品采集管、2μl定量吸管和20μl定量吸管、一次性手套以及滴加1μl阳性质粒pmd18
‑
virb12的阳性对照膜片、阴性对照膜片。
[0041]
实施例1:
[0042]
反应体系引物和探针浓度的优化
[0043]
(1)反应体系的配置
[0044]
组分用量toroivd 5g聚合酶0.5μlung酶0.5μl10
×
qpcr buffer4.0μl上游引物(10μm)0.5μl上游引物(10μm)0.5μltaqman探针(10μm)0.5μl阳性质粒pmd18
‑
virb12(质量浓度5
×
103copies/μl)1.0μlddh2o补至25.0μl
[0045]
上述反应体系中以引物和探针为变量,剩余组分为定量,探针浓度在0.1
‑
0.4μm之间优化,引物浓度在0.2
‑
0.8μm之间优化,采用正交试验设计。
[0046]
采用taqman探针实时荧光定量pcr法(qpcr)进行检测,检测程序为:防污染37℃ 2分钟;预变性95℃5分钟;变性95℃10秒、退火/延伸60℃20秒共40个循环,均重复3次;根据检测结果筛选出引物和探针浓度最优的比例,如表3所示;
[0047]
表3不同浓度比例引物和探针对检测结果的影响
2.0μl、4.0μl、6.0μl、8.0μl、10.0μl加入至“实施例1”优化后的反应体系中,采用qpcr 方法进行检测。
[0056]
检测结果如图2所示,对于强阳性奶牛(a),起峰由前向后依次为样本测试量2.0μl >4.0μl>1.0μl>6.0μl>8.0μl,样本测试量在10.0μl未起峰;对于弱阳性奶牛(b),起峰由前向后依次为样本测试量2.0μl>4.0μl>1.0μl>6.0μl=8.0μl>10.0μl。由此,最终确定样品测试量为富集后的样品沉淀2μl。
[0057]
实施例3:
[0058]
本发明提供的布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒与国标gb/t18646
‑
2018所述pcr方法对临床样本的检测效果对比分析。
[0059]
选取某大型奶牛养殖场50份以上疑似发病样本,按照本发明试剂盒所述检测步骤对临床样本进行检测。同时,所有样本均采用国标gb/t 18646
‑
2018所述pcr方法进行复检。
[0060]
如表4所示,对目标基因virb12,本发明提供的试剂盒的dse值为100%,dsp值均为100%,kappa值分别为1.00。结果表明,与国标gb/t 18646
‑
2018所述pcr方法相比,本发明提供的布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒具有极好的可重复性(kappa=1.00)。
[0061]
表4本发明提供的诊断试剂盒和国标gb/t 18646
‑
2018所述pcr方法对目标基因virb12 的检测结果
[0062][0063][0064]
注:dse=tp/(tp+fn);dsp=tn/(tn+fp),其中,tp代表阳性结果,fn代表假阴性结果,tn代表阴性结果,fp代表假阳性结果。kappa=(po
–
pe)/(1
–
pe),其中po是观察符合率,pe是机遇符合率。0<kappa≤0.40,则说明诊断试验的可重复性差;如果0.40< kappa<0.75,则说明具有中、高度可重复性;如果kappa≥0.75,那么该诊断试验就具有极好的可重复性。
[0065]
实施例4:
[0066]
试剂盒保存期试验
[0067]
分别考察保存于37℃和室温(26
‑
28℃)的有效期。结果详见表5、6。
[0068]
表5保存于37℃的测试ct值
[0069][0070]
结果显示:试剂盒在37℃热加速试验64天内,ct差值<0.5,即对qpcr的ct值及荧光信号值无显著影响。
[0071]
表6保存于室温(26
‑
28℃)的测试ct值
[0072][0073][0074]
结果显示:试剂盒在室温(26
‑
28℃)试验12个月内,ct差值<0.5,由此,对qpcr 的ct值及荧光信号值无显著影响。该体系仍在持续测试中。
[0075]
综上,本发明提供了布鲁氏菌病疫苗株与野毒株快速高灵敏鉴别诊断试剂盒及其使用方法,实现从生鲜乳中一步扩增目标基因的目的,根据a19
‑
δvirb12活疫苗缺失的virb12 基因实现区分疫苗免疫和野毒感染的目的,诊断特异性、诊断灵敏性、重复性极好,免去移液器的复杂转液操作和样品核酸提取纯化步骤,真正实现从样品进到结果出的一步扩增,全流程约30分钟。
[0076]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同或相似部分互相参见即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的原理或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这
些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1