一种用于检测降钙素原的核酸适配体和试剂盒的制作方法
1.本发明涉及生物医学技术领域,特别涉及一种用于检测降钙素原的核酸适配体和试剂盒。
背景技术:
2.感染性疾病是临床常见的疾病类型。感染性疾病的病原体种类繁多、感染途径多样、症状和体征存在个体差异,如果不能及时明确诊断、有效治疗可引发严重后果。因此,如何对感染性疾病进行早期诊断和鉴别是临床亟待解决的实际问题。降钙素原是降钙素前体物质,甲状腺细胞可产生该物质。细菌感染情况下因内毒素诱导,导致细胞异常表达降钙素原,感染越严重血清中降钙素原浓度越高。降钙素原浓度与炎症严重程度呈正比关系,健康人血液中几乎不能检测到,可以动态反映疾病的发展。
3.目前市面上针对降钙素原的检测试剂盒都是抗原检测,以单通道检测为主。而且市售抗原检测试剂盒用的是抗体检测,抗体作为一种蛋白成分,具有不易表达合成、易降解、存在非特异性免疫原性等缺点。
4.因此有必要开发一种特异性高、灵敏度高的检测方法。
技术实现要素:
5.本发明目的是提供一种用于检测降钙素原的核酸适配体和试剂盒,灵敏度较高、特异性好、测量范围宽、操作简单、可以快速检测靶蛋白、适合大规模推广,有着良好的市场前景。
6.在本发明的第一方面,提供了一种用于检测降钙素原的核酸适配体,所述用于检测降钙素原的核酸适配体的核苷酸序列seq id no.1所示。
7.进一步地,所述用于检测降钙素原的核酸适配体还包括:在所述核酸适配体的核苷酸序列上结合有荧光物质、纳米发光材料、生物素、地高辛和酶标记中一种。
8.进一步地,所述荧光物质为fam荧光基团或cy5荧光基团;所述纳米发光材料为量子点或上转换纳米颗粒;所述酶标记为辣根过氧化物酶或蔗糖酶。
9.进一步地,所述用于检测降钙素原的核酸适配体还包括:在所述核酸适配体的核苷酸序列上的某一位置被磷酸化、甲基化、氨基化、巯基化或同位素化的核酸适配体。
10.在本发明的第二方面,提供了一种用于检测降钙素原的试剂盒,包括所述的核酸适配体。
11.进一步地,所述用于检测降钙素原的试剂盒还包括:
12.(a)固定样本溶液的蛋白包被板;
13.(b)蛋白包被液;
14.(c)封闭液;
15.(d)漂洗液;
16.(e)降钙素原校准品。
17.进一步地,所述蛋白包被液的配方为:35mm nahco3,15mm na2co3,ph 9.3-ph 9.9。
18.进一步地,所述封闭液的配方为136mm nacl,2.6mm kcl,2mm kh2po4,8mm na2hpo4,0.05%tween-20,1%bsa,ph 7.1-ph 7.7。
19.进一步地,所述漂洗液的配方为136mm nacl,2.6mm kcl,2mm kh2po4,8mm na2hpo4,0.05%tween-20,ph 7.1-ph 7.7。
20.进一步地,所述降钙素原校准品有5个浓度,分别为6.25μg/l、12.5μg/l、25μg/l、50μg/l、100μg/l。
21.在本发明的第四方面,提供了一种所述的用于检测降钙素原的核酸适配体和/或所述检测试剂盒在检测感染样本中降钙素原含量中的应用。
22.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
23.本发明提供一种用于检测降钙素原的核酸适配体和试剂盒,本发明通过selex技术筛选到的针对降钙素原的核酸适配体具有较高的特异性和亲和力,并且具有无免疫原性、分子小、可进行修饰、合成容易、不易降解、无毒等优点。本发明所用核酸适配体序列为通过selex技术筛选所得,具有完全的独创性。
24.本发明的试剂盒灵敏度较高、特异性好、测量范围宽、操作简单、可以快速检测靶蛋白、适合大规模推广,有着良好的市场前景。具体地:本发明试剂盒对降钙素原的检测具有较高的精密度,检测结果的变异系数为2.52%;在抗干扰性试验中,对各种干扰物的相对误差均在5%以内。
25.本发明试剂盒采用核酸适配体作为检测物,能有效克服不易表达合成、易降解、存在非特异性免疫原性等问题,它具有分子小、可进行修饰、合成容易、不易降解、无毒、无免疫原性等优点。
附图说明
26.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
27.图1是本发明核酸适配体
‑‑
降钙素原-aptamer核苷酸序列的二级结构图;
28.图2为本发明实施例3提供的荧光强度与靶蛋白浓度的标准曲线图。
具体实施方式
29.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
30.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
31.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
32.本技术实施例的技术方案为解决上述技术问题,总体思路如下:
33.本技术以降钙素原抗原表位具有如seq id no.2所示序列氨基酸,通过selex技术筛选所得本技术的降钙素原的核酸适配体,再联接上荧光基团,以便观察和识别;最后将所述核酸适配体用于制备检测试剂盒,具体包括:
34.1、确定待测靶蛋白抗原表位
35.通过文献查阅与生物信息学分析,本发明人确定了降钙素原抗原表位的氨基酸序列如seq id no.2所示。
36.2、筛选特异性结合的核酸适配体序列
37.体外合成一个含有42个随机序列的单链dna文库;以降钙素原靶蛋白特定区域为筛选条件,采用selex技术筛选出具有高特异性、高亲和力的dna适配体序列,降钙素原的核酸适配体具有seq id no.1所示的核苷酸序列。
38.3、合成带有荧光基团标记的核酸适配体
39.直接在常规生物技术服务公司合成筛选得到的核酸适配体序列,合成时以共价键的形式在核酸适配体5’端连上荧光基团。检测降钙素原的核酸适配体具有如seq id no.1所示序列,所带荧光基团为fam。
40.4、制备试剂盒
41.试剂盒包括以下组分:a)固定样本溶液的蛋白包被板,b)蛋白包被液,c)封闭液,d)漂洗液,e)带有荧光基团标记的核酸适配体,和f)降钙素原校准品。
42.下面将结合实施例及实验数据对本技术的一种用于检测降钙素原的核酸适配体和试剂盒进行详细说明。
43.实施例1、用于检测降钙素原的核酸适配体
44.1、确定降钙素原抗原表位
45.根据文献查阅与生物信息学分析,确定待测适合作为核酸适配体检测靶点的靶蛋白上的具体抗原表位区域。
46.(1)选择降钙素原成熟肽全长作为适配体筛选靶蛋白,并通过突变去除肽段内两个易降解位点,提高了重组靶蛋白的稳定性,具有如seq id no.2所示序列:
47.apfrsalesspadpatlsedearlllaalvqdyvqmkaseleqeqeregssldsprsggcgnlstcmlgtytqdfnkfhtfpqtaigvgapsgggdmssdlerdhrphvsmpqnan(seq id no.2)
48.(2)根据已确定的氨基酸序列,直接在公司进行核苷酸序列的合成以及原核密码子优化,将合成的基因片段(核苷酸序列如seq id no.5所示)插入原核表达载体pet32a的bamh i/hind iii的酶切位点上。诱导表达出相应用于适配体筛选的的靶蛋白。
49.2、构建适配体文库与引物设计
50.(1)通过常规生物技术服务公司的基因合成服务,体外合成含有42个随机序列的单链dna文库,其核苷酸序列如下:
[0051]5’‑
gatgacattgcacaagtcagg-(n42)-gagtgaatcctgctgttcga-3’[0052]
(2)针对核酸适配体5’端固定序列,设计合成的上游引物p1,具有如seq id no.3所示序列:5
’‑
gatgacattgcacaagtcagg-3’(seq id no.3)
[0053]
(3)针对核酸适配体3’端固定序列,设计合成的下游引物p2,具有如seq id no..4所示序列,同时在引物5’端连接有生物素基团,具体为:
[0054]5’‑
biotin-tcgaacagcaggattcactc-3’(seq id no.4)
[0055]
3、利用selex筛选技术,从文库中筛选得到能有效结合靶蛋白的核酸适配体序列
[0056]
(1)将10nmol的初始单链dna随机文库溶解在500μl的pbs溶液中,用92℃的恒温水浴锅水浴5min,之后迅速的插入冰中冰浴10min,之后将经过处理的初始单链dna随机文库与相应靶蛋白在冰上孵育1h,再加入ni-ntamagnetic agarose beads,继续孵育1h。孵育完成后,使用磁性分离器吸附,去除上清,用2ml的pbs洗涤beads。最后用10ml预冷的pbs重悬beads,使之充分吹打混匀,之后92℃恒温水浴10min,13000g离心,收集上清,即为第一轮筛选后特异性识别靶蛋白的单链dna文库。
[0057]
(2)对筛选后的单链dna文库进行pcr扩增,以制备次级文库。pcr反应的体系如下:premix tap mix 25μl,筛选后的单链dna文库8μl,上游引物2.5μl,下游引物2.5μl,ddh2o 12μl,总体积为50μl。按照如下的程序进行pcr循环扩增:95℃变性3min,经过35个循环扩增程序为95℃30s,55℃30s,72℃30s,最终的延伸为72℃10min,最后维持在16℃终止反应。对经过pcr扩增后的文库进行琼脂糖凝胶回收以得到纯净的文库片段。
[0058]
(3)对扩增得到的次级文库进行进一步的制备。将扩增后的双链dna文库与100μl链酶亲和素标记的磁珠常温孵育20min,利用双链dna文库上的生物素与链酶亲和素的亲和作用将双链dna文库结合到磁珠的表面,之后使用磁性分离器吸附,去除上清,用2ml的pbs洗涤磁珠。加入终浓度为200mm的naoh溶液常温反应10min使得双链dna文库变性变成单链,其中带有生物素标记的一条链会结合在磁珠上,不带生物素标记的那一条链会脱离到上清液中。收集上清液,用脱盐柱除去naoh,最后加入500μl的pbs,收集到的溶液即为下一轮筛选所需要用到的单链dna文库。
[0059]
(4)重复上述的阳性筛选过程、pcr扩增以及次级单链dna文库的制备过程15次,最后筛选得到的单链dna文库对于靶蛋白的识别能力最强。将所得到的单链dna文库进行克隆测序后,最终得到了本发明中所筛选出来的可用于检测降钙素原的核酸适配体,其dna序列分别为:降钙素原-aptamer
[0060]
gatgacattgcacaagtcagggaccgcaatagctctcgtgatgagccagtagatgctatagtagagtgaatcctgctgttcga;
[0061]
(5)为了能在反应体系内对反应产物进行灵敏检测,给适配体5’端标记上荧光基团(共价键结合的形式,直接在常规生物技术服务公司合成),最终的试剂盒里的适配体信息如下:降钙素原-aptamer,具有如seq id no.1所示序列:
[0062]5’‑
fam-gatgacattgcacaagtcagggaccgcaatagctctcgtgatgagccagtagatgctatagtagagtgaatcctgctgttcga-3’(seq id no.1)
[0063]
实施例2、核酸适配体的验证
[0064]
1、通过结构预测软件rnastructure program来分析预测筛选出来的核酸适配体的二级结构,结果显示该核酸适配体可以形成特殊的茎环结构和发卡结构。降钙素原-aptamer可形成如图1所示的二级结构。
[0065]
2、使用fortebio octet red96相互作用分析仪检测核酸适配体与靶蛋白的结合力,所得结果如下:
[0066]
表1
[0067]
适配体与靶蛋白的解离常数kd(nm)
降钙素原-aptamer8.0pbs对照无结合
[0068]
3、分别采用人血白蛋白、免疫血清球蛋白与核酸适配体进行特异性检测,经过结合实验发现,适配体不与这些蛋白结合。用靶蛋白对适配体进行交叉反应检测,实验结果显示,适配体只与对应的靶蛋白结合。
[0069]
4、取0.2μg适配体,放置于常温血清、水溶液中。4周后用rt-pcr检测,发现放置的核酸适配体结构稳定,没有发生降解。
[0070]
实施例3、用于检测降钙素原的试剂盒及其制备方法
[0071]
1、用于检测降钙素原的试剂盒包含以下配方:
[0072]
(a)固定样本溶液的蛋白包被板;作为一种具体的实施方式,采用96孔蛋白包被板;
[0073]
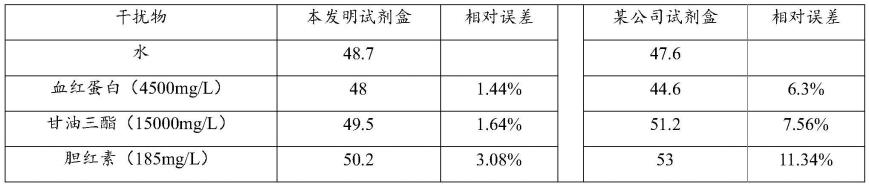
(b)蛋白包被液;
[0074]
(c)封闭液;
[0075]
(d)漂洗液;
[0076]
(e)带有荧光基团标记的核酸适配体(seq id no.1);
[0077]
(f)降钙素原校准品。
[0078]
2、用于检测降钙素原的试剂盒的制备
[0079]
(a)用于固定样本溶液的96孔蛋白包被板:直接使用市面上销售的具有蛋白吸附能力的elisa酶标板;
[0080]
(b)蛋白包被液:属于常规分子检测试剂,配方为35mm nahco3,15mm na2co3,ph 9.3-ph 9.9,使用双蒸水配置。
[0081]
(c)封闭液:属于常规分子检测试剂,配方为136mm nacl,2.6mm kcl,2mm kh2po4,8mm na2hpo4,0.05%tween-20,1%bsa,ph 7.1-ph 7.7,使用双蒸水配置。
[0082]
(d)漂洗液:属于常规分子检测试剂,配方为136mm nacl,2.6mm kcl,2mm kh2po4,8mm na2hpo4,0.05%tween-20,ph 7.1-ph 7.7,使用双蒸水配置。
[0083]
(e)带有荧光基团标记的核酸适配体:通过常规生物技术服务公司的基因合成服务,直接合成,用te缓冲液溶解并配置到工作浓度(200nm)。
[0084]
(f)降钙素原校准品:降钙素原校准品有5个浓度,分别为6.25μg/l、12.5μg/l、25μg/l、50μg/l、100μg/l,由不同浓度的重组降钙素原溶解于包被液制备而成。
[0085]
实施例4、检测样本中降钙素原含量
[0086]
使用实施例3所述的用于检测降钙素原的试剂盒检测感染样本中降钙素原含量,包括:
[0087]
1、使用前让所有试剂和样品恢复至室温,将待测样品用包被液稀释到合适浓度。
[0088]
2、向相应的孔中添加100μl的标准品和待测样品,室温孵育2小时。包被时间可根据实际情况进行优化调整。
[0089]
3、弃溶液并用漂洗液洗涤2次,每次在样品孔中加入200μl漂洗液。在完成最后一次洗涤后,通过吸取或倾倒而将残留的漂洗液进行去除。
[0090]
4、向样品孔中添加200μl封闭液,室温孵育2小时。
[0091]
5、弃溶液。重复第3步的洗涤步骤。
[0092]
6、向样品孔中添加100μl带有荧光基团标记的核酸适配体,避光室温孵育2小时。孵育时间可根据实际检测的荧光信号强度进行优化调整。
[0093]
7、弃溶液。重复第3步的洗涤步骤,共进行4次洗涤。
[0094]
8、使用全波段激光酶标仪对样品孔进行检测,设置如下:激发波长为494nm,检测波长为522nm。
[0095]
9、使用校准品得到荧光强度与靶蛋白浓度的标准曲线(如图2所示),再根据样品孔荧光强度以及样品稀释倍数计算出样品中靶蛋白浓度。
[0096]
实施例5、试剂盒变异系数的检测
[0097]
采用实施例3的试剂盒与实施例4的检测方法,随机对一个临床血清样本重复检测10次。检测结果如下:
[0098]
表2
[0099]
检测次数12345678910检测浓度(mg/l)27.52827.32627.327.72826.826.528
[0100]
由表2可知,根据10次重复检测结果,计算出变异系数为2.52%,小于5%,证明本发明的试剂盒具有较高精密度。
[0101]
实施例6、试剂盒抗干扰性试验
[0102]
采用实施例3的试剂盒与实施例4的检测方法,同时与一款市售降钙素原的抗体检测试剂盒进行抗干扰性试验。随机选取一个临床血清样本,加入灭菌水或其它干扰物,进行靶蛋白浓度检测,试验结果如下:
[0103]
表3
[0104][0105]
由表3数据可知,加入干扰物后,本发明试剂盒对各种干扰物的相对误差均在5%以内,而对照试剂盒对各种干扰物的相对误差都在5%以上。试验结果证明,本试剂盒的检测样本中即使存在一定浓度的干扰物(例如血红蛋白、甘油三酯或胆红素等),对检测结果也不会有太明显的影响。
[0106]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0107]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0108]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围
之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1