一种单碱基延伸引物组及维生素A代谢相关基因多态性的检测方法与流程
一种单碱基延伸引物组及维生素a代谢相关基因多态性的检测方法
技术领域
1.本技术涉及基因检测的技术领域,更具体地说,它涉及一种单碱基延伸引物组及维生素a代谢相关基因多态性的检测方法。
背景技术:
2.基因缺陷导致维生素的吸收利用能力低下是出现维生素缺乏的重要原因,维生素的吸收利用能力低下可以由大量摄取所需维生素来代偿。但是在不知道自身维生素吸收利用能力低的情况下,往往不能有针对性地补充所需维生素;进而反复出现维生素缺乏的症状:如在光线昏暗的环境中出现眼睛适应慢,如嘴唇、皮肤易干燥,如手部长倒刺等;这些不良症状都可能是因为维生素缺乏。而长期处于维生素缺乏状态会导致不可逆的伤害或更严重疾病。
3.目前,维生素a的代谢相关基因是相对明确的,人们可以通过合理的基因检测来帮助了解自己维生素a的代谢情况。常采用pcr测序法来检测多个基因/位点的基因多态性。在该检测过程中,现有的检测方法所选用的扩增引物,存在特异性不高的问题。且现有的检测方法,一次只能检测一个基因/位点的基因多态性类型,使得该检测方法存在检测周期长、通量低的问题,最终导致检测效率低。
技术实现要素:
4.为了提高检测维生素a代谢相关基因多态性时,单碱基延伸过程的延伸特异性和效率,本技术提供了一种单碱基延伸引物组;为了进一步提高检测多个维生素a代谢相关基因多态性时的检测通量和检测效率,本技术提供了一种维生素a代谢相关基因多态性的检测方法。
5.第一方面,本技术提供一种单碱基延伸引物组,采用如下的技术方案:一种单碱基延伸引物组,包括以下单碱基延伸引物的至少一条:用于维生素a代谢相关的bco1基因的单碱基延伸的引物ep
‑
1、引物ep
‑
2、引物ep
‑
3、引物ep
‑
4、引物ep
‑
5、引物ep
‑
6和引物ep
‑
7,引物ep
‑
1、引物ep
‑
2、引物ep
‑
3、引物ep
‑
4、引物ep
‑
5、引物ep
‑
6和引物ep
‑
7的核苷酸序列分别如seq id no.1
‑
7所示;用于维生素a代谢相关的rbp4基因的单碱基延伸的引物ep
‑
8、引物ep
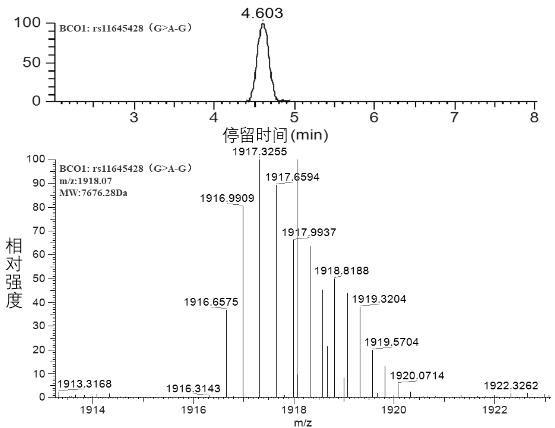
‑
9、引物ep
‑
10和引物ep
‑
11,引物ep
‑
8、引物ep
‑
9、引物ep
‑
10和引物ep
‑
11的核苷酸序列分别如seq id no.8
‑
11所示;用于维生素a代谢相关的ffar4基因的单碱基延伸的引物ep
‑
12,引物ep
‑
12的核苷酸序列如seq id no.12所示;用于维生素a代谢相关的pkd1l2基因的单碱基延伸的引物ep
‑
13,引物ep
‑
13的核苷酸序列如seq id no.13所示;用于维生素a代谢相关的pnpla3基因的单碱基延伸的引物ep
‑
14,引物ep
‑
14的核
苷酸序列如seq id no.14所示;用于维生素a代谢相关的ttr基因的单碱基延伸的引物ep
‑
15,引物ep
‑
15的核苷酸序列如seq id no.15所示。
6.通过采用上述技术方案,设计出延伸特异性优异的单碱基延伸引物,能够有效改善现有的单碱基延伸引物特异性不高的问题。特异性高的单碱基延伸引物能够进一步提高延伸效率,使得检测结果更加准确高效。此外,将该单碱基延伸引物或单碱基延伸引物组用于维生素a代谢相关基因多态性的检测时,其具有使得检测方法准确性高且检测效率高的优势。
7.优选的,所述单碱基延伸引物组,包括所述引物ep
‑
1、引物ep
‑
2、引物ep
‑
3、引物ep
‑
4、引物ep
‑
5、引物ep
‑
6、引物ep
‑
7、引物ep
‑
8、引物ep
‑
9、引物ep
‑
10、引物ep
‑
11、引物ep
‑
12、引物ep
‑
13、引物ep
‑
14和引物ep
‑
15中的至少两条。
8.通过采用上述技术方案,采用上述至少两条的单碱基延伸引物,能够实现一次检测过程,至少获得两个基因/位点的碱基类型。而在该单碱基延伸反应过程中,选用上述的单碱基延伸引物或单碱基延伸引物组时,各目标基因的单碱基延伸反应过程互不影响。将该单碱基延伸引物组用于维生素a代谢相关基因多态性检测时,最终能够实现对多个维生素a代谢相关基因多态性同时进行检测,并获得高效率、高通量的检测方法。
9.第二方面,本技术提供一种维生素a代谢相关基因多态性的检测方法,采用如下的技术方案:一种维生素a代谢相关基因多态性的检测方法,包括以下步骤:s1、分别设计多重pcr扩增引物组和如上所述的单碱基延伸引物组,备用;提取待测样本基因组dna,备用;s2、配制多重pcr扩增体系:所述多重pcr扩增体系包括待测样本基因组dna和所述多重pcr扩增引物组;以所述待测样本基因组dna为模板,并加入所述多重pcr扩增引物组,扩增得到多重pcr扩增产物;s3、配制酶消化反应体系:所述酶消化反应体系包括所述多重pcr扩增产物和碱性磷酸酶;所述多重pcr扩增产物经碱性磷酸酶消化后得到酶消化产物;s4、配制单碱基延伸反应体系:所述单碱基延伸反应体系包括所述酶消化产物和所述单碱基延伸引物组:以所述酶消化产物为模板,加入所述单碱基延伸引物组后,进行单碱基延伸反应,得到单碱基延伸产物;s5、将所述单碱基延伸产物纯化后进行质谱检测,获得待测标本的维生素a代谢相关基因位点的多态性。
10.其中,所述维生素a代谢相关基因包括bco1、rbp4、ffar4、pkd1l2、pnpla3以及ttr中的至少一个。进一步的,bco1基因相关的多态性位点包括rs11645428、rs12926540、rs119478057、rs12923433、rs12934922、rs7501331以及rs6564851中的至少一个;rbp4基因相关的多态性位点包括rs121918584、rs121918585、rs794726862以及rs794726861中的至少一个;ffar4基因相关的多态性位点包括rs10882272;pkd1l2基因相关的多态性位点包括rs6420424;pnpla3基因相关的多态性位点包括rs738409,ttr基因相关的多态性位点包括rs1667255。
11.在本技术的检测方法中,设计了特定碱基序列的单碱基延伸引物组;在对维生素a
代谢相关基因的多态性位点进行多重pcr扩增后,将得到的多重pcr扩增产物以碱性磷酸酶进行消化,随后将酶消化产物和单碱基延伸引物组混合以进行相关序列的单碱基延伸反应,以便在后期对相关产物顺利进行多态性位点的检测。通过采用上述技术方案,不仅能够实现特异性强的单碱基延伸反应;此外,pcr扩增方法和特有的单碱基延伸反应,再结合液相
‑
质谱或者质谱检测等检测技术,能够实现对6个维生素a代谢相关基因(包括bco1、rbp4、ffar4、pkd1l2、pnpla3和ttr)的高达15个多态性位点的同时检测。和传统pcr扩增测序法的一次仅检测一个多态性位点碱基类型相比,该方法除了具有特异性高的优势外,还能够实现高效、快速、高通量检测基因多态性类型。此外,本技术检测方法的检测结果准确,且检测效率更高。
12.优选的,所述多重pcr扩增引物组包括以下引物对的一对或多对:用于维生素a代谢相关的bco1基因扩增的引物对,其上游引物bco1
‑
1f和下游引物bco1
‑
1r的核苷酸序列分别如seq id no.16
‑
17所示;用于维生素a代谢相关的bco1基因扩增的引物对,其上游引物bco1
‑
2f和下游引物bco1
‑
2r的核苷酸序列分别如seq id no.18
‑
19所示;用于维生素a代谢相关的bco1基因扩增的引物对,其上游引物bco1
‑
3f和下游引物bco1
‑
3r的核苷酸序列分别如seq id no.20
‑
21所示;用于维生素a代谢相关的bco1基因扩增的引物对,其上游引物bco1
‑
4f和下游引物bco1
‑
4r的核苷酸序列分别如seq id no.22
‑
23所示;用于维生素a代谢相关的bco1基因扩增的引物对,其上游引物bco1
‑
5f和下游引物bco1
‑
5r的核苷酸序列分别如seq id no.24
‑
25所示;用于维生素a代谢相关的rbp4基因扩增的引物对,其上游引物rbp4
‑
f和下游引物rbp4
‑
r的核苷酸序列分别如seq id no.26
‑
27所示;用于维生素a代谢相关的ffar4基因扩增的引物对,其上游引物ffar4
‑
f和下游引物ffar4
‑
r的核苷酸序列分别如seq id no.28
‑
29所示;用于维生素a代谢相关的pkd1l2基因扩增的引物对,其上游引物pkd1l2
‑
f和下游引物pkd1l2
‑
r的核苷酸序列分别如seq id no.30
‑
31所示;用于维生素a代谢相关的pnpla3基因扩增的引物对,其上游引物pnpla3
‑
f和下游引物pnpla3
‑
r的核苷酸序列分别如seq id no.32
‑
33所示;用于维生素a代谢相关的ttr基因扩增的引物对,其上游引物ttr
‑
f和下游引物ttr
‑
r的核苷酸序列分别如seq id no.34
‑
35所示。
13.在对本技术的多重pcr扩增引物组进行设计时,充分考虑其扩增产物能够适用于后期的单碱基延伸反应,因此在所有扩增引物的5’端加入了一个特异性接头:tag(5
’‑
acgttggatg
‑3’
),以减少引物对之间的相互干扰,并用以区别于单碱基延伸产物的分子量,便于后期单碱基延伸产物的分析。若是不加入该特异性接头,可能会导致在pcr扩增时的非特异性扩增或者在pcr扩增引物之间产生二聚体,则最终无法得到特异性的目标产物。此外,质谱法分析基因位点的多态性是基于基因多态性位点碱基不同,且通过单碱基延伸反应后,延伸产物分子量的大小不同,通过检测延伸产物分子量的大小,应用专业的分析软件,通过判断分子量的差异来进行基因位点的多态性分型。当正常设计引物时,扩增引物、延伸引物和产物的碱基数量差别不大,如果不在扩增引物5’端加入特异性接头,可能会导
致扩增引物、延伸引物及延伸产物的分子量大小相近,因而不能很好的区分扩增引物、延伸引物及延伸产物,造成后期单碱基延伸产物的质谱分析难度增大甚至无法进行。本技术通过设计合理的多重pcr扩增引物组,以进一步提高多重pcr扩增效率;同时,选用适当的多重pcr扩增引物组进行目的基因的扩增,以便得到更加适合检测的目的基因,从而为后期实现高效、高通量检测基因多态性类型建立基础。其中,需要说明的是,本技术中对于各个pcr扩增引物对和单碱基延伸引物的命名并无特殊含义,仅为便于描述。
14.优选的,在所述多重pcr扩增体系内,所述多重pcr扩增引物组中每条pcr扩增引物的浓度为20
‑
500nm。
15.在本技术中,需进一步说明的是,无论选择用的pcr扩增引物对是几对,对应的每条pcr扩增引物的浓度均在20
‑
500nm的范围内。即,若是多重pcr扩增引物组中选择的pcr扩增引物为一对时,则该pcr扩增引物的上游引物和下游引物的浓度分别是20
‑
500nm。若是多重pcr扩增引物组中选择的pcr扩增引物为多对时,以两对为例,则两对pcr扩增引物对中含有的四条扩增引物的浓度均为20
‑
500nm。
16.优选的,s2中进行pcr扩增时,所述多重pcr扩增引物组中各pcr扩增引物对的摩尔比为(0.5~10)1:(0.5~10)2:
……
:(0.5~10)
n
,其中n指的是pcr扩增引物对的对数,n≥2。
17.在本技术中,需进一步说明的是,当选用的扩增引物对是多对,例如是两对时,n的取值为2,两对pcr扩增引物对的摩尔比为(0.5~10):(0.5~10);当选用的扩增引物对是三对时,n的取值为3,三对pcr扩增引物对的摩尔比为(0.5~10):(0.5~10):(0.5~10)。
18.进一步优选的,在所述多重pcr扩增体系中,引物对bco1
‑
1f/bco1
‑
1r、引物对bco1
‑
2f/bco1
‑
2r、引物对bco1
‑
3f/bco1
‑
3r、引物对bco1
‑
4f/bco1
‑
4r、引物对bco1
‑
5f/bco1
‑
5r、引物对rbp4
‑
f/rbp4
‑
r、引物对ffar4
‑
f/ffar4
‑
r、引物对pkd1l2
‑
f/pkd1l2
‑
r、引物对pnpla3
‑
f/pnpla3
‑
r和引物对ttr
‑
f/ttr
‑
r的摩尔比为1:1:2.5:1:1.5:1:1.5:1:1.5:0.5。
19.通过采用上述技术方案,进一步优化了各引物对的摩尔比,以使得最终的扩增效果更加优异,从而有利于实现高效、高通量地检测基因多态性类型。
20.优选的,所述多重pcr扩增体系的体积为2.5
‑
50μl。
21.优选的,所述多重pcr扩增体系还包括dna聚合酶和dntps;在所述多重pcr扩增体系中,所述dna聚合酶的浓度为0.05
‑
0.5u/μl,所述dntps的浓度为200
‑
1000μm,所述待测样本基因组dna的浓度为1
‑
10ng/μl。
22.通过采用上述优化的多重pcr扩增体系进行多重pcr扩增引物组的扩增,能够获得更加优异的扩增效果。
23.优选的,所述酶消化反应体系的体积为2.5
‑
50μl。
24.优选的,在所述酶消化反应体系中,所述碱性磷酸酶浓度为0.02
‑
0.2u/μl。
25.若是酶消化反应体系和碱性磷酸酶浓度不在上述规定的范围内,将导致酶消化反应不完全,造成后续的非特异性扩增,进而导致检测结果不准确。因此,通过采用上述技术方案,能够使得消化反应完全并顺利进行后续的特异性扩增,从而最终使得检测结果更加准确。
26.优选的,s3中,酶消化反应的条件为:30
‑
45℃消化10
‑
70min,随后在70
‑
90℃变性5
‑
40min。
27.优选的,所述碱性磷酸酶选自虾碱性磷酸酶、小牛肠碱性磷酸酶、大肠杆菌碱性磷酸酶和大鼠碱性磷酸酶中的任意一种或多种。
28.通过上述碱性磷酸酶的添加以实现消除dntps对单碱基延伸反应的干扰,从而能够在后续进行高效准确的单碱基延伸反应。
29.优选的,s4中进行单碱基延伸反应时,在所述单碱基延伸反应体系内,所述单碱基延伸引物组中的各单碱基延伸引物的摩尔比为(0.1~10)1:(0.1~10)2:
……
:(0.1~10)
m
,其中m指的是单碱基延伸引物的条数,m≥2。
30.在本技术中,需进一步说明的是,当选用的单碱基延伸引物是多条,例如是两条时,m的取值为2,两条单碱基延伸引物的摩尔比为(0.1~10):(0.1~10);当选用的单碱基延伸引物是三条时,m的取值为3,三条单碱基延伸引物的摩尔比为(0.1~10):(0.1~10):(0.1~10)。
31.通过采用上述技术方案,进一步优化了各引物的浓度比,以得到易于后期检测的单碱基延伸引物,以使得能够在后期实现高效、高通量且准确地检测得到各基因/位点的基因多态性类型。
32.进一步优选的,所述单碱基延伸引物组中,引物ep
‑
1、引物ep
‑
2、引物ep
‑
3、引物ep
‑
4、引物ep
‑
5、引物ep
‑
6、引物ep
‑
7、引物ep
‑
8、引物ep
‑
9、引物ep
‑
10、引物ep
‑
11、引物ep
‑
12、引物ep
‑
13、引物ep
‑
14和引物ep
‑
15的摩尔比为1:1:1:1:2:1.5:1:1:1:1:1.5:1:1:3:1.5。
33.通过采用上述技术方案,进一步优化单碱基延伸引物的选择以及各单碱基延伸引物的摩尔比,以提高单碱基延伸的效率和准确性,进而使得能够在后期实现高效、高通量且准确地检测得到各基因/位点的基因多态性类型。
34.优选的,所述单碱基延伸反应体系还包括单碱基延伸酶,在该体系中,所述单碱基延伸酶的添加量为0.02
‑
0.2u/
µ
l。
35.优选的,步骤s5中对所述单碱基延伸产物的纯化过程包括以下步骤:向所述单碱基延伸产物中加入树脂、再加入超纯水后充分混匀,取上清液即为纯化产物。
36.优选的,步骤s5中对纯化后的单碱基延伸产物的检测步骤包括:收集所述纯化产物并进行检测,得到所述维生素a代谢相关基因多态性位点的分子量检测谱图,并与基因多态性位点的理论分子量进行比对,得到相应基因多态性位点的基因型。
37.优选的,步骤s5中对纯化后的所述单碱基延伸产物采用液相
‑
质谱联用方法进行检测;进行液相分离时选用c18反相色谱柱,柱温42~75℃,色谱柱的流动相由水相a和有机相b组成,所述水相a为含有0.5~5vol.%六氟异丙醇和0.05~0.5vol.%三乙胺的水溶液,所述有机相b为含有0.5~5vol.%六氟异丙醇和0.05~0.5vol.%三乙胺的甲醇溶液;采用梯度洗脱方式,洗脱程序为:在0min时,有机相b为2%~8%;在0~(2~3.5)min时,有机相b由2%~8%连续匀速变化至45%~75%;在(2~3.5)~(4.5~5.5)min时,有机相b由45%~75%连续匀速变化至85%~98%;(4.5~5.5)~(6~7.5)min时,有机相b由85%~98%连续匀速变化至2%~8%;(6~7.5)~(8~15)min,维持有机相b为2%~8%,梯度洗脱总时间为8~15min,流动相的流速为0.1~0.5ml/min;或者采用梯度洗脱方式,洗脱程序为:在0min时,有机相b为2%~8%;在0~(1.0~2.5)
min时,有机相b由2%~8%连续匀速变化至45%~75%;在(1.0~2.5)~(2.6~3.5)min时,有机相b由45%~75%连续匀速变化至85%~98%;(2.6~3.5)~(3.6~4.5)min时,有机相b由85%~98%连续匀速变化至2%~8%;(3.6~4.5)~(5~10)min,维持有机相b为2%~8%,梯度洗脱总时间为5~10min,流动相的流速为0.1~0.5ml/min。
38.若是水相a和有机相b中六氟异丙醇和三乙胺的比例未在上述体积比范围内,可能会降低色谱保留,导致部分位点检测不到。因此通过采用上述技术方案,以优化后的检测条件进行相关检测,使得最终能够准确、完整地检测出相关结果,进而提高该检测方法的准确性。
39.优选的,在进行检测时的质谱条件包括:质谱仪的喷雾电压为3500~4000v,鞘气为25~50arb,辅气为10~50arb,离子传输管温度为250~400℃,离子源雾化温度为300~420℃,离子源温度为300~400℃,分辨率为3000~140000,离子化模式为负离子模式。
40.综上所述,本技术具有以下有益效果:1、采用本技术提供的多重pcr扩增引物组和单碱基延伸引物组,并结合液相质谱或者质谱检测等检测技术,不仅可以实现对一个基因/位点的碱基类型检测,还可以同时对多个、甚至是6个精神类药物相关基因bco1、rbp4、ffar4、pkd1l2、pnpla3、ttr的高达15个多态性位点进行多态性的检测,具有结果准确、高通量、检测效率高等优点。
41.2、本技术进一步优化了pcr扩增引物对和各单碱基延伸引物的摩尔比,以实现最高的延伸效率,从而提高碱基类型的检测结果的准确性。
附图说明
42.图1是本技术一实施例的bco1基因的rs11645428位点为g基因型的lc
‑
ms谱图;图2是本技术一实施例的bco1基因的rs11645428位点为a基因型的lc
‑
ms谱图;图3是本技术一实施例的bco1基因的rs12926540位点为t基因型的lc
‑
ms谱图;图4是本技术一实施例的bco1基因的rs12926540位点为c基因型的lc
‑
ms谱图;图5是本技术一实施例的bco1基因的rs119478057位点为c基因型的lc
‑
ms谱图;图6是本技术一实施例的bco1基因的rs119478057位点为t基因型的lc
‑
ms谱图;图7是本技术一实施例的bco1基因的rs12923433位点为a基因型的lc
‑
ms谱图;图8是本技术一实施例的bco1基因的rs12923433位点为g基因型的lc
‑
ms谱图;图9是本技术一实施例的bco1基因的rs12934922位点为a基因型的lc
‑
ms谱图;图10是本技术一实施例的bco1基因的rs12934922位点为t基因型的lc
‑
ms谱图;图11是本技术一实施例的bco1基因的rs12934922位点为g基因型的lc
‑
ms谱图;图12是本技术一实施例的bco1基因的rs7501331位点为c基因型的lc
‑
ms谱图;图13是本技术一实施例的bco1因的rs7501331位点为t基因型的lc
‑
ms谱图;图14是本技术一实施例的bco1基因的rs6564851位点为t基因型的lc
‑
ms谱图;图15是本技术一实施例的bco1基因的rs6564851位点为g基因型的lc
‑
ms谱图;图16是本技术一实施例的rbp4基因的rs121918584位点为t基因型的lc
‑
ms谱图;图17是本技术一实施例的rbp4基因的rs121918584位点为a基因型的lc
‑
ms谱图;图18是本技术一实施例的rbp4基因的rs121918585位点为g基因型的lc
‑
ms谱图;图19是本技术一实施例的rbp4基因的rs121918585位点为a基因型的lc
‑
ms谱图;
图20是本技术一实施例的rbp4基因的rs794726862位点为g基因型的lc
‑
ms谱图;图21是本技术一实施例的rbp4基因的rs794726862位点为a基因型的lc
‑
ms谱图;图22是本技术一实施例的rbp4基因的rs794726861位点为g基因型的lc
‑
ms谱图;图23是本技术一实施例的rbp4基因的rs794726861位点为a基因型的lc
‑
ms谱图;图24是本技术一实施例的ffar4基因的rs10882272位点为t基因型的lc
‑
ms谱图;图25是本技术一实施例的ffar4基因的rs10882272位点为c基因型的lc
‑
ms谱图;图26是本技术一实施例的pkd1l2基因的rs6420424位点为g基因型的lc
‑
ms谱图;图27是本技术一实施例的pkd1l2基因的rs6420424位点为a基因型的lc
‑
ms谱图;图28是本技术一实施例的pnpla3基因的rs738409位点为c基因型的lc
‑
ms谱图;图29是本技术一实施例的pnpla3基因的rs738409位点为g基因型的lc
‑
ms谱图;图30是本技术一实施例的ttr基因的rs1667255位点为a基因型的lc
‑
ms谱图;图31是本技术一实施例的ttr基因的rs1667255位点为c基因型的lc
‑
ms谱图;图32是本技术一实施例的ttr基因的rs1667255位点为g基因型的lc
‑
ms谱图;图33是本技术一实施例的ttr基因的rs1667255位点为t基因型的lc
‑
ms谱图。
具体实施方式
43.以下结合附图和实施例对本技术作进一步详细说明。
实施例
44.一种维生素a代谢相关基因多态性的检测方法,包括以下步骤:s1、根据维生素a代谢相关基因的多态性位点分别设计多重pcr扩增引物组和单碱基延伸引物组;提取待测样本基因组dna。
45.(1)多重pcr扩增引物组和的单碱基延伸引物组设计及结果:在设计多重pcr扩增引物组和单碱基延伸引物组时,根据文献调研的结果,选择维生素a代谢相关的6个基因的15个多态性位点,具体见表1。随后通过ncbi查找各位点的dna序列,设计并合成最佳的多重pcr扩增引物组和单碱基延伸引物组,设计原则为:保证各扩增片段之间不会相互作用产生非特异性产物或二聚体,设计的单碱基延伸引物组具体见表2,多重pcr扩增引物组见表3。其中,各引物合成是委托北京六合华大基因科技有限公司合成得到。最后,根据需要将多重pcr扩增引物组稀释到所需的浓度20μm后备用(20μm即20μmol/l)。
46.表1 维生素a代谢相关基因及多态性位点
表2 维生素a代谢相关基因的多态性位点的单碱基延伸引物表3 维生素a代谢相关基因和位点的多重pcr扩增引物组
(2)待测样本基因组dna的制备方法包括如下步骤:用口腔拭子收集的口腔脱落细胞或收集的新鲜外周血样本,并采用相应的试剂盒提取获得待测样本基因组dna的初始样本,随后采用np80
‑
touch(德国implen)测定dna的浓度及纯度,然后保存基因组dna。
47.其中,若是用口腔拭子收集的口腔脱落细胞,则可以适配性的采用天根口腔拭子基因组dna提取试剂盒(dp322,购自天根生化科技(北京)有限公司)提取待测样本基因组dna的初始样本;若是收集的新鲜外周血样本,则适配性的采用血液/细胞/组织基因组dna提取试剂盒(dp304,购自天根生化科技(北京)有限公司)提取待测样本基因组dna的初始样本。
48.在本实施例中是自外周血采样并最终获得待测样本基因组dna的初始样本,并采用np80
‑
touch(德国implen)测定dna的浓度及纯度。经测定,待测样本基因组dna的浓度为
27.5ng/μl,纯度od260/280为1.869。
49.s2、配制多重pcr扩增体系,多重pcr扩增体系包括步骤s1中获得的待测样本基因组dna(即模板dna)和多重pcr扩增引物组,以待测样本基因组dna为模板,并加入多重pcr扩增引物组,扩增得到多重pcr扩增产物,备用。
50.其中,多重pcr扩增体系中还包括dna聚合酶、pcr反应缓冲液和dntp,dna聚合酶购自赛默飞,货号f630s,通过调整引物浓度、dntp浓度、缓冲液浓度、酶用量,来配制多重pcr扩增体系,多重pcr扩增体系的组成成分见表4。
51.表4 多重pcr扩增体系其中,“5
×
pcr buffer”是指:在使用时将pcr反应缓冲液按照体积稀释5倍获得的缓冲液,pcr反应缓冲液是tris
‑
hcl(ph8.3
‑
8.8);“25mm dntp mix”指的是四种dntp浓度均为25mmol/l的dntp混合液;“dna聚合酶”选用的是taq dna聚合酶。多重pcr扩增引物组中,所有引物对的添加总体积为2.5μl。
52.在本实施例中,选择的引物对是上述10对引物对,对引物对的摩尔比进行优化,从表5所示的数据结果中确定的最优摩尔比是1:1:2.5:1:1.5:1:1.5:1:1.5:0.5(即摩尔比3)。其中,在多重pcr扩增引物组的引物复合物中,bco1
‑
1f和bco1
‑
1r的浓度均为1μm(即1μmol/l),即在多重pcr扩增体系中,bco1
‑
1f和bco1
‑
1r的浓度均为250nm(即250nmol/l)。
53.表5
“
信号低”指的是信噪比<10的信号显示;
“‑”
指的是检出信号且有明显信号,“有明显信号”指的是信噪比≥10的信号显示。
54.根据选取的扩增酶系,对退火及延伸的温度及时间进行优化,确定最优的pcr扩增程序见表6。
55.表6多重pcr扩增程序
s3、配置酶消化反应体系:酶消化反应体系中包括碱性磷酸酶、酶缓冲液和步骤s2中得到的多重pcr扩增产物。具体组分及用量见表7。
56.表7碱性磷酸酶消化体系和程序在本实施例中,选择的碱性磷酸酶为虾碱性磷酸酶(购自赛默飞世尔科技(中国)有限公司,货号ef0651),其中,“酶反应缓冲液”指的是10
×
buffer,其含有100mm tris
‑
hcl(ph8.0),1m kcl,50mm mgcl2和0.2wt% triton x
‑
100(其中的单位“m”指代的是“mol/l”;单位“mm”指代的是“mmol/l”)。
57.在进行pcr扩增产物的酶消化反应时,将上述原料加在一起之后,先在37℃的温度下反应60min,随后在80℃的温度下反应10min后得到酶消化产物。
58.s4、配制单碱基延伸反应体系:单碱基延伸反应体系包括酶消化产物、单碱基延伸引物组、单碱基延伸酶、单碱基延伸反应缓冲液和双脱氧核苷三磷酸混合物(ddntps)。其中的单碱基延伸酶具体选择为罗氏的taq dna聚合酶,货号12032945001,单碱基延伸反应缓冲液具体选择为10
×
pcr buffer,包括100mm tris
‑
hcl (ph8.3),500mm kcl,20mm mgcl2(其中的单位“m”指代的是“mol/l”;单位“mm”指代的是“mmol/l”)。该单碱基延伸反应体系中的各组分的用量见表8。配置好单碱基延伸反应体系后,对退火及延伸的温度及时间进行优化,最终确定以表9中所示条件进行单碱基延伸反应。按照表9所示的体系进行单碱基延伸反应,首先进行步骤1(不循环);随后进行步骤2(不循环),然后依次进行步骤3
‑
4(步骤3
‑
4整体循环10次)后,将“步骤2(不循环),然后依次进行步骤3
‑
4(步骤3
‑
4整体循环10次)”的步骤整体循环35次;最后依次进行步骤5
‑
6,得到单碱基延伸产物。
59.其中,酶消化产物的添加量为10μl,单碱基延伸引物选择的是上述15个引物的复合物,对各引物的摩尔比进行优化,从表10所示的摩尔比中优选出各单碱基延伸引物的摩尔比是1:1:1:1:2:1.5:1:1:1:1:1.5:1:1:3:1.5(即摩尔比3),其中,在单碱基延伸引物组复合物中,ep
‑
1的浓度为15μm(其中的单位“μm”指代的是“μmol/l”)。
60.表8单碱基延伸反应体系
表9单碱基延伸反应条件表10
“
信号低”指的是信噪比<10的信号显示;
“‑”
指的是检出信号且有明显信号,“有明显信号”指的是信噪比≥10的信号显示;“/”指的是该样本不包含此基因型。
61.s5、将单碱基延伸产物纯化后进行液相
‑
质谱联用检测,获得待测标本的维生素a相关基因的多态性。
62.(1)单碱基延伸产物的纯化于步骤s4中得的单碱基延伸产物中加入50μl的蒸馏水,再加入25mg的树脂(购自默克公司的amberlite cg50型树脂,是一种弱酸性的羧酸型阳离子交换树脂),将上述含有单碱基延伸产物和树脂的pcr管固定到旋转混匀仪上,充分旋转混匀旋转30min,离心取上清,得到纯化产物。
63.(2)纯化产物的检测收集上述获得的纯化产物,取40μl纯化产物进行液相
‑
质谱联用检测。质谱条件
为:质谱仪的喷雾电压为4000v,鞘气为40arb,辅气为25arb,离子传输管温度为350℃,离子源雾化温度为380℃,离子源温度为400℃,分辨率为140000,离子化模式为负离子模式。
64.液相的检测条件为:采用c18反相色谱柱,c18反相色谱柱的柱温为:42~75℃;所述纯化产物的进样量为:20
µ
l;色谱柱的流动相由水相a和有机相b组成,水相a为含有3vol.%六氟异丙醇(hfip)和0.1vol.%三乙胺(tea)的水溶液,有机相b为含3vol.%六氟异丙醇(hfip)和0.1vol.%三乙胺(tea)的甲醇溶液。采用梯度洗脱方式,洗脱程序为:在0~3.0min时,有机相b自5%连续匀速变化至60%;在3.0~5.0min时,有机相b自60%连续匀速变化至95%;在5.0~6.0min时,有机相b自95%连续匀速变化至5%;在6.0~8.0min时,维持有机相b为5%;梯度洗脱总时间为8min,流动相的流速为0.3ml/min。
65.最终得到维生素a代谢相关基因多态性位点的分子量检测谱图(图1
‑
33),并与基因多态性位点的理论分子量进行比对,得到相应基因多态性位点的基因型,理论的维生素a代谢相关基因多态性位点的分子量见表11。
66.表11理论的维生素a代谢相关基因多态性位点的基因型对应分子量大小根据图1
‑
33的结果得出,维生素a代谢相关基因多态性位点的基因型对应的实际测得的分子量大小见表12;通过与上述表11相比对,得到相应基因多态性位点的基因型见
表12。
67.表12注:表12中的“/”表示没有检测到该分子量的基因型;即该样本不包含此基因型。
68.与“金标准”pcr
‑
测序方法(即sanger测序法)相比,采用本技术的测序方法所获得的结果与之一致,且本技术所提供的检测方案具有较好的特异性和适用性。
69.对比例1本对比例和实施例的区别在于,单碱基延伸引物ep
‑
5不同。在本对比例中,单碱基延伸引物ep
‑
5的核苷酸序列如seq id no.36所示,具体为5'
‑
tagcaggaggcccagctcat
‑
3'。其他单碱基延伸引物ep
‑
1、ep
‑
2、ep
‑
3、ep
‑
4、ep
‑
6、ep
‑
7、ep
‑
8、ep
‑
9、ep
‑
10、ep
‑
11、ep
‑
12、ep
‑
13、ep
‑
14和ep
‑
15的核苷酸序列同实施例,且各单碱基延伸引物ep
‑
1、ep
‑
2、ep
‑
3、ep
‑
4、ep
‑
5、ep
‑
6、ep
‑
7、ep
‑
8、ep
‑
9、ep
‑
10、ep
‑
11、ep
‑
12、ep
‑
13、ep
‑
14和ep
‑
15的摩尔比为1:1:1:1:2:1.5:1:1:1:1:1.5:1:1:3:1.5。
70.扩增引物对选用的是摩尔比为1:1:2.5:1:1.5:1:1.5:1:1.5:0.5的引物对bco1
‑
1f/bco1
‑
1r、引物对bco1
‑
2f/bco1
‑
2r、引物对bco1
‑
3f/bco1
‑
3r、引物对bco1
‑
4f/bco1
‑
4r、
引物对bco1
‑
5f/bco1
‑
5r、引物对rbp4
‑
f/rbp4
‑
r、引物对ffar4
‑
f/ffar4
‑
r、引物对pkd1l2
‑
f/pkd1l2
‑
r、引物对pnpla3
‑
f/pnpla3
‑
r以及引物对ttr
‑
f/ttr
‑
r。
71.其他同实施例。
72.采用本对比例的单碱基延伸引物组和pcr扩增引物组进行维生素a代谢相关基因多态性检测时发现,rs12934922位点延伸不到目标产物。
73.对比例2本对比例和对比例1的区别在于,单碱基延伸引物ep
‑
5和ep
‑
6不同。在本对比例中,单碱基延伸引物ep
‑
5的核苷酸序列如seq id no.5所示;单碱基延伸引物ep
‑
6的核苷酸序列如seq id no.37所示,具体为5'
‑
gccgtggctgttgtagat
‑
3'。
74.其他同对比例1。
75.采用本对比例的单碱基延伸引物组和pcr扩增引物组进行维生素a代谢相关基因多态性检测时发现,rs7501331位点延伸不到目标产物。
76.对比例3本对比例和对比例1的区别在于,单碱基延伸引物ep
‑
5和ep
‑
14不同。在本对比例中,单碱基延伸引物ep
‑
5的核苷酸序列如seq id no.5所示;单碱基延伸引物ep
‑
14的核苷酸序列如seq id no.38所示,具体为5'
‑
gataaggccactgtagaaggg
‑
3'。
77.其他同对比例1。
78.采用本对比例的单碱基延伸引物组和pcr扩增引物组进行维生素a代谢相关基因多态性检测时发现,rs738409位点延伸不到目标产物。
79.对比实施例1本对比实施例和对比例3的区别在于,本对比例中单碱基延伸引物ep
‑
14的核苷酸序列如seq id no.14所示。且最终进行液相检测时,采用梯度洗脱的洗脱程序为:在0~0.5min时,有机相b自5%连续匀速变化至40%;在0.5~1.5min时,有机相b自40%连续匀速变化至95%;在1.5~3.5min时,有机相b自95%连续匀速变化至5%;在3.5~5.0min时,维持有机相b为5%。梯度洗脱时间为5min,流动相的流速为0.3ml/min。检测结果为:15个位点中大多数位点的信号低,无法判断相关基因的多态性。
80.对比实施例2本对比实施例和对比实施例1的区别在于,最终进行液相检测时,采用洗脱程序为:在0~1.0min时,有机相b自5%连续匀速变化至20%;在1.0~4.5min时,有机相b自20%连续匀速变化至95%;在4.5~5.0min时,有机相b自95%连续匀速变化至5%;在5.0~6.0min时,维持有机相b为5%。梯度洗脱的总时间为6min,流动相的流速为0.3ml/min。检测结果为:15个位点中大多数位点的信号低,无法判断相关基因的多态性。
81.对比实施例3本对比例和对比实施例1的区别在于,最终进行液相检测时,采用洗脱程序为:在0~2.5min时,有机相b自5%连续匀速变化至40%;在2.5~4.5min时,有机相b自40%连续匀速变化至95%;在4.5~5.5min时,有机相b自95%连续匀速变化至5%;在5.5~8.0min时,维持有机相b为5%,梯度洗脱的总时间为8min,流动相的流速为0.2ml/min。检测结果为:15个位点中大多数位点的信号低,无法判断相关基因的多态性。
82.对比实施例4
本对比例和对比实施例1的区别在于,最终进行液相检测时,采用洗脱程序为:在0~2.5min时,有机相b自5%连续匀速变化至60%;在2.5~3.5min时,有机相b自60%连续匀速变化至95%;在3.5~4.0min时,有机相b自95%连续匀速变化至5%;在4.0~5.0min时,维持有机相b为5%,梯度洗脱总时间为5min,流速为0.3ml/min。检测结果为:能够获得15个位点的信号并能够判断相关基因的多态性。
83.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1