用于鉴别中蜂蜂蜜和意蜂蜂蜜的PCR方法及应用
用于鉴别中蜂蜂蜜和意蜂蜂蜜的pcr方法及应用
技术领域
1.本发明属于生物检测技术领域,具体涉及一种用于鉴别中蜂蜂蜜和意蜂蜂蜜的核酸序列、方法及应用。
背景技术:
2.蜂蜜作为一种广泛食用的天然保健食品,自古以来就一直深受消费者喜爱。蜂蜜除了含有丰富的糖类,还含有多种微量成分,包括游离氨基酸、蛋白质、酚类化合物、矿物质、维生素和有机酸等(ouchemoukh et al.2005,da silva et al 2016);同时,蜂蜜还在抗炎抗氧化等方面起到作用。因此,蜂蜜受到越来越多消费者的青睐。
3.我国是养蜂大国,养蜂业已成为我国现代农业的重要组成部分。我国的蜜蜂养殖量、蜂产品产量和出口量均处于世界首位。据中国养蜂学会2018年统计数据显示,我国年产蜂蜜47.9万吨、蜂王浆3000吨,蜂蜡6000吨、蜂花粉4000吨、蜂胶350吨。中华蜜蜂(apis cerana cerana),简称中蜂,意大利蜜蜂(apis mellifera ligustica),简称意蜂,其中,中蜂年产蜜量为5
‑
10万吨,意蜂年产蜜量约40万吨(张言政.中蜂蜂蜜与意蜂蜂蜜蜂种来源真实性研究[d].杭州:浙江大学,2019.)。基于中蜂蜜的低产量,以及部分消费者对传统土蜂蜜的偏爱,中蜂蜜的价格是意蜂蜜的数倍,市场上也存在将意蜂蜜掺入或伪造成中蜂蜜进行销售的现象。
[0004]
目前鉴别中蜂蜂蜜和意蜂蜂蜜的方法主要集中在通过鉴别蜂蜜中蛋白成分差异(例如申请号为cn201510999246.9的一种鉴别中蜂蜂蜜和意蜂蜂蜜的方法,申请号为cn201610545277.1为基于王浆主蛋白成分鉴别中蜂蜂蜜与意蜂蜂蜜的方法)或者辨别蜂蜜中有机成分差异(如申请号为cn201810008004.2的一种鉴别中蜂蜂蜜和意蜂蜂蜜的方法,申请号为cn202010197053.2的吲哚
‑3‑
乙酸甲酯在鉴别中蜂蜂蜜和意蜂蜂蜜中的应用,申请号为cn202011120746.8的一种区分中蜂蜂蜜与意蜂蜂蜜的方法)。在鉴别技术上也有通过液相色谱质谱分析技术(如申请号为cn202010198016.3的的一种鉴别中蜂蜂蜜和意蜂蜂蜜的方法)来达到鉴别中蜂蜂蜜和意蜂蜂蜜的目的。但通过蛋白检测区分中蜂蜂蜜和意蜂蜂蜜耗时较长,而液相色谱质谱分析对仪器要求较高,且操作人员要求专业技术人员,在实际应用中存在有局限性。
[0005]
随着现代分子生物学的发展,以聚合酶链式反应(pcr)为基础的技术在鉴别产品动物源性中起到重要作用。目前已有研究通过线粒体dna来鉴别蜂蜜的物种来源(kim,c.
‑
k.;lee,d.c.;choi,s.
‑
h.detection of korean native honey and european honey by using duplex polymerase chain reaction and immunochromatographic assay.korean j.food sci.anim.resour.2017,37,599.),但线粒体dna拷贝数较多,在不同组织中含量不同,稳定性较差。动物核基因组dna序列具有高度的物种特异性,避免非特异性扩增,更加适合pcr定性定量分析。针对核基因组dna,国内也有研究通过王浆主蛋白2基因设计引物对中蜂蜂蜜和意蜂蜂蜜进行鉴定(张言政.中蜂蜂蜜与意蜂蜂蜜蜂种来源真实性研究[d].杭州:浙江大学,2019.),其提出采用双重pcr和荧光定量pcr鉴别中蜂蜂蜜和意蜂蜂蜜。其中,双
重pcr方法能够鉴别中蜂蜂蜜里1%比例意蜂蜂蜜的掺入,但该方法对混合蜂蜜中含有的中蜂蜂蜜检测效果不佳,且未提出中蜂引物的灵敏度,因此在实际应用中可能会导致假阴性;而所开发的荧光定量pcr并未明确指出鉴别的灵敏度且荧光定量pcr因容易受到仪器设备的限制,成本较高。因此,亟需一种特异性强、灵敏度高、成本较低的pcr方法来鉴别中蜂蜂蜜和意蜂蜂蜜。
技术实现要素:
[0006]
为了解决上述技术问题,本发明提供用于鉴别中蜂蜂蜜和意蜂蜂蜜核苷酸序列和pcr方法。
[0007]
为实现上述目的,本发明采用以下的技术方案为:
[0008]
用于鉴别中蜂蜂蜜和意蜂蜂蜜的核苷酸序列,其包括用于能同时扩增seq id no.1所示序列与seq id no.2所示序列的引物对。
[0009]
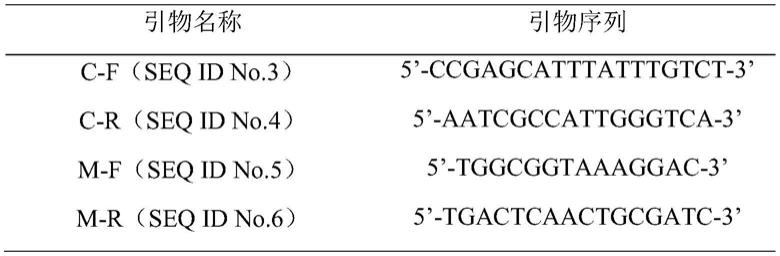
如上所述的核苷酸序列,优选地,其包括用于检测中蜂蜂蜜的引物对如seq id no.3和seq id no.4所示的序列和用于检测意蜂蜂蜜的引物对如seq id no.5和seq id no.6所示序列。
[0010]
用于鉴别中蜂蜂蜜和意蜂蜂蜜的检测试剂盒,其包括如上所述的核苷酸序列。
[0011]
如上所述的检测试剂盒,优选地,还包括2
×
taq dna mastermix。
[0012]
一种鉴别中蜂蜂蜜和意蜂蜂蜜的pcr方法,其包括如下步骤:
[0013]
s1、提取蜂蜜的基因组dna,
[0014]
s2、采用如seq id no.3、seq id no.4、seq id no.5和seq id no.6所示的引物序列对提取的蜂蜜基因组dna进行pcr扩增;
[0015]
s3、对扩增产物进行电泳,判断结果。
[0016]
如上所述的pcr方法,优选地,在步骤s1中,提取蜂蜜的dna前的预处理为将蜂蜜先加入无菌水稀释,振荡混匀,40℃孵育10min,7000r/m离心30min,弃上清;将沉淀悬浮于超纯水中,13000r/min离心20min,弃上清,保留沉淀物用于提取dna。
[0017]
如上所述的pcr方法,优选地,在步骤s2中,pcr扩增的反应体系中各引物对中引物的终浓度为0.25μmol/l,反应程序为:94℃初始预变性2min;94℃变性30s,58℃退火30s,72℃延伸30s,35个循环;72℃延伸10min。
[0018]
如上所述的pcr方法,优选地,在步骤s3中,电泳结果中若出现有194bp大小的特异性条带,说明含有中蜂蜂蜜,若出现有330bp大小的特异性条带,说明含有意蜂蜂蜜,如果有194bp、330bp两条条带都存在,说明中蜂蜂蜜中掺和有意蜂蜂蜜。
[0019]
如上所述的pcr方法在中蜂蜂蜜和意蜂蜂蜜鉴别中的应用。
[0020]
本发明的有益效果在于:
[0021]
本发明提供的一种中蜂蜂蜜与意蜂蜂蜜的鉴别方法,根据中蜂和意蜂基因组dna的特异性条带差异来鉴别中蜂蜂蜜和意蜂蜂蜜。采用本发明的特异性引物pcr扩增处理后的蜂蜜样品,中蜂蜂蜜于194bp处出现特异性条带,而意蜂蜂蜜于330bp处出现特异性条带,两者的掺和蜂蜜样品同时能扩增出194bp和330bp两条特异性条带。本发明通过区别不同蜂蜜的特异性条带来达到鉴别目的,可以快速、准确地鉴别中蜂蜂蜜和意蜂蜂蜜。本发明具有简便、快捷、特异性强的特点,且成本较低,适用性广。
[0022]
本发明提供的用于鉴别中蜂蜂蜜和意蜂蜂蜜的pcr方法能有效鉴别出中蜂蜂蜜中掺入最低有1%意蜂蜂蜜的结果,同时本发明直接比对中蜂和意蜂全基因组,得到特异性核苷酸序列,避免了假阴性结果。
[0023]
本发明提供的用于鉴别中蜂蜂蜜和意蜂蜂蜜的pcr方法仅需要普通pcr仪、凝胶电泳仪和凝胶成像系统或紫外透射仪,检测过程仅需3h,所需试剂简单易得,因此该方法仪器设备要求简单、耗时短、成本低,适合推广。
附图说明
[0024]
图1为中蜂和意蜂中、意蜂基因组dna扩增结果。
[0025]
图2为中蜂和意蜂中、意蜂蜂蜜dna提取物扩增结果。
[0026]
图3为不同浓度中蜂基因组dna模板扩增结果。
[0027]
图4为不同浓度在中蜂蜜dna提取物扩增结果。
[0028]
图5为不同浓度意蜂基因组dna模板扩增结果。
[0029]
图6为不同浓度意蜂蜜dna提取物扩增结果。
[0030]
图7为混合基因组dna双重pcr扩增结果。
[0031]
图8为混合蜂蜜dna提取物双重pcr扩增结果。
[0032]
图9为不同中蜂引物对扩增的结果。
[0033]
图10为不同意蜂引物对扩增的结果。
具体实施方式
[0034]
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。在不背离本发明精神和实质的前提下,对本发明所作的修饰或者替换,均属于本发明的范畴。
[0035]
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,除另有规定,本发明所用试剂均为分析纯或以上规格。
[0036]
实施例1:中蜂和意蜂特异性检测
[0037]
1试样的制备及保存
[0038]
1.1取样
[0039]
采集中蜂和意蜂各一只,于
‑
80℃保存备用;采集中蜂蜂蜜和意蜂蜂蜜各15g,于4℃保存备用。
[0040]
蜜蜂的处理:将蜜蜂样品冷冻后使用双蒸水洗净并用吸水纸去除水分,取头部和胸部置于1.5ml离心管中,液氮研磨或使用组织研磨仪破碎,破碎后的产物置于
‑
80℃保存备用;
[0041]
蜂蜜的处理:取15g蜂蜜稀释于50ml超纯水中,42℃孵育10min,涡旋振荡后7000r/min离心30min,弃去上清液,将沉淀物悬浮于1ml纯水中,13000r/min离心20min,弃上清,沉淀物置于
‑
80℃保存。
[0042]
1.2 dna提取
[0043]
dna模板制备采用常用的苯酚
‑
氯仿粗提法或者公认的、具有相同效力的其他提取方法,这些方法都是报道的常用方法,对上述样品提取dna。
[0044]
2引物设计
[0045]
比对中蜂和意蜂全基因组dna序列,筛选得到鉴别中蜂和意蜂的特异性核苷酸序列。根据筛选得到的中蜂和意蜂特异性核苷酸序列,使用primer premier 5.0软件或其他引物设计软件设计引物。经过大量实验进行优化,最后获得的引物dna序列如表1所示,其中引物对c
‑
f与c
‑
r对中华蜜蜂(apis cerana cerana fabricius)的基因组扩增,预期扩增片段大小为194bp,其核苷酸的序列如seq id no.1所示,m
‑
f与m
‑
r对意大利蜜蜂(apis mellifera ligustica)的基因组扩增,预期扩增片段大小为330bp,其核苷酸序列如seq id no.2所示。引物合成由具备引物合成服务的公司完成即可,本实施例中所用引物由武汉擎科合成。
[0046]
表1本发明设计的中蜂pcr扩增引物和意蜂pcr扩增引物
[0047][0048]
实验表明,该引物特异性强,仅在各自对应的物种中特异性表达,而在非本物种中无目的片段扩增。以上述引物分别向3’、5’延伸一个碱基和两个碱基或修饰形成的引物进行对进行实验,实验表明仍能进行特异性扩增;从经济性和综合效果来看以表1中引物最佳。
[0049]
3 pcr检测
[0050]
3.1 pcr反应
[0051]
将表1中的上下游引物都配置成为浓度为10μmol/l的引物,以步骤1.2中提取的dna作为模板进行pcr扩增,对于中蜂蜂蜜pcr扩增中采用引物序列如seq id no.3和seq id no.4所示序列,对于意蜂蜂蜜pcr扩增中采用如seq id no.5和seq id no.6所示序列,都按上下游引物的用量和浓度加入pcr反应体系,具体如表2所示;
[0052]
表2本发明pcr扩增的反应体系
[0053][0054]
pcr反应程序为:94℃初始预变性2min;94℃变性30s,58℃退火30s,72℃延伸30s,35个循环;72℃延伸10min。
[0055]
3.2在pcr反应的同时设置空白对照,以双蒸水作为pcr反应的空白对照。
[0056]
3.3以中蜂和意蜂提取的dna为模板和两种蜂蜜提取的dna为模板进行扩增。
[0057]
4 pcr扩增产物的检测
[0058]
按20g/l的质量浓度称量琼脂糖,加入1
×
tae缓冲液中,加热溶解,配置成2%的琼脂糖溶液,稍适冷却后,将其倒入电泳板上,插上梳板,室温凝固成凝胶后,放入1
×
tae缓冲液中,垂直向上轻轻拔去梳板。取5μl pcr产物与1μl 6
×
rna/dna loading buffer混合后加入凝胶点样孔中,同时在其中一个点样孔中加入dna分子量标准,接通电源在2v/cm~5v/cm条件下电泳30~45min后检测。
[0059]
电泳结束后,取出琼脂糖凝胶,置于凝胶成像仪或紫外透射仪上成像。根据dna分子量标准判断扩增条带大小,将电泳结果形成电子文件存档或用照相系统拍照。
[0060]
5结果分析
[0061]
采用中、意蜂提取的基因组dna进行扩增的结果如图1所示,图中,m:为bm5000 dna marker;l1:中蜂基因组dna和中蜂引物c
‑
f与c
‑
r;l2:意蜂基因组dna和中蜂引物c
‑
f与c
‑
r;l3:空白对照和中蜂引物c
‑
f与c
‑
r;l4:中蜂基因组dna和意蜂引物m
‑
f与m
‑
r;l5:意蜂基因组dna和意蜂引物m
‑
f与m
‑
r;l6:空白对照和意蜂引物m
‑
f与m
‑
r。采用中、意蜂蜂蜜提取的dna进行扩增的结果如图2所示,图中l1:中蜂蜜dna和中蜂引物c
‑
f与c
‑
r;l2:意蜂蜜dna和中蜂引物c
‑
f与c
‑
r;l3:空白对照和中蜂引物c
‑
f与c
‑
r;l4:中蜂蜜dna和意蜂引物m
‑
f与m
‑
r;l5:意蜂蜜dna和意蜂引物m
‑
f与m
‑
r;l6:空白对照和意蜂引物m
‑
f与m
‑
r。结果表明该方法以中蜂特异性引物和意蜂特异性引物与中蜂dna和意蜂dna为模板进行pcr扩增反应,很好的验证了中蜂特异性引物和意蜂特异性引物的有效性和特异性。可以看出,中蜂引物和意蜂引物均能很好的扩增出其对应物种的特异性大小的片段,而在非本物种中均为扩增出目的条带。
[0062]
实施例2:灵敏度试验
[0063]
分别以100ng、10ng、1ng、0.1ng、0.01ng、0.001ng的中蜂基因组dna、中蜂蜜dna提取物和意蜂基因组dna、意蜂蜜dna提取物为模板,按照实施例1的条件,扩增中蜂特异性引物和意蜂特异性引物。结果如图3
‑
6所示,其中图3为不同浓度中蜂基因组dna模板扩增结果;图4为不同浓度在中蜂蜜dna提取物扩增结果;图5为不同浓度意蜂基因组dna模板扩增结果;图6为不同浓度意蜂蜜dna提取物扩增结果。泳道中编号说明如下:m:为bm5000 dna marker;l1:100ng;l2:10ng;l3:1ng;l4:0.1ng;l5:0.01ng;l6:0.001ng;l7:空白对照。结果表明0.1ng的模板即有扩增,表明特异性引物所扩增的片段具有较好的灵敏性。实施例3:检测中蜂蜂蜜中掺入意蜂蜂蜜
[0064]
本发明是对中蜂蜂蜜鉴定及其掺假的检测,通过意蜂引物pcr扩增的情况,判断是否存在意蜂dna,进而判定是否有意蜂蜂蜜掺入。
[0065]
1制备混合样品
[0066]
1.1.混合基因组dna制备
[0067]
将提取的中蜂、意蜂基因组dna稀释至相同浓度,按照意蜂基因组dna占比为0%、1%、5%、10%、30%、50%、80%和100%进行混合,制得混合基因组dna样品。
[0068]
1.2.混合蜂蜜dna提取物制备
[0069]
使用中蜂蜂蜜和意蜂蜂蜜制备不同比例的混合蜂蜜样品,其中意蜂蜂蜜所占比例依次为:0%、1%、5%、10%、30%、50%、80%和100%。使用实施例1的方法提取混合蜂蜜dna,得到混合蜂蜜dna提取物。
[0070]
2 pcr及电泳方法与实施例1相同。
[0071]
3凝胶电泳检测结果如图7和图8所示。
[0072]
4结果分析
[0073]
混合基因组dna双重pcr扩增结果所得凝胶成像如图7所示,混合蜂蜜dna提取物双重pcr扩增结果所得凝胶成像如图8所示,图中,泳道中编号说明如下:m:为bm5000 dna marker;l1:意蜂模板比例0%;l2:意蜂模板比例1%;l3:意蜂模板比例5%;l4:意蜂模板比例10%;l5:意蜂模板比例30%;l6:意蜂模板比例50%;l7:意蜂模板比例80%;l8:意蜂模板比例100%。可以看到在1%意蜂模板dna混入时即可观察到330bp的意蜂特异性条带;且随着意蜂模板dna比例的上升,意蜂特异性条带的亮度逐渐增强,而中蜂特异性条带(194bp)的亮度逐渐减弱。表明本发明的中蜂蜜真伪鉴别方法的灵敏度可达1%。
[0074]
实施例3中蜂和意蜂特异性引物的筛选
[0075]
采用不同的中蜂引物对和意蜂引物对如表3中所示,分别以中蜂基因组dna和意蜂基因组dna为模板,按照实施例1的条件进行扩增,之后进行电泳检测。结果如图9
‑
10所示,其中图9为不同中蜂引物对的扩增结果;图10为不同意蜂引物对的扩增结果。图9泳道中编号说明如下:m:为bm5000dna marker;l1:中蜂引物c1
‑
f与c1
‑
r和中蜂基因组dna;l2:中蜂引物c1
‑
f与c1
‑
r和意蜂基因组dna;l3:中蜂引物引物c1
‑
f与c1
‑
r和空白对照;l4:中蜂引物c
‑
f与c
‑
r和中蜂基因组dna;l5:中蜂引物c
‑
f与c
‑
r和意蜂基因组dna;l6:中蜂引物引物c
‑
f与c
‑
r和空白对照。图10泳道中编号说明如下:m:为bm5000 dna marker;l1:意蜂引物m
‑
f与m
‑
r和中蜂基因组dna;l2:意蜂引物m
‑
f与m
‑
r和意蜂基因组dna;l3:意蜂引物引物m
‑
f与m
‑
r和空白对照;l4:意蜂引物m1
‑
f与m1
‑
r和中蜂基因组dna;l5:意蜂引物m1
‑
f与m1
‑
r和意蜂基因组dna;l6:意蜂引物引物m1
‑
f与m1
‑
r和空白对照;l7:意蜂引物m2
‑
f与m2
‑
r和中蜂基因组dna;l8:意蜂引物m2
‑
f与m2
‑
r和意蜂基因组dna;l9:意蜂引物引物m2
‑
f与m2
‑
r和空白对照。
[0076]
表3本对比例使用的中蜂pcr扩增引物和意蜂pcr扩增引物
[0077][0078][0079]
结果表明,虽然中蜂引物c1
‑
f与c1
‑
r可以扩增出中蜂特异性条带,但在相同的操
作条件下,仅用引物不同,其所扩增出的条带亮度较本发明所提供的引物对c
‑
f与c
‑
r扩增出的条带低,说明本发明提供的引物效果最佳;意蜂引物结果类似,引物对m1
‑
f与m1
‑
r和引物对m2
‑
f与m2
‑
r效果比本发明提供的引物m
‑
f与m
‑
r差;综合考虑,本发明提供的引物对具有最优的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1