一株分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株及其应用
1.本发明属于免疫检测技术领域,具体涉及一株分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株及其应用。
背景技术:
2.三氯杀螨醇(dicofol),又名1,1
‑
二(对氯苯基)
‑
2,2,2
‑
三氯乙醇或开乐散,是农业生产中常用的一种有机氯杀螨剂,在我国常被用于防治棉花、果树、花卉的多种害螨。然而在三氯杀螨醇生产过程中,可能含有一定量的ddt残留,危害到环境和人体健康。近些年来已有越来越多的证据表明,其在环境中的暴露对鱼类、爬行类、鸟类、哺乳类和人类有毒性和雌激素效应,对水生生物有极高毒性。因此,我国已经禁止三氯杀螨醇在农业生产中的应用。2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,三氯杀螨醇在3类致癌物清单中。《gb 2763—2021食品中农药最大残留限量》中规定了三氯杀螨醇在各种食品中的最大残留限量标准(mrl),如其在蔬菜和水果中的mrl均为0.01mg/kg,在坚果中的mrl均为0.02mg/kg,在稻类、麦类和杂粮类谷物中的mrl为0.02mg/kg。
3.为了有效监督监测食品中三氯杀螨醇的使用情况,需要一种特异性好,灵敏度高的测定方法,而目前检测方法如气相色谱法、高效液相色谱法、高效液相色谱串联质谱法等,其成本昂贵、样本前处理繁琐、对操作人员技术要求教高,且不能立即出结果,加上食品中干扰物较多,因此仪器方法并不适用于现场检测。免疫学快速检测方法是一种低成本、快速且高灵敏度高特异性的免疫学检测方法,而且操作简便,已广泛适用于农药残留检测领域。建立高效的免疫学检测方法,筛选高特异性的单克隆抗体是其重要前提。
技术实现要素:
4.发明目的:为了克服现有技术中存在的不足,本发明提供一株分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株及其应用,由该细胞株制备的抗体对三氯杀螨醇具有较高的检测灵敏度,可以用来建立三氯杀螨醇的免疫学检测方法。
5.技术方案:为实现上述目的,本发明采用的技术方案为:
6.本发明的第一个目的是提供一株分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株jhj,已保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,分类命名为单克隆细胞株jhj,保藏日期2021年05月13,保藏编号cgmcc no.22329。
7.三氯杀螨醇单克隆抗体,它由所述保藏编号为cgmcc no.22329的三氯杀螨醇单克隆抗体的杂交瘤细胞株jhj分泌产生。
8.本发明的第二个目的是提供一种三氯杀螨醇半抗原,所述三氯杀螨醇半抗原的结构式如下:
[0009][0010]
本发明的第三个目的是提供一种三氯杀螨醇半抗原的合成方法,所述方法包括步骤如下:4,4
′‑
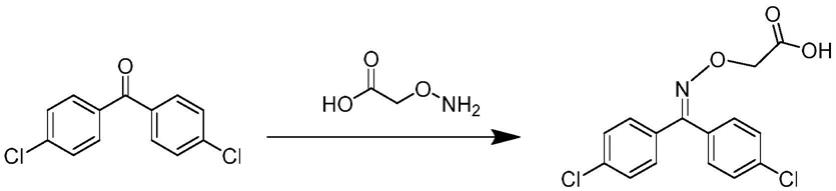
二氯二苯甲酮和羧甲基羟胺半盐酸盐固体加入加入由甲醇、吡啶和纯水组成的混合溶液中,60~90℃水浴持续搅拌反应5~10h;取出,室温静置过夜;氮气吹干,加入二氯甲烷复溶,纯水萃取,弃水层,有机相经氮气吹干得到的粘稠状固体即为三氯杀螨醇半抗原。
[0011]
在本发明的一种实施方式中,所述4,4
′‑
二氯二苯甲酮和羧甲基羟胺半盐酸盐固体的摩尔质量比为1:3~6,所述4,4
′‑
二氯二苯甲酮在所述混合溶液中的浓度为5~10g/l;优选的,所述4,4
′‑
二氯二苯甲酮和羧甲基羟胺半盐酸盐固体的摩尔质量比为1:4,所述4,4
′‑
二氯二苯甲酮在所述混合溶液中的浓度为8.3g/l。
[0012]
在本发明的一种实施方式中,所述混合溶液由甲醇、吡啶和纯水按照体积比2~5:1~3:1形成;优选的,所述混合溶液由甲醇、吡啶和纯水按照体积比4:1:1形成。
[0013]
本发明的第四个目的是提供一种三氯杀螨醇完全抗原的制备方法,所述完全抗原包括三氯杀螨醇免疫原,所述方法包括步骤如下:三氯杀螨醇半抗原用n,n
‑
二甲基甲酰胺溶解,加入1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺,室温持续搅拌反应,得三氯杀螨醇半抗原活化液;将载体蛋白用硼酸缓冲溶液溶解,称为蛋白a液;在室温条件,将三氯杀螨醇半抗原活化液缓慢滴加到蛋白a液中,室温搅拌反应过夜,透析,即得三氯杀螨醇完全抗原。
[0014]
在本发明的一种实施方式中,所述载体蛋白包括钥孔血蓝蛋白、牛血清白蛋白bsa及其他适用于偶联的载体蛋白。
[0015]
本发明的一种实施方式中,所述三氯杀螨醇半抗原、1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺的摩尔质量比为1:3~5:3~5,所述三氯杀螨醇半抗原在n,n
‑
二甲基甲酰胺中的浓度为20~30g/l;优选的,所述三氯杀螨醇半抗原、1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺的摩尔质量比为1:4.1:3.4,所述三氯杀螨醇半抗原在n,n
‑
二甲基甲酰胺中的浓度为25g/l。
[0016]
本发明的一种实施方式中,所述载体蛋白在硼酸缓冲溶液中的浓度为3~5g/l;优选的,所述载体蛋白在硼酸缓冲溶液中的浓度为3.3g/l。
[0017]
本发明的一种实施方式中,所述三氯杀螨醇半抗原与所述载体蛋白的摩尔质量比为6000~8000:1;优选的,所述三氯杀螨醇半抗原与所述载体蛋白的摩尔质量比为6160:1。
[0018]
本发明的一种实施方式中,所述三氯杀螨醇半抗原的结构式如下:
[0019]
[0020]
本发明的第五个目的是提供一种三氯杀螨醇完全抗原的制备方法,所述完全抗原包括三氯杀螨醇包被原,所述方法包括步骤如下:2,2
‑
双对氯苯基乙酸用无水n,n
‑
二甲基甲酰胺溶解,加入1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺,室温持续搅拌反应,得三氯杀螨醇半抗原活化液;载体蛋白溶解于硼酸缓冲溶液中,称为b液;在室温条件下,将三氯杀螨醇半抗原活化液逐滴加入到b液中,室温搅拌反应过夜,透析,即得三氯杀螨醇包被原。
[0021]
本发明的一种实施方式中,所述载体蛋白包括鸡卵白蛋白ova、牛血清白蛋白bsa及其他适用于偶联的载体蛋白。
[0022]
本发明的一种实施方式中,所述2,2
‑
双对氯苯基乙酸、1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺的摩尔质量比为1:3~5:3~5,所述2,2
‑
双对氯苯基乙酸在n,n
‑
二甲基甲酰胺中的浓度为10~25g/l;优选的,所述2,2
‑
双对氯苯基乙酸、1
‑
乙基碳二亚胺盐酸盐、n
‑
羟基琥珀酰亚胺的摩尔质量比为1:3.5:3.0,所述2,2
‑
双对氯苯基乙酸在n,n
‑
二甲基甲酰胺中的浓度为20g/l。
[0023]
本发明的一种实施方式中,所述载体蛋白在硼酸缓冲溶液中的浓度为3~7g/l;优选的,所述载体蛋白在硼酸缓冲溶液中的浓度为5g/l。
[0024]
本发明的一种实施方式中,所述2,2
‑
双对氯苯基乙酸与所述载体蛋白的摩尔质量比为50~100:1;优选的,所述2,2
‑
双对氯苯基乙酸与所述载体蛋白的摩尔质量比为64:1。
[0025]
本发明的一种实施方式中,本发明提供的分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株jhj的制备基本步骤为:
[0026]
(1)半抗原的合成:
[0027][0028]
三氯杀螨醇半抗原的合成方案如上述反应式所示。称取4,4
′‑
二氯二苯甲酮(15mg)和羧甲基羟胺半盐酸盐(30mg)固体加入10ml螺口棕色玻璃瓶中,加入1.8ml甲醇、吡啶和纯水(v:v:v=4:1:1)的混合溶液,随后置于70℃水浴持续搅拌反应6h。反应完成后取出,室温静置过夜。溶液经氮气吹干后,加入2ml二氯甲烷复溶,并用纯水重复萃取3
‑
4次(1ml/次),弃水层,有机相经氮气吹干得到的粘稠状固体即为三氯杀螨醇半抗原。
[0029]
(2)免疫原和包被原的制备:
[0030]
免疫原的制备:称取5.0mg三氯杀螨醇半抗原,用200μl无水n,n
‑
二甲基甲酰胺溶解,然后加入12mg 1
‑
乙基碳二亚胺盐酸盐,6.0mg n
‑
羟基琥珀酰亚胺,混匀,室温持续搅拌反应6h(称为a液)。将钥孔血蓝蛋白10mg,用3.0ml硼酸缓冲溶液溶解(称为蛋白a液),在室温条件,将a液缓慢加入到蛋白a液中,室温搅拌反应过夜,透析,即得免疫原;
[0031]
包被原的制备:称取4.0mg 2,2
‑
双对氯苯基乙酸,用200μl无水n,n
‑
二甲基甲酰胺溶解,随后加入9.6mg 1
‑
乙基碳二亚胺盐酸盐,4.8mg n
‑
羟基琥珀酰亚胺,混匀,室温持续搅拌反应6h(称为b液)。称取10mg鸡卵白蛋白ova,溶解于2ml硼酸缓冲溶液中(称为b液),在室温条件下,将b液逐滴加入到b液中,室温搅拌反应过夜,透析,即得包被原。
[0032]
(3)小鼠的免疫:三氯杀螨醇完全抗原与等体积完全弗氏佐剂混合乳化后,通过颈
背部皮下注射balb/c小鼠。首次免疫用完全弗氏佐剂,加强免疫用不完全弗氏佐剂。每一次加强免疫之间均间隔3周。最后一次加强免疫采用完全抗原(不含佐剂)进行腹腔注射;通过间接竞争酶联免疫法(ic
‑
elisa)检测血清效价和抑制率。
[0033]
(4)细胞融合与细胞株建立:通过peg法将小鼠脾细胞和骨髓瘤细胞融合,通过hat培养基选择性培养,ic
‑
elisa检测细胞孔的阳性和抑制率,通过有限稀释法对阳性及抑制率较高的杂交瘤细胞进行亚克隆,最终筛选获得三氯杀螨醇单克隆抗体杂交瘤细胞株jhj。
[0034]
(5)杂交瘤细胞株性质的鉴定:通过ic
‑
elisa测定灵敏度。
[0035]
取高效价低ic
50
小鼠的脾细胞,通过peg方法与小鼠骨髓瘤细胞融合,经过间接竞争酶联免疫法筛选和亚克隆,得到一株杂交瘤细胞株jhj。
[0036]
本发明的第六个目的是提供一种三氯杀螨醇单克隆抗体的应用,用于食品安全检测中三氯杀螨醇残留的分析检测。
[0037]
本发明的一种实施方式中,所述三氯杀螨醇单克隆抗体用于制备食品安全检测中三氯杀螨醇残留量的分析检测用的检测主体。
[0038]
本发明的一种实施方式中,所述检测主体包括试剂、检测板、试剂盒。
[0039]
本发明的有益效果:首先,本发明提供的细胞株jhj分泌的单克隆抗体,对三氯杀螨醇具有较好的特异性和检测灵敏度(ic
50
值为2ng/ml),可实现对果蔬、谷物中三氯杀螨醇残留量的检测,为食品中三氯杀螨醇残留的免疫检测提供了原料,具有实际应用价值。其次,本发明提出了一种用于制备可分泌三氯杀螨醇单克隆抗体的杂交瘤细胞株的制备方法,尤其是提出了一种新的半抗原制备方法,采用4,4
′‑
二氯二苯甲酮和羧甲基羟胺半盐酸盐固体,加入由甲醇、吡啶和纯水组成的混合溶液中反应所得,原料简单易得,制备过程精简易操作。
[0040]
生物材料样品保藏:一株三氯杀螨醇单克隆抗体杂交瘤细胞株jhj,已保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,分类命名为单克隆细胞株jhj,保藏日期2021年05月13日,保藏编号cgmcc no.22329。
附图说明
[0041]
图1为本发明实施例jhj单克隆抗体的免疫球蛋白亚型鉴定结果示意图。
[0042]
图2为本发明实施例jhj单克隆抗体对三氯杀螨醇的抑制标准曲线。
具体实施方式
[0043]
下面结合附图和实施例对本发明作更进一步的说明。根据下述实施例,可以更好的理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制本发明的保护范围。
[0044]
本发明实施例中所用试剂:
[0045]
溶液的配置:碳酸盐缓冲液(cbs):称取na2co
3 1.59g,nahco
3 2.93g,分别溶于少量双蒸水后混合,加双蒸水至约800ml混匀,调ph值至9.6,加双蒸水定容至1000ml,4℃贮存备用;
[0046]
磷酸盐缓冲液(pbs):8.00g nacl,0.2g kcl,0.2g kh2po4,2.9g na2hpo4·
12h2o,
溶于800ml纯水中,用naoh或hcl调ph到7.2~7.4,定容至1000ml;
[0047]
pbst:含0.05%吐温20的pbs;
[0048]
tmb显色液:a液:na2hpo
4.
12h2o 18.43g,柠檬酸9.33g,纯水定容至1000ml;b液:60mg tmb溶于100ml乙二醇中。a、b液按体积比1:5混合即为tmb显色液,现用现混。
[0049]
本发明实施例通过将三氯杀螨醇完全抗原免疫小鼠,通过细胞融合,hat选择性培养基培养,通过ic
‑
elisa筛选细胞上清,最终得到了对三氯杀螨醇有较高灵敏度的单克隆抗体杂交瘤细胞株。
[0050]
实施例1杂交瘤细胞株jhj的制备
[0051]
(1)半抗原的合成:
[0052][0053]
三氯杀螨醇半抗原的合成方案如上反应式所示。称取4,4
′‑
二氯二苯甲酮(15mg,0.0597mmol)和羧甲基羟胺半盐酸盐(30mg,0.235mmol)固体加入10ml螺口棕色玻璃瓶中,加入1.8ml甲醇、吡啶和纯水(v:v:v=4:1:1)的混合溶液,随后置于70℃水浴持续搅拌反应6h。反应完成后取出,室温静置过夜。溶液经氮气吹干后,加入2ml二氯甲烷复溶,并用纯水重复萃取3
‑
4次(1ml/次),弃水层,有机相经氮气吹干得到的粘稠状固体即为三氯杀螨醇半抗原。
[0054]
(2)免疫原和包被原的制备:
[0055]
免疫原的制备:称取5.0mg(0.0154mmol)三氯杀螨醇半抗原,用200μl无水n,n
‑
二甲基甲酰胺溶解,然后加入12mg(0.0628mmol)1
‑
乙基碳二亚胺盐酸盐,6.0mg(0.0522mmol)n
‑
羟基琥珀酰亚胺,混匀,室温持续搅拌反应6h(称为a液)。将钥孔血蓝蛋白10mg(0.0000025mmol),用3.0ml硼酸缓冲溶液溶解(称为蛋白a液),在室温条件,将a液缓慢加入到蛋白a液中,室温搅拌反应过夜,透析,即得免疫原;
[0056]
包被原的制备:称取4.0mg(0.0142mmol)2,2
‑
双对氯苯基乙酸,用200μl无水n,n
‑
二甲基甲酰胺溶解,随后加入9.6mg(0.0503mmol)1
‑
乙基碳二亚胺盐酸盐,4.8mg(0.0417mmol)n
‑
羟基琥珀酰亚胺,混匀,室温持续搅拌反应6h(称为b液)。称取10mg(0.000222mmol)鸡卵白蛋白ova,溶解于2ml硼酸缓冲溶液中(称为b液),在室温条件下,将b液逐滴加入到b液中,室温搅拌反应过夜,透析,即得包被原。
[0057]
(3)小鼠的免疫:三氯杀螨醇完全抗原与等体积完全弗氏佐剂混合乳化后,通过颈背部皮下注射balb/c小鼠。首次免疫用完全弗氏佐剂,加强免疫用不完全弗氏佐剂。每一次加强免疫之间均间隔3周。最后一次加强免疫采用完全抗原(不含佐剂)进行腹腔注射;通过间接竞争酶联免疫法(ic
‑
elisa)检测血清效价和抑制率。
[0058]
(4)细胞融合:在最后一次加强免疫三天后,按照常规peg法进行细胞融合,具体步骤如下:
[0059]
a、摘眼球取血,颈椎脱臼法处死小鼠后,立即放入75%酒精中消毒,浸泡5min左右,无菌操作取出小鼠的脾脏,用注射器的胶头适度研磨并通过200目细胞筛网得到脾细胞
悬液,收集,离心(1200rpm,8min),用rpmi
‑
1640培养基洗涤脾细胞三次,最后一次离心后,将脾细胞稀释到一定体积,计数,备用;
[0060]
b、收集sp2/0细胞:融合前7
‑
10天,将sp2/0瘤细胞用含10%fbs(胎牛血清)rpmi
‑
1640培养基在5%co2培养箱中。融合前要求sp2/0瘤细胞数量达到(1~4)
×
107,保证融合前sp2/0瘤细胞处于对数生长期。融合时,收集瘤细胞,悬浮于rpmi
‑
1640基础培养液中,进行细胞计数;
[0061]
c、融合过程7min。第1min,将1ml的peg 1500由慢到快滴加到细胞中;第2min,静置。第3min和第4min,在1min内滴加1ml rpmi
‑
1640培养基;第5min和第6min,在1min内滴加2ml rpmi
‑
1640培养基;第7min,每10s滴加1ml的rpmi
‑
1640培养基。然后37℃温浴5min。离心(800rpm,8min),弃上清,重悬入含20%胎牛血清、2%的50
×
hat的rpmi
‑
1640筛选培养液中,按照200μl/孔加到96孔细胞板,置于37℃、5%co2培养箱中培养。
[0062]
(5)细胞筛选与细胞株建立:在细胞融合的第3天对融合细胞进行rpmi
‑
1640筛选培养液半换液,第5天进行用含20%胎牛血清,1%的100
×
ht的rpmi
‑
1640过渡培养液进行全换液,在第7天取细胞上清进行筛选。筛选分两步:第一步先用ic
‑
elisa筛选出阳性细胞孔,第二步选用三氯杀螨醇为标准品,用ic
‑
elisa对阳性细胞进行抑制效果测定。选择对三氯杀螨醇标准品均有较好抑制的细胞孔,采用有限稀释法进行亚克隆,用同样的方法进行检测。重复三次,获得细胞株jhj。
[0063]
(6)单克隆抗体的制备与鉴定:取8
‑
10周龄balb/c小鼠,每只小鼠腹腔注射无菌石蜡油1ml;7天后每只小鼠腹腔注射1
×
106杂交瘤细胞,从第七天开始收集腹水,将腹水通过辛酸
‑
硫酸铵法纯化。在偏酸条件下,正辛酸可以沉淀腹水中除igg免疫球蛋白外的其他杂蛋白,然后离心,弃沉淀;再用等量饱和度的硫酸铵溶液沉淀igg型的单克隆抗体,离心,弃上清,用0.01m pbs溶液(ph7.4)溶解后,透析脱盐,最终得到纯化后的单克隆抗体置于
‑
20℃保存;
[0064]
使用小鼠单抗亚型鉴定试剂盒对腹水纯化获得的三氯杀螨醇单克隆抗体进行免疫球蛋白亚型鉴定,其亚型为igg2b型,经小鼠单抗亚型鉴定试剂盒检测得轻链类型为kappa型,如图1所示。
[0065]
实施例2三氯杀螨醇单克隆抗体的ic
50
的测定
[0066]
1包被:将实施例1步骤(2)制备的包被原用0.05m ph9.6碳酸盐缓冲液从1μg/ml开始倍比稀释,100μl/孔,37℃反应2h;
[0067]
2洗涤:将板内溶液倾去,并用洗涤液洗涤3次,每次3min;
[0068]
3封闭:拍干后,加入200μl/孔封闭液,37℃反应2h。洗涤后烘干备用;
[0069]
4加样:将抗血清从1:1000开始倍比稀释,并加入到各稀释度的包被孔中,100μl/孔,37℃反应30min;充分洗涤后,加入1:3000稀释的hrp
‑
羊抗鼠igg,100μl/孔,37℃反应30min;
[0070]
5显色:将酶标板取出,充分洗涤后,每孔加入100μl的tmb显色液,37℃避光反应15min;
[0071]
6终止和测定:每孔加入50μl终止液以终止反应,然后用酶标仪测定各孔的od 450值。
[0072]
采用ic
‑
elisa检测对三氯杀螨醇的灵敏度,如图2所示,根据标准方程y=0.1159+
1.375/(1+(x/1.240)
0.784
),用ic
‑
elisa测定三氯杀螨醇单克隆抗体的ic
50
为2ng/ml,说明该抗体具有较高的灵敏度,可用于三氯杀螨醇免疫分析检测。
[0073]
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1