ATP7B基因敲除小鼠模型的构建方法与流程
atp7b基因敲除小鼠模型的构建方法
技术领域
1.本发明涉及病理学、遗传学和生物技术领域,具体地说,涉及一种atp7b基因敲除小鼠模型的构建方法。
背景技术:
2.肝豆状核变性(hepatolenticular degeneration,hld),又称威尔森病(wilson disease,wd),是一种常染色体隐性遗传的铜代谢障碍性疾病,人群患病率为3/100,000,亚洲人群的患病率高于欧美。主要致病机制为atp7b(atpase cu2+transporting beta polypeptide,铜离子转运atp酶β肽)基因突变导致atp酶功能的减弱或丧失,进而产生一系列铜代谢障碍。其发病隐匿,极易漏诊或误诊,而爆发性肝豆状核变性病情凶险,预后极差。该病是由位于13号染色体上的atp7b基因发生突变、插入或者缺失引起一类铜离子代谢障碍的疾病。atp7b蛋白位于反式高尔基体膜上,具有将铜离子运进反式高尔基体中使其与铜蓝蛋白相结合和将多余的铜离子运入胆汁排泄出肝细胞的双重功能。目前,针对肝豆状核变性的治疗手段主要有控制饮食减少铜离子的摄取,利用铜离子螯合剂将淤积的铜排出体外和肝移植三种方法。
3.atp7b基因定位于13q14.3,编码p型铜转运atp酶(p
‑
type atpase)。atp7b基因主要在肝脏中高表达,执行将铜离子从胞浆转运至高尔基体,并将过量的铜从肝脏通过胆汁排泄两项功能。生理状态时,atp7b蛋白主要定位于高尔基体反面网络(trans golgi network,tgn),将胞浆中由atox1蛋白携带的铜离子传递于此,用于血浆铜蓝蛋白(ceruloplasmin,cp)的生物合成;当铜离子浓度增加时,atp7b蛋白从tgn上解离,向肝细胞面的胆小管移动,通过胆汁将多余的铜排出体外。
4.atp7b复杂而精密的铜转运过程与其特殊的蛋白结构密切相关。人类atp7b蛋白为具有8次跨膜结构的膜蛋白,其核心结构包括:n端的铜离子结合域(共6个亚基,每个亚基上含有一个金属结合位点(metal
‑
binding site domain,mbd))、8次跨膜结构(transmembrane domain,tmd)、atp结合域(由核酸结合区域及磷酸化区域共同构成(nucleotide
‑
binding and phosphorylation domains,nbd,包括a、p、n
‑
domain)以及一个较长的c末端。
5.目前,对atp7b的分子功能研究多集中于6个mbds上。mbds1
‑
4被认为具有调控作用,敲除这些区域并不影响atp7b的酶活性及其与铜离子的亲和性,但可抑制自身的催化活性。atp7b蛋白的n端对维持其功能起着重要的作用,但铜离子亦可刺激atp7b的c端,使其转变为高磷酸化状态,从而促进其转运效率(braiterman lt,gupta a,chaerkady r,cole rn,hubbard al.communication between the n and c termini is required for copper
‑
stimulated ser/thr phosphorylation of cu(i)
‑
atpase(atp7b)[j].j biol chem.2015apr 3,290(14):8803
‑
19.doi:10.1074/jbc.m114.627414.)。
[0006]
atp7b基因突变可能阻碍atp7b催化循环的每一步,而最终对蛋白质功能的影响取决于受到影响的氨基酸残基。atp7b基因突变以错义突变为主,较为常见的包括p.r778l及
p.h1069q突变,前者位于靠近a
‑
domain的tmd4中,在亚洲人群中发生频率最高,后者位于n
‑
domain中,是欧洲及北美人群中最为常见的突变。迄今为止,atp7b基因上共有超过800个突变被报道(人类基因突变数据库,hgmd,www.hgmd.org)。研究认为不同突变可能对atp7b功能有着不同的影响:最为常见的作用机制是使错误折叠的atp7b蛋白滞留于内质网中,导致细胞铜转运功能障碍。引起肝豆状核变性的致病性突变在所有mbds中均有发现,但mbd5和mbd6包含其中大约三分之二的突变(arioz c,li y,wittung
‑
stafshede p.the six metal binding domains in human copper transporter,atp7b:molecular biophysics and disease
‑
causing mutations[j].biometals.2017dec,30(6):823
‑
840.doi:10.1007/s10534
‑
017
‑
0058
‑
2.)。研究显示,不同的atp7b基因突变可能对其生物学功能的影响存在差异,从而有可能导致表型的不一样,但其机制尚不清楚。因此,利用动物模型研究wd疾病可以为人类wd疾病的诊断、治疗提供理论基础。
[0007]
目前,atp7b基因敲除的动物模型主要有buiyakova等于1999年报道的通过基因敲除建立的小鼠模型(buiakova oi,xu j,lutsenko s,zeitlin s,das k,das s,ross bm,mekios c,scheinberg ih,gilliam tc..null mutation of the murine atp7b(wilson disease)gene results in intracellular copper accumulation and late
‑
onset hepatic nodular transformation.hum mol genet.1999sep;8(9):1665
‑
71.doi:10.1093/hmg/8.9.1665.)。近年来,crispr
‑
cas9系统广泛应用于基因敲除及疾病动物模型的构建和基因治疗等领域中。利用crispr
‑
cas9系统在基因组特定位点造成dna双链损伤断裂,再利用机体dna双链损伤修复途径实现基因敲除或者基因敲入。
技术实现要素:
[0008]
本发明的目的是提供一种atp7b基因敲除小鼠模型,特别是模拟人类wd疾病的小鼠模型的构建方法。
[0009]
为实现上述目的,本发明的技术方案如下:
[0010]
本发明提供一种atp7b基因敲除小鼠模型的构建方法,包括以下步骤:
[0011]
1)基于crispr
‑
cas9系统设计靶向小鼠atp7b基因的sgrna;
[0012]
2)sgrna与cas9核酸酶的mrna经体外转录后,一起注射到小鼠受精卵中,然后将受精卵移植到假孕母鼠体内,产出f0代,对f0代进行pcr鉴定,将阳性f0代与野生型小鼠交配获得f1代杂合子,f1代杂合子进行自交,筛选atp7b基因敲除的纯合子代,最终将纯合子作为atp7b基因敲除小鼠模型。
[0013]
其中,sgrna作用位点位于atp7b基因的2号外显子上,sgrna作用位点的dna序列为:5
’‑
caagatccggaaactgcaag
‑3’
和5
’‑
gcatgccgtctattcttagt
‑3’
。
[0014]
用于pcr鉴定的特异性引物为atp7b
‑
f:5
’‑
tgccgtctgtcatgaacctg
‑3’
,atp7b
‑
r:5
’‑
acactttaaagtgcccaggtgg
‑3’
,对应的扩增产物大小为野生型669bp,突变型390bp。
[0015]
本发明提供按照上述方法构建的atp7b基因敲除小鼠模型,模拟人类wd疾病。
[0016]
本发明提供上述小鼠模型在wd疾病研究及其药物开发中的应用。
[0017]
本发明的目的可以采用以下的技术措施来进一步实现。建立atp7b基因敲除小鼠模型;鉴定小鼠atp7b基因敲除效率;用elisa方法检测小鼠肝铜含量;通过组织学方法验证小鼠肝损伤程度;
[0018]
借由上述技术方案,本发明至少具有下列优点及有益效果:本发明提供了一种通过atp7b基因敲除小鼠动物模型模拟人wd疾病的方法。利用crispr
‑
cas9基因敲除技术,敲除atp7b基因第2外显子。atp7b基因敲除后的小鼠均表现明显的肝脏铜离子淤积等多种人wd患者临床表现。本发明构建的模拟人wd疾病的小鼠模型,该模型稳定性强稳定遗传,与人类wd疾病表现类似,可为进一步研究wd发病机制以及基因治疗提供经济、简单、可靠的动物模型。
附图说明
[0019]
下面结合附图对本发明的具体实施方式作进一步详细的说明。
[0020]
图1本发明实施例1中构建的atp7b基因敲除小鼠f0代(a)和f1代(b)基因检测鉴定电泳图,5#,12#,14#,16#为阳性杂合小鼠,作为首建鼠分别传代。后续研究显示f014#(del 277bp)(c)繁殖情况较其他品系好,得到纯合小鼠数量最多。
[0021]
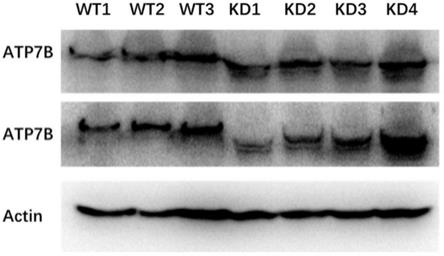
图2验证atp7b基因敲除效率的western
‑
blots图:取小鼠肝组织研磨提取总蛋白,将总蛋白上样进行sds
‑
page电泳,检测小鼠肝脏atp7b的表达情况,结果western
‑
blots图显示kd组小鼠atp7b蛋白分子量变小。
[0022]
图3验证atp7b基因敲除效率的肝铜含量测定结果:取小鼠肝组织加入磷酸盐缓冲液(pbs)中完全研磨,按照铜定量检测试剂盒(bioassay systems,美国)说明书测定肝研磨液中铜含量,根据359nm波长吸光度值和标准曲线计算铜浓度。结果显示atp7b基因缺陷(kd组)小鼠肝脏铜含量显著升高。
[0023]
图4atp7b基因敲除小鼠肝损伤检测结果:取各组小鼠肝组织于多聚甲醛中固定并石蜡包埋切片,将石蜡切片进行h&e染色,观察铜累积诱导的小鼠肝损伤。
具体实施方式
[0024]
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sam brook等分子克隆实验手册(sam brook j&r ussell dw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
[0025]
实施例1
[0026]
atp7b基因敲除小鼠模型的构建:根据小鼠atp7b基因(genbank:nc_000073.6)第2外显子序列,基于crispr
‑
cas9系统设计sgrna;所述atp7b的sgrna序列如下:第2外显子上的识别位点:5
’‑
caagatccggaaactgcaag
‑3’
和5
’‑
gcatgccgtctattcttagt
‑3’
。
[0027]
pmsg处理c57/bl6雌性小鼠(3周龄,平均体重15g),46小时后注射hcg,与雄性小鼠合笼交配,次日取受精卵进行显微注射,将步骤1的sgrna(100ng/ml)与cas9核酸酶(50ng/ml)的mrna经体外转录后,一起注射到受精卵中,取注射后存活的受精卵移植到假孕母鼠体内,产出小鼠,即f0代小鼠。
[0028]
提取f0代小鼠尾部dna,pcr扩增产物测序。
[0029]
待f0代雄性founder小鼠7周龄,雌性小鼠7周龄,分别与野生型异性小鼠交配获得杂合子小鼠f1代,小鼠出生后20天进行pcr鉴定,若有阳性小鼠出生,则表示生殖细胞中目的基因已经敲除
[0030]
将f1代杂合子小鼠自交获得f2代纯合子小鼠,即为atp7b
‑
/
‑
小鼠动物模型。本发
明选用f3代及后续代次遗传稳定的小鼠模型进行后续实验。
①
小鼠基因型鉴定pcr鉴定结果对应的扩增产物大小为野生型669bp,突变型390bp(图1),390bp为突变等位基因条带,669bp为野生型等位基因条带,两条条带同时出现表明小鼠同时携带野生型和突变型基因,即小鼠为杂合子atp7b+/
‑
小鼠。用于pcr鉴定的特异性引物为atp7b
‑
f:5
’‑
tgccgtctgtcatgaacctg
‑3’
,atp7b
‑
r:5
’‑
acactttaaagtgcccaggtgg
‑3’
。
[0031]
验证atp7b基因敲除效率的western
‑
blots检测:取wt和kd组小鼠肝组织研磨提取总蛋白,检测小鼠肝脏atp7b的表达情况,结果如图2显示,kd组小鼠肝组织内atp7b蛋白分子量显著变小,可能atp7b一段序列被敲除掉。
[0032]
验证atp7b基因敲除效率的肝铜含量测定结果:将atp7b基因敲除(kd)小鼠和野生型(wt)小鼠分别于4周龄和12周龄时处死,使用铜定量检测试剂盒检测肝铜含量,结果如图3所示,第4周时kd组小鼠肝铜含量约为wt组小鼠的4.2倍,第12周时kd组小鼠肝铜含量约为wt组小鼠的5.2倍,atp7b基因敲除小鼠肝铜含量均显著提高,并且12周龄的kd小鼠肝铜含量比4周龄kd小鼠的略微升高。
[0033]
atp7b基因敲除小鼠肝损伤检测结果:取各组小鼠肝组织做石蜡切片进行h&e染色,观察铜累积诱导的小鼠肝损伤,结果如图4所示,与wt组小鼠相比,kd组尤其是12周龄组小鼠肝脏产生明显的灶状坏死、脂肪变性,并且染色质疏松、核仁边缘化,说明kd组小鼠铜累积造成了显著的肝损伤。
[0034]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1