一种基于q-PCR法检测复制型逆转录病毒的引物、试剂盒及检测方法与流程
一种基于q
‑
pcr法检测复制型逆转录病毒的引物、试剂盒及检测方法
技术领域
1.本发明涉及病毒检测技术领域,尤其涉及一种基于q
‑
pcr法检测复制型逆转录病毒的引物、试剂盒及检测方法。
背景技术:
2.现有用于治疗癌症的细胞注射液是采用pg13细胞包装逆转录病毒,生产逆转录病毒载体,再侵染患者t淋巴细胞,制成细胞制剂。其中逆转录病毒载体为长臂猿白细胞病毒(gibbon ape leukemia virus,galv)的复制缺陷型病毒载体,该缺陷型病毒载体的基因组rna缺少逆转录病毒复制所需的gag、pol和env序列,理论上大大降低了产生复制型病毒的风险。但是,病毒包装细胞pg13的基因组中人为整合了小鼠白血病病毒(moloney murine leukemia virus,momlv)的gag、pol表达序列以及galv的env序列,这些逆转录病毒的包装元件对于逆转录病毒载体的生产是必要的,但它们可能和pg13基因组、细胞制备时的人源基因组发生重组可能产生可复制性逆转录病毒。这种病毒将自身基因序列整合进宿主基因组(即患者待回输的t细胞)后将持续不断地复制,存在极大的安全隐患。同时,国家出台了指导文件,提出细胞治疗产品需要进行病毒载体和细胞终产品的复制型逆转录病毒(rcr)的检测,因此,需要建立检测方法来检测细胞产品的复制型逆转录病毒,以降低在生产阶段产生rcr污染的风险。
3.目前,复制型逆转录病毒(rcr)的检测方法包括针对特定基因(如vsvg基因)的pcr法或qpcr法和敏感细胞感染试验法,根据国家食品药品监督管理要求,rcr检测推荐采用基于敏感细胞的扩增培养法,但该方法耗时长(4
‑
6个月),不适用于需要新鲜输注的细胞终产品放行。实时荧光定量聚合酶链式反应法(qpcr法)是一种灵敏度高、特异性强且可通过实时监控进行定量的核酸检测技术,qpcr法最常用的有两种技术,一种是荧光染料法,但其与dna亲和力强,通常对pcr反应有抑制作用;另一种是荧光探针法,为序列特异性的taqman探针,灵敏度高,特异性强,已经被应用于生物制药的一些领域,国外已有相关文献研究利用探针qpcr法建立可复制型慢病毒的快速检测方法;然而,不同病毒的具有特异性,如何利用探针qpcr法建立针对逆转录病毒载体为galv的可复制型逆转录病毒的快速检测方法,以提高对细胞产品的快速检测和品质控制的快速放行。
技术实现要素:
4.本发明所要解决的技术问题现有检测复制型逆转录病毒的方法耗时长,效率低。
5.为了解决上述问题,本发明提出以下技术方案:
6.第一方面,本发明提供一种基于q
‑
pcr法检测复制型逆转录病毒的引物,包括引物galv
‑
f、引物galv
‑
r及探针galv
‑
probe;
7.所述引物galv
‑
f、引物galv
‑
r及探针galv
‑
probe的核苷酸序列seq id no如下所示,或与这些序列具有至少95%同一性的同功能序列;
8.galv
‑
f(seq id no 1):ggcacctttcctatgcacaaccc;
9.galv
‑
r(seq id no 2):ggtcgcctactccaccgacct;
10.galv
‑
probe(seq id no 3):ccttgggtcccccagcggcaccggtc。
11.进一步地技术方案为,所述探针galv
‑
probe的荧光报告基团为fam,淬灭基团为nfq
‑
mgb。
12.第二方面,本发明提供一种包括所述引物的复制型逆转录病毒检测试剂盒,所述引物galv
‑
f、引物galv
‑
r、以及探针galv
‑
probe的浓度为10μm。
13.进一步地,所述试剂盒还包括如下成分:pcr反应体系缓冲液、荧光染料、galv标准品。
14.进一步地,所述试剂盒进行荧光定量pcr的反应体系为:
[0015]2×
probe qpcr premix ex taq 10μl,引物galv
‑
f、引物galv
‑
r各0.4μl,探针galv
‑
probe 0.8μl,rox reference dye ii 0.2μl,待检样品dna或标准品dna或质控点标准品5
‑
7μl,补充ultrapure water至20μl。
[0016]
第二方面,本发明提供一种基于q
‑
pcr法的复制型逆转录病毒检测方法,包括步骤:
[0017]
s1、提取待检样品基因组dna,测定样品dna浓度;
[0018]
s2、制备qpcr反应体系,包括引物galv
‑
f、引物galv
‑
r、以及探针galv
‑
probe,其核苷酸序列如下:
[0019]
引物galv
‑
f:ggcacctttcctatgcacaaccc;
[0020]
引物galv
‑
r:ggtcgcctactccaccgacct;
[0021]
探针galv
‑
probe:ccttgggtcccccagcggcaccggtc;
[0022]
s3、配制标准曲线用标准品溶液和质控点用标准品溶液;
[0023]
s4、无模板阴性对照、待检样品的阴性对照以及加入了标准品的待检样品上样检测;
[0024]
s5、结果判定。
[0025]
进一步地,s5中,检测结果同时满足以下条件,判定检测结果有效:
[0026]
(1)标准曲线斜率的相关系数r2≥0.99,扩增效率介于90%~110%之间;
[0027]
(2)无模板阴性对照组(ntc)的ct值应为undetermined;
[0028]
(3)阴性对照组(ncs)的ct值应为undetermined。
[0029]
进一步地,s5中,若待检样品的ct值为undetermined,则判定该批次样品未检出复制型逆转录病毒;若待检样品有ct值,则判定该批次样品中检出复制型逆转录病毒。
[0030]
进一步地,s4中,设定qpcr反应条件为:95℃预变性60s;然后95℃5s,62℃34s,反应40个循环。
[0031]
进一步地,s3中,标准品的标准曲线中各个稀释样品的浓度为:1.4
×
105copies/μl,1.4
×
104copies/μl,1.4
×
103copies/μl,1.4
×
102copies/μl,1.4
×
101copies/μl,1.4copies/μl。
[0032]
与现有技术相比,本发明所能达到的技术效果包括:
[0033]
本发明提供了基于q
‑
pcr法检测复制型逆转录病毒的引物,所述引物包括引物galv
‑
f以及引物galv
‑
r,核苷酸序列seq id no如下所示:galv
‑
f:
ggcacctttcctatgcacaaccc;galv
‑
r:ggtcgcctactccaccgacct。
[0034]
本发明提供的试剂盒可以快速检测细胞产品是否存在针对逆转录病毒载体为galv的复制型逆转录病毒(rcr),以降低在生产阶段产生rcr污染的风险,具有灵敏度高、特异性好的优点,定量限可以达到7拷贝/反应,可用于逆转录病毒载体的细胞产品的快速放行质控。
[0035]
本发明提供的检测方法特异性好、重复性佳、灵敏度高,且可以利用已建立的标准曲线对样本进行定量分析。
附图说明
[0036]
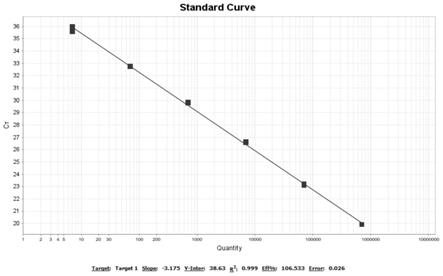
图1为标准品的荧光定量pcr标准曲线图;
[0037]
图2为标准品的荧光扩增图。
具体实施方式
[0038]
下面将对实施例中的技术方案进行清楚、完整地描述。显然,以下将描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0039]
实施例1
[0040]
复制型逆转录病毒检测试剂盒及使用该试剂盒进行复制型逆转录病毒的检测方法
[0041]
本实施例提供的复制型逆转录病毒检测试剂盒,包括引物galv
‑
f、引物galv
‑
r、以及探针galv
‑
probe。
[0042]
具体介绍如下:
[0043]
引物及探针
[0044]
本发明引物设计靶点选择理由:基于qpcr法的rcr检测可针对复制型逆转录病毒所必需的dna元件,如gag、pol、env(编码vsv
‑
g,galv等)。已有的研究显示相较于gag、pol基因,env基因变异较小。因此,我们选取galv的env即galvgp3蛋白的dna序列片段作为检测靶点(以下简称为fgalv)。我们首先使用ncbi的blastn程序,确定fgalv序列在人基因组中无相似序列,该序列已插入到pcr2.1载体中。
[0045]
引物及探针的核苷酸序列见表1。
[0046]
表1引物及探针的核苷酸序列
[0047][0048]
需要说明的是,本发明实施例所用标准品为galv标准品,具体为pcr2.1
‑
fgalv质粒(全长4430bp)的线性化产物;制备过程包括以下步骤:
[0049]
(1)酶切,反应条件为37℃孵育60分钟;
[0050]
酶切的反应体系见下表2:
[0051]
表2 pcr2.1
‑
fgalv质粒单酶切反应体系
[0052][0053]
(2)使用重组虾碱性磷酸酶(rsap)对pcr2.1
‑
fgalv质粒的线性化产物进行去磷酸化,降低产物自连:往(1)反应完毕的酶切体系内直接加入1.5μl rsap,混匀。反应条件为37℃孵育60分钟,然后升温至65℃,终止5分钟。
[0054]
(3)对(2)得到产物进行琼脂糖凝胶电泳、胶回收。
[0055]
(4)picogreen法精确测定胶回收产物的浓度(标准品的浓度)。
[0056]
(5)按标准品拷贝数浓度的计算公式计算galv标准品拷贝数浓度:
[0057][0058]
其中:
[0059]
·
c为galv标准品通过picogreen精确定量的pcr2.1
‑
fgalv胶回收产物的浓度;
[0060]
·
6.02
×
10
23
为阿伏伽德罗常数;
[0061]
·
660g/(mol
·
bp)为双链dna每碱基对的平均分子质量;
[0062]
(6)标准品的储存:将galv标准品的拷贝数浓度稀释为7
×
107copies/μl,命名为galv标准品母液(stock)
‑
80℃冰箱保存。
[0063]
本发明实施例所用健康人基因组dna制备过程同检测样品基因组dna的制备过程,浓度为100ng/μl,
‑
80℃冰箱保存。
[0064]
1材料
[0065]
1.1样品
[0066]
待检样品:tcr
‑
t细胞注射液(tcr
‑
t细胞);阴性对照:患者t细胞基因组(nc
‑
t细胞);标准品:galv标准品母液(stock)(7
×
107copies/μl);健康人基因组dna(100ng/μl)
[0067]
1.2试剂
[0068]
(1)血液/组织/细胞基因组提取试剂盒,天根生物;
[0069]
(2)rnasea,天根生物;
[0070]
(3)quant
‑
it
tm picogreen
tm dsdna assay kit,invitrogen;
[0071]
(4)premix ex taq(probe qpcr),takara;
[0072]
(5)ultrapure dnase/rnase
‑
free distilled water(以下简称ultrapure water),invitrogen;
[0073]
(6)rcr
‑
taqman
‑
f、rcr
‑
taqman
‑
r、rcr
‑
taqman
‑
probe,生工生物。
[0074]
2检测过程
[0075]
2.1细胞样品处理
[0076]
将细胞轻轻吹打混匀后,用血球计数板在显微镜下计数或细胞计数仪计数,测定
细胞密度,取出所需要的细胞(≤5
×
106/管),1500rpm离心3min,去上清,加入1ml 1
×
pbs溶液,重悬细胞。
[0077]
2.2细胞基因组dna(gdna)的提取
[0078]
按照天根生物的《血液/组织/细胞基因组提取试剂盒》操作说明书提取tcr
‑
t细胞和nc
‑
t细胞基因组dna。
[0079]
2.3 picogreen精确测定待检样品基因组dna的浓度。
[0080]
采用《quant
‑
it
tm picogreen
tm dsdna assay kit》试剂盒操作说明书精确测定样品基因组dna的浓度。
[0081]
2.4 qpcr检测
[0082]
2.4.1 qpcr反应体系的配制
[0083]
(1)标准品的反应体系配制见表3:
[0084]
表3标准品的qpcr反应体系
[0085][0086]
(2)待检样品的反应体系配制见表4:
[0087]
表4待检样品的qpcr反应体系
[0088][0089]
(3)质控点的反应体系配制见表5:
[0090]
表5质控点的qpcr反应体系
[0091][0092][0093]
2.4.2样品的稀释
[0094]
使用ultrapure water将细胞基因组dna稀释为20ng/μl,稀释液体积不少于20μl。放至微型离心机离心10秒,放常温待用。
[0095]
2.4.3标准曲线用标准品的配制见表6。
[0096]
表6不同浓度的标准品溶液
[0097][0098]
2.4.4质控点用标准品溶液的配制
[0099]
质控点:在反应孔中加入100ng的nc
‑
t细胞基因组和200拷贝的标准品。
[0100]
2.4.5上机检测
[0101]
(1)设置靶点:靶点名称为“galv”,报告荧光基团为“fam”,猝灭荧光基团为“nfq
‑
mgb”,检测参比荧光为“rox”。
[0102]
(2)设置反应程序,如下表7所示:
[0103]
表7 qpcr反应程序
[0104][0105]
本实施例得到的标准品的标准曲线及扩增结果见图1及图2、样品检测结果见表8。
[0106]
表8检测结果
[0107][0108]
2.5结果判定
[0109]
2.5.1该实验结果同时满足以下条件,实验结果方有效(如图1、图2和表8):
[0110]
(1)标准曲线相关系数r2应≥0.99,扩增效率应介于90%~110%之间;
[0111]
(2)无模板阴性对照组(ntc)的ct值应为undetermined;
[0112]
(3)阴性对照组(ncs)的ct值应为undetermined;
[0113]
(4)质控点的回收率应介于80%~120%之间。
[0114]
2.5.2如果待检样品的ct值为undetermined,则判定该批次样品未检出复制型逆转录病毒(rcr);如果待检样品有ct值,则判定该批次样品检出复制型逆转录病毒(rcr)。
[0115]
实际生产中,如待检样品的ct值为undetermined,说明该批次样品未检出针对逆转录病毒载体为galv的复制型逆转录病毒,质检合格,可对该批次样品的细胞产品进行快速放行。
[0116]
专属性(引物特异性)验证试验
[0117]
tcr
‑
t细胞注射液中可能有的干扰成分为:病人或健康人的t细胞基因组dna、msgv病毒载体和目的基因tcr可能与引物同源,因此设置检测样本为:患者t细胞基因组(即nc
‑
t细胞基因组dna)、pmsgv
‑
eso质粒、健康人pbmc基因组dna。同时设置阳性对照样本:pg13细胞基因组dna。
[0118]
将上述样本按实施例1所示方法进行荧光定量pcr检测。结果如表9所示。
[0119]
表9专属性验证试验检测结果
[0120][0121]
根据表9可知,除了阳性对照样本,其余样本均未检出,说明本发明提供的引物和探针不会在这些样本中发生非特异性反应。因此,本发明提供的复制型逆转录病毒检测试剂盒中的引物对复制型逆转录病毒具有良好的特异性。
[0122]
灵敏度试验:
[0123]
将galv标准品用ultrapure water稀释成一系列浓度梯度样品:700000拷贝/反应、70000拷贝/反应、7000拷贝/反应、700拷贝/反应、70拷贝/反应,7拷贝/反应,分别标记为:st1、st2、st3、st4、st5、st6,得到的标准曲线及扩增结果见图1及图2。
[0124]
如图2的扩增曲线显示:各浓度的扩增曲线均有明显的指数增长期。如图1的标准曲线:线性方程y=
‑
3.175lgx+38.63,r2=0.999,表明加入galv标准品的每个反应孔中,在7拷贝至700000拷贝之间呈良好的线性关系,即ct值与dna模板量的lg值呈良好的线性关系,扩增效率为106.53%,介于90%~110%之间,检测灵敏度可达7拷贝/反应。
[0125]
从表10的重复实验结果中可看出,额外三次实验结果的标准曲线,在dna模板量7拷贝/反应至700000拷贝/反应之间的线性很好,r2均在0.99以上,扩增效率介于90%~110%之间,所以本方法对tcr
‑
t细胞dna的定量限loq可达7拷贝/反应。
[0126]
表10灵敏度试验标准曲线重复实验结果
[0127]
实验线性方程线性判定系数r2扩增效率%重复1y=
‑
3.387lgx+39.1410.99997.338重复2y=
‑
3.315lgx+38.9840.999100.273
重复3y=
‑
3.452lgx+39.3980.99994.837
[0128]
准确度及精密度验证试验
[0129]
在实施例1的基础上,准确度和精密度分析采用tcr
‑
t细胞注射液样品加标(高、中、低浓度)的方式,三名不同实验人员进行相同检验操作,准确度(回收率)结果见表11。精密度结果见表12
‑
13。
[0130]
表11准确度试验回收率计算结果
[0131][0132][0133]
表12批内精密度计算结果
[0134][0135]
表13批间精密度计算结果
[0136]
[0137]
根据表11结果可知,在三次实验中,三批次样品的高中低浓度加标回收率均介于70%~130%之间,本发明的试剂盒及检测方法的准确度验证符合标准要求。
[0138]
根据表12
‑
13结果可知,在三次实验中,三批次样品的高中低加标含量测定值的批内变异系数不超过10%、批间变异系数不超过20%。因此,本发明提供的试剂盒和检测方法的精密度验证符合标准要求。
[0139]
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详细描述的部分,可以参见其他实施例的相关描述。
[0140]
以上所述,为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1