小RNA及其在糖尿病治疗中的用途
小rna及其在糖尿病治疗中的用途
技术领域
1.本发明一般地涉及核酸治疗领域。更具体地,本发明涉及新的小rna及其在治疗糖尿病中的用途。
背景技术:
2.糖尿病是一种多病因引发的代谢性疾病,其特点是慢性高血糖,伴随因胰岛素分泌和/或作用缺陷引起的糖、脂肪和蛋白质代谢紊乱。其中2型糖尿病约占95%。其主要特点是葡萄糖排出机能不良、肝细胞合成的甘油三酯增多、胰岛素利用障碍导致油脂分泌过量,进而引发严重的心脏疾病。环境因素和遗传因素都影响糖尿病的发生和发展,其发病机制迄今仍不清楚。肝糖输出异常增加是造成糖尿病高血糖的一个主要因素。
3.当前糖尿病的治疗药物主要以西药为主,中药较少,据相关调查显示中药的市场份额仅0.64%。常见的中药有消渴丸和金茂降糖胶囊,几乎占据全部的中药。西药治疗二型糖尿病,具有显著的疗效,但西药的不良反应较多如低血糖、乳酸性酸中毒等,且不能很好控制并发症。随着中医药研究的不断深入,其在糖尿病治疗上取得不错的疗效,较西药在改善胰岛素抵抗方面有一定的优势。我国有不少降血糖中药的研究,如黄酮类、生物碱、不饱和脂肪酸、多糖类等化学成分,均有较佳的降糖作用。
4.本发明人的研究小组在之前的研究中发现了从药用植物中提取多种能够促进核酸递送的化合物或合成的化合物,并利用所提取的化合物或多种组合促进核酸如srna吸收和进入靶细胞中,并能促进核酸进入有此需要的对象体内的靶部位(参见wo2019184991a1,cn111918672a,其内容通过引用并入本文)。
技术实现要素:
5.本技术部分基于发明人对一系列药用植物小rna的发现:本发明人从药用植物中分离出的小rna可以在ii型糖尿病小鼠模型上起到降低血糖的作用。
6.本发明人利用ii型糖尿病小鼠模型,即db/db小鼠模型,筛选了从中药绞股蓝中分离的具有降糖功能的小rna。
7.基于以上发现,在第一方面,本发明提供了一种分离的核酸分子,其包含以下序列或由以下序列组成:
8.a)seq id no:1(ggcccggguucgauucccggu)所示的核苷酸序列;
9.b)与seq id no:1(ggcccggguucgauucccggu)所示的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、96%、97%、98%、99%序列同一性的序列;
10.c)与seq id no:1(ggcccggguucgauucccggu)所示的核苷酸序列相比具有至少10个、优选地至少9个、至少8个、至少7个、至少6个、至少5个、至少4个、至少3个、至少2个、至少1个核苷酸取代、缺失或添加的序列;
11.d)在严格条件下能够与seq id no:1(ggcccggguucgauucccggu)所示的核苷酸序
列杂交的序列;或
12.e)能够与seq id no:2所示的核苷酸序列互补结合的核苷酸序列。
13.在一个优选的实施方案中,根据本发明所述的分离的核酸分子能够通过靶向g6pase抑制糖异生从而发挥降糖功效;优选地,根据本发明所述的分离的核酸分子能够通过与g6pase的3’utr区的序列gauuggagggucgccuggcuu(seq id no:2)互补结合而发挥降糖功效。
14.在优选的实施方案中,根据本发明所述的分离的核酸分子是rna分子或dna分子,优选地,其是小rna分子;优选地,其是长度为18
‑
24核苷酸的小rna分子,优选地,其是长度为19、20、21、22、23、或24个核苷酸的小rna分子。
15.另一方面,本发明提供了一种载体,其包含本发明所述的核酸分子。
16.另一方面,本发明提供了一种宿主细胞,其转染有本发明所述的载体。
17.另一方面,本发明提供了一种药物组合物,其包含本发明所述的核酸分子和脂质;优选地,所述脂质为16:0lyso pa;优选地,所述核酸分子的含量为0.1
‑
1000μm、优选为3.0μm
‑
300μm;优选为0.3μm、0.6μm、0.9μm、1.0μm、3.0μm、6.0μm、9.0μm、10.0μm、13.0μm、16.0μm、19.0μm、20.0μm、23.0μm、26.0μm、29.0μm、30.0μm、33.0μm、36.0μm、39.0μm、40.0μm、43.0μm、46.0μm、49.0μm、50.0μm、53.0μm、56.0μm、59.0μm、60.0μm、63.0μm、66.0μm、69.0μm、70.0μm、73.0μm、76.0μm、79.0μm、80.0μm、83.0μm、86.0μm、89.0μm、90.0μm、100μm、130μm、160μm、190μm、200μm、250μm、300μm、350μm、400μm、450μm、500μm、550μm、600μm、650μm、700μm、750μm、800μm、850μm、900μm、950μm、1000μm、或这些点值之间的任意范围;所述16:0lyso pa的含量为0.01
‑
100mg/ml,优选为0.03mg/ml、0.06mg/ml、0.09mg/ml、0.1mg/ml、0.13mg/ml、0.16mg/ml、0.19mg/ml、0.2mg/ml、0.23mg/ml、0.26mg/ml、0.29mg/ml、0.3mg/ml、0.33mg/ml、0.36mg/ml、0.39mg/ml、0.4mg/ml、0.43mg/ml、0.46mg/ml、0.49mg/ml、0.5mg/ml、0.53mg/ml、0.56mg/ml、0.59mg/ml、0.6mg/ml、0.63mg/ml、0.66mg/ml、0.69mg/ml、0.7mg/ml、0.73mg/ml、0.76mg/ml、0.79mg/ml、0.8mg/ml、0.83mg/ml、0.86mg/ml、0.89mg/ml、0.9mg/ml、0.93mg/ml、0.96mg/ml、0.99mg/ml、1.0mg/ml、3.0mg/ml、6.0mg/ml、9.0mg/ml、10.0mg/ml、13.0mg/ml、16.0mg/ml、19.0mg/ml、20.0mg/ml、23.0mg/ml、26.0mg/ml、29.0mg/ml、30.0mg/ml、33.0mg/ml、36.0mg/ml、39.0mg/ml、40.0mg/ml、43.0mg/ml、46.0mg/ml、49.0mg/ml、50.0mg/ml、53.0mg/ml、56.0mg/ml、59.0mg/ml、60.0mg/ml、63.0mg/ml、66.0mg/ml、69.0mg/ml、70.0mg/ml、73.0mg/ml、76.0mg/ml、79.0mg/ml、80.0mg/ml、83.0mg/ml、86.0mg/ml、89.0mg/ml、90.0mg/ml、100mg/ml或这些点值之间的任意范围。
18.优选地,根据本发明的药物组合物可用于口服、肌肉内、静脉内、皮下、经皮、动脉内、腹膜内、肺内、脑脊髓内、关节内、滑膜内、鞘内、心室内、和/或吸入途径施用,优选地,根据本发明的组合物通过口服施用。
19.另一方面,本发明提供了根据本发明所述的分离的核酸分子、载体、细胞或药物组合物在制备用于治疗受试者中糖尿病的药物中的用途;优选地,所述根据本发明所述的分离的核酸分子、载体、细胞或药物组合物可用于改善糖耐量、抑制体内糖异生水平、增加胰岛素的敏感性、和/或保护糖尿病引起的肝脏损伤。进一步优选地,所述糖尿病为i型糖尿病或ii型糖尿病。
20.优选地,根据本发明的分离的核酸分子、载体、细胞或药物组合物可以与一种或多
种,优选一种至三种其他药物组合用于治疗糖尿病,所述其他药物选自胰岛素及其类似物、磺酰脲类促泌剂、二甲双胍类、α
‑
葡萄糖苷酶抑制剂、噻唑烷二酮类衍生物促敏剂、苯茴酸类衍生物促泌剂、glp
‑
1受体激动剂和dpp
‑
4酶抑制剂。
21.另一方面,本发明提供了用于治疗有需要的受试者中糖尿病的方法,所述方法包括向所述受试者施用治疗有效量的根据本发明所述的分离的核酸分子、载体、细胞或药物组合物;优选地,如本文所用的“受试者”是脊椎动物,更优选地是哺乳动物,甚至更优选地是家畜或伴侣动物,例如鸡、鹅、鸭、山羊、绵羊、牛、猪、马、狗、猫、仓鼠、大鼠、小鼠、仓鼠或豚鼠。最优选地,受试者是人。
22.除非有相反的说明,否则本文使用的术语具有本领域技术人员通常理解的含义。
23.术语
24.通常,人们一般把sirna,mirna及其它非编码小rna不加区分地称之为小核酸或小rna(srna)。如本文使用的“小rna”是一大类小的非编码rna,其由动、植物基因组内所编码,长度大约为18
‑
24个核苷酸。研究表明,小rna参与各种各样的调节途径,包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等。
25.如本文所用的术语“核酸”包括“多核苷酸”、“寡核苷酸”和“核酸分子”,并且通常意指dna或rna聚合物,其可以是单链的或双链的、合成的或从天然来源获得的(例如分离的和/或纯化的);其可以包含天然的、非天然的或被改变的核苷酸。在一些实施方案中,核酸不包含任何插入、缺失、倒位和/或替换。然而,如本文所讨论的,在一些情况下对核酸而言,包含一个或更多个插入、缺失、倒位和/或替换可以是合适的。
26.如本文所用的术语在“严格条件下杂交”意指核苷酸序列以可检测地强于非特异性杂交的量与靶序列(例如,seq id no:1所示的序列)特异性杂交。严格性条件可以包括例如低盐和/或高温条件,例如由在约50℃至70℃的温度下约0.02m至0.1m nacl或等同物提供的。
27.如本文所用,“序列同一性”是指两个多核苷酸序列之间的序列相似性。当两个比较序列中的位置均被相同碱基占据时,例如如果两个dna分子的每一个位置都被腺嘌呤占据时,那么所述分子在该位置是同一的。两个序列之间的同一性百分率是两个序列共有的匹配或同源位置数除以比较的位置数
×
100的函数。
28.如本文所用的术语“载体”,是指并入本文所述的核酸的重组表达载体。所述重组表达载体可以是任何合适的重组表达载体,并且可以用于转化或转染任何合适的宿主细胞,包括但不限于植物表达载体、动物表达载体、病毒载体,例如逆转录病毒载体或慢病毒载体。这些载体是本领域技术人员熟知的,并且可以商购获得。
29.本文所用的术语“宿主细胞”是指可以转染有本发明的重组表达载体的任何类型的细胞。宿主细胞可以是真核细胞,例如植物、动物、真菌或藻类,或者可以是原核细胞,例如细菌或原生动物。
30.多种转染技术是本领域公知的,包括但不限于磷酸钙共沉淀、直接微注射到培养的细胞内、电穿孔、脂质体介导的基因转移、脂质介导的转导和使用高速微型射弹的核酸递送。
31.如本文所用,“治疗”包括治疗在哺乳动物中(特别是在人类中)的疾病状态,并且包括:(a)抑制疾病状态,即阻止其发展;和/或(b)缓解疾病状态,即引起疾病状态消退。
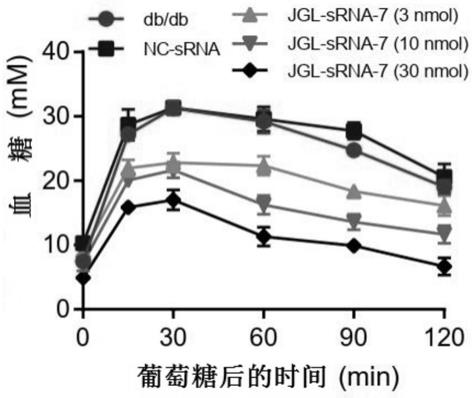
32.如本文所用,术语“受试者”是指可能潜在地从用本发明的核酸分子、包含其的载体、细胞或组合物的治疗中受益的任何人类或非人类生物体。示例性受试者包括患有糖尿病的受试者。优选地,如本文所用的“受试者”是脊椎动物,更优选地是哺乳动物,甚至更优选地是家畜或伴侣动物,例如鸡、鹅、鸭、山羊、绵羊、牛、猪、马、狗、猫、仓鼠、大鼠、小鼠、仓鼠或豚鼠。最优选地,受试者是人。
33.如本文所用,术语“治疗有效量”旨在包括当单独或组合施用本发明的核酸分子、包含其的载体、细胞或组合物时,使受试者获益的所述核酸分子、包含其的载体、细胞或组合物的量。
34.如本文所用,术语“互补结合”或“互补地结合”是指两条单链彼此碱基配对以形成可检测的双链。但是,只要可以形成稳定的双链,就允许两条单链之间存在一定百分比的不匹配。例如,在一些实施方案中,双链具有约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,或约50%的不匹配。
35.为了更详细的说明本发明,本说明书提供了下列具体实施方案,并结合附图说明这些具体实施方案,但本公开的方案并非仅限于此。本领域技术人员可以结合本领域的公知常识,对本发明的方法、用途和小rna进行适当的改变,只要其能够实现本发明所述的功能,即应落入本发明的范围内。
附图说明
36.图1a和图1b显示本发明的小rna jgl
‑
srna
‑
7(其序列如seq id no:1所示)对糖尿病模型db/db小鼠口服葡萄糖耐量(ogtt)剂量依赖性的影响;
37.图2a和图2b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍对比在糖尿病模型db/db小鼠口服葡萄糖耐量(ogtt)的影响;
38.图3a和图3b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍比较对糖尿病模型db/db小鼠丙酮酸耐量(ptt)的影响;
39.图4a和图4b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍比较对糖尿病模型db/db小鼠胰岛素耐量(itt)的影响;
40.图5显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍比较对糖尿病模型db/db小鼠血清甘油三酯(tg)的影响;
41.图6a和图6b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍比较对糖尿病模型db/db小鼠肝脏h&e染色的影响;
42.图7a和图7b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍比较对糖尿病模型db/db小鼠肝脏油红o染色的影响;
43.图8a和图8b显示本发明的小rna jgl
‑
srna
‑
7与二甲双胍相比可以更好的保护肾功能;
44.图9a和图9b显示本发明的小rna jgl
‑
srna
‑
7通过靶向葡萄糖6
‑
磷酸酶(g6pase)发挥降糖功效。
具体实施方式
45.实施例1.本草体16:0lyso pa
‑
jgl
‑
srna
‑
7的制备
46.向30nmol小rna jgl
‑
srna
‑
7干粉中加入300μl无核酸酶水溶解后,加入10μl 10mg/ml 16:0lyso pa(1
‑
十六烷酰基
‑
sn
‑
甘油
‑3‑
磷酸酯(钠盐),购买自sigma,货号857123p)的脂质溶液,充分震荡混匀之后,90℃水浴15min,冷却至室温,制备出包含小rna jgl
‑
srna
‑
7和16:0lyso pa的混合液。
47.以类似的方式制备阴性对照混合液,其中将小rna jgl
‑
srna
‑
7替换成小rna的无义对照序列(nc),其余步骤同上。
48.实施例2.本草体16:0lyso pa
‑
jgl
‑
srna
‑
7改善葡萄糖耐量(gtt)的剂量梯度实验
49.取40只6周龄的雄性db/db小鼠(由北京维通利华生物公司提供),随机分为以下4组:
50.db/db模型组:不做任何处理;
51.db/db+nc组:以10nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
nc
‑
srna,连续给药14天;
52.db/db+jgl
‑
srna
‑
7(3nmol)组:以3nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
jgl
‑
srna
‑
7,连续给药14天;
53.db/db+jgl
‑
srna
‑
7(10nmol)组:以10nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
jgl
‑
srna
‑
7,连续给药14天;
54.db/db+jgl
‑
srna
‑
7(30nmol)组:以30nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
jgl
‑
srna
‑
7,连续给药14天;
55.口服葡萄糖耐量试验(ogtt)
56.小鼠空腹16小时,16小时后对每只鼠进行体重称量,按照体重计算口服葡萄糖的量(注射量标准:2mg/kg,葡萄糖溶液的浓度:10mg/ml),首先测定此时的空腹血糖,以0分钟血糖作为标记。固定小鼠,针头与腹部45
°
角度刺入腹腔,缓慢注射葡萄糖溶液,而后开始计时,分别在第15分组、30分钟、60分钟、90分钟、120分钟时检测血糖量(取鼠尾部血进行检测),绘制折线图(参见图1a和1b)。
57.在ii型糖尿病模型db/db小鼠的ogtt试验中,与模型组相比,jgl
‑
srna
‑
7能呈现剂量依赖性抑制血糖的上升并保持血糖处于较低的平稳状态,明显增强对糖的代谢能力,综上所述,本发明的小rna jgl
‑
srna
‑
7具有能呈现剂量依赖性地改善小鼠葡萄糖耐量的作用。
58.实施例3.本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7与二甲双胍比较改善葡萄糖耐量(gtt)的实验
59.取40只6周龄的雄性db/db小鼠(由北京维通利华生物公司提供),随机分为以下4组:
60.db/db模型组:不做任何处理;
61.db/db+nc组:以30nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
nc
‑
srna,连续给药14天;
62.db/db+二甲双胍(30nmol)组:以与jgl
‑
srna
‑
7等剂量30nmol/只的剂量给小鼠灌胃二甲双胍,连续给药14天;
63.db/db+二甲双胍(3*104nmol)组:以临床有效剂量3*104nmol/只的剂量给小鼠灌胃二甲双胍,连续给药14天;
64.db/db+jgl
‑
srna
‑
7(30nmol)组:以30nmol/只的剂量给小鼠灌胃本草体16:0lyso pa
‑
jgl
‑
srna
‑
7,连续给药14天。
65.口服葡萄糖耐量试验(ogtt)
66.小鼠空腹16小时,16小时后对每只鼠进行体重称量,按照体重计算口服葡萄糖的量(注射量标准:2mg/kg,葡萄糖溶液的浓度:10mg/ml),首先测定此时的空腹血糖,以0分钟血糖作为标记。固定小鼠,针头与腹部45
°
角度刺入腹腔,缓慢注射葡萄糖溶液,而后开始计时,分别在第15分组、30分钟、60分钟、90分钟、120分钟时检测血糖量(取鼠尾部血进行检测),绘制折线图(参见图2a和2b)。
67.在ii型糖尿病模型db/db小鼠的ogtt试验中,与模型组相比,30nmol二甲双胍处理的小鼠葡萄糖耐受能力没有变化,而30nmol小rna jgl
‑
srna
‑
7和3*104nmol二甲双胍的治疗能显著地抑制血糖的上升并保持血糖处于较低的平稳状态,明显增强对糖的代谢能力,并且小rna组效果更好,综上所述,本发明的小rna jgl
‑
srna
‑
7与二甲双胍相比,能更好地改善小鼠葡萄糖耐量。
68.实施例4.本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7与二甲双胍比较改善丙酮酸耐量(ptt)的实验
69.小鼠空腹16小时,之后对每只鼠进行体重称量,按照体重计算丙酮酸钠的腹腔注射量(注射量标准:1.5mg/kg,丙酮酸钠溶液的浓度:10mg/ml),首先测定此时的空腹血糖,以0分钟血糖作为标记。固定小鼠,针头与腹部45
°
角度刺入腹腔,缓慢注射丙酮酸钠溶液,而后开始计时,分别在第15分钟、30分钟、60分钟、90分钟、120分钟时检测血糖量(取鼠尾部血进行检测),绘制折线图(图3a和图3b)。
70.在ii型糖尿病模型db/db小鼠的ogtt试验中,与模型组相比,30nmol二甲双胍处理的小鼠丙酮酸耐量没有明显变化,而30nmol小rna jgl
‑
srna
‑
7和3*104nmol二甲双胍的治疗能显著地抑制血糖的上升并保持血糖处于较低的平稳状态,抑制糖异生,并且小rna效果更好,综上所述,本发明的小rna jgl
‑
srna
‑
7与二甲双胍相比,能更好地通过抑制体内糖异生而发挥降血糖的功效。
71.实施例5.本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7与二甲双胍比较改善胰岛素耐量(itt)的实验
72.小鼠空腹4小时,4小时后对每只鼠进行体重称量,按照体重计算需腹腔注射的胰岛素的量(注射量标准:0.75u/kg,胰岛素的浓度:0.0375u/10μl),首先测定此时的空腹血糖,以0分钟血糖作为标记。固定小鼠,针头与腹部45
°
角度刺入腹腔,缓慢注射胰岛素,而后开始计时,分别在第15分钟、30分钟、60分钟、90分钟、120分钟时检测血糖量(取鼠尾部血进行检测),绘制折线图(参见图4a和图4b)。
73.在ii型糖尿病模型db/db小鼠的itt试验中,与模型组相比,30nmol二甲双胍处理的小鼠葡萄糖水平没有变化,而30nmol jgl
‑
srna
‑
7和3*104nmol二甲双胍显著增强了胰岛素敏感性,且效果相似。综上所述,本发明的小rna jgl
‑
srna
‑
7在机体对胰岛素的敏感性方面有着明显的增强作用,且效果与二甲双胍类似。
74.实施例6:本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7与二甲双胍比较改善血清甘
油三酯的实验
75.小鼠给药14天后,眼球取血,分离血清,通过试剂盒检测血清中甘油三酯含量进行不同给药组甘油三酯含量比较,绘制点图(参见图5)。
76.在ii型糖尿病模型db/db小鼠的血清甘油三酯含量检测中,与模型组相比,30nmol二甲双胍处理的小鼠甘油三酯水平没有变化,而30nmol jgl
‑
srna
‑
7和3*104nmol二甲双胍显著降低了血清甘油三酯水平,且小rna效果更好。综上所述,本发明的小rna jgl
‑
srna
‑
7可以显著降低db/db小鼠的血清甘油三酯水平,且效果比二甲双胍更好。
77.实施例7:本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7对ii型糖尿病模型db/db小鼠肝脏的保护作用
78.小鼠给药14天后,取肝脏进行4%多聚甲醛溶液中固定,然后进行h&e染色和油红o染色。
79.肝脏h&e染色的结果表明(参见图6a和6b),在ii型糖尿病模型组db/db小鼠肝脏的切片有明显的脂肪粒增大现象发生,细胞核形状异常,30nmol二甲双胍处理的脂肪变性现象没有得到改善,而30nmol小rna jgl
‑
srna
‑
7和3*104nmol二甲双胍均能显著改善这种肝脏异常,且小rna效果更好。
80.肝脏油红o染色的结果表明(参见图7a和7b),在ii型糖尿病模型组db/db小鼠肝脏的切片有明显的脂质堆积现象,30nmol二甲双胍处理的脂肪变性现象没有得到改善,而30nmol小rna jgl
‑
srna
‑
7和3*104nmol二甲双胍均能显著改善这种肝脏脂质堆积现象,且小rna效果更好。
81.实施例8:本发明的本草体16:0lyso pa
‑
jgl
‑
srna
‑
7与二甲双胍对肾功能的影响
82.小鼠给药14天后,眼球取血,分离血清,通过试剂盒检测血清中肌酐和尿素氮含量进行不同给药组甘油三酯含量比较,绘制点图(参见图8a和8b)。
83.在ii型糖尿病模型db/db小鼠的血清肌酐和尿素氮含量检测中,与模型组相比,3*104nmol二甲双胍处理的小鼠肌酐和尿素氮水平没有变化,而30nmol jgl
‑
srna
‑
7显著降低了血清肌酐和尿素氮水平。综上所述,本发明的小rna jgl
‑
srna
‑
7可以显著降低db/db小鼠的血清肌酐和尿素氮水平,改善肾功能。
84.实施例9:小rna jgl
‑
srna
‑
7通过靶向g6pase发挥降糖功效
85.培养293t细胞,分别转染小rna jgl
‑
srna
‑
7和nc
‑
srna,之后转染g6pase的双荧光素酶报告基因质粒,48h后检测双荧光素酶活性(参见图9a和9b)。
86.与nc
‑
srna相比,jgl
‑
srna
‑
7通过与g6pase(所述g6pase的ncbi编号为nm_000151.4)的3’utr区的序列gauuggagggucgccuggcuu(seq id no:2)互补结合,可以显著降低双荧光素酶的活性,而将jgl
‑
srna
‑
7与g6pase结合区碱基突变之后,结合能力消失,证明小rna jgl
‑
srna
‑
7通过靶向g6pase抑制糖异生从而发挥降糖功效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1