一种竹子根内生菌的分离鉴定方法
1.本发明属于微生物学技术领域,具体而言,涉及一种竹子根内生菌的分离鉴定方法。
背景技术:
2.植物内生菌是一个庞大的微生物类群,指那些在其生活史的某一阶段生活在健康植物的各种组织内,是植物微生态系统的重要组成部分。植物内生菌的种类繁多,主要包括内生细菌、内生真菌和内生放线菌三大类,其中放线菌的数量和种类一般较少。现已分离到的植物内生细菌有革兰氏阳性菌和革兰氏阴性菌,超过129种,分属于54个属。主要为伯克氏菌属、假单胞菌属、肠杆菌属、芽孢杆菌属等。植物内生真菌都属于子囊菌类,主要包括核菌纲、盘菌纲和腔菌纲等。是一类与宿主植物建立了和谐的关系并且使宿主植物不表现感染症状的微生物。
3.内生菌既可以通过产生对植物生长有促进作用的植物激素、蛋白酶等物质直接影响竹子的生理代谢,还可以通过生物固氮、溶磷等方式增强宿主植物吸收营养物质的能力间接促进植物生长。
4.现有技术中也有公开关于植物内生菌的分离方法。例如,申请号为:cn200810107514.1的中国发明专利公开了一种分离获得植物内生菌的方法,是经过植物预处理、表面消毒、内生菌的浸出、内生菌的分离纯化等步骤,利用机械研磨和剪切力使植物内生菌浸出,同时加入表面活性剂和纤维素酶分解植物纤维及植物细胞壁,使植物组织中的内生菌分离出来。又如,申请号为cn201510410155.7的中国发明专利公开了一种牡丹营养器官内生细菌的分离纯化方法、培养基及其制备方法,本发明的关键在于分离纯化培养基的配制。
5.有研究表明竹子中有对自身有促生长等作用的内生菌,但目前尚未公开有对竹子根内生菌的分离鉴定方法。
技术实现要素:
6.针对上述问题,本发明提供了一种竹子根内生菌的分离鉴定方法。本发明的分离鉴定方法效果明显,能够有效分离出对植物有促生长作用的内生菌菌株。
7.本发明的目的及解决其技术问题是采用以下技术方案来实现的。
8.本发明提供了一种竹子根内生菌的分离鉴定方法,其特征在于,该方法包括以下步骤:
9.采集无病虫害的健康且生长良好的毛竹根部作为样品,剪取新鲜健康竹根若干,剪取后立即将所得竹根置于密封袋中保存;
10.将上述剪取的竹根进行消毒,然后转移到无菌研钵中充分研钵,然后取上清液稀释,将稀释后的上清液200μl分别倒入lb和pda培养基中培养,将lb培养基至于37℃恒温培养,pda培养基至于28℃恒温培养;
11.挑取长势较好菌落用接种灭菌环进行划线培养,从形态特征明显的,典型的单菌落中挑取少量菌体至lb和pda培养基中,经培养后即为初步分离的毛竹内生菌纯种;
12.对分离得到的毛竹内生菌进行鉴定。
13.优选地,所述消毒过程为:用自来水对植株表面洗涤4-5次,用经过消毒的纸巾充分吸干水分,首先使用75%乙醇溶液漂洗1min,后用无菌水反复冲洗,再用经过消毒的纸巾充分吸干水分,使用1%次氯酸钠溶液漂洗4min,再次用无菌水冲洗掉次氯酸钠溶液后置于转移至75%乙醇溶液中浸泡30s,最后用无菌水将乙醇溶液冲洗干净,并用无菌试纸将竹根的水分吸干。
14.优选地,取最后1次冲洗的无菌水200μl在lb和pda培养基上涂布,pda在28℃、lb在37℃恒温培养,检验消毒灭菌效果。
15.优选地,所述lb培养基成分及含量为:0.5~3%大豆蛋白胨、0.2~0.7%酵母粉、0.5~1.2%氯化钠。
16.优选地,所述pda培养基成分及含量为:10%马铃薯、0.05~0.2%酵母粉或膏,0.050~0.2%蛋白豚,0.05~0.2磷酸氢二钾,0.05~0.2%硫酸镁,2%葡萄糖或蔗糖。
17.优选地,所述pda培养基中还含有抗生素,所述抗生素为硫酸链霉素,浓度为0.1%。
18.优选地,所述上清液按照10-1
、10-2
、10-3
、10-4
、10-5
进行稀释。
19.优选地,所述毛竹内生菌鉴定方法包括:革兰氏染色以及pcr分子鉴定。
20.借由上述技术方案,本发明至少具有下列优点:本发明以生长速度快的毛竹根为原材料,通过选择性培养基进行划线筛选和分离根内生菌株,采用形态学观察和革兰氏染色进行鉴定,能够有效筛选分离出毛竹内生菌。本发明的分离鉴定方法简单,易操作。
21.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例及附图详细说明如后。
附图说明
22.参照附图,本本发明的公开内容将变得更易理解。本领域技术人员容易理解的是:这些附图仅仅用于举例说明本发明的技术方案,而并非意在对本发明的保护范围构成限制。图中:
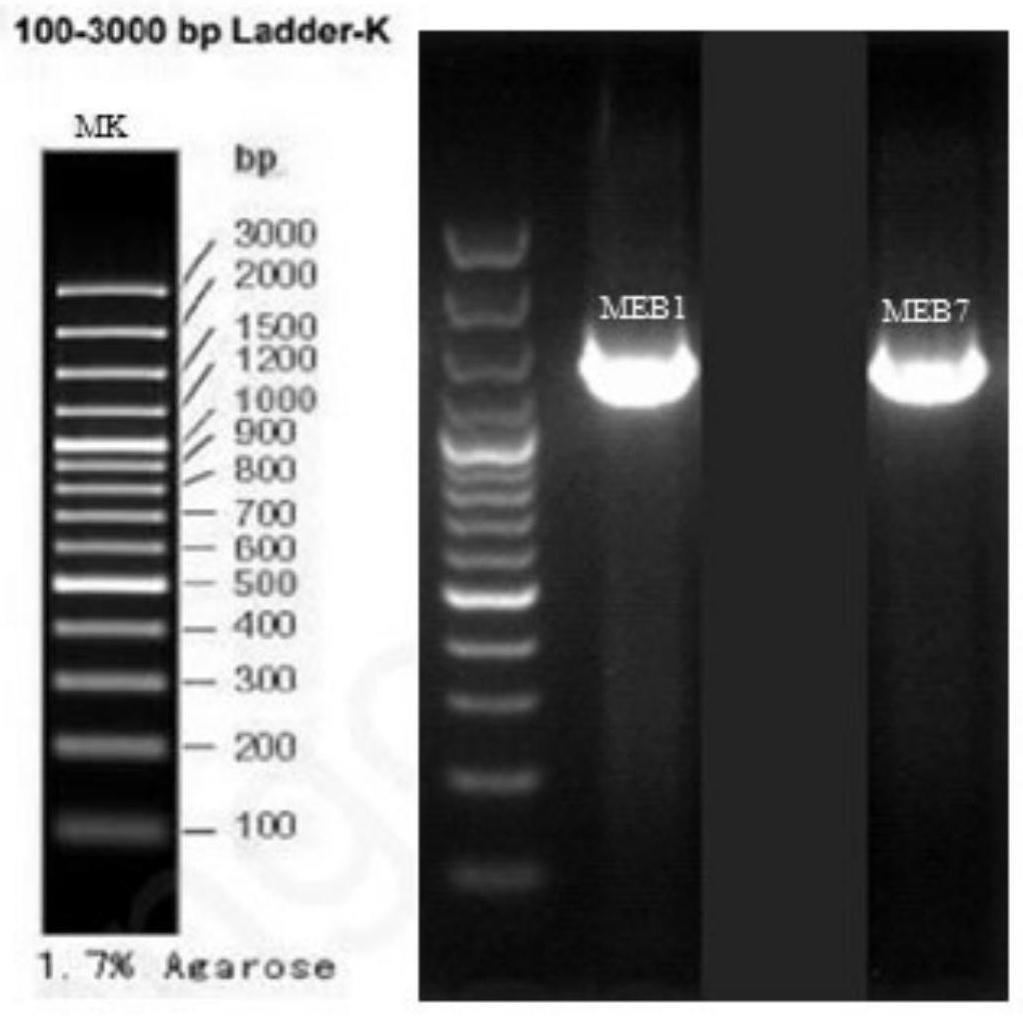
23.图1是16srdna序列的pcr产物电泳图;
24.图2是根据16srdna序列建立的meb1系统进化树;
25.图3是根据16srdna序列建立的meb7系统进化树。
具体实施方式
26.为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面将结合本发明实施例及附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
27.实施例1内生菌的分离和纯化
28.(1)制作做培养基:将事先准备好的灭菌的固体lb和pda培养基进行加热融化,制作培养基。lb培养基成分及含量为:0.5~3%大豆蛋白胨、0.2~0.7%酵母粉、0.5~1.2%氯化钠。pda培养基成分及含量为:10%马铃薯、0.05~0.2%酵母粉或膏,0.050~0.2%蛋白豚,0.05~0.2磷酸氢二钾,0.05~0.2%硫酸镁,2%葡萄糖或蔗糖。
29.(2)采样:采集嘉兴学院围墙边小道旁无病虫害的健康且生长良好的毛竹根部作为样品,剪取新鲜健康竹根若干,剪取后立即将所得竹根置于密封袋以避免与空气接触产生杂菌影响竹根菌种的提取。
30.(3)样品消毒:取新鲜竹子部根,将竹根放置在自来水下将植株反复冲洗其表面污垢,后用无菌水反复冲洗几次,再用无菌试纸将样品擦干后使用经典表面消毒法对所用样品植株的根进行消毒。
31.消毒步骤:用自来水对植株表面进行充分清洗干净(大概4-5次),用经过消毒的纸巾充分吸干水分,首先使用75%乙醇溶液漂洗1min,后用无菌水反复冲洗几次(将乙醇溶液冲洗干净),再用经过消毒的纸巾充分吸干水分,使用1%次氯酸钠溶液漂洗4min,再次用无菌水冲洗掉次氯酸钠溶液后置于转移至75%乙醇溶液中浸泡30s,最后用无菌水将乙醇溶液冲洗干净,并用无菌试纸将竹根的水分吸干。取最后1次冲洗的无菌水200μl在lb和pda培养基上涂布,pda在28℃、lb在37℃恒温培养,检验消毒灭菌效果。
32.(4)内生细菌及真菌分离纯化:
33.a将上述已经进行消毒灭菌的毛竹根部转移到无菌研钵中,在超净台中用经过灭菌的剪刀剪碎,在钵体中加入少量石英砂和少量无菌水充分研磨。
34.b取少量上清进行“10-1”、“10-2”、“10-3”、“10-4”、“10-5”梯度稀释,分别取200μl菌悬液倒入已凝固的lb和pda培养基中,用三角涂布棒涂均匀,做好标记。每个稀释度设置三个平行组。
35.c将lb培养基至于37℃恒温培养,pda培养基至于28℃恒温培养。每天观察平板上菌落生长状况。
36.d选取合适稀释度(每个培养皿30-300个菌落)平板进行菌落计数,计算不同培养基平板上的菌落形成单位(cfu/gfw),并记录不同培养基平板中菌落形态。
37.e同时,对“无菌水洗涤板”进行观察,若没有长出菌落,则证明表面消毒已经彻底,所得菌株即为内生菌。根据不同培养基平板中菌落形态,从合适稀释度的培养基中挑取长势较好菌落用接种灭菌环进行划线培养。
38.f挑取单菌落:从形态特征明显的,典型的单菌落中挑取少量菌体至lb和pda培养基中,经培养后即为初步分离的毛竹内生菌纯种。由于细菌比真菌的生长速度快得多,所以可以选择在pda培养基中加入抗生素来抑制细菌的生长,本实验使用的抗生素为硫酸链霉素,培养基中抗生素浓度在0.1%左右。
39.本实施例使用了1.34g竹子根进行研磨,将竹子匀浆液梯度稀释涂布在培养基上,菌落生长情况如表1和表2所示。
40.表1 lb板涂布菌落计数
[0041][0042]
注:
“‑‑”
表示菌落数过多,难以计数。
[0043]
表2 pda板菌落计数
[0044][0045][0046]
原始菌液浓度=某稀释度各平板菌落数总和
÷
此稀释度平行板数
×5÷
稀释倍率通过公式计算得出竹根匀浆液中细菌浓度约为7.13
×
105cfu/ml,真菌浓度约为1.33
×
102cfu/ml,本实施例分离出11种细菌,2种真菌。
[0047]
实施例2内生菌的鉴定
[0048]
(1)将分离纯化得到的菌株进行编号,将这些菌株再次在培养基上培养,将上述筛选的不同单一菌株进行肉眼和400倍显微观察,同时,针对细菌菌株进行革兰氏染色,初步辨别所属属种类型。结果列于表3,对细菌的革兰氏染色见表4。
[0049]
表3细菌编号对应类型和菌落形态描述
[0050][0051][0052]
注:m-mosobamboo,毛竹;e-endophyte,内生菌;b-bacteria,细菌
[0053]
(2)对分离纯化得到的真菌进行编号,记录平板上菌落和摇瓶里菌株的生长情况:
[0054]
表4真菌编号对应平板和摇瓶生长情况的描述
[0055][0056]
注:m-mosobamboo,毛竹;e-endophyte,内生菌;f-fungus,真菌
[0057]
实施例3内生菌的分子鉴定
[0058]
(1)pcr凝胶电泳成像
[0059]
如图1所示,从左至右分别为marker条带长度标注、meb1菌和meb7菌的16srdna序列pcr产物电泳图,由图1可以看出meb1和meb7的16srdna序列长度大约在1500bp左右。
[0060]
(2)dna测序
[0061]
见表5。
[0062]
表5内生细菌dna测序结果
[0063]
[0064]
[0065][0066]
(3)两种菌的进化树:
[0067]
将ncbi的比对结果下载导入mega7进行分析。使用邻位相邻法,构建系统发育进化树(如图2和图3所示)。在ncbi中比对后发现,meb1可能为葡萄球菌,meb7可能为微杆菌蛋白
溶菌属。
[0068]
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的方法及技术内容作出些许的更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1