一种从人诱导多能干细胞分化为外周神经元的方法与流程
1.本发明涉及神经科学干细胞领域,具体而言,涉及一种从人诱导多能干细胞分化为外周神经元的方法。
背景技术:
2.诱导外周神经是指脑和脊髓以外的所有神经,包括神经节、神经干、神经丛及神经终末装置;外周神经系统药物包括胆碱类药物、肾上腺素受体激动剂、组胺受体拮抗剂、局部麻醉药等,此类药物的药效和毒性可通过外周神经元的体外细胞模型进行研究。此外,许多药物会引起外周神经系统功能病变,亟需合适的体外细胞毒性模型进行研究测试。目前药物诱导的神经毒性主要是用啮齿类动物体外模型进行研究,然而这种模型具有一定的局限性,啮齿类动物试验结果外推至人的可靠性有限,因此充足的人源性外周神经元模型对于评价药物外周神经毒性具有十分重要的意义。
3.人诱导多能干细胞(human induced pluripotent stem cell,hipsc)技术是近些年的研究热点。hipsc规避了使用人胚胎干细胞(human embryonic stem cell,hesc)所带来的伦理道德问题,可在体外大规模产生多种人源性的细胞类型。在神经科学领域,目前的研究表明hipsc可成功分化获得多巴胺神经元、运动神经元和胶质细胞等,并有望作为补充和替代缺损的神经元,通过临床移植进一步用于帕金森病、脊髓损伤和胶质细胞相关疾病等的治疗,为患者带来新的希望。
4.虽然目前已可通过多种方法将hipsc成功分化为外周神经元,但早期主要采用基质细胞共培养法进行,基质细胞大多选择pa6细胞等,由于基质细胞的存在使得培养条件不清楚,诱导时间较长且分化效率低。此外,研究人员一直致力于优化小分子抑制剂的组合,以期得到诱导时间短且分化效率高的外周神经元,但采用这些方法分化得到的外周神经元的纯度仍需进一步提高,并且对起始ipsc状态要求高,依赖于饲养层共培养细胞,存在不确定性培养因子(如血清、条件培养基等。
5.因此,一种能够高效分化ipsc的方法是本领域的研发方向。
技术实现要素:
6.本发明目的在于提供将人诱导性多能干细胞高效分化为外周神经元细胞,本方案通过采用一种从人诱导多能干细胞分化为外周神经元的方法,包括如下步骤:
7.步骤一、诱导准备阶段:将ipsc消化为单细胞悬液,并加入外周神经元分化培养基p终止消化,将重铺诱导当天记为d0’,随后d2’天开始每天完全更换新鲜的外周神经元分化培养基p,并观察hipsc的形态,培养6
‑
8天。
8.步骤二、诱导成熟阶段:重铺成熟当天记为d0,更换步骤一培养瓶中的外周神经元分化培养基p为外周神经元成熟培养基n1或外周神经成熟培养基n2,培养至d10。
9.其中诱导成熟阶段中重铺成熟当天记的d0,是在诱导准备阶段的d8’或d10’后的重新计时。
10.诱导分化的步骤包括:
11.一:将聚合度70
‑
90%的干细胞消化为单细胞悬液,加入等体积的外周神经元分化培养基p终止消化;
12.二:将细胞以每1cm2含0.1
‑5×
104个细胞的密度接种于预先用matrigel胶包被过的培养瓶中,摇晃使细胞均匀分布后放入培养箱中,将重铺诱导当天记为d0’;
13.三:d2’天完全更换新鲜的外周神经元分化培养基p,并观察hipsc的形态,每天更换外周神经元分化培养基p至d8’或d10’。
14.步骤二中所述更换培养基的步骤包括,
15.一:外周神经元进入成熟阶段,将细胞消化后以每1cm2含(0.5~5)
×
104个细胞的密度接种于预先用matrigel胶包被过的板中,更换培养瓶中外周神经元分化培养基p为外周神经元成熟培养基n1,重铺成熟当天为d0;
16.二:d2与d3更换50%的外周神经元成熟培养基n1;
17.三:d4开始更换75%的外周神经成熟培养基n2,d5开始每隔两天更换2/3的外周神经成熟培养基n2,培养至d10,即可得到分化的外周神经元细胞;
18.进一步改进在于,所述外周神经元分化培养基p是在基础培养中添加0.01
‑
25um的bmp信号抑制剂、0.5
‑
50um的alk5抑制剂、0.02
‑
50um的gsk
‑
3α/β抑制剂、0.01
‑
50um的γsecretase抑制剂和0
‑
80um的vegf、fgf、pdgf抑制剂。
19.进一步改进在于,所述bmp信号抑制剂是ldn212854、ldn193189中一种或者两种的组合。
20.进一步改进在于,alk5抑制剂是sb431542、sb505124d中一种或者两种的组合。
21.进一步改进在于,gsk
‑
3α/β抑制剂是chir
‑
98014、sb415286、ly2090314或chir99021中一种或者两种以上的组合。
22.进一步改进在于,γsecretase抑制剂是ro4929097、napt或ly411575中一种或两种以上的组合。
23.进一步改进在于,vegf,fgf,pdgf抑制剂是su5402、e3810中一种或者两种以上的组合。
24.进一步改进在于,所述基础培养为在dmem/f
‑
12培养基、neurobasal培养基中的一种或两种组合物中添加neaa、b27、丙酮酸钠、cdlc、glutamax和视黄酸。
25.进一步改进在于,所述外周神经元成熟培养基n1是在外周神经元分化培养基p中加入5
‑
fu,以及神经因子ngf、bdnf与nt
‑
3中的一种或两种以上组合,其中5
‑
fu的浓度为0.1
‑
60ug/ml,神经因子的浓度为5
‑
150ng/ml。
26.进一步改进在于,所述外周神经成熟培养基n2是在外周神经元分化培养基p中加入神经因子ngf、bdnf和nt
‑
3中的一种或两种以上组合,其中神经因子的浓度为5
‑
150ng/ml。
27.由以上技术方案可知,本发明的技术方案提供了如下有益效果:
28.1、本发明具有操作便捷、分化纯度高、可重复性强等优点。整个环节无血清避免病源感染风险,提高了ipsc来源神经干细胞的安全性。
29.2、本发明提供了一种快速高效的诱导多能干细胞分化为外周神经元的方法,重新优化组合了培养基中的小分子抑制剂及神经营养因子,提高了hipsc向外周神经元的分化
效率;由该方法获得的外周神经元,总需时间为半个月左右,不仅缩短诱导神经干细胞所需的时间,且神经元细胞的纯度可达90%以上。
30.3、本发明提供的将人诱导性多能干细胞高效分化为神经元的方法为神经元损伤缺失后的补充来源提供了保障,也为用干细胞移植替代临床治疗神经退行性疾病,如用于帕金森病、脊髓损伤和胶质细胞相关疾病等的治疗,应用前景广阔。
附图说明
31.附图不意在按比例绘制。在附图中,在各个图中示出的每个相同或近似相同的组成部分可以用相同的标号表示。为了清晰起见,在每个图中,并非每个组成部分均被标记。现在,将通过例子并参考附图来描述本发明的各个方面的实施例,其中:
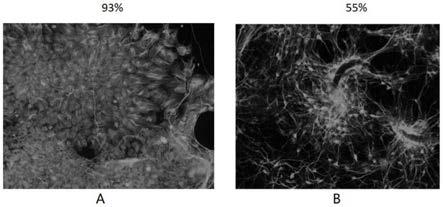
32.附图1为两种不同条件下,神经元标志物tuj1的染色图;
33.附图2为四种不同浓度条件下,外周神经元标志物brn3a的染色图。
具体实施方式
34.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另作定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
35.本发明专利申请说明书以及权利要求书中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的组成部分。同样,除非上下文清楚地指明其它情况,否则单数形式的“一个”“一”或者“该”等类似词语也不表示数量限制,而是表示存在至少一个。“包括”或者“包含”等类似的词语意指出现在“包括”或者“包含”前面的元件或者物件涵盖出现在“包括”或者“包含”后面列举的特征、整体、步骤、操作、元素和/或组件,并不排除一个或多个其它特征、整体、步骤、操作、元素、组件和/或其集合的存在或添加。“上”“下”“左”“右”等仅用于表示相对位置关系,当被描述对象的绝对位置改变后,则该相对位置关系也可能相应地改变。
36.除非另外指明,否则实践本发明将采用细胞生物学的常规技术,所述常规技术在本领域技术人员的能力范围内。除非另外定义,本文所用的全部技术和科学术语都具有本发明相关领域的普通技术人员通常理解的相同含义。
37.neaa为非必需氨基酸;b27为无血清细胞培养添加剂;cdlc为浓缩脂质乳液;glutamax添加剂是l
‑
谷氨酰胺的替代品,具有更好的稳定性,可改善细胞健康;5
‑
fluorouracil(5
‑
fu)是一种尿嘧啶的类似物,是一种胸苷酸合成酶一直剂。
38.实施例中描述到的各种生物材料的取得途径仅是提供一种实验或实施获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
39.实施例1、诱导分化期
40.将ipsc消化为单细胞悬液,并加入外周神经元分化培养基p终止消化,将重铺诱导当天记为d0’,随后d2’天开始每天完全更换新鲜的外周神经元分化培养基p,并观察hipsc的形态,培养6
‑
8天,至d8
’‑
d10’。
41.诱导准备阶段中诱导分化的步骤包括:
42.s1.1:将聚合度70
‑
90%的干细胞消化为单细胞悬液,加入等体积的外周神经元分化培养基p终止消化;
43.s1.2:将细胞以每1cm2含0.1
‑5×
104个细胞的密度接种于预先用matrigel胶包被过的培养瓶中,摇晃使细胞均匀分布后放入培养箱中,将重铺诱导当天记为d0’;
44.s1.3:d2’天完全更换新鲜的外周神经元分化培养基p,并观察hipsc的形态,每天更换外周神经元分化培养基p至d8’或d10’。
45.外周神经元分化培养基p是在基础培养中添加0.01
‑
25um的bmp信号抑制剂、0.5
‑
50um的alk5抑制剂、0.02
‑
50um的gsk
‑
3α/β抑制剂、0.01
‑
50um的γsecretase抑制剂和0
‑
80um的vegf、fgf、pdgf抑制剂。
46.所述bmp信号抑制剂是ldn212854、ldn193189中一种或者两种的组合。
47.alk5抑制剂是sb431542、sb505124d中一种或者两种的组合。
48.gsk
‑
3α/β抑制剂是chir
‑
98014、sb415286、ly2090314或chir99021中一种或者两种以上的组合。
49.γsecretase抑制剂是ro4929097、napt或ly411575中一种或两种以上的组合。
50.vegf,fgf,pdgf抑制剂是su5402、e3810中一种或者两种以上的组合。
51.所述基础培养为在dmem/f
‑
12培养基、neurobasal培养基中的一种或两种组合物中添加neaa、b27、丙酮酸钠、cdlc、glutamax和视黄酸。
52.实施例2、诱导成熟期
53.步骤二的诱导成熟阶段:重铺成熟当天记为d0,更换步骤一培养瓶中的外周神经元分化培养基p为外周神经元成熟培养基n1或外周神经成熟培养基n2,培养至d10。
54.其中诱导成熟阶段中重铺成熟当天记的d0,是在诱导准备阶段的d8’或d10’后的重新计时。
55.诱导成熟阶段中更换培养基的步骤包括:
56.s2.1:外周神经元进入成熟阶段,将细胞消化后以每1cm2含(0.5~5)
×
104个细胞的密度接种于预先用matrigel胶包被过的板中,更换培养瓶中外周神经元分化培养基p为外周神经元成熟培养基n1,重铺成熟当天为d0;
57.s2.2:d2与d3更换50%的外周神经元成熟培养基n1;
58.s2:3:d4开始更换75%的外周神经成熟培养基n2,d5开始每隔两天更换2/3的外周神经成熟培养基n2,培养至d10,即可得到分化的外周神经元细胞。
59.所述外周神经元成熟培养基n1是在外周神经元分化培养基p中加入5
‑
fu,以及神经因子ngf、bdnf与nt
‑
3中的一种或两种以上组合,其中5
‑
fu的浓度为0.1
‑
60ug/ml,神经因子的浓度为5
‑
150ng/ml。
60.所述外周神经成熟培养基n2是在外周神经元分化培养基p中加入神经因子ngf、bdnf和nt
‑
3中的一种或两种以上组合,其中神经因子的浓度5
‑
150ng/ml。
61.表1为不同条件下添加剂的浓度
[0062][0063][0064]
实施例3、细胞免疫荧光(confocal)
[0065]
将通过实施例1与实施例2后操作得到的神经元细胞分别通过神经元特异性标志物tuj1染色、外周神经元特异性标志物brn3a染色。结果见图1与图2;
[0066]
图1是神经元标志物tuj1的免疫荧光染色结果图,其中绿色荧光的细胞表明tuj1阳性,tuj1阳性说明细胞是神经元细胞;图2是成熟神经元标志物brn3a的免疫荧光染色结果图,其中浅绿色荧光的细胞表明神经元为brn3a阳性,brn3a阳性说明细胞是成熟的外周神经元细胞。
[0067]
神经元(总体)和外周神经元纯度的鉴定方法:
[0068]
预先用4%多聚甲醛作溶剂配制含1%牛血清白蛋白(bsa)和0.2%triton x
‑
100(聚乙二醇辛基苯基醚)的固定封闭破膜液;根据各种抗体说明书分别按照不同的比例采用封闭液稀释一抗:tuj
‑
1(1∶900)、brn3a(1∶500),得一抗工作液。取出分化成熟至d10时的外周神经元细胞,用dpbs缓冲液清洗后加入固定封闭破膜液室温作用20min,然后吸弃固定封闭破膜液,用dpbs缓冲液清洗后再加入一抗工作液4℃孵育过夜;第二日从冰箱取出板子室温平衡0.5h,之后吸弃一抗工作液,用dpbs清洗,加入相对应的二抗工作液(1∶500)室温下避光孵育1.5h;然后用dpbs清洗,加入hoechst 33342工作液(1∶1250)染核,室温下避光孵育20min后,吸弃核染液。采用荧光倒置显微镜观察细胞染色情况并拍照记录。用image j软件计算阳性的外周神经元占视野中细胞总数的比例,即为外周神经元纯度。
[0069]
对tuj
‑
1表达阳性的细胞进行观察。见附图1,其中a图为表1中浓度1、b图为表1中浓度4,两种条件下采用荧光倒置显微镜观察细胞染色情况并拍照记录,对tuj
‑
1表达阳性的细胞进行观察,随机拍摄两种浓度条件下的视野。
[0070]
对图1进行统计,用image j软件计算可得出,在上述两种条件下,在浓度1条件下,可以看出本发明以tuj1为标志物统计的神经元纯度达超过90%,可以达到93%。
[0071]
对brn3a表达阳性的细胞进行观察。见附图2,其中a图为表1中浓度1、b图为表1中浓度2、c图为表1中浓度3、d图为表1中浓度4,四种条件视野下采用荧光倒置显微镜观察细胞染色情况并拍照记录,对brn3a表达阳性的细胞进行观察。
[0072]
对图2进行统计,用image j软件计算可得出,在上述四种条件中,在浓度1与浓度2
条件的情况下,可以看出本发明以brn3a为标志物统计的外周神经元纯度达超过85%,可以达到90%。
[0073]
可以看出本发明得到的阳性的外周神经元占视野中细胞总数的比例能够达到90%,说明由本发明方法得到的外周神经元纯度高。并且本方法得到的分化的时间周期为18
‑
20天,为半个月左右,即分化周期短,纯度高。
[0074]
虽然本发明已以较佳实施例揭露如上,然其并非用以限定本发明。本发明所属技术领域中具有通常知识者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰。因此,本发明的保护范围当视权利要求书所界定者为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1