一种发酵乳中干酪乳酪杆菌的快速鉴定检测方法与流程
1.本发明属于分子生物学领域,具体涉及复合乳酸菌发酵乳及菌剂产品中干酪乳酪杆菌的特异性pma
‑
qpcr检测引物和快速检测方法。
背景技术:
2.干酪乳酪杆菌(lacticaseibacillus casei)广泛存在于干酪、发酵乳、泡菜等发酵食品以及人体的口腔、肠道之中,兼性厌氧,不运动不产生芽胞,具有调节免疫、缓解肠道炎症、平衡肠道菌群、缓解便秘等功效,具备长久的安全使用历史,已被列入我国《可用于食品菌种名单》和欧盟安全资格认定(qps)名单中。2020年,干酪乳杆菌(lactobacillus casei)分类学变迁为干酪乳酪杆菌(lacticaseibacillus casei),我国法规标准还未进行更新,在《可用于食品菌种名单》及发酵乳产品标识中仍表述为干酪乳杆菌。研究表明干酪乳酪杆菌(lacticaseibacillus casei)等益生菌的功能性和安全性特征在菌株水平具有特异性。目前已有多株商业化菌株在发酵乳、菌剂、固体饮料、保健食品等领域广泛应用,在功能性、安全性等方面具备较大差异。
3.乳业是健康中国、强壮民族的重要产业。针对国内乳品行业研究基础薄弱、标准法规滞后、国外技术垄断等现状,本发明的研究目标是攻克复合乳酸菌发酵乳及菌剂“检不准”、“测不快”的技术难点,现有复合乳酸菌发酵乳及菌剂干酪乳酪杆菌(lacticaseibacillus casei)鉴定检测方法主要有选择性培养基计数结合生理生化检测等,选择性培养基计数结合生理生化方法,操作步骤繁琐,需要操作人员具备一定的经验和技巧,一般鉴定检测一种菌需要15天左右的时间,非常耗时,且选择特异性和鉴定准确性不高。而随机扩增多态性dna(rapd)、脉冲场凝胶电泳(pfge)、核糖体分型(ribotyping)等鉴定检测方法,需要以纯培养物样品为分析前提,不适用于复合乳酸菌发酵乳及菌剂产品样品。
4.本发明采用pma
‑
qpcr特异性检测技术,建立复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌(lacticaseibacillus casei)种水平活菌靶向精确鉴定及定量检测方法。通过优化pma处理复合乳酸菌发酵乳样品的条件,使pma与死细胞中dna结合减少pcr信号,得到pma处理的基因组dna,设计待检物种特异性扩增引物和探针序列,利用qpcr扩增,检测是否呈现特异性扩增曲线,解决复合乳酸菌发酵乳及菌剂中目标活性干酪乳酪杆菌(lacticaseibacillus casei)特异性检出及定量。
5.近年来,国内外文献或专利技术,运用相关技术鉴定或定量检测干酪乳酪杆菌,说明如下。
6.中华人民共和国发明专利授权公告号cn101153316 b,专利名称[一种益生菌乳制品中干酪乳杆菌的检测方法],此方法利用培养基及加入氯洁霉素抗生素培养基对干酪乳杆菌进行分离,分别挑取疑似菌落进行革兰氏染色和生化鉴定。此方法检测周期长,生化鉴定准确性不高。
[0007]
国家标准[gb 4789.35
‑
2016食品安全国家标准食品微生物学检验乳酸菌检验],
此方法利用改良mrs选择性培养基等进行乳杆菌计数,挑取3个或以上单个菌落进行涂片镜检和生化鉴定。此方法检测周期长,选择性不强,生化鉴定准确性不高。
[0008]
文献[molecular quantification of lactic acid bacteria in fermented milk products using real
‑
time quantitative pcr. international journal of food microbiology,2004(97): 197
‑
207.],此方法利用特异性引物实时荧光定量pcr对发酵乳中干酪乳杆菌群(含干酪乳杆菌、类干酪乳杆菌、鼠李糖乳杆菌)进行种群水平检测,检测限为1
×
10
3 cfu/ml,引物通过16s rrna基因设计获得。此方法只能鉴定至种群水平,包含干酪乳杆菌(lactobacillus casei)、类干酪乳杆菌(lactobacillus paracasei),鼠李糖乳杆菌(lactobacillus rhamnosus)等,只能检测死菌,无法区分死菌和活菌。
[0009]
文献[identification and quantification of lactobacillus casei strain shirota in human feces with strain
‑
specific primers derived from randomly amplified polymorphic dna. international journal of food microbiology, 2008(126): 210
‑
215],此方法利用特异性引物实时荧光定量pcr对干酪乳杆菌代田株进行株水平检测,引物通过rapd试验设计获得。此方法只能检测干酪乳杆菌代田株,只能检测死菌,无法区分死菌和活菌。
[0010]
文献[quantitative real
‑
time pcr analysis of fecal lactobacillus species in infants receiving a prebiotic infant formula. applied and environmental microbiology, 2006,2359
‑
2365],此方法利用特异性引物实时荧光定量pcr对干酪乳杆菌进行种水平检测,引物通过16s
‑
23s区段设计获得。此方法只能检测纯菌株,不涉及发酵乳等产品,只能检测死菌,无法区分死菌和活菌。
[0011]
文献[probiotic bacteria survive in cheddar cheese and modify population of other lactic acid bacteria. journal of applied microbiology, 2014 (116),1642
‑
1656],此方法利用pma和特异性引物荧光定量pcr对切达奶酪中干酪乳杆菌和类干酪乳杆菌进行种群水平检测,引物通过16s rrna基因设计获得。此方法只能鉴定至种群水平,包含干酪乳杆菌(lactobacillus casei)、类干酪乳杆菌(lactobacillus paracasei)等。
[0012]
综合上述先前技术,现有复合乳酸菌发酵乳及菌剂产品干酪乳杆菌鉴定检测,在检测周期、检测结果准确性、检测属群种水平、活菌和死菌区分、产品背景干扰等方面还存在提升空间,因此,如何设计出一种兼顾以上薄弱环节改进的复合乳酸菌发酵乳及菌剂产品干酪乳杆菌鉴定检测方法,即成为本发明待解决的一项重要内容。
[0013]
本发明具有以下优点。
[0014]
分辨率高,在传统的引物设计中,并不能区分干酪乳酪杆菌群的干酪乳酪杆菌(lacticaseibacillus casei)、类干酪乳酪杆菌(lacticaseibacillus paracasei)、鼠李糖乳酪杆菌(lacticaseibacillus rhamnosus),如何正确检验复合发酵乳及菌剂中的干酪乳酪杆菌成为一大挑战,不同于序列较短的16s序列,全基因组序列更加完整的展示了细菌之间的差异,同时通过找到核心单拷贝基因,有效的缩小差异基因的范围,基于这个方式我们成功设计出了分辨率更高的特异性引物。
[0015]
活菌快速检出,在传统的细菌检验中,想要检验出活菌需要长时间的培养计数,想要通过pcr快速检测总会受到死菌或者受损菌dna的影响,本发明能够提供快速检出目标菌
的活菌数目,对于复合发酵乳及菌剂中的菌株检验手段进行了进一步优化,并且同时具备快速和精准的特点。
技术实现要素:
[0016]
本发明采用pma
‑
qpcr特异性检测技术,建立复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌(lacticaseibacillus casei)种水平活菌靶向精确鉴定及定量检测方法。通过优化pma处理复合乳酸菌发酵乳样品的条件,使pma与死细胞中dna结合减少pcr信号,得到pma处理的基因组dna,设计待检物种特异性扩增引物和探针序列,利用qpcr扩增,检测是否呈现特异性扩增曲线,解决复合乳酸菌发酵乳及菌剂中目标活性干酪乳酪杆菌(lacticaseibacillus casei)特异性检出及定量。本发明的第一个目的是提供一种利用单拷贝rsme基因在复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌鉴定检测方面的用途,核苷酸序列如seq id no.1所示,基于该特异性分子标记设计的一种鉴定检测复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌的特异性pcr检测引物,该引物为一对,正向引物核苷酸序列如seq id no.2所示,反向引物核苷酸序列如seq id no.3所示,引物详细信息见表1。
[0017]
表1干酪乳酪杆菌引物信息。
[0018]
引物设计及特异性验证引物设计及特异性验证包括特异性引物设计、pcr扩增验证引物特异性、数据库比对验证引物特异性。
[0019]
1)特异性引物设计。
[0020]
从cicc数据库以及ncbi genome数据库收集12株干酪乳酪杆菌(lacticaseibacillus casei)全基因组序列,采用busco软件,计算每一株干酪乳酪杆菌的单拷贝基因集,得到123个干酪乳酪杆菌单拷贝候选基因,根据单拷贝基因在乳杆菌属菌种中的特异性和碱基差异性,进一步筛选得到rsme基因,使用primer premier 6.0和 primer
‑
blast对rsme基因设计引物共6对,经过blast特异性,二级结构,产物长度,引物温度等条件过滤,筛选得到1对引物用于pcr扩增验证。
[0021]
2)pcr扩增验证引物特异性。
[0022]
选取不同来源、不同种、同种株间的发酵乳代表性菌株及模式菌株共13株,复苏后培养至对数生长期,采用细菌基因组提取试剂盒分别提取13株菌的基因组dna,以双蒸水为阴性对照,应用引物组casei
‑
f/casei
‑
r和(表1)进行pcr扩增。pcr总反应体系为25μl,包括premix taq 12.5 μl,上、下游引物(10 μmol/l)各1.0 μl、稀释的dna 模板2 μl,无菌ddh2o补足体积至25 μl。扩增条件:95
°
c预变性5min;95
°
c变性30 s,55
°
c退火30 s,72
°
c延伸 30 s,35个循环;72
°
c后延伸10 min。13株菌的pcr扩增结果显示,仅有干酪乳酪杆菌(lacticaseibacillus casei)有特异性扩增,其余参考菌株和阴性对照均无条带,结果表明,rsme基因引物组具有种水平特异性(图 1)。
[0023]
3)数据库比对验证引物特异性。
[0024]
在refseq genome 数据库blast(参数:bacteria (taxid:2) )验证引物在细菌基因组范围的特异性,引物组casei
‑
f/casei
‑
r (表1)仅在干酪乳酪杆菌
(lacticaseibacillus casei)和玉米乳酪杆菌(lacticaseibacillus zeae)中存在,由于玉米乳酪杆菌未被我国监管部门批准用于食品,因此rsme基因引物组在可用于食品的菌种中具有种水平特异性,包括干酪乳酪杆菌群(lacticaseibacilluscaseigroup)的类干酪乳酪杆菌(lacticaseibacillusparacasei)和鼠李糖乳酪杆菌(lacticaseibacillus rhamnosus)。
[0025]
本发明的第二个目的是提供一种干酪乳酪杆菌特异性pcr检测引物进行复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌pma
‑
qpcr检测的方法,步骤如下。
[0026]
1)叠氮溴化丙锭(pma)处理。
[0027]
用无菌生理盐水稀释菌体浓度为10
8 cfu/ml 。取500 μl菌液,加入pma,使其终浓度为50 μm,暗孵育5 min,每隔1 min 混匀一次,于led 光敏仪(美国biotium pt
‑
h18a)曝光15 min。
[0028]
2)死菌pcr扩增抑制。
[0029]
刮取37
ꢀ°
c厌氧、固体培养48h的干酪乳酪杆菌(lacticaseibacillus casei),用无菌生理盐水调节菌体浓度为10
8 cfu/ml的菌悬液(od
620
为0.4 左右),分成两份,一份为活菌,一份为死菌(80
ꢀ°
c 水浴处理20 min)。按照1)进行pma处理。12 000 rpm 室温离心 10 min 收集菌体,用于活、死菌基因组dna提取。通过qpcr检测pma 处理条件对死菌dna 扩增的抑制率。
[0030]
抑制率(%)=(1-c
死菌
‑
pma(+)
/c
死菌
‑
pma(
‑
)
)%c
死菌
‑
pma(+)
:经pma 处理的待测样品菌浓度(cfu/ml);c
死菌
‑
pma(
‑
)
:未经pma 处理的待测样品菌浓度(cfu/ml)。
[0031]
3)基因组dna提取。
[0032]
按照dneasy blood &tissue kit试剂盒进行基因组dna提取。
[0033]
4)实时荧光定量pcr检测。
[0034]
pcr扩增体系如下:premix extaq 12.5 μl,上、下游引物(10 μmol/l)各1.0 μl、50
×
rox 0.5 μl、稀释的dna 模板5 μl,无菌ddh2o 补足体积至25 μl。pcr扩增程序如下:95
°
c, 30,1 cycle;95
°
c 10 s,55
°
c 35 s,72
°
c 24 s,40 cycles 进行荧光信号检测。
[0035]
5)标准曲线绘制。
[0036]
刮取37
ꢀ°
c厌氧、固体培养48h的干酪乳酪杆菌(lacticaseibacillus casei),用无菌生理盐水调节菌体浓度为10
8 cfu/ml的菌悬液(od
620
为0.4 左右),500μl菌悬液经pma处理后按照3)的方法进行基因组dna提取。将提取的基因组dna 以10 倍梯度进行稀释,通过qpcr测定对应的cq 值,建立菌落浓度(log
10
cfu/ml)与cq 值之间的线性关系,并通过公式e=10
−
1/s
−
1 计算扩增效率,其中s 为标准曲线的斜率。标准曲线如图2所示,干酪乳酪杆菌引物满足定量pcr 要求。
[0037]
表2干酪乳酪杆菌标准曲线信息。
[0038] 6)结果判定。
[0039] 干酪乳酪杆菌(lacticaseibacillus casei)的引物casei
‑
f/casei
‑
r在种间和自身基因组内均具有特异性,基因组dna 的pcr 扩增条带的大小与模式菌株(阳性对照)基因组dna的pcr 扩增条带大小吻合,且qpcr 溶解曲线为单一峰。表明casei
‑
f/casei
‑
r可以实现复合发酵乳中干酪乳酪杆菌(lacticaseibacillus casei)的定量检测。
[0040]
本发明的第三个目的是提供上述方法在复合乳酸菌发酵乳及菌剂中干酪乳酪杆菌(lacticaseibacillus casei)/干酪乳杆菌(lactobacillus casei)鉴定检测的应用。
附图说明
[0041]
图1是引物特异性扩增验证电泳图,其中m
‑
2k marker; n
‑
空白对照; 1
‑
cicc 6163
t
德氏乳杆菌保加利亚亚种lactobacillus delbrueckii subsp. bulgaricus; 2
‑
cicc 10134r德氏乳杆菌保加利亚亚种lactobacillus delbrueckii subsp. bulgaricus; 3
‑
cicc 10139r德氏乳杆菌保加利亚亚种lactobacillus delbrueckii subsp. bulgaricus; 4
‑
cicc 6222
t
嗜热链球菌streptococcus thermophilus; 5
‑
cicc 10135r嗜热链球菌streptococcus thermophilus; 6
‑
cicc 10138r嗜热链球菌streptococcus thermophilus; 7
‑
cicc 10141r嗜热链球菌streptococcus thermophilus; 8
‑
cicc 6263
t
类干酪乳酪杆菌lacticaseibacillus paracasei; 9
‑
cicc 6117
t
干酪乳酪杆菌lacticaseibacillus casei; 10
‑
cicc 10136r干酪乳酪杆菌lacticaseibacillus casei; 11
‑
cicc 6250
t
动物双歧杆菌动物亚种bifidobacterium animalis subsp.animalis; 12
‑
cicc 10137r动物双歧杆菌乳亚种bifidobacterium animalis subsp.lactis; 13
‑
cicc 10140r动物双歧杆菌乳亚种bifidobacterium animalis subsp. lactis。
[0042]
图2是干酪乳酪杆菌qpcr标准曲线(standard curve)。
[0043]
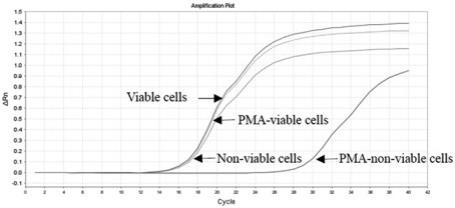
图3是干酪乳酪杆菌qpcr扩增曲线(amplification curve)。
[0044]
图4 是干酪乳酪杆菌qpcr熔解曲线(melting curve)。
具体实施方式
[0045]
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
[0046]
实施例1。
[0047]
1)检测样品信息。
[0048]
市售某品牌发酵乳(生产日期:20210817 0047、规格:135g/瓶,标识菌种组成:保加利亚乳杆菌,嗜热链球菌,干酪乳杆菌,标识乳酸菌活菌数≥1
×
10
6 cfu/g)。
[0049]
2)实时荧光定量pcr检测干酪乳酪杆菌基因组内特异性。
[0050]
将干酪乳酪杆菌(lacticaseibacillus casei)cicc10136r复苏后,培养至对数生长期,采用细菌基因组提取试剂盒分别提取菌株基因组dna,以双蒸水为阴性对照,应用引物组casei
‑
f/casei
‑
r (表1)进行荧光定量pcr扩增。荧光定量pcr总反应体系为25μl,包括premix extaq 12.5 μl,上、下游引物(10 μmol/l)各1.0 μl、50
×
rox 0.5 μl、稀释的dna 模板5 μl,无菌ddh2o 补足体积至25 μl。扩增条件:95
°
c,30,1 cycle;95
°
c 10 s,55
°
c 35 s,72
°
c 24 s,40 个循环,在55℃收集荧光信号,在反应的最后添加熔解曲线。基因组内引物特异性实时荧光定量pcr检测结果显示,产物熔解曲线单一,表明rsme基因引物在基因组
内特异性良好(图2)。
[0051]
3)基因组dna提取。
[0052]
按照dneasy blood &tissue kit试剂盒进行基因组dna提取。
[0053]
4)灵敏度试验及标准曲线绘制。
[0054]
获得的基因组dna 以10 倍梯度进行7个梯度的稀释,通过qpcr 测定每个稀释度dna 对应的cq值,以菌液浓度的对数值(log10cfu/ml)为x 轴,cq值为y 轴,建立基于cfu 的qpcr 标准曲线。根据平板计数结果,干酪乳酪杆菌(lacticaseibacillus casei)培养物的浓度为3.7
×
108cfu/ml, 经实时荧光pcr检测后干酪乳酪杆菌(lacticaseibacillus casei)的稀释度依次从3.7
×
108cfu/ml~3.7
×
103cfu/ml, 结果显示其检测限(lod)为3,700cfu/ml,以菌液浓度的对数值为横坐标,循环数cq值为纵坐标建立标准曲线(图3),标准曲线线型回归系数r2为1。干酪乳酪杆菌 y=
‑
3.355x+42.594;r2=1;eff%=98.63%。
[0055]
5)叠氮溴化丙锭(pma)处理和死菌/活菌抑制率验证。
[0056]
刮取在37
ꢀ°
c厌氧条件,固体培养48h的干酪乳酪杆菌(lacticaseibacillus casei),用无菌生理盐水稀释至108 cfu/ml的菌悬液(od620为0.4 左右),分成两份,一份记为活菌,一份于80
ꢀ°
c 水浴处理20 min,取出立即于冰浴冷却,记为死菌(利用平板菌落计数法来检测无活菌生长)。分别向500 μl活、死菌菌液中加入pma 溶液,使其终浓度为50 μm,暗孵育5 min,每隔1 min 混匀一次,于led 光敏仪(美国biotium pt
‑
h18a)曝光15 min。12 000 rpm 室温离心 15 min 收集菌体。
[0057]
采用统计软件进行单因素方差分析pma处理前后cq值的差异。干酪乳酪杆菌(lacticaseibacillus casei)的pma终浓度均为50 μmol/l,暗孵育时间15 min。曝光时间均为15 min,pma 作用条件对死菌qpcr 的抑制率如下。
[0058]
表3 pma 作用条件对死菌qpcr 的抑制率。
[0059]
注:pma(-):未经pma 作用;pma(+):加pma作用。
[0060]
干酪乳酪杆菌(lacticaseibacillus casei)的pma终浓度均为50 μmol/l,暗孵育时间15 min,曝光时间均为15 min。
[0061]
pma 作用条件对活菌qpcr 的影响如下。
[0062]
表4 pma 作用条件对活菌qpcr 的影响。
[0063] 注:pma(-):未经pma 作用;pma(+):加pma作用。
[0064]
未经热处理的干酪乳酪杆菌(lacticaseibacillus casei)浓度为7.57
×
10
7 cfu / ml;80℃热处理20min后,平板计数干酪乳酪杆菌(lacticaseibacillus casei)浓度为0。通过t检验分析不加pma 处理的活菌与加pma 处理的活菌qpcr 的cq值,结果表明活菌的两个cq值之间均无显著性差异(p>0.05);不加pma 处理的死菌与加pma 处理的死菌qpcr 的cq值,结果表明死菌的两个cq值之间存在显著性差异(p>0.05)。pma
‑
qpcr法可将活菌和死菌区分出来,因此,pma
‑
qpcr法检测结果更加准确(图4) 。pma对死菌/活菌抑制率满足试验预期用途要求。
[0065]
6)实时荧光定量pcr检测。
[0066]
pcr扩增体系如下:premix extaq 12.5 μl,上、下游引物(10 μmol/l)各1.0 μl、50
×
rox 0.5 μl、稀释的dna 模板5 μl,无菌ddh2o 补足体积至25 μl。pcr扩增程序如下:95
°
c, 30, 1 cycle; 95
°
c 10 s, 55
°
c 35 s, 72
°
c 24 s, 40 cycles 进行荧光信号检测。
[0067]
7)检测结果。
[0068]
将qpcr检测检测样品中干酪乳酪杆菌(lacticaseibacillus casei)的cq=25.70代入公式y=
‑
3.355x+42.594中,从而得出检测样品中干酪乳酪杆菌(lacticaseibacillus casei)活菌数为1.09
×
10
6 cfu/ml。
[0069]
8)与传统培养法检测结果比较。
[0070]
参考《gb 4789.35
‑
2016 食品安全国家标准食品微生物学检验乳酸菌检验》方法,采用mrs(含50 ug/ml的万古霉素)选择性培养基替代标准中的培养基,对检测样品中干酪乳酪杆菌(lacticaseibacillus casei)的菌落计数结果为2.5
×
106cfu/ml,pma
‑
qpcr结果与选择性培养基平板菌落计数结果在数量级上一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1