1.本发明涉及合成化学领域,特别涉及一种具环外双键芳基环内脂的高效构筑方法。
背景技术:2.环内酯结构,是诸多具有特异活性的天然药物的重要结构单元,常见于大环内酯类抗生素结构中,典型如青蒿素,具有六元环内酯结构;罗汉松脂素、银杏内酯等,具有五元环内酯结构。此外,其分子内酯键的断裂开环,可应用于合成制备高分子材料,且其聚合物所具有的生物可降解功能,使得其成为多种医学用途高分子材料的理想原料。因此,环内脂的高效制备一直以来是化学工作者研究的重要选题。
3.通常,环内酯的制备是通过羟基羧酸的分子内缩合反应以及卤代羧酸金属化合物的脱金属卤代物来实现。限于底物的适用性以及反应过程中分子间缩合反应所生成的副产物难以分离等问题,以上合成制备方法局限性较大。
技术实现要素:4.本发明的目的是提供一种具环外双键芳基环内脂的高效构筑方法。为此,本发明采用以下技术方案:
5.具环外双键芳基环内酯的高效构筑方法:以邻碘苯甲酸和炔丙基芳基醚为起始原料,碱性条件下,以银盐作为催化剂,惰性气体氛围下于有机溶剂中反应得到具环外双键的五元芳基环内酯。
6.所制备的五元芳基环内酯可用以下结构式表示:
[0007][0008]
在采用上述技术方案的基础上,本发明还可组合采用以下优选的进一步技术方案:
[0009]
选用新蒸的三乙胺构建碱性条件氛围。
[0010]
选用氧化银作为金属催化剂。
[0011]
选用甲苯为溶剂。
[0012]
100℃反应24h,淬灭,柱色谱分离后,乙酸乙酯中重结晶,制备得到具环外双键的五元芳基环内酯白色固体。
[0013]
反应结束后以石油醚和乙酸乙酯的混合物为洗脱相进行柱色谱分离,得到白色固体五元芳基环内酯粗产品,而后以乙酸乙酯为溶剂,重结晶制得白色针状或片状具环外双键的五元芳基环内酯白色单体。
nmr(100mhz,cdcl3)δ=166.28,158.03,146.94,138.75,134.63,130.46,129.57,125.51,124.62,121.12,120.41,114.54,103.41,61.95.hr-ms(esi)m/z c
16h12
o3:计算值,[m]252.0786;测定值,[m+h]
+
253.0858.
[0029]
实施例2
[0030][0031]
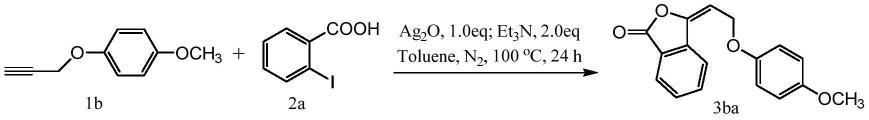
干燥的schlenk反应瓶中加入邻碘苯甲酸(2a,0.5mmol)和4-甲氧基取代的芳基炔丙基醚(1b,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=20:1作为展开剂。
[0032]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=30:1)分离提纯,可得具环外双键芳基环内酯3ba(129.7mg,产率92%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色针状固体。产物3ba经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=7.92(d,j=7.7hz,1h),7.77~7.64(m,2h),7.58(t,j=7.2hz,1h),7.19(t,j=8.5hz,1h),6.61~6.48(m,3h),5.85(t,j=6.7hz,1h),5.00(d,j=6.7hz,2h),3.79(s,3h);
13
c nmr(100mhz,cdcl3)δ=166.21,160.86,159.31,146.99,138.75,134.61,130.47,130.00,125.51,124.62,120.41,106.89,106.66,103.24,100.97,62.06,55.25,29.66.hr-ms(esi)m/z c
17h14
o4:计算值,[m]282.0892;测定值,[m+h]
+
283.0970.
[0033]
实施例3
[0034][0035]
干燥的schlenk反应瓶中加入邻碘苯甲酸(2a,0.5mmol)和4-三氟甲基取代的芳基炔丙基醚(1c,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=10:1作为展开剂。
[0036]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=20:1)分离提纯,可得具环外双键芳基环内酯3ca(88mg,产率55%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色片状固体。产物3ca经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=7.93(d,j=7.6hz,1h),7.72(q,j=7.6hz,2h),7.63~7.50(m,3h),7.02(d,j=8.2hz,2h),5.83(t,j=6.7hz,1h),5.04(d,j=6.7hz,2h);
13
c nmr(100mhz,cdcl3)δ=166.05,160.51,147.44,138.53,134.71,130.67,126.94(d,j=3.6hz),125.53,124.60,123.03(q,j=97hz),120.45,114.56,102.15,62.19.hr-ms(esi)m/z c
17h11
f3o3:计算值,
[m]320.0660;测定值,[m+h]
+
321.0734.
[0037]
实施例4
[0038][0039]
干燥的schlenk反应瓶中加入邻碘苯甲酸(2a,0.5mmol)和2-醛基取代的芳基炔丙基醚(1d,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=10:1作为展开剂。
[0040]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=15:1)分离提纯,可得具环外双键芳基环内酯3da(65.8mg,产率47%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色针状固体。产物3da经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=10.53(s,1h),7.95(d,j=7.7hz,1h),7.85(dd,j=7.7,1.8hz,1h),7.77~7.71(m,2h),7.65~7.52(m,2h),7.10~7.04(m,2h),5.88(t,j=6.8hz,1h),5.15(d,j=6.8hz,2h);
13
c nmr(100mhz,cdcl3)δ=189.65,166.05,160.41,147.52,138.52,135.99,134.77,130.75,128.65,125.61,125.04,124.64,121.13,120.54,112.62,102.05,62.59.hr-ms(esi)m/z c
17h12
o4:计算值,[m]280.0736;测定值,[m+h]
+
281.0813.
[0041]
实施例5
[0042][0043]
干燥的schlenk反应瓶中加入芳基炔丙基醚(1a,0.5mmol)和4-溴取代的邻碘苯甲酸(2b,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=20:1作为展开剂。
[0044]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=30:1)分离提纯,可得具环外双键芳基环内酯3ab(110.5mg,产率67%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色针状固体。产物3ab经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=7.84(s,1h),7.79(d,j=8.2hz,1h),7.71(d,j=8.2hz,1h),7.30(t,j=7.7hz,2h),7.0~6.95(m,3h),5.86(t,j=6.6hz,1h),5.01(d,j=6.6hz,2h);
13
c nmr(100mhz,cdcl3)δ=165.31,157.96,145.59,140.34,133.91,129.96,129.61,126.79,123.73,123.41,121.27,114.59,104.97,61.89.hr-ms(esi)m/zc
16h11br
o3:计算值,[m]329.9892;测定值,[m+h]
+
330.9963.
[0045]
实施例6
[0046][0047]
干燥的schlenk反应瓶中加入芳基炔丙基醚(1a,0.5mmol)和4-乙酰基取代的邻碘苯甲酸(2c,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=10:1作为展开剂。
[0048]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=10:1)分离提纯,可得具环外双键芳基环内酯3ac(109.5mg,产率75%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色针状固体。产物3ac经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=8.25(s,1h),8.13(d,j=8.0hz,1h),8.02(d,j=8.0hz,1h),7.31(t,j=8.0hz,2h),6.98(t,j=8.7hz,3h),5.98(t,j=6.6hz,1h),5.03(d,j=6.6hz,2h),2.70(s,3h);
13
c nmr(100mhz,cdcl3)δ=196.48,165.23,157.93,146.32,142.04,139.06,130.05,129.58,127.62,125.91,121.23,120.26,114.56,104.80,61.84,27.06.hr-ms(esi)m/z c
18h14
o4:计算值,[m]292.0892;测定值,[m+h]
+
293.0806.
[0049]
实施例7
[0050][0051]
干燥的schlenk反应瓶中加入芳基炔丙基醚(1a,0.5mmol)和4,5-二甲氧基取代的邻碘苯甲酸(2d,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=10:1作为展开剂。
[0052]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂,可得棕色固体粗产物。在etoac中进行重结晶,可得到白色针状固体3ad(67mg,产率43%),粗产品为白色固体。产物3ad经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=7.33~7.28(m,2h),7.27(s,1h),7.03(s,1h),6.99~6.96(m,3h),5.70(t,j=6.7hz,1h),5.01(d,j=6.7hz,2h),3.99(s,3h),3.96(s,3h);
13
c nmr(100mhz,cdcl3)δ=166.49,158.07,155.31,151.95,147.03,133.42,129.56,121.07,117.34,114.59,105.51,101.82,101.34,62.01,56.48,56.41.hr-ms(esi)m/z c
18h16
o5:计算值,[m]312.0998;测定值,[m+h]
+
313.1066.
[0053]
实施例8
[0054][0055]
干燥的schlenk反应瓶中加入邻碘苯甲酸(2a,0.5mmol)和4-甲基取代的芳基炔丙基硫醚(1e,0.5mmol)为起始底物,ag2o(0.5mmol,1.0eq)作为金属催化物,n2保护下,加入et3n(1.0mmol,2.0eq),甲苯(3.0ml)作为溶剂,于100℃的油浴中反应24h。薄层层析色谱(tlc)监测反应进程,以石油醚:乙酸乙酯(pe/etoac,v/v)=20:1作为展开剂。
[0056]
反应结束,加入20ml etoac作为萃取试剂,迅速抽滤通过一小段硅胶小柱以除去固体杂质。另加20ml etoac洗脱。合并有机相,于旋转蒸发仪上浓缩,除去溶剂。浓缩液经柱层析色谱(pe/etoac,v/v=30:1)分离提纯,可得具环外双键芳基环内酯3ea(128.3mg,产率91%),粗产品为白色固体。进一步,在etoac中进行重结晶,可得到白色片状固体。产物3ea经高分辨质谱(hrms)、核磁共振波谱(1h nmr和
13
c nmr)表征,具体数据为1h nmr(400mhz,cdcl3)δ=7.85(d,j=7.7hz,1h),7.66(t,j=7.4hz,1h),7.60(d,j=7.7hz,1h),7.51(t,j=7.4hz,1h),7.31(d,j=7.8hz,2h),7.06(d,j=7.7hz,2h),5.67(t,j=8.0hz,1h),3.90(d,j=8.0hz,2h),2.28(s,3h);
13
c nmr(100mhz,cdcl3)δ=166.30,146.64,138.87,136.89,134.33,131.01,130.87,129.92,129.63,125.27,124.46,120.00,104.41,30.10,20.94.hr-ms(esi)m/z c
17h14
o2s:计算值,[m]282.0715;测定值,[m+h]
+
283.0786。
