一种以低盐培养基培养嗜盐菌生产PHA的方法与流程
一种以低盐培养基培养嗜盐菌生产pha的方法
技术领域
1.本发明涉及生物化学技术领域,具体涉及一种新的嗜盐菌(保藏编号为:cgmcc no.22795,分类命名为:halomonas bluephagenesis,保藏日期为2021年06月28日),以及在低盐培养基中用非相关碳源(如葡萄糖等)培养嗜盐菌生产phb,p3hb4hb,p(3hb
‑
co
‑
4hb
‑
co
‑
3hv),phbhhx,含3hp的均聚物p3hp或共聚物p(3hb
‑
co
‑
3hp)(或phbhp)等产品,以及对各种pha进行单体组分调节的方法。
背景技术:
2.聚羟基脂肪酸酯(polyhydroxyalkanoates,pha)是一种可以由多种细菌积累的可降解聚酯,根据其单体组成,可分为短链和/或中长链pha,也有均聚物和共聚物。pha是一种环境友好型材料,有着广泛的应用前景,可以作为传统石油基塑料的环保替代品。目前工业上经常使用生物发酵的方法,来获得富含pha的细菌,然后进行复杂的提纯工作。
3.pha生产是以罗氏真氧杆菌(ralstonia eutropha)、基因改造的大肠杆菌(e. coli)和嗜盐菌等来进行的。虽然发酵液中菌体富含pha,但是pha的提取和纯化除杂工艺很复杂,同时使用嗜盐菌提取pha后的废水由于含盐量高,废水处理非常繁杂,进一步提高了pha的生产成本。
4.目前使用嗜盐菌pha的生产工艺通常使用海水或者含盐量在3
‑
6%(w/v)(即30g/l)的培养基进行发酵生产,可参考文献pilot scale
‑
up of poly(3
‑
hydroxybutyrate
‑
co
‑4‑
hydroxybutyrate) production by halomonas bluephagenesis via cell growth adaptedoptimization process(ye j, huang w, wang d, et al., biotechnology journal, 2018, 13)。cn111117906a公开了一种改善的微生物培养方法,其在基础培养基中再添加钠盐和碳源,以维持嗜盐菌的高盐度环境,其中,钠盐浓度在5g/l
‑
100g/l。由于废水盐浓度过高,处理成本高,这提高了pha的生产成本。
5.物理射线,比如artp技术,是常温常压等离子体技术的简称,该技术运用是利用射频辉光放电原理,在常温常压状态下产生高能量的等离子体,其富含的高能化学活性粒子能够对菌株/植物/动物细胞产生高强度遗传物质损伤,进而利用细胞启动的sos高容错率修复机制,产生种类多样的错配位点,并最终经稳定遗传进而形成突变多样库,可参考文献atmospheric and room temperature plasma (artp) as a new powerful mutagenesis tool(zhang x, zhang x, li h, et al., applmicrobiolbiotechnol, 2014,98)。。
6.目前,通过基因工程和等离子照射(artp)诱变筛选育种相结合的手段,是改造pha工程生产菌的新型手段之一。开发phb,p3hb4hb等二元或多元pha的微生物低盐发酵生产,具有降低成本和工艺可控的重要意义。
技术实现要素:
7.本发明的第一方面,提供了一种生产pha的方法,包括利用嗜盐菌生产pha。
8.优选的,所述的方法包括以低盐培养基培养嗜盐菌生产pha。
9.所述的低盐培养基中盐的含量为5
‑
20g/l。
10.优选的,所述的低盐培养基中盐的含量为5
‑
15g/l。
11.在本发明的一个具体实施方式中,所述的低盐培养基中盐的含量为5
‑
10g/l。
12.优选的,所述的低盐培养基中盐选自氯化钠、硫酸钠、磷酸钠、硝酸钠、碳酸钠、乙酸钠、柠檬酸钠、葡萄糖酸钠中的一种或两种以上的组合。
13.在本发明的一个具体实施方式中,所述的盐选自氯化钠和/或硫酸钠。
14.优选的,所述的低盐培养基中包含非相关碳源和/或相关碳源。
15.所述的非相关碳源选自葡萄糖、葡萄糖酸、葡萄糖酸盐(优选为葡萄糖酸钠、葡萄糖酸钾或葡萄糖酸钙等)、葡萄糖酸酯、淀粉、甘油、乙酸、己酸、木糖、纤维素水解物、乳糖、果糖中的一种或两种以上的组合。
16.所述的相关碳源选自γ
‑
丁内酯、油酸和/或丙酸,以及其他中长链脂肪酸中的一种或多种。
17.上述的低盐培养基可通过在基础培养基中添加与产物合成相关或不相关的碳源,例如最终的培养基可包含葡萄糖、葡萄糖酸、葡萄糖酸盐、葡萄糖酸酯或者其组合作为嗜盐菌培养的碳源。优选地,所述培养基包含葡萄糖作为碳源。任选地,所述培养基还可以含有或者不含有葡萄糖以外的碳源。
18.作为碳源的非相关碳源或相关碳源的浓度可以由本领域技术人员根据使用的培养条件和嗜盐菌来适当调整,并且可以在,例如,约1
‑
100g/l、约1
‑
90g/l、约1
‑
80g/l、约1
‑
70g/l、或约1
‑
60g/l的范围内;优选地,该浓度可以在约3
‑
60g/l、约3
‑
50g/l或约3
‑
40g/l的范围内;更优选约5
‑
60g/l、约10
‑
60g/l、约20
‑
40g/l的范围内,包括例如约25.5
‑
34.5g/l。需理解,以上浓度范围并非是穷尽式列举,而是可以由本领域技术人员根据发酵体系的条件通过实验进行适当的调整,这些浓度范围均涵盖在本发明的范围内,只要其不会不利地影响本发明目的即可。
19.作为低盐培养基中的盐可以是在嗜盐菌培养开始之前加入到基础培养基中。或者,也可以是在嗜盐菌培养过程中一次、分批多次或流加到培养基中。再或者,还可以是在将嗜盐菌接种到培养基的同时加入到培养基中。
20.优选的,所述的低盐培养基中还可以包含调节物质,例如乙酸、乙酸盐、乙酸酯或其他的乙酸衍生物,其可以是在微生物培养开始之前加入到基础培养基中。或者,乙酸、乙酸盐、乙酸酯或其他的乙酸衍生物也可以是在微生物培养过程中一次、分批多次或流加到培养基中。再或者,乙酸、乙酸盐、乙酸酯或其他的乙酸衍生物还可以是在将微生物接种到培养基的同时加入到培养基中。乙酸、乙酸盐、乙酸酯或其他的乙酸衍生物的添加浓度可以为,例如在约1
‑
12g/l、约1
‑
11g/l、约1
‑
10g/l、约1
‑
9g/l或约1
‑
8g/l的范围内;优选约1
‑
8g/l,例如,在约2
‑
8g/l、约2
‑
7g/l、约2
‑
6g/l、约2
‑
5g/l、约2
‑
4g/l、或2
‑
3g/l的范围内;更优选2
‑
6g/l,例如在约3
‑
6g/l或约3
‑
5g/l的范围内。这些浓度可以在本发明的基础上根据培养基的组成和培养条件等因素而适当地调整,只要其不影响本发明的效果即可。
21.所述的pha为均聚pha和/或共聚pha。优选的,所述的pha选自3
‑
羟基丁酸(3hb)均聚物phb,3
‑
羟基丁酸(3hb)和4
‑
羟基丁酸(4hb)二元共聚物p3hb4hb,3
‑
羟基丁酸(3hb)、4
‑
羟基丁酸(4hb)和3
‑
羟基戊酸三元共聚物p(3hb
‑
co
‑
4hb
‑
co
‑
3hv),3
‑
羟基丁酸(3hb)和3
‑
羟基己酸二元共聚物phbhhx,3
‑
羟基丙酸(3hp)的均聚物或共聚物,
优选的,所述的3
‑
羟基丙酸(3hp)的均聚物为p3hp,优选的,所述的3
‑
羟基丙酸(3hp)的共聚物为p(3hb
‑
co
‑
3hp)或phbhp。
22.所述嗜盐菌可以为野生型(即以其天然形式在合适的培养条件下能够利用适当的底物合成聚合物,比如pha),也可以是经过人工改造的重组型,包括但不限于通过诱变、基因工程改造等得到的菌。例如,在重组型的情况下,上述嗜盐菌可以是在自身不能够合成pha的微生物中通过人工方式(比如导入pha合成相关的基因)改造、进而使其能够在合适的培养条件下能够利用适当的底物合成聚合物的重组微生物,例如通过在大肠杆菌中引入聚羟基丁酸酯的合成基因phac基因而得到的重组微生物。其还可以是在能够合成pha的野生型微生物(如halomonasbluephagenesistd01)的基础上通过对菌株全基因组进行随机诱变和定向筛选获得的菌株,更具体地,例如通过在halomonasbluephagenesis(优选td01,保藏编号cgmcc.no.4353),halomonascampaniensis(优选ls21,保藏编号cgmccno.6593),halomonasaydingkolgenesis(优选m1,保藏号cgmccno.19880)或恶臭假单胞菌(pseudomonasputida)的基础上诱变筛选因而获得的细菌。例如,本发明的方法所涉及的嗜盐菌可以是halomonasbluephagenesistd01(优选保藏号为cgmccno.4353),或者是在halomonasbluephagenesistd01的基础上通过诱变、基因工程改造等方法得到的工程菌,例如通过等离子照射(artp)、其他物理方法以及化学诱变剂和分子改造基因重组技术来获得的。又如本发明的一个具体实施方式中,所述的嗜盐菌可以是halomonasbluephagenesistdh4
‑
δphap,或者是在halomonasbluephagenesistdh4
‑
δphap基础上通过诱变、基因工程改造等方法得到的工程菌,例如通过等离子照射(artp)、其他物理方法以及化学诱变剂和分子改造基因重组技术来获得的。又如本发明的一个具体实施方式中,所述的嗜盐菌可以是halomonasbluephagenesistdh4abp(保藏号为cgmccno.22795),或者是在halomonasbluephagenesistdh4abp(保藏号为cgmccno.22795)基础上通过诱变、基因工程改造等方法得到的工程菌,例如通过等离子照射(artp)、其他物理方法以及化学诱变剂和分子改造基因重组技术来获得的。
23.优选的,所述的诱变、基因工程改造为调整了多种pha产品合成代谢通路的基因表达,其中所述基因包括sucd、ogda、4hbd、orfz、gabd、phaa、phab、phac以及脂肪酸beta氧化途径中的一种或多种或全部。它们所编码的酶分别是琥珀酸半醛合成酶、α酮戊二酸脱羧酶、4
‑
羟基丁酸脱氢酶、辅酶a转移酶、琥珀酸半醛降解酶、β
‑
酮硫解酶、nadh型乙酰乙酰辅酶a还原酶和pha合成酶。其中,sucd、ogda、4hbd、orfz、phaa、phab和phac基因等进行了过表达,而gabd、beta氧化途径中的基因进行了删除或者弱化表达。sucd、ogda、4hbd、orfz、phaa、phab和phac基因等可以在质粒上和/或染色体上进行过表达,而且表达可以是组成型的,也可以是诱导型的。其中,phac基因编码聚羟基脂肪酸酯pha合成酶;orfz编码4
‑
羟基丁酰辅酶a转移酶基因;sucd编码琥珀酸半醛脱氢酶基因;4hbd编码4羟基丁酸脱氢酶;prpc编码丙酰辅酶a降解蛋白。
24.在本发明的一个具体实施方式中,所述的嗜盐菌经过artp诱变和/或低盐压力筛选。
25.优选的,所述的嗜盐菌为嗜盐单胞菌属halomonas,更优选halomonasbluephagenesistd01(保藏编号:cgmcc.no.4353),halomonascampaniensisls21(保藏编号:cgmccno.6593)和halomonasaydingkolgenesism1(保藏编号:cgmcc
no.19880)。
26.在本发明的一个具体实施方式中,为halomonas bluephagenesis td01、halomonas bluephagenesis td68、halomonas bluephagenesis td68
‑
194、halomonas bluephagenesis tdh4
‑
δphap(简称tdh4p)、halomonas bluephagenesis ty194、halomonas bluephagenesis tdhx或halomonas bluephagenesis tdp129。
27.在本发明的一个具体实施方式中,将halomonas bluephagenesis td01、halomonas bluephagenesis td68、halomonas bluephagenesis td68
‑
194、halomonas bluephagenesis tdh4
‑
δphap、halomonas bluephagenesis ty194、halomonas bluephagenesis tdhx或halomonas bluephagenesis tdp129进行artp诱变与低盐压力筛选,筛选出的菌株分别命名为halomonas bluephagenesis td01ab、halomonas bluephagenesis td68ab、halomonas bluephagenesis td68
‑
194ab、halomonas bluephagenesis tdh4
‑
δphapab、halomonas bluephagenesis ty194ab、halomonas bluephagenesis tdhxab或halomonas bluephagenesis tdp129ab。
28.在本发明的一个具体实施方式中,所述的嗜盐菌为halomonas bluephagenesis tdh4
‑
δphapab(tdh4abp,分类命名为:halomonas bluephagenesis,保藏编号为:cgmcc no.22795,保藏日期为2021年06月28日,保藏单位是中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址是北京市朝阳区北辰西路1号院3号),或者,所述的嗜盐菌为以tdh4abp为底盘衍生的菌株,具体为:a)在tdh4abp基因组上编辑聚羟基脂肪酸酯pha合成酶基因phac,获得halomonas bluephagenesis td01ab;b)在tdh4abp基因组上编辑4
‑
羟基丁酰辅酶a转移酶基因orfz,获得halomonas bluephagenesis td68ab;c)在tdh4abp基因组上编辑4羟基丁酸脱氢酶基因4hbd、琥珀酸半醛脱氢酶基因sucd和4
‑
羟基丁酰辅酶a转移酶基因orfz,获得halomonas bluephagenesis td68
‑
194ab;d)在tdh4abp基因组上敲除丙酰辅酶a降解基因prpc,同时过表达琥珀酰辅酶a转移酶基因scpab,获得halomonas bluephagenesis ty194ab;e)在tdh4abp基因组上过表达pha合成酶基因phac,同时敲除脂肪酸降解基因fada和fadb,获得halomonas bluephagenesis tdhxab;或,f)在tdh4abp基因组上过表达二元醇降解基因pcs、羟基醛还原酶aldd、羟基酸还原酶dhat三个基因,获得halomonas bluephagenesis tdp129ab。
29.所述的嗜盐菌可以在适当的培养条件(温度、转速、溶氧、ph等等)下培养,只要该培养能够使其合成期望的pha聚合物即可。例如,培养过程中的温度和转速可以由本领域技术人员根据微生物的特性来适当地设定,或常规的优化实验来进行选择。
30.在本发明的一个具体实施方式中,以葡萄糖(浓度优选为3
‑
10g/l,在本发明的一个具体实施方式中,浓度为5g/l)作为碳源,盐浓度为5
‑
15g/l(优选8
‑
10g/l),产物为phb。低盐培养基的配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%
na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o)(ph调至约9.0),以及葡萄糖3%,nacl 1%。
31.在本发明的一个具体实施方式中,以γ
‑
丁内酯(浓度优选为3
‑
10g/l,在本发明的一个具体实施方式中,浓度为5g/l)作为碳源,盐浓度为5
‑
15g/l(优选8
‑
10g/l),产物p3hb4hb中4hb的摩尔百分比为3
‑
20(优选为10
‑
15)。低盐培养基的配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o)(ph调至约9.0),以及葡萄糖2%,γ
‑
丁内酯0.5%,nacl 1%。
32.在本发明的一个具体实施方式中,以γ
‑
丁内酯和丙酸(浓度优选为3
‑
10g/l,在本发明的一个具体实施方式中,浓度为5g/l)作为碳源,盐浓度为5
‑
15g/l(优选8
‑
10g/l),产物p(3hb
‑
co
‑
4hb
‑
co
‑
3hv)中4hb的摩尔百分比为1
‑
20(优选为2
‑
7),3hv的摩尔百分比为1
‑
20(优选为1
‑
7)。低盐培养基的配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o)(ph调至约9.0),以及葡萄糖2%,γ
‑
丁内酯0.5%,丙酸0.5%,nacl 1%。
33.在本发明的一个具体实施方式中,以油酸(浓度优选为3
‑
10g/l,在本发明的一个具体实施方式中,浓度为5g/l)作为碳源,盐浓度为5
‑
15g/l(优选8
‑
10g/l),产物phbhhx中hhx的摩尔百分比为1
‑
20(优选为2
‑
7)。低盐培养基的配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o)(ph调至约9.0),以及油酸1%,nacl 1%。
34.在本发明的一个具体实施方式中,以丙酸(浓度优选为3
‑
10g/l,在本发明的一个具体实施方式中,浓度为5g/l)作为碳源,盐浓度为5
‑
15g/l(优选8
‑
10g/l),产物p(3hb
‑
co
‑
3hp)中3hp的摩尔百分比为5
‑
50(优选为12
‑
40)。低盐培养基的配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其
bluephagenesis td68ab;c)在tdh4abp基因组上编辑4羟基丁酸脱氢酶基因4hbd、琥珀酸半醛脱氢酶基因sucd和4
‑
羟基丁酰辅酶a转移酶基因orfz,获得halomonas bluephagenesis td68
‑
194ab;d)在tdh4abp基因组上敲除丙酰辅酶a降解基因prpc,同时过表达琥珀酰辅酶a转移酶基因scpab,获得halomonas bluephagenesis ty194ab;e)在tdh4abp基因组上过表达pha合成酶基因phac,同时敲除脂肪酸降解基因fada和fadb,获得halomonas bluephagenesis tdhxab;或,f)在tdh4abp基因组上过表达二元醇降解基因pcs、羟基醛还原酶aldd、羟基酸还原酶dhat三个基因,获得halomonas bluephagenesis tdp129ab。
44.本发明的第八方面,提供了一种上述的嗜盐菌的制备方法,包括将halomonas bluephagenesis、halomonas campaniensis或halomonas aydingkolgenesis进行artp诱变和/或低盐压力筛选。
45.本发明的第九方面,提供了一种上述的嗜盐菌或重组菌在生产pha中的应用。
46.本发明的第十方面,涉及一种pha生产过程中单体组分调节的方法,所述的方法包括以非相关碳源和/或相关碳源作为碳源,在适当的条件下发酵生产pha。
47.本发明所述的方法以非相关碳源(如葡萄糖)或者其与相关碳源的混合作为碳源,在低盐培养基(含盐量5
‑
20g/l)中发酵生产pha。同时,通过使用的具体碳源以及比例的不同,自由调节pha中各单体的比例。该方法工艺温和、成本低廉、对设备要求低、生产环境简单,最重要的是,由于盐含量低,水和菌体的比重差较大,下游废水处理成本极低,设备简单,且相同条件下能够实现更好的分离效果,可实现大规模工业化生产。
48.本文所提及的pha是指聚羟基脂肪酸酯,其根据单体组成可以分为均聚物和共聚物。根据单体的碳原子数,本发明的pha可以是短链pha(即,单体为c3
‑
c5的羟基脂肪酸)或者中长链pha(即,单体为c6
‑
c18的羟基脂肪酸),但不限于此。本发明方法中合成的pha可以为均聚物、共聚物或其组合。在本发明的一些实施方式中,pha可以是均聚物,包括但不限于聚羟基丙酸酯、聚羟基丁酸酯(phb)、聚羟基戊酸酯等等,例如,聚
‑3‑
羟基丁酸酯(phb)、聚
‑4‑
羟基丁酸酯(p4hb)、聚
‑3‑
羟基丙酸酯(p3hp)或聚
‑3‑
羟基戊酸酯(p3hv)等。在本发明的一些实施方式中,pha可以是共聚物,所述共聚物可以是二聚物、三聚物,但不限于此,例如,共聚物可以是羟基丙酸酯与羟基丁酸酯的共聚物;羟基丙酸酯与羟基戊酸酯的共聚物;羟基丁酸酯与羟基戊酸酯的共聚物;羟基丙酸酯、羟基丁酸酯、羟基戊酸酯三者的共聚物等等。更具体地,其可以是聚(3
‑
羟基丁酸酯
‑
co
‑4‑
羟基丁酸酯)(p3hb4hb)、聚(3
‑
羟基丁酸酯
‑
co
‑3‑
羟基戊酸酯)(p3hb3hv)、聚(3
‑
羟基丁酸酯
‑
co
‑4‑
羟基丁酸酯
‑
co
‑3‑
羟基戊酸酯)(p3hb4hb3hv)等等。
附图说明
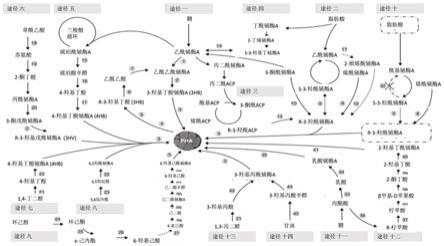
49.以下,结合附图来详细说明本发明的实施例,其中:图1:各种pha产品涉及的代谢通路。
具体实施方式
50.本发明在以下的实施例中进一步说明。这些实施例只是为了举例说明的目的,而
不是用来限制本发明的范围。
51.除非另外指出,本文中所用术语具有本领域技术人员理解的一般技术含义。
52.以下反应中所用的化学物质都是可商购的产品,除非另外指明。
53.本文所提及的产品纯度,诸如p3hb4hb含量(wt%),为p3hb4hb的质量与参与酯化的冰干菌体质量的百分比,其中p3hb4hb质量为酯化后得到的3hb和4hb总质量。
54.本文所提及的产品回收率即破壁、纯化收集后冰干菌体的质量与发酵产物直接冰干后菌体的比值。
55.本文中标注“plasmid”为质粒载体过表达基因,标注“chromosome”为基因组整合过表达基因。
56.halomonas bluephagenesis td01(td01)是在tdh4基因组上编辑聚羟基脂肪酸酯pha合成酶基因phac获得的。td01ab是td01经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。
57.halomonas bluephagenesis td68(td68)是在tdh4基因组上编辑4
‑
羟基丁酰辅酶a转移酶基因orfz获得的。td68ab是td68经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。
58.halomonas bluephagenesis td68
‑
194(td68
‑
194)是在tdh4基因组上编辑琥珀酸半醛脱氢酶基因sucd、4羟基丁酸脱氢酶基因4hbd和4
‑
羟基丁酰辅酶a转移酶基因orfz获得的。td68
‑
194ab是td68
‑
194经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。
59.halomonas bluephagenesis ty194(简称ty194)是在tdh4基础上进行了改造,提高了3hb含量,同时加入3hv和4hb相关碳源后可以合成p(3hb
‑
co
‑
4hb
‑
co
‑
3hv)。具体在halomonas bluephagenesis tdh4
‑
δphap基因组上敲除了prpc基因,同时在基因组上过表达了scpab基因。ty194ab是ty194经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。其功能与ty194类似,加入3hv和4hb相关碳源后可以合成p(3hb
‑
co
‑
4hb
‑
co
‑
3hv)。可参考文献chromosome engineering of the tca cycle in halomonas bluephagenesis for production of copolymers of 3
‑
hydroxybutyrate and 3
‑
hydroxyvalerate (phbv)(chen y, chen x, ye j, et al., metabolic engineering, 2019, 54,69
‑
82.)halomonas bluephagenesis tdhx(简称tdhx)是在tdh4基础上进行了改造,提高了3hb含量,同时加入hhx相关碳源后可以合成phbhhx。具体在halomonas bluephagenesis tdh4
‑
δphap基因组上过表达了phac基因,同时敲除了脂肪酸降解基因fada和fadb。加入hhx相关碳源后可以合成phbhhx。tdhxab是tdhx经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。其功能与tdhx类似,加入hhx相关碳源后可以合成phbhhx。可参考文献engineering the diversity of polyesters(meng d, shen r, yao h, et al., current opinion in biotechnology, 2014, 29, 24
‑
33)。
60.halomonas bluephagenesis tdp129(简称tdp129)是在tdh4基础上进行了改造,提高了3hb含量,同时加入3hp相关碳源后可以合成p(3hb
‑
co
‑
3hp)。具体在halomonas bluephagenesis tdh4
‑
δphap基因组上过表达了pcs、aldd、dhat三个3hp合成相关基因,最高可以合成3hp摩尔比为40%的p(3hb
‑
co
‑
3hp)。tdp129ab是tdp129经过两轮artp诱变与低
盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。其功能与tdp129类似,加入3hp相关碳源后可以合成p(3hb
‑
co
‑
3hp)。可参考文献hyperproduction of 3
‑
hydroxypropionate by halomonas bluephagenesis(jiang x, yan x,yu l, et al., nature communications, 2021, 12,1513
‑
1526)。
61.所有菌株后ab代表对应原始菌株的低盐版本,即菌株经过两轮artp诱变与低盐压力筛选后,获得的可以在低盐培养基中生长并积累pha的菌株。
62.本文所提及的培养基:基础培养基:是指适用于培养微生物并适合该微生物利用向培养基中添加的碳源合成聚羟基脂肪酸酯的培养基,这样的培养基比如mm培养基、lb培养基、矿物质培养基等等,但不限于此。这些培养基的配方是本领域技术人员常规知晓的,并且本领域技术人员可以常规地对其组分或组分浓度进行适当地调整。在本文中,除特殊说明外,用于培养微生物以合成目的产物的培养基或基础培养基是指液体培养基。
63.lb液体培养基的一般配方为:4
‑
6g/l酵母提取物,8
‑
12g/l蛋白胨,8
‑
12g/l nacl,其余为蒸馏水(ph调至7.0
‑
7.2);优选为:5g/l酵母提取物,10g/l蛋白胨,10g/l nacl,其余为蒸馏水(ph调至7.0
‑
7.2)。
64.mm液体培养基的一般配方为:0.1
‰‑2‰
(nh4)2so4或者尿素,0.1
‰‑1‰
mgso4,5
‰‑
10
‰
na2hpo4·
12h2o,0.5
‰‑2‰
kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4
‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o微量) (ph调至约9.0)。优选为:0.1%(nh4)2so4或者0.2%尿素,0.02% mgso4,1.0%na2hpo4·
12h2o,0.15%kh2po4,不超过0.1%的其他微量元素(fe(iii)
‑
nh4
‑
citrate,cacl2·
2h2o,znso4·
7h2o,mncl2·
4h2o,h3bo3,cocl2·
6h2o,cuso4·
5h2o,nicl2·
6h2o,namoo4·
2h2o)(ph调至约9.0)。
65.10lb培养基:5g/l酵母提取物,10g/l蛋白胨,10g/l nacl,其余为蒸馏水;调ph值至7.0
‑
7.2;然后高压蒸汽灭菌。
66.10mmg培养基:配制酵母提取物的nacl溶液,酵母提取物浓度为1g/l,nacl浓度为10g/l;溶解后高压灭菌;冷却后每50ml溶液加入1ml组分i(向10g(nh4)2so4和2g mgso4加蒸馏水定容至200ml,然后高压蒸汽灭菌)和1ml组分ii(向96.5gna2hpo4·
12h2o和15g kh2po4加蒸馏水定容至200ml,然后高压蒸汽灭菌);最后用5m的naoh水溶液将体系的ph值调整为约9.0。
67.60lb培养基:5g/l酵母提取物,10g/l蛋白胨,60g/l nacl,其余为蒸馏水;调ph值至7.0
‑
7.2;然后高压蒸汽灭菌。
68.60mmg培养基:配制酵母提取物的nacl溶液,酵母提取物浓度为1g/l,nacl浓度为60g/l;溶解后高压灭菌;冷却后每50ml溶液加入1ml组分i(向10g(nh4)2so4和2g mgso4加蒸馏水定容至200ml,然后高压蒸汽灭菌)和1ml组分ii(向96.5gna2hpo4·
12h2o和15g kh2po4加蒸馏水定容至200ml,然后高压蒸汽灭菌);最后用5m的naoh水溶液将体系的ph值调整为约9.0。
69.本文所提及的artp诱变与低盐压力筛选:诱变载气为氦气,进气量1 slm,机器工作功率115w,照射1
‑
10min。低盐设置0,5,7,10四个盐浓度梯度,仅在10g/l的压力条件下晒得目的菌株。
70.实施例1:低盐培养基培养生产含phb的嗜盐菌菌体,并从发酵液中提取纯化pha本发明通过在嗜盐菌(见表1)中加入葡萄糖为碳源,在菌体自身的pha合酶(phac)作用下自身代谢产生3hb
‑
coa聚合成phb。
71.将td01、td01ab、tdh4p、tdh4abp、td68、td68ab、td68
‑
194与td68
‑
194ab分别在10lb中,与td01、tdh4p、td68与td68
‑
194分别在60lb培养基中37℃,200 rpm,培养12小时后,分别按1%接种至50ml 10mmg以及60mmg培养基中,同时加入30g/l的葡萄糖作为碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表1所示:表1各种halomonas bluephagenesis低盐重组菌合成pha(phb)的情况结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高。
72.实施例2:低盐培养基培养生产含p3hb4hb的嗜盐菌菌体,并从发酵液中提取纯化
pha本发明通过在halomonasbluephagenesistd中引入了4
‑
羟基丁酰辅酶a转移酶(orfz)来合成4hb
‑
coa,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa共聚成p(3hb
‑
co
‑
4hb)。
73.将td01、td01ab、tdh4p、tdh4abp、td68、td68ab、td68
‑
194与td68
‑
194ab分别在10lb中,与td01、tdh4p、td68与td68
‑
194分别在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml10mmg以及60mmg培养基中,同时加入5g/l的γ
‑
丁内酯作碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表2所示:表2各种halomonasbluephagenesis低盐重组菌合成p3hb4hb的情况结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的
环境,同时,细胞干重及产物pha含量均大幅提高,更重要的是,提高了聚合物中4hb单体的含量。
74.实施例3:低盐培养基中提高嗜盐菌发酵液p3hb4hb的含量和细胞干重。(以halomonasbluephagenesistdh4p系列为例)本发明通过在halomonasbluephagenesistd01中引入了4
‑
羟基丁酰辅酶a转移酶(orfz)来合成4hb
‑
coa,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa共聚成p(3hb
‑
co
‑
4hb)。在此基础上,进行了artp诱变与低盐压力筛选,并且在质粒上和基因组上分别过表达了罗氏真养杆菌来源pha合酶(phac)、β
‑
酮硫解酶(phaa)、nadh型乙酰乙酰辅酶a还原酶(phab),的最终成功在获得了可以在低盐培养基中生长并积累大量pha的菌株。干重和pha含量均得到提高。
75.将tdh4p、tdh4abp、tdh4abp+phacab(plasmid)与tdh4abp+phacab(chromosome)在10lb中,与tdh4p在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml10mmg以及60mmg培养基中,同时加入5g/l的γ
‑
丁内酯作碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表3所示:表3各种halomonasbluephagenesistdh4p低盐重组菌合成p3hb4hb的情况结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高,更重要的是,提高了聚合物中4hb单体的含量。
76.实施例4:低盐培养基培养生产含p(3hb
‑
co
‑
4hb
‑
co
‑
3hv)的嗜盐菌菌体,并从发酵液中提取纯化pha。
77.本发明通过在halomonasbluephagenesistd01中引入了4
‑
羟基丁酰辅酶a转移酶(orfz)来合成4hb
‑
coa,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa共聚成p(3hb
‑
co
‑
4hb)。此外还引入了甲基丙二酰辅酶a易位酶scpa和scpb、琥珀酸脱氢酶组成因子sdha和sdhe。在前面工作的基础上上,进行了artp诱变与低盐压力筛选,最终获得了可以在低盐培养基中生长并积累大量pha的菌株。
78.将ty194、ty194ab在10lb中,与ty194、ty194ab在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml10mmg以及60mmg培养基中,同时加入5g/l的γ
‑
丁内酯和5g/l的丙酸作碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表4所示:表4各种halomonasbluephagenesisty194重组菌合成p(3hb
‑
co
‑
4hb
‑
co
‑
3hv)的情况结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高,更重要的是,提高了聚合物中4hb及3hv单体的含量。
79.实施例5:低盐培养基培养生产含phbhhx的嗜盐菌菌体,并从发酵液中提取纯化pha。
80.本发明通过在halomonasbluephagenesistd01中引入了烯酰辅酶a水合酶、反式烯酰辅酶a还原酶、3
‑
羟基丁酰辅酶a脱氢酶来合成hhx
‑
coa,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa共聚成p(3hb
‑
co
‑
hhx)。在前面工作的基础上上,进行了artp诱变与低盐压力筛选,最终获得了可以在低盐培养基中生长并积累大量pha的菌株。
81.将tdhx、tdhxab在10lb中,与tdhx、tdhxab在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml10mmg以及60mmg培养基中,同时加入5g/l的油酸作hhx相关碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表5所示:表5各种halomonasbluephagenesistdhx重组菌合成phbhhx的情况
结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高,更重要的是,提高了聚合物中hhx单体的含量。
82.实施例6:低盐培养基培养生产含p(3hb
‑
co
‑
3hp)的嗜盐菌菌体,并从发酵液中提取纯化pha。
83.本发明通过在halomonas bluephagenesis td01中引入了3
‑
羟基丙酰辅酶a转移酶(pcs)来合成3hp单体,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa共聚成p(3hb
‑
co
‑
3hp)。在前面工作的基础上上,进行了artp诱变与低盐压力筛选,最终获得了可以在低盐培养基中生长并积累大量pha的菌株。
84.将tdp129、tdp129ab在10lb中,与tdp129、tdp129ab在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml 10mmg以及60mmg培养基中,同时加入5g/l的丙酸作为3hp相关碳源,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表6所示:表6各种halomonas bluephagenesis tdp129重组菌合成p(3hb
‑
co
‑
3hp)的情况
结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高,更重要的是,提高了聚合物中3hp单体的含量。
85.本领域技术人员应该理解,尽管参照上述实施例对本发明进行了具体的描述,但是本发明并不限于这些具体的实施例。基于本发明所教导的方法和技术方案,在不背离本发明的精神的前提下,本领域技术人员能够进行适当的修改或改进,由此所得的等价实施方案都在本发明的范围内。
86.实施例7:低盐培养基培养halomonas campaniensis ls21 cgmcc no.6593生产phb本发明通过在halomonas campaniensis ls21 cgmcc no.6593中进行诱变获得ls21p菌株,以在低盐培养基中生长,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa聚合成phb。在前面工作的基础上上,进行了artp诱变与低盐压力筛选,最终获得了可以在低盐培养基中生长并积累大量pha的菌株。
87.将ls21、ls21p在10lb中,与ls21、ls21p在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml 10mmg以及60mmg培养基中,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表7所示:表7各种halomonas campaniensis重组菌合成p(3hb
‑
co
‑
3hp)的情况
结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高。
88.实施例8:低盐培养基培养halomonas aydingkolgenesis m1 cgmcc no.19880生产phbv本发明通过在halomonas aydingkolgenesis m1 cgmcc no.19880中进行诱变获得m1p菌株,以在低盐培养基中生长,并在菌体自身的pha合酶(phac)作用下与自身代谢生产的3hb
‑
coa聚合成phb。在前面工作的基础上上,进行了artp诱变与低盐压力筛选,最终获得了可以在低盐培养基中生长并积累大量pha的菌株。
89.将m1,m1p在10lb中,与m1,m1p在60lb培养基中37℃,200rpm,培养12小时后,分别按1%接种至50ml 10mmg以及60mmg培养基中,培养48小时。48小时后收集菌体,检测细胞干重和pha含量,每组实验设三个平行样,结果取均值。结果如下表8所示:表8各种halomonas aydingkolgenesis重组菌合成p(3hb
‑
co
‑
3hp)的情况
结果显示,经过artp诱变与低盐压力筛选后的菌株可以更好的适应低盐培养基的环境,同时,细胞干重及产物pha含量均大幅提高。
90.本领域技术人员应该理解,尽管参照上述实施例对本发明进行了具体的描述,但是本发明并不限于这些具体的实施例。基于本发明所教导的方法和技术方案,在不背离本发明的精神的前提下,本领域技术人员能够进行适当的修改或改进,由此所得的等价实施方案都在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1