一种高特异性识别APE1的寡核苷酸适配体APT-D1及其制备方法和应用
一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1及其制备方法和应用
技术领域
1.本发明属于分子生物医药技术领域,具体涉及一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1及其制备方法和应用。
背景技术:
2.脱嘌呤脱嘧啶核酸内切酶1/氧化还原因子1(apurinic/apyrimidinic endonuclease1/redox factor
‑
1,ape1/ref
‑
1,后文简称ape1)是一种参与碱基切除修复(ber)途径的多功能酶。ape1能够特异性识别并切割位点脱嘌呤嘧啶位点(ap位点),从而进行dna的修复过程,可准确去除受损碱基,并保证基因组完整性。ape1的失调被证明与多种癌症有关,ape1在大多数恶性肿瘤中高表达或胞浆异位表达,被认为是恶性肿瘤的重要标志物。ape1与肿瘤的发生、发展及预后相关,可能成为极具潜力的肿瘤基因治疗的新靶点。
3.指数富集的配基系统进化技术,简称selex(systematic evolution of ligands by exponential enrichment)技术,是近十几年迅速发展起来的高通量生物文库筛选技术。应用大容量的随机寡核苷酸适配体文库(ssdna或rna),结合实时荧光pcr技术,筛选出逐步富集的寡核苷酸,经反复体外筛选、扩增,最终获得与靶标分子结合呈高特异性、高亲和力的寡核苷酸适配体。
4.核酸适配体是在体外通过指数富集的配基系统进化技术(selex)从人工合成的dna或rna文库中筛选出来的一小段寡核苷酸,具有高亲和力强特异性结合靶标分子的优点,并且适配体分子量小,免疫原性低,化学修饰性强,应用领域广等。消减筛选是通过去除与非目标靶蛋白识别的一系列寡核苷酸,筛选出与非目标靶蛋白不结合但与目标靶蛋白特异性结合的寡核苷酸,然后再将其应用到后序实验中。这样将消减筛选应用到复合靶标筛选中会大大降低筛选难度,从而提高成功率。
5.现有技术大多是基于elisa的方法使用抗体来检测血清中的ape1,但是抗体尺寸大、生产成本高、批间差异大、免疫原性高、热稳定性差,而适配体具有低免疫原性、组织穿透力强、易于化学合成与修饰等优势,且与其靶标的结合具有较好亲和力和特异性,可像抗体一样实现肿瘤的免疫治疗,但是现在没有针对ape1的适配体被筛选出来。
6.本课题组首次以ape1为靶标,通过selex技术筛选特异性核酸适配体,采用pcr法监测筛选过程,通过对适配体亲和力和特异性分析,表明适配体apt
‑
d1与ape1具有良好的亲和力和特异性,进一步验证了适配体apt
‑
d1与结直肠癌血清具有良好的亲和力和特异性。
技术实现要素:
7.针对上述现有技术中存在的问题,本发明的目的在于设计提出一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1及其制备方法和应用。应用包括作为试剂盒的组成部分或检测指标和制备生物传感器,用于癌症的早期辅助诊断或进行癌症相关疾病发生、发展进程
相关的基础研究。
8.为了实现上述发明目的,本发明提供以下技术方案:
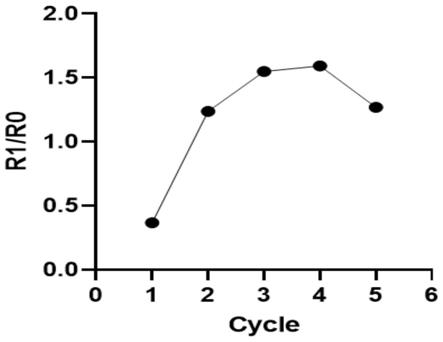
9.一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1,其特征在于所述寡核苷酸适配体apt
‑
d1的核苷酸序列如seq id no.1所示。
10.所述的一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1,其特征在于所述寡核苷酸适配体apt
‑
d1包括磷酸骨架修饰、截断、延长、颠换,或对核酸适配体碱基进行化学修饰,或在序列上结合生物素、地高辛、荧光物质及纳米发光材料或者酶标记。或在所述寡核苷酸适配体apt
‑
d1的5’端或3’端结合生物素。
11.所述的一种高特异性识别ape1的寡核苷酸适配体apt
‑
d1,其特征在于所述寡核苷酸适配体apt
‑
d1还包括以下任一序列:
12.(1)与所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1同源性在80%以上的核苷酸序列;
13.(2)与所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1核苷酸序列进行杂交的序列;
14.(3)所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1核苷酸序列转录的rna序列。
15.一种任一所述的高特异性识别ape1的寡核苷酸适配体apt
‑
d1的制备方法,其特征在于所述制备方法包括通过体外合成或pcr扩增。
16.一种任一所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1在制备治疗癌症疾病药物中的应用,所述癌症疾病包括结直肠癌、肺癌、宫颈癌、和乳腺癌。
17.一种任一所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1在抑制ape1的dna损伤修复功能中的应用。
18.一种任一所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1在制备癌症诊断试剂盒或生物传感器中的应用。
19.一种任一所述高特异性识别ape1的寡核苷酸适配体apt
‑
d1在制备判断癌症分期或分型药物、癌症诊断试剂中的应用。优选利用所述试剂中的寡核苷酸适配体apt
‑
d1,采用q
‑
pcr方法对ape1相关癌症进行辅助性判断,即根据是否与血清有特异性结合,如有特异性结合则可判断为ape1相关癌症,如没有特异性结合,则可判断为其他组织。
20.一种抗癌药物,其特征在于所述药物的有效成分包含任一所述的高特异性识别ape1的寡核苷酸适配体apt
‑
d1。同时核酸适配体自身具有的抑制特性还可直接作为抗肿瘤药及肿瘤药物增效剂。
21.一种试剂盒,其特征在于包含任一所述的高特异性识别ape1的寡核苷酸适配体apt
‑
d1。
22.本发明具有以下有益效果:
23.本发明利用基于磁珠的靶标消减selex首次筛选出了所述寡核苷酸适配体apt
‑
d1,经验证apt
‑
d1能够特异性结合ape1,且进一步鉴定,apt
‑
d1可以显著区分部分在血清中过分泌ape1的癌症病人血清(如直肠癌病人血清、结肠癌病人血清)与正常人血清或者其他癌症血清。
24.本发明寡核苷酸适配体apt
‑
d1与ape1作用的平衡解离常数(kd)为1.306
±
0.1418nm,因此可将所述寡核苷酸适配体apt
‑
d1作为结肠癌血清、直肠癌血清等血清中过
表达ape1的癌症病人血清的检测试剂,用于多种癌症的辅助检测、靶向治疗或者进行癌症疾病的发生、发展、进程相关的基础研究等。
25.本发明寡核苷酸适配体apt
‑
d1及截短适配体d1
‑
1(seq id no.5ctgtcaacgctttacctagccggtcgtgtgggggtcccca)、d1
‑
2(seq id no.6tagcaatggtacggtacttccctgtcaacgctt)、d1
‑
3(seq id no.7tacctagccggtcgtgtgggggtccccacaaaagtgcacgctactttg)均可以不同程度抑制ape1的酶活性,进而抑制ape1的dna损伤修复功能。
26.本发明所述寡核苷酸适配体apt
‑
d1能够简单、迅速、灵敏的识别、结合并抑制ape1。适用于临床前癌症的辅助诊断、肿瘤生物导向、直接治疗或作为肿瘤药物辅助药物进行治疗,具有广泛的临床应用前景和基础应用前景。
附图说明
27.图1为寡核苷酸适配体筛选结合比监测图,其中,binding ration结合比代表与ape1结合的寡核苷酸适配体摩尔数与投入文库摩尔数的比例;
28.图2为每轮筛选的正反筛保留比,其中r1/r0=每一轮的正筛保留率/反筛保留率;
29.图3为ape1候选寡核苷酸适配体apt
‑
d1与ape1结合的kd解离常数;
30.图4为ape1候选寡核苷酸适配体apt
‑
d1与ape1结合的特异性验证;
31.图5为ape1候选寡核苷酸适配体apt
‑
d1与癌症血清ape1结合的特异性验证;
32.图6为ape1候选寡核苷酸适配体apt
‑
d1对ape1活性抑制作用鉴定;
33.图7为ape1候选寡核苷酸适配体apt
‑
d1及其截断适配体d1
‑
1、d1
‑
2、d1
‑
3对ape1活性抑制作用鉴定。
具体实施方式
34.以下将通过实施例和附图对本发明作进一步说明。但是不能把它们理解为对本发明保护范围的限定。
35.本发明提供了一种特异性结合ape1的寡核苷酸适配体apt
‑
d1,所述寡核苷酸适配体apt
‑
d1的核苷酸序列如seq id no.1所示:ctatagcaatggtacggtacttccctgtcaacgctttacctagccggtcgtgtgggggtccccacaaaagtgcacgctactttgctaa,可用于ape1的检测与活性抑制。
36.本发明优选通过指数富集的配基系统进化技术(systemic evolution of ligands by exponential enrichment,简称selex)筛选获得所述寡核苷酸适配体apt
‑
d1的序列,具体的以ape1为正筛靶标,以his
‑
tag为反筛靶标,经过多轮反复孵育,洗脱,扩增,从随机文库中筛选出出多条寡核苷酸适配体序列,通过对这些寡核苷酸适配体序列进行序列比对和同源性分析,确定出4条寡核苷酸适配体序列进行特异性和亲和力验证;首先进行候选适配体与靶标ape1结合的平衡常数的测定,再用ape1、his
‑
tag、空磁珠对候选适配体进行特异性验证,最后鉴定了候选适配体对其靶标ape1的抑制作用。结果发现寡核苷酸适配体apt
‑
d1表现出对靶标ape1强亲和力和特异性的特性,同时还鉴定出寡核苷酸适配体apt
‑
d1与结直肠癌血清具有很强的特异性和亲和力,最后通过native
‑
page实验检测表明寡核苷酸适配体apt
‑
d1及其截短适配体d1
‑
1、d1
‑
2、d1
‑
3均可以有效抑制ape1发挥dna损伤修复功能,阻止ape1识别并切割含有ap位点的dna双链。
37.实施例1:寡核苷酸适配体apt
‑
d1的制备
38.(1)构建初始寡核苷酸文库(seq id no.2):
39.5'
‑
ctatagcaatggtacggtacttcc
‑
(40n)
‑
caaaagtgcacgctactttgctaa
‑
3',其中n代表a,t,c,g中任意碱基。
40.上游引物:p7 primer(seq id no.3,5
′‑
ctatagcaatggtacggtacttcc
‑3′
);
41.下游引物:p11 primer(seq id no.4,5
′‑
ttagcaaagtagcgtgcacttttg
‑3′
);
42.生物素标记下游引物:bio
‑
p11:5'
‑
biotin
‑
ttagcaaagtagcgtgcacttttg
‑
3';
43.以上序列均购自上海生工生物工程股份有限公司。
44.(2)配制pcr扩增体系
45.q
‑
pcr体系:taq hs(0.1μl),10
×
pcr(2μl),dntp mix(0.4μl),eva(1μl),depc water(13.1μl),p7引物(10μm)0.2μl,bio
‑
p11引物(10μm)0.2μl;充分震荡混合,17μl/管进行分装。
46.普通pcr体系:taq hs(0.1μl),10
×
pcr(2μl),dntpmix(0.4μl),depc water(14.1μl),p7引物(10μm)0.2μl,bio
‑
p11引物(10μm)0.2μl;充分震荡混合,17μl/管进行分装。
47.(3)实验所用溶液配制
48.正反筛靶标溶液配制:ape1溶液(0.125mg/ml);6
×
his
‑
tag溶液(0.1mg/ml)。
49.pbs(0.01m):nacl 8.0g;kcl 0.2g;na2hpo41.44 g;kh2po40.24 g;加蒸馏水至1000ml,调节ph到7.4(用na2hpo4或kh2po4调节)。
50.t
‑
pbs(1%):2ml tween 20加入到上述配制好的200ml pbs溶液中,分装后120℃高压灭菌20min。
51.封闭液:蔗糖0.2g;酪蛋白0.025g;bsa0.025 g;加灭菌后的0.01m的pbs缓冲液至20ml,震荡超声。
52.hepes:hepes 5.9575g;nacl 2.922g;mgcl20.047605g;kcl 0.1864g;cacl20.0555g,加ddh2o至500ml,用naoh调节ph至7.4。
53.t
‑
hepes(0.1%):10μl tween 20加入到上述配制好的10mlhepes溶液中,分装后121℃高压灭菌20min。
54.t
‑
hepes(0.05%):100μltween 20加入到上述配制好的200mlhepes溶液中,分装后121℃高压灭菌20min。
55.(4)文库的处理
56.步骤(1)所述的寡核苷酸文库用depc水溶解,95℃变性10min,冰浴5min,室温5min,使ssdna形成特定的三维空间结构。
57.(5)磁珠活化
58.用1ml mes(mes 1.564g溶于500ml超纯水中)溶液洗涤磁珠(purimag biotech,pmag016)三遍,加入edc(50mg/ml)混匀后,加入nhs(50mg/ml),室温旋转孵育30min,弃上清,用mes溶液洗涤3遍。
59.(6)反筛
60.活化的羧基琼脂糖磁珠与6
×
his
‑
tag在hepes缓冲液中室温孵育0.5h。加入封闭液封闭0.5h,t
‑
hepes(0.05%)洗3次。将随机文库ssdna加入到磁珠
‑6×
his
‑
tag复合物中,37℃孵育1h。收集不与磁珠
‑6×
his
‑
tag复合物结合的ssdna,用于下一步正筛。向磁珠
‑6×
his
‑
tag中加入1ml t
‑
hepes(0.1%)洗1遍,1ml hepes洗1遍。向磁珠
‑6×
his
‑
tag中加入150μlhepes,95℃高温变性后迅速冰浴,收集变性下来的ssdna溶液,标记为
‑
1mb。
61.(7)正筛
62.ape1和步骤(1)中收集的ssdna上清于37℃孵育1h后与活化后的磁珠室温孵育1h。收集与磁珠
‑
ape1结合的ssdna。向磁珠
‑
ape1中加入t
‑
hepes(0.1%)洗1遍,hepes洗1遍。向磁珠
‑
ape1中加入150μlhepes,95℃高温变性后迅速冰浴,收集变性下来的ssdna溶液,标记为+1mb。
63.(8)q
‑
pcr检测
64.并依次从
‑
1mb、+1mb中取3μl加到q
‑
pcr体系中,通过实时荧光pcr仪进行扩增,检测得到正、反筛的ct值,计算各自筛选保留率。
65.(9)单链制备
66.步骤(2)+1中的ssdna进行普通pcr扩增,分别扩增15、18、21、24、27、30轮后停止扩增。扩增后的dsdna进行2%琼脂糖凝胶电泳,确定最佳扩增轮数,扩增剩余+1ssdna。用扩增后的双链和包被链霉亲和素的琼脂糖羧基磁珠于37℃下孵育0.5h,加5%的甲酰胺,40℃水浴5min,重复3次,加碱溶液于95℃高温加热后迅速冰浴,收集变性下来的ssdna,即为下一轮使用的次级库。
67.(10)重复步骤(1)~(3),分别收集第二轮结合到磁珠
‑
ape1复合物和磁珠
‑6×
his
‑
tag复合物上的ssdna,检测得到第二轮的回收率和正、反筛的ct值,并计算各自筛选保留率。
68.(7)重复步骤(4)和(5),前5轮筛选pcr监测结果如图1、图2所示,第3轮正筛保留率最高(如图1所示)且正反筛保留比(r1/r0=每一轮的正筛保留率/反筛保留率)与第四轮相当(如图2所示),电泳检测没有杂带说明筛选成功。最后将富集筛选出的第3轮次级库送上海生工进行高通量测序。测序结果通过序列分析比对,挑选得到寡核苷酸适配体apt
‑
d1,所述寡核苷酸适配体apt
‑
d1的核苷酸序列如seq id no.1所示。
69.实施例2:通过q
‑
pcr法检测寡核苷酸适配体apt
‑
d1与ape1的结合能力
70.配制等体积不同浓度梯度(0nm、5nm、12.5nm、20nm、50nm、100nm和200nm)的寡核苷酸适配体apt
‑
d1,根据实施例1所述的方法与ape137℃旋转孵育1h,随后与活化磁珠室温继续旋转孵育1h形成复合物。用1ml含有0.1%吐温
‑
20的筛选buffer洗1次,以去除与非靶标蛋白非特异结合的寡核苷酸适配体,95℃变性,收集上清,进行与实施例1相同的q
‑
pcr分析,将相对荧光强度rfu(1/ct
×
103)作为监测指标,结果如图3所示,得到寡核苷酸适配体apt
‑
d1的平衡解离常数(kd)为1.306
±
0.1418nm。
71.实施例3:通过q
‑
pcr法验证寡核苷酸适配体apt
‑
d1与ape1的特异识别
72.将适配体apt
‑
d1进行浓度比例稀释至25nm,分别与ape1、his
‑
tag和筛选buffer于37℃旋转孵育1h,随后与磁珠室温旋转孵育1h。用1ml含有0.1%吐温
‑
20的筛选buffer洗1次,以去除与非靶标蛋白非特异结合的寡核苷酸适配体,95℃变性,收集上清,进行q
‑
pcr监测,将rfu(1/ct
×
103)作为监测指标。结果如图4所示,寡核苷酸适配体apt
‑
d1对ape1具有强特异性结合能力。
73.实施例4:通过q
‑
pcr法验证寡核苷酸适配体apt
‑
d1与结、直肠癌血清的特异识别
74.(1)血清收集来自秦皇岛市第一医院。取10例健康人血清,15000g,4℃离心30min,
去除血清中的红细胞,收集血清。肺癌、结肠癌、直肠癌、浸润性乳腺癌血清处理过程同前。
75.(2)将适配体apt
‑
d1进行浓度比例稀释,分别与肺癌血清、结肠癌血清、直肠癌血清、浸润性乳腺癌血清、健康人血清于37℃旋旋转孵育1h,随后与磁珠在室温旋转孵育1h。
76.(3)用1ml含有0.1%吐温
‑
20的筛选buffer洗1次,以去除与非靶标蛋白非特异结合的寡核苷酸适配体,95℃变性,收集上清,进行q
‑
pcr分析,将rfu(1/ct
×
103)作为监测指标。结果如图5所示,据调查血清ape1蛋白相关癌症结、直肠癌血清中阳性(结、直肠癌血清)rfu均值明显高于阴性(健康人血清)与浸润性乳腺癌rfu均值,因此适配体apt
‑
d1对血清中的ape1具有强特异性结合能力,可用于相关癌症的检测。
77.实施例5:基于native
‑
page检测apt
‑
d1及其裁断适配体d1
‑
1、d1
‑
2、d1
‑
3对ape1酶活性抑制作用
78.(1)上样:首先制备10%native
‑
page胶,同时将ap
‑
p1、p2两条dna单链退火形成一条带有ap位点的双链,然后按照p2;ap双链;ap双链+ape1;ap双链+ape1+梯度浓度的apt
‑
d1(100nm;200nm;400nm;800nm;1.2μm;1.6μm)上样顺序上样.
79.(2)电泳:电泳液是1
×
tbe电泳液,设置恒压120v,时间为30min.
80.(3)照胶:量取30ml电泳液,加入3μl核酸染料,闭光染胶,照胶。结果如图6所示,随着apt
‑
d1浓度的增加,ap双链(底物)的条带越来越亮,说明了寡核苷酸适配体apt
‑
d1可以明显抑制ape1切割ap双链,因此可以将apt
‑
d1视为ape1的抑制剂。
81.(4)裁断适配体d1
‑
1、d1
‑
2、d1
‑
3对ape1酶活性抑制作用检测方法同上。上样顺序为:ap双链+ape1;ap双链+ape1+apt
‑
d1;ap双链+ape1+d1
‑
1;ap双链+ape1+d1
‑
2;ap双链+ape1+d1
‑
3。结果如图7所示,泳道2345的条带明显亮于泳道1的条带,说明寡核苷酸适配体apt
‑
d1及其裁断适配体d1
‑
1、d1
‑
2、d1
‑
3均可以明显抑制ape1切割ap双链。其中截短适配体d1
‑
1(seq id no.5ctgtcaacgctttacctagccggtcgtgtgggggtcccca)、d1
‑
2(seq id no.6tagcaatggtacggtacttccctgtcaacgctt)、d1
‑
3(seq id no.7tacctagccggtcgtgtgggggtccccacaaaagtgcacgctactttg)。
82.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1