一种基于mSNP技术检测大白菜种子纯度的混样检测方法与流程
一种基于msnp技术检测大白菜种子纯度的混样检测方法
技术领域
1.本发明属于种子纯度检测领域,具体涉及一种基于msnp技术检测大白菜种子纯度的混样检测方法。
背景技术:
2.大白菜(brissica campestris l.ssp.pekinesis)又名结球白菜、黄芽菜、白菜,属于十字花科芸苔属。大白菜起源于我国,已有五千多年的栽培历史,种质资源丰富,生态类型多样,是我国主要的传统蔬菜之一。20世纪70年代,杂种优势的利用在大白菜新品种选育中占主导地位,取得了丰硕成果。为了在短时间内培育出优良的新品种,育种家会选择少数优质的骨干亲本,使品种的遗传基础不断趋于狭窄。品种的差异直接影响生产,大白菜杂交种中常有亲本自交系种子或其他品种种子造成的生物学混杂。种子纯度是种子质量的主要指标,定义为本品种的种子数占供检本作物样品种子数的百分率,必需对杂交种的纯度进行鉴定后才能包装出售。
3.种子纯度鉴定从80年代以来,从常规的形态特征鉴定到物理化学鉴定,发展到生化鉴定,再进一步发展应用到分子标记鉴定,实现了由表观水平、蛋白质水平到核酸水平的发展。形态鉴定是应用最早的方法,根据种子形态、幼苗形态和植株的形态进行鉴定。传统的田间形态鉴定是种子纯度鉴定的仲裁方法,此方法可以参考的形态多、结果较为可靠,但是所需周期长,花费大且易受季节、环境和人为因素等限制。物理化学鉴定主要用于区分燕麦品种,在大白菜鉴定中罕见报道。生化鉴定包括同工酶和蛋白质电泳技术。生化标记具有组织特异性、可用的谱带较少、谱带的差异有限且在不同器官、不同生长时期带型差异不稳定,导致结果的稳定性和准确性降低,不能满足越来越多品种检测的要求。分子标记是继形态、生化标记之后发展迅速的标记技术,具有不易受时期环境影响、多态性好、结果准确等优点。分子标记可分为三大类:一是以酶切为基础的标记技术,如rflp,多态性稳定但操作复杂、成本好、多态性较少;二是以pcr反应为基础的标记技术,如rapd、ssr、scar等,此类标记成本低、操作简便但稳定性较差;三是酶切和pcr相结合的技术,如aflp,该标记兼具rflp和rapd的优点,有较高的可靠性和高效性、dna用量少,但是操作步骤繁琐,成本费用较高。
技术实现要素:
4.本发明的目的在于克服现有技术的缺陷,提供一种基于msnp技术检测大白菜种子纯度的混样检测方法,其高效、准确、成本低。
5.为了实现上述目的,本发明采取的技术方案如下:
6.技术方案一:
7.一种于msnp技术的大白菜种子纯度检测的引物组,其特征在于,其包括引物对1f/r、引物对2f/r、引物对3f/r、引物对4f/r、引物对5f/r、引物对6f/r、引物对7f/r、引物对8f/r、引物对9f/r、引物对10f/r、引物对11f/r、引物对12f/r、引物对13f/r、引物对14f/r、引物对15f/r、引物对16f/r、引物对17f/r、引物对18f/r、引物对19f/r、引物对20f/r、引物对
21f/r、引物对22f/r;其中每条引物对均由正向引物和反应引物组成;
8.所述引物对1f/r中,f引物的序列seqidno.1所示,r引物的序列如seqidno.2所示;
9.所述引物对2f/r中,f引物的序列seqidno.3所示,r引物的序列如seqidno.4所示;
10.所述引物对3f/r中,f引物的序列seqidno.5所示,r引物的序列如seqidno.6所示;
11.所述引物对4f/r中,f引物的序列seqidno.7所示,r引物的序列如seqidno.8所示;
12.所述引物对5f/r中,f引物的序列seqidno.9所示,r引物的序列如seqidno.10所示;
13.所述引物对6f/r中,f引物的序列seqidno.11所示,r引物的序列如seqidno.12所示;
14.所述引物对7f/r中,f引物的序列seqidno.13所示,r引物的序列如seqidno.14所示;
15.所述引物对8f/r中,f引物的序列seqidno.15所示,r引物的序列如seqidno.16所示;
16.所述引物对9f/r中,f引物的序列seqidno.17所示,r引物的序列如seqidno.18所示;
17.所述引物对10f/r中,f引物的序列seqidno.19所示,r引物的序列如seqidno.20所示;
18.所述引物对11f/r中,f引物的序列seqidno.21所示,r引物的序列如seqidno.22所示;
19.所述引物对12f/r中,f引物的序列seqidno.23所示,r引物的序列如seqidno.24所示;
20.所述引物对13f/r中,f引物的序列seqidno.25所示,r引物的序列如seqidno.26所示;
21.所述引物对14f/r中,f引物的序列seqidno.27所示,r引物的序列如seqidno.28所示;
22.所述引物对15f/r中,f引物的序列seqidno.29所示,r引物的序列如seqidno.30所示;
23.所述引物对16f/r中,f引物的序列seqidno.31所示,r引物的序列如seqidno.32所示;
24.所述引物对17f/r中,f引物的序列seqidno.33所示,r引物的序列如seqidno.34所示;
25.所述引物对18f/r中,f引物的序列seqidno.35所示,r引物的序列如seqidno.36所示;
26.所述引物对19f/r中,f引物的序列seqidno.37所示,r引物的序列如seqidno.38所示;
27.所述引物对20f/r中,f引物的序列seqidno.39所示,r引物的序列如seqidno.40所示;
28.所述引物对21f/r中,f引物的序列seqidno.41所示,r引物的序列如seqidno.42所示;所述引物对22f/r中,f引物的序列seqidno.43所示,r引物的序列如seqidno.44所示。
29.进一步的,引物对1f/r~22f/r由msnp技术获得。
30.技术方案二:
31.一种根据上述的引物组检测大白菜种子纯度的混样检测方法,其包括如下步骤:
32.步骤1、选材:选取1个或多个大白菜品种;每份份大白菜样品至少采用96粒种子;
33.步骤2、对大白菜基因组dna进行准确定量;
34.步骤3、将所述的引物组中进行引物合成,每个引物对中的正向引物和反向引物合成时,均合成10条带有不同目标标签的引物;然后按照指定的标签组合进行引物的混合制备引物混合液;
35.步骤4、以大白菜基因组dna为模板,用引物混合液分别对大白菜的基因组dna进行一轮pcr扩增,获得目标区域;
36.步骤5、将所获得的pcr扩增产物,进行等量混合;
37.步骤6、混合后的产物进行片段筛选;
38.步骤7、对筛选后所得体系中的单链dna进行消化;
39.步骤8、对消化后的产物进行纯化;
40.步骤9、在步骤8中获得的体系中配置二轮pcr体系;
41.步骤10、对二轮pcr产物进行纯化,完成测序文库的制备;
42.步骤11、将测序文库等质量混合后上机测序,获得测序数据;
43.步骤12、对获得的测试数据,再次根据标签组合将样本拆分开;
44.步骤13、识别测试样目标位点的基因型结果,通过位点基因型情况判定种子的纯度。
45.进一步的,引物对中的正向引物和反向引物合成时,均合成10条带有不同目标标签的引物;
46.每个引物对的标签组合中,所述正向引物的标签序列与所述反向引物的标签序列不同。
47.进一步的,步骤3中,每个引物对中,合成的10条带有标签的正向引物中的标签序列分别如seqidno.49~58所示;
48.每个引物对中,合成的10条带有标签的反向引物中的标签序列分别如seqidno.59~68所示。
49.进一步的,每对引物对合成的10条带有标签的引物对中,正向引物和反向引物的标签组合方式选自表1中的任意一种或几种。
50.表1:标签组合方式
51.52.[0053][0054]
进一步的,步骤3中,引物对1f/r~22f/r中的f引物还包括f端通用引物,所述f端通用引物的序列如seqidno.45所示;引物对1f/r~22f/r中的r引物还包括r端通用引物,所述r端通用引物的序列如seqidno.46所示;
[0055]
步骤9中、二轮pcr所用的frimer f的序列如seqidno.47所示,
[0056]
所用的primer r的序列如seqidno.48所示。
[0057]
更进一步的,当大白菜品种为多个时,所述primer r的序列还包括用于区别大白菜品种的条形码序列。
[0058]
进一步的,步骤2中,每个引物对的标签组合中,所述正向引物的标签序列与所述反向引物的标签序列不同。
[0059]
进一步的,在步骤1中,采用大白菜种子基因组dna提取试剂盒对大白菜种子的基因组dna进行提取。
[0060]
进一步的,在步骤4中,所述一轮pcr扩增体系:引物混合液8μl;dna用量100ng;3*t
酶15μl;加水补足45μl;
[0061]
所述一轮pcr扩增程序:95℃3min;(95℃30s,60℃4min,72℃30s)28个循环;72℃4min。
[0062]
进一步的,在步骤6中,混合后的产物进行片段筛选,具体操作如下:
[0063]
步骤6.1、加入一轮pcr体积0.4倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,取上清转移至新的管中;
[0064]
步骤6.2、加入一轮pcr体积0.6倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0065]
步骤6.3、添加一轮pcr体积0.9倍的磁珠悬浮液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0066]
步骤6.4、加入100μl的体积浓度为80%的乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤,用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净。
[0067]
在步骤7中,对筛选后所得体系中的单链dna进行消化,具体操作步骤为:
[0068]
步骤7.1、向所获产物中加入20μl水,混匀磁珠;
[0069]
步骤7.2、吸附磁珠,转移16μl上清至新的ep管中;
[0070]
步骤7.3、向体系中加入exo i 2μl,10
×
reaction buffer 2μl;
[0071]
步骤7.4、消化体系的消化程序为:37℃30min;85℃15min;
[0072]
在步骤8中,对消化后的产物进行纯化的具体操作步骤为:
[0073]
步骤8.1、加入0.9倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0074]
步骤8.2、添加等pcr体积的磁珠重悬液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0075]
步骤8.3、加入100μl的体积浓度为80%的乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤,用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净。
[0076]
进一步的,在步骤9中,所述二轮pcr体系:3*t酶10μl;primer f;primer r;h2o18μl;
[0077]
所述二轮pcr程序:95℃3min;(95℃15s,58℃15s,72℃30s)12个循环;72℃4min;
[0078]
进一步的,在步骤10中,对二轮pcr产物进行纯化,利用的是0.80倍的磁珠,具体操作如下:
[0079]
步骤10.1、加入0.8倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0080]
步骤10.2、添加等pcr体积的磁珠重悬液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0081]
步骤10.3、加入100μl的80%乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤,用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净;
[0082]
步骤10.4、加入23μl elution buffer,充分悬浮磁珠,室温静置2min以洗脱dna,将磁珠用磁铁吸附,所得到的上清dna溶液吸至一新的管中,获得测序文库;所述elution buffer为10mm tris
‑
hcl,ph 8.0
‑
8.5。
[0083]
与现有技术相比,本发明所取得的有益效果如下:
[0084]
msnp技术:本发明采用msnp技术,一个扩增子内对应多个snp,最大限度的利用了每个扩增子片段所获得的的信息,可以在扩增子不变的情况下检测到尽量多的snp变异。且这些snp之间可构成单倍型,提高了变异的检测效率。这样不仅可以采用msnp位点内和位点间的变异,而且还可以采用单倍型和snp两种方式进行检测,使得遗传变异的检测更加精细,提高了标记鉴定的准确度和灵敏度。本专利中采用了22对引物对,实际检测到的变异信息有100多个,有助于筛选出更多的符合需求的多态性位点用于纯度鉴定分析。与常规snp检测相比,减少了引物对数的使用,降低了成本。
[0085]
成本低:采用msnp技术,扩增子不变的情况下可以检测到更多的snp变异;采用一轮扩增后至少96个测试样产物混样检测的方案,减少二轮扩增工作量的同时降低了测序成本。
[0086]
高效:采用混样检测的方案,一轮扩增后至少96个检测样的产物混样进行后续的扩增和测序,可在一天时间内最多可完成1440粒种子的检测。与其他检测方法相比,操作简单,不用田间种植、不需要工作量大、检测难度大的实验操作等,可以快速进行种子纯度的检测工作。
[0087]
准确:本方法是利用测序技术直接读取单核苷酸多态,通过程序直接进行纯度结果的判读,结果直观,可靠,避免受种子发育期、及结果判读时主观因素的影响。
附图说明
[0088]
图1是本发明混样检测方法的流程图。
具体实施方式
[0089]
实施例1:特异性引物的获得方法
[0090]
本发明特异性引物的获得方法,具体为:
[0091]
利用大白菜的全基因组重测序数据,采用bwa
‑
mem(http://bio
‑
bwa.sourceforge.net/)回贴到大白菜参考基因组上,利用gatk(https://software.broadinstitute.org/gatk/)进行单核苷酸变异鉴定。
[0092]
鉴定出的单核苷酸变异位点集,筛选最小等位变异频率>0.02、杂合率<15%、缺失率<20%,将单核苷酸变异位点进行合并,筛选单核苷酸位点数位于2
‑
10的区段,即msnp(多聚单苷酸多态性)位点,相较于传统的snp(单核苷酸多态性)位点,msnp位点可最大限度的利用每个引物对所获得的信息,即在引物对不变的情况下检测到尽可能多的snp位点,且同一引物对内的所有snp还可以组合成单倍型,使其多态性更高。例如一个snp存在a/t两种变异,其可区分的多态为aa、at、tt共计3种,若检测的为msnp位点,假如一个引物对内有3个snp(a/t、g/t、c/a),则可以存在8种(agc、aga、ata、atc、tgc、tga、tta、ttc)多态。这使得遗传变异的检测更加精细,同时提高了标记鉴定的准确度和灵敏度。本专利筛选多态性比较高的区段共计43个。
[0093]
对43个目标区段进行引物设计,并对引物特异性进行筛选,共获得染色体特异引物22对,共计145个单核苷酸变异位点。从检测成本和实用角度综合考虑,同样按大白菜样本间5
‑
10%的多样性原则,我们最终选取22对引物混合进行大白菜种子纯度的检测,共计可检测140个左右snp位点。
[0094]
在本发明中,共计获得22组特异性引物对,即引物对1f/r~22f/r,引物对1f/r~22f/r的基因序列如seqidno.1~44所示。
[0095]
实施例2:大白菜种子纯度检测所用引物组
[0096]
大白菜种子纯度检测所用的引物组,包括引物对1f/r~22f/r,在引物对1f/r~22f/r中,不仅包括如seqidno.1~44所示特异性引物序列,还包括通用引物序列,引物对1f/r~22f/r中的f引物的f端通用引物序列如seqidno.45所示;引物对1f/r~22f/r中的r引物的r端通用引物的序列如seqidno.46所示;
[0097]
实施例3:引物混合液的获得方法:
[0098]
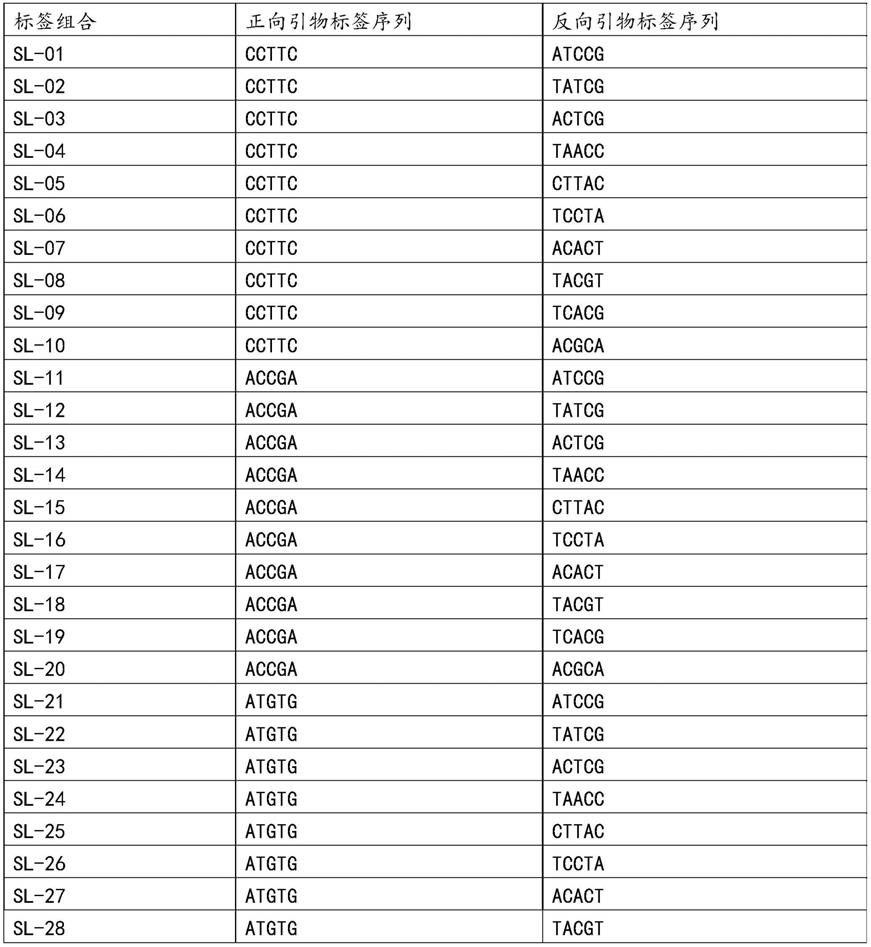
获得特异性引物后,设计特异的标签序列,再重新进行引物合成,此时引物合成时会添加上特异的标签序列,本实施例采用96组特异的标签组合,具体为:
[0099]
依据特定标签组合情况,将每条特异性引物合成10条带有不同目标标签的引物,带有目标标签的引物序列形式如表2所示,将带有目标标签的所有f(正向引物)和所有r(反向引物),每条引物取10μl,定容至10ml;每条引物的浓度0.1μm,本实施例共计制备出含有96组特异标签组合的引物对,即引物混合液;
[0100]
表2引物组
[0101][0102][0103]“ff”为f端通用引物序列,所述f端通用引物序列为aacgacatggctacgatccgactt,
如seqidno.45所示;
[0104]“rr”为r端通用引物序列,所述r端通用引物序列为ctaagaccgcttggcctccgactt,如seqidno.46所示。
[0105]
其中“yy”为标签序列,
[0106]
每个引物对中,合成的10条带有标签的正向引物中的标签序列分别为ccttc、accga、atgtg、aatgc、ttcgg、aaggt、cccat、atgga、acgat、ctctg,即分别如seqidno.49~58所示;
[0107]
每个引物对中,合成的10条带有标签的反向引物中的标签序列分别为atccg、tatcg、actcg、taacc、cttac、tccta、acact、tacgt、tcacg、acgca,即分别如seqidno.59~68所示。
[0108]
每对引物对合成的10条带有标签的引物对中,正向引物和反向引物的标签组合方式选自表2中的任意一种或几种。
[0109]
实施例4:纯种鉴定
[0110]
步骤1、材料的选取,选取2份大白菜(每份大白菜分别选取96粒种子),分别编号为18
‑
19和18
‑
20,提取大白菜种子的基因组dna,采用石家庄博瑞迪生物技术有限公司生产的大白菜种子基因组dna提取试剂盒对提取后的dna进行准确定量。
[0111]
步骤2、以大白菜种子基因组dna为模板,用引物混合液进行一轮pcr扩增,获得目标区域;
[0112]
所述一轮pcr扩增体系:实施例3获得的引物混合液8μl;dna用量100ng;3*t酶15μl;加水补足45μl。
[0113]
所述一轮pcr扩增程序:95℃3min;(95℃30s,60℃4min,72℃30s)28个循环;72℃4min。
[0114]
步骤3、将所获得的pcr扩增产物,进行等量混合,只有扩增产物为带有不同组合的特定标签才可进行混合,混合时直接按照体系1:1混合即可。等量混合后,对混合后的产物进行产物纯化即片段筛选,具体步骤为;
[0115]
步骤3.1、加入一轮pcr体积0.4倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,取上清转移至新的管中;
[0116]
步骤3.2、加入一轮pcr体积0.6倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0117]
步骤3.3添加一轮pcr体积0.9倍的磁珠悬浮液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0118]
步骤3.4加入100μl的体积浓度为80%的乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤。用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净;
[0119]
所述磁珠为:诺唯赞磁珠
[0120]
步骤4、对筛选后所得体系中的单链dna进行消化;
[0121]
在步骤3中获得的含磁珠的体系中,进行如下操作:
[0122]
步骤4.1、向所获产物中加入20μl水,混匀磁珠;
[0123]
步骤4.2、吸附磁珠,转移16μl上清至新的ep管中;
[0124]
步骤4.3、向上述体系中加入exo i 2μl,10*reaction buffer 2μl。
[0125]
步骤4.4、上述体系的消化程序为:37℃30min;85℃15min。
[0126]
步骤5、对消化后的产物进行纯化:
[0127]
步骤5.1、加入0.9倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0128]
步骤5.2、添加等pcr体积的磁珠重悬液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0129]
步骤5.3、加入100μl的体积浓度为80%的乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤。用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净。
[0130]
步骤6、在步骤5获得的体系中配置二轮pcr体系:
[0131]
在步骤5中获得的含磁珠的体系中,配置二轮pcr体系,进行二轮pcr扩增;
[0132]
所述二轮pcr体系:3*t酶10μl;primer f;primer r;h2o 18μl
[0133]
所述二轮pcr程序:95℃3min;(95℃15s,58℃15s,72℃30s)12个循环;72℃4min。
[0134]
所述primer f的序列如seqidno.47所示,为gaacgacatggctacgatccgactt;所述primer r的序列如seqidno.48所示,为tgtgagccaaggagttgttgtcttcctaagaccgcttggcctccgactt;
[0135]
由于本实施例采用的是2份大白菜品种,为了对样本进行区分,因此,primer r的序列除包括如seqidno.48所示的序列外,还包括唯一条形码序列barcode;
[0136]
带条形码的primer r的序列为:
[0137]
tgtgagccaaggagttgxxxxxxxxxxttgtcttcctaagaccgcttggcctccgactt;
[0138]
其中“xxxxxxxx”为用于识别样品的唯一条形码barcode,以区分样本。
[0139]
本实施例中2份大白菜品种样本的barcode序列分别为cggctaaa、tccccgtg;即分别如seqidno.69
‑
70所示。
[0140]
步骤7、利用0.80倍的磁珠对二轮pcr扩增产物进行纯化,完成测序文库的制备;
[0141]
步骤7.1加入0.8倍的磁珠,用移液器上下吹打混匀,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0142]
步骤7.2添加等pcr体积的磁珠重悬液,重悬磁珠,静置2min,用磁力架吸附,至溶液澄清,去除上清;
[0143]
步骤7.3加入100μl的体积浓度为80%的乙醇,用磁力架反复在不同的两面吸附磁珠,使磁珠得到充分的洗涤。用磁力架吸附2min,去除上清,室温放置至乙醇挥发干净。
[0144]
步骤7.4加入23μl elution buffer,充分悬浮磁珠,室温静置2min以洗脱dna。将磁珠用磁铁吸附,所得到的上清dna溶液吸至一新的管中,获得测序文库(elution buffer为10mm tris
‑
hcl,ph 8.0
‑
8.5);
[0145]
步骤8、将测序文库等质量混合后上机测序,获得测序数据。
[0146]
步骤9、识别目标dna的基因型结果,从96粒种子中分别选取检测合成的种子用于后续纯度的判断依据,通过多态性高的位点基因型情况判定这批种子的纯度,本实施例的检测结果见表3。
[0147]
表3检测结果
[0148]
样品编号自交种子数种子纯度结论18
‑
19396.74%同常规鉴定结果
18
‑
20396.77%同常规鉴定结果
[0149]
种子纯度程序判读原则:
[0150]
首先对每个位点是杂交/异交还是自交进行判断,判断标准:计算一批种子在每个位点基因型种类所占的比例。如果这个位点的基因型只有一种且纯合,这个位点舍弃,因为无法判断是自交还是杂交。如果一种杂合基因型的占比超过90%,判断为杂交;一个样本在这个位点的基因型是纯合就判断是自交;如果是其他杂合基因型就判断为异交。
[0151]
然后对样本进行自交、异交和杂交的判定。最后统计这批种子的整体情况。
[0152]
纯度计算,用一批种子纯度百分率表示:
[0153][0154]
以上所述实施方式仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域一般技术人员而言,在不背离本发明原理和精神的前提下对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1