一种可降解多环芳烃的硫酸盐还原菌的筛选方法
1.本发明涉及环境微生物技术领域,尤其涉及一种可降解多环芳烃的硫酸盐还原菌的筛选方法。
背景技术:
2.多环芳烃(polycyclic aromatic hydrocarbon,简称pahs下同)主要为石油污染、油轮泄露、汽车尾气、煤及石油等天然燃料的不完全燃烧产生的一类毒性极强的物质,是一类由两个或两个以上的苯环通过稠和键联接形成的有毒有机污染物。pahs具有较为稳定的化学结构及较强的疏水性,从而在环境中分布广泛且稳定存在,易造成高分子量的pahs大量积累。同时,pahs的脂溶性使得其很容易被动物吸收且难以排出,并能通过食物链在动植物体内逐级富集。由于大多数pahs具有“三致(致癌、致畸、致突变)”效应,对人类健康和生态环境具有很大的潜在危害。因此,近年来,去除环境中pahs的污染而引起了研究人员的广泛关注。
3.pahs具有极强的化学稳定性,去除难度较大,微生物降解技术由于处理成本低、见效快,无论从生态上还是从经济上均具有优势,在国内外倍受关注。菲作为研究pahs生物降解时的模式化合物,近几十年来,具有菲降解能力的好氧降解菌株相继报道,包括红球菌属(rhodococcus)、假单胞菌属(pseudomonas)、弧菌属(vibrio)、芽孢杆菌属(bacillus)以及微球菌属(micrococcus)等。然而,地下含水层或污染土壤通常是厌氧状态,使污染带中的好氧微生物被厌氧微生物所替代。因此,pahs的厌氧生物降解比好氧生物降解更加可行且经济有效。
4.硫酸盐还原菌(sulfate-reducing bacterium,简称srb,下同)是一类能将硫酸盐,其它氧化态硫化物以及单质硫作为电子受体异化有机物质的微生物,其广泛存在于我们的环境中,包括深层土壤、水稻土、海洋沉积物、地下水以及含硫沉积物等,因此srb可以用于修复多种厌氧环境中的污染物质,包括pahs。srb在受污染的厌氧区域的土壤以及地下水的修复中扮演着很重要的角色。
5.srb因其重要的作用而被很多研究者广泛的筛选,然而现有筛选所得的srb多为脱硫弧菌属(desulfovibrio),其对氧气和氧化还原电位敏感度不高,无法对厌氧区域pahs进行有效降解,制约了厌氧区域pahs污染土壤及地下水厌氧生物修复技术的进一步发展和应用研究。因此,分离驯化出pahs厌氧降解菌对于治理和修复pahs污染土壤及地下水有重要的意义。
技术实现要素:
6.为此,发明人对筛选可厌氧降解多环芳烃的硫酸盐还原菌的方法进行大量的研究后,发现现有方法无法筛选出pahs厌氧降解菌,关键原因在于现有方法中的培养基(如添加l-半胱氨酸、抗坏血酸和硫酸亚铁等成分的培养基)仅能降低培养基的氧化还原电位,培养基中仍含有的微量氧及不含有pahs,致使无法筛选出pahs的严格厌氧降解菌。
7.具体而言,本发明提供一种可降解多环芳烃的硫酸盐还原菌的筛选方法,包括:对含有硫酸盐还原菌群的样品进行富集培养,以得到富集菌液,而后通过叠皿夹层法对所述富集菌液进行厌氧培养;
8.在所述叠皿夹层法中,所使用的固体培养基中含有亚硫酸钠和l-半胱氨酸盐酸盐,且在厌氧条件下涂布多环芳烃和所述富集菌液。
9.本发明发现,通过对叠皿夹层法中所使用的固体培养基,以及涂布菌液时的条件进行上述优化后,降低培养基的氧化还原电位的同时脱除培养基中的微量氧,大幅改善srb的生长环境,从而能够高效分离出具有pahs降解能力的厌氧srb。
10.作为优选,所述亚硫酸钠的加入方式为:在厌氧条件下,将浓度50-150g/l的亚硫酸钠溶液滴加至固体培养基中使其溶氧为零及氧化还原电位小于-100mv;所述亚硫酸钠溶液的浓度优选为100
±
10g/l。
11.在一个具体的实施方案中,将所述亚硫酸钠溶液滴加至含有刃天青的固体培养基中,当其颜色变为无色时,表明固体培养基中氧溶量及氧化还原电位达到上述要求。
12.作为优选,所述l-半胱氨酸盐酸盐的加入方式为:在厌氧条件下,将浓度为50-150g/l的l-半胱氨酸盐酸盐溶液添加至所述固体培养基中,以1l固体培养基为基准,所述l-半胱氨酸盐酸盐溶液的添加量为2
±
0.5ml。所述l-半胱氨酸盐酸盐溶液的浓度优选为100
±
10g/l。由此,进一步将固体培养基的氧化还原电位降低至-200mv。
13.本发明进一步发现,向固体培养基中按上述方式加入亚硫酸钠和l-半胱氨酸盐酸盐,能够高效脱除固体培养基内残余的微量氧气,并使固体培养基的氧化还原电位降低到极低水平,在缩短筛选分离周期的同时,更有利于筛选出具有pahs降解能力的厌氧srb。
14.作为优选,所述多环芳烃包括萘、菲、苯并[a]蒽、苊、芴、芘中的一种或多种;优选为菲。
[0015]
作为优选,所述样品为石油污染的底层土壤;优选为地面20cm以下的土壤。本领域人员可根据常识确定上述样品内含有硫酸盐还原菌群。
[0016]
作为优选,所述富集培养包括:在厌氧条件下,将所述样品加入液体培养基中,并进行富集培养,以得到富集菌液。
[0017]
作为优选,所述液体培养基的制备方法包括:将nh4cl 0.5-0.7g/l,kh2po
4 0.5-0.7g/l,k2hpo
4 0.6-0.8g/l,na2so
4 2-3.5g/l,高压蒸汽灭菌121℃,20min;然后加入cacl
2 80-120g/l,mgcl
2 180-220g/l,fecl
2 40-60g/l和na2s 5-15g/l溶液1
±
0.2ml,nahco
3 40-60g/l溶液4
±
0.5ml,微量元素溶液10
±
1ml和维生素溶液2
±
0.5ml;
[0018]
其中,所述微量元素溶液的成分包括:
[0019]
cocl2·
6h2o 20-40mg/l,cucl
2 0.1-0.2mg/l,h3bo
3 5-6mg/l,mncl2·
4h2o 18-22mg/l,na2mo4·
h2o 2-3mg/l,nicl2·
2h2o 1-2mg/l,zncl
2 1.5-2.5mg/l;
[0020]
所述维生素溶液的成分包括:
[0021]
biotin 35-45mg/l,folic acid 35-45mg/l,pyridorine hd 180-220mg/l,riboflavin 90-110mg/l,tliamine 90-110mg/l,nicotinic acid 90-110mg/l,panto thenic acid 90-110mg/l,维生素b10-15mg/l,对氨基苯甲酸90-110mg/l,硫辛醇90-110mg/l;
[0022]
所述固体培养基含有所述液体培养基和1.5-2wt%的琼脂。
[0023]
在上述液体培养基和固体培养基的配制过程中,本领域人员能够依照常识判断是否需要对相应组分进行灭菌,和/或灭菌方法。
[0024]
作为优选,所述筛选方法还包括:
[0025]
将通过叠皿夹层法培养得到的菌落接种至含有多环芳烃的液体培养基内进行培养,而后对液体培养基中残余的多环芳烃的浓度进行测定和比较。由此,以筛选出具有优异pahs降解能力的硫酸盐还原菌。
[0026]
在一些优选的方案中,对培养4-6周后的液体培养基中残余的多环芳烃的浓度进行测定和比较。
[0027]
本领域人员能够依照常识知晓液体培养基中残余的多环芳烃的浓度的测定和比较方法。进一步优选的,所述测定方法:向液体培养基中加入等体积的二氯甲烷萃取2-4min,然后由高效液相色谱测定。高效液相色谱测定条件为:10μl的进样量,c18柱,(85-95):(5-15)的甲醇:水作为流动相,流动相的流速为0.5-1.5ml/min,检测波长为254nm,柱温箱温度为40
±
5.0℃。
[0028]
所述比较方法:在相同时间对添加菌落和未添加菌落的液体培养基中残余的多环芳烃的的浓度进行比较。更具体地,空白对照组测定的三次残余量与培养物测定的三次残余量利用minitab 17的双样品t检验完成,若p值小于0.05,则认为空白对照组和培养物残余的多环芳烃浓度之间存在着明显的差异,对应的培养物具有多环芳烃降解的能力。
[0029]
作为优选,所述筛选方法还包括:对筛选得到的菌落进行纯化和种类鉴定。
[0030]
其中,纯度及种类的鉴定方法为:利用天根细菌基因组dna提取试剂盒提取培养物的dna,然后将其16s rrna扩增后送往北京赛默百合生物科技有限公司进行测序,通过测序所得序列是否为单峰序列以及培养物的扫描电镜图片判断培养物是否为纯细菌,根据测序序列与ncbi数据库内序列的比对结果得到培养物的种类。
[0031]
16s rrna扩增方法为:利用引物27f和1492r用pcr仪扩增细菌的16s rrna区域,pcr程序为:95
±
2℃预变性4-6min,然后进入30个扩增循环,每个循环包括95
±
2℃变性40-80sec,最佳温度下退火40-80sec,72
±
2℃延伸40-80sec,最后在完成所有的循环后再在72
±
2℃延伸4-6min,最后保存在4℃直到使用。每个样品平行pcr三次,三次pcr产物混合在一块,然后通过琼脂糖电泳对其扩增序列的长度进行验证。
[0032]
作为优选,所述厌氧条件通过厌氧瓶和/或厌氧手套箱实现。
[0033]
具体地,本发明提供一种可降解多环芳烃的硫酸盐还原菌的筛选方法,包括:
[0034]
1)在厌氧条件下,将石油污染的底层土壤加入液体培养基中,并进行富集培养,以得到富集菌液;
[0035]
2)而后通过叠皿夹层法对所述富集菌液进行厌氧培养,在所述叠皿夹层法中,所使用的固体培养基中含有亚硫酸钠和l-半胱氨酸盐酸盐,且在厌氧条件下,优选在厌氧手套箱内,涂布多环芳烃和所述富集菌液;
[0036]
3)将通过叠皿夹层法培养得到的菌落接种至含有多环芳烃的液体培养基内进行培养,而后对液体培养基中残余的多环芳烃的浓度进行测定和比较;
[0037]
4)对筛选得到的菌落进行纯化和种类鉴定。
[0038]
为了减少样品与氧气的接触时间,以及缩短富集培养时间,本发明优选对所述样品进行以下预处理:
[0039]
将所述样品装入厌氧培养盒,然后放入装有干冰的泡沫箱,再将样品运送到实验室,并立即将样品转移入厌氧手套箱,并利用200目筛网将所述样品过筛磨细。
[0040]
作为优选方案,所述富集培养中:所述样品与液体培养基的重量体积比为(0.5-1)g:50ml;
[0041]
所述富集培养的条件包括:在28-32℃避光及100-200rpm下培养25-35天,而后按5-10%接种量转接至新的液体培养基中进行培养,所述转接次数为3-5次。
[0042]
本发明还提供通过上述筛选方法获得的可降解多环芳烃的硫酸盐还原菌。
[0043]
基于上述技术方案,本发明的有益效果如下:
[0044]
本发明方法进一步减少了固体培养基内残留的少量溶解氧,并在涂布硫酸盐还原菌时避免其短暂接触空气中的氧气,同时克服了硫酸盐还原菌空气一侧接触的环境氧化还原电位不够低的问题,从而能够高效的获取具有pahs降解能力的厌氧降解菌株,且该方法操作简单,具有广泛的应用前景。
附图说明
[0045]
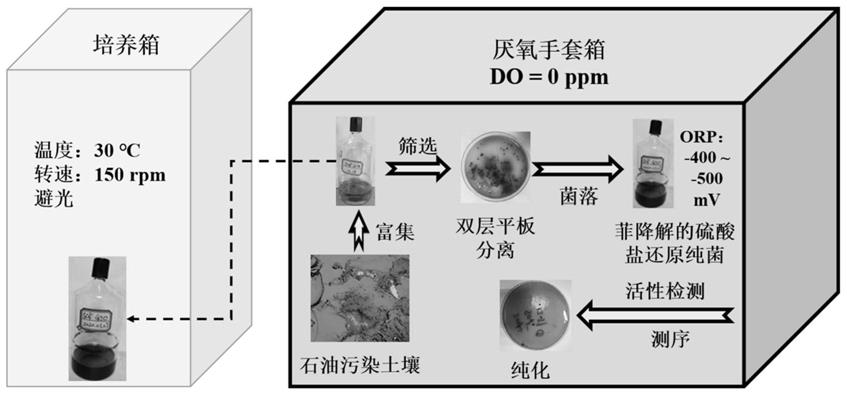
图1为本发明提供的可降解多环芳烃的硫酸盐还原菌的筛选方法的流程图。
[0046]
图2为采用本发明提供的方法筛选得到的菌落的平板图。
[0047]
图3为采用本发明提供的方法筛选得到的硫酸盐还原纯菌phes1的系统发育树。
[0048]
图4为采用本发明提供的方法筛选得到的硫酸盐还原纯菌phes2的系统发育树。
[0049]
图5为采用对比例1提供的方法筛选得到的硫酸盐还原纯菌s8的系统发育树。
[0050]
图6为采用本发明提供的方法筛选的硫酸盐还原菌和对比例1提供的方法筛选的硫酸盐还原菌的菲降解情况。
具体实施方式
[0051]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0052]
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
[0053]
实施例1
[0054]
如图1所示,可厌氧降解菲的硫酸盐还原菌的筛选方法包括:菲厌氧生物降解的硫酸盐还原菌群的富集,菌株的稀释涂布-厌氧手套箱与叠皿夹层法结合筛选,菌株的分离纯化,筛选所得硫酸盐还原纯菌降解菲和还原硫酸根能力的测定以及菌种的保藏。
[0055]
菲厌氧生物降解的硫酸盐还原菌群的富集:
[0056]
将50ml基础培养基加入容积为300ml的小口厌氧瓶中,然后抽真空1min,曝高纯氮气15min,用丁基胶塞将厌氧瓶密封后,在121℃及高压条件下灭菌20min,将厌氧瓶转入厌氧手套箱,去掉丁基胶塞,加入25mg/l的菲,敞口放置至液体培养基颜色由粉红色转为无色,加入通过灭菌的0.22μm膜过滤的且无氧的无机盐离子,微量元素以及维生素配置为液体培养基,然后在厌氧瓶内接种0.5g的过200目筛网的胜利油田受石油污染区域的土壤样品,再次用丁基胶塞将厌氧瓶密封,将厌氧瓶转移出厌氧手套箱,在避光的摇床内在30℃及150rpm条件下培养一个月,待富集液呈现墨汁色视为富集成功。取总体积5%(v/v)的培养
液转接到新鲜培养液中,反复5次。
[0057]
上述液体培养基的制备方法包括:将nh4cl 0.6g/l,kh2po
4 0.64g/l,k2hpo
4 0.7g/l,na2so
4 2.84g/l,蒸馏水1l,高压蒸汽灭菌121℃,20min。然后加入用灭菌后的0.22μm滤膜过滤的cacl
2 100g/l,mgcl
2 200g/l,fecl
2 50g/l和na2s 10g/l溶液1ml,nahco
3 50g/l溶液4ml,微量元素溶液10ml和维生素溶液2ml;其中:
[0058]
微量元素溶液配方为:cocl2·
6h2o 30mg/l,cucl
2 0.15mg/l,h3bo
3 5.7mg/l,mncl2·
4h2o 20mg/l,na2mo4·
h2o 2.5mg/l,nicl2·
2h2o 1.5mg/l,zncl
2 2.1mg/l;
[0059]
维生素溶液配方为:biotin 40mg/l,folic acid 40mg/l,pyridorine hd 200mg/l,riboflavin 100mg/l,tliamine 100mg/l,nicotinic acid 100mg/l,panto thenic acid 100mg/l,维生素b12 2mg/l,对氨基苯甲酸100mg/l,硫辛醇100mg/l。
[0060]
菌株的稀释涂布-厌氧手套箱与叠皿夹层法结合筛选:
[0061]
在上述液体培养基中加入1.7wt%琼脂粉制备得到固体培养基。将固体培养基在121℃及高压条件下灭菌20min后转入厌氧手套箱,利用加入200μl 100g/l的亚硫酸钠溶液的方式去除固体培养基内的残余的溶解氧(加入亚硫酸钠至含刃天青的培养基颜色由粉红色转化为无色),在每升固体培养基内加入2ml的100g/l的l-半胱氨酸盐酸盐溶液进一步降低固体培养基的氧化还原电位,然后将固体培养基倾注于多个平板内,待固体培养基凝固后在表面均匀涂布0.5mg的菲,然后在厌氧手套箱内涂布100μl的各稀释倍数的富集菌群,然后将另一份保存在90℃烘箱内的固体培养基转移入厌氧手套箱,待固体培养基温度降低到55℃后倾倒在在已涂布微生物的固体培养基之上,待上层固体培养基凝固后,盖上平板的上盖,将平板转移入厌氧手套箱内的培养箱在30℃及避光的条件下培养4周。将上层固体培养基去除,挑取边缘清晰的菌黑色菌落接种到多瓶含菲的液体培养基。
[0062]
菌株的分离纯化:
[0063]
利用天根细菌基因组dna提取试剂盒提取培养物的dna,然后将其16s rrna扩增后送往北京赛默百合生物科技有限公司进行测序,通过测序所得序列是否为单峰序列判断培养的微生物是否为纯细菌,根据测序序列与ncbi数据库内序列的比对结果得到培养的微生物的种类。16s rrna扩增方法为:利用引物27f和1492r用pcr仪扩增细菌的16s rrna区域,pcr程序为:95℃预变性5min,然后进入30个扩增循环,每个循环包括95℃变性60sec,最佳温度下退火60sec,72℃延伸60sec,最后在完成所有的循环后再72℃延伸5min,最后保存在4℃直到使用。每个样品平行pcr三次,三次pcr产物混合在一块,然后通过琼脂糖电泳对其扩增序列的长度进行验证。如培养物不纯,则继续利用新的稀释涂布-厌氧手套箱与叠皿夹层法结合筛选的方法进行培养物的第二次、第三次甚至更多次的筛选,直到培养物为纯菌为止。
[0064]
筛选所得的硫酸盐还原纯菌降解菲和还原硫酸根能力的测定:
[0065]
通过6周培养后的纯菌培养物和无生物的空白对照组残余的菲的浓度的比较获取的,残余的溶液内的菲由等体积的二氯甲烷通过整瓶萃取3min,然后由高效液相色谱测定。高效液相色谱测定条件为:10μl的进样量,c18柱,90:10的甲醇:水作为流动相,流动相的流速为1ml/min,检测波长为254nm,柱温箱温度为40℃。残余菲浓度的比较方法为空白对照组测定的三次残余量与培养物测定的三次残余量利用minitab 17的双样品t检验完成,若p值小于0.05,则认为空白对照组和纯菌培养物残余的菲浓度之间存在着明显的差异,对应的
纯菌具有降解菲的能力。硫酸根浓度由阴离子色谱测定,根据硫酸根浓度的变化判断菌株还原硫酸根的能力。
[0066]
菌种的保藏:
[0067]
利用斜管穿刺培育的方法获得带有培养菌丝状菌落的斜管,然后将其置于-80℃冰箱保藏。
[0068]
对比例1
[0069]
本对比例提供一种硫酸盐还原菌的筛选方法,其区别与实施例1的区别仅在于,向固体培养基中仅添加l-半胱氨酸盐酸盐,即在每升固体培养基内加入2.5ml的100g/l的l-半胱氨酸盐酸盐溶液使固体培养基的氧化还原电位降至低于-200mv。
[0070]
试验例
[0071]
将实施例1及对比例1筛选的菌种分别进行多环芳烃的降解试验。
[0072]
具体方法如下:将实施例1和对比例1筛选的菌种分别接种到含20-30mg/l浓度的菲的液体培养基,培养6周后,将初始样品和培养物通过等体积的二氯甲烷萃取,然后利用高效液相色谱测定它们的菲的浓度,利用菲浓度的变化判断筛选的菌株是否具有菲降解的能力。
[0073]
利用实施例1筛选的硫酸盐还原菌株phes1可以在6周内将78%的初始浓度为22.7mg/l的菲降解,硫酸盐还原菌株phes2可以在6周内将99%的初始浓度为22.9mg/l的菲降解。而利用对比例1筛选的硫酸盐还原菌株s8在6周内对初始浓度为22.6mg/l的菲的降解率几乎为零。
[0074]
同时本发明对专利文件cn 107058108b筛选分离的硫酸盐还原菌的多环芳烃降解效果进行了验证,即重复cn 107058108b实施例1的内容(其中所涉及的工艺参数均取右边端值)。结果显示,通过cn 107058108b记载的方法筛选分离得到菌种不具备菲降解的能力。
[0075]
结果表明:本发明方法筛选到的菌种具有降解多环芳烃的能力。
[0076]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1