一种以人源肠癌类器官筛选抗肠癌干细胞中药活性成分的方法
1.本发明涉及生物医药领域,尤其针对以肠癌干细胞为靶向的中药活性成分的筛选新方法。
背景技术:
2.大肠癌(colorectalcancer,crc)死亡率位居全球第二。由于人口老龄化速度的加快以及生活方式转变等各种原因,大肠癌的发病率呈快速上升且年轻化的趋势。极高的发病率和死亡率让结肠大肠癌成为社会的重大负担,严重危害着人类的健康。肠癌干细胞(crc-cscs)是肠癌起始、转移及耐药的根本原因,而肠癌患者死亡率高皆源于肠癌治疗中的耐药及复发、转移。crc-cscs的致瘤性已得到普遍共识,从人肠癌患者组织中分离的富含crc-cscs的上皮隐窝并在细胞外基质中离体培养,可构建出能够忠实再现原发肿瘤增殖性、转移性及耐药性的体外类器官模型。肠癌类器官具有显著的crc-cscs特异性分子标记物,如已报道的lgr5、dclk1、sox2、aldh1、nanog、oct4等。肠癌类器官(organoid)虽已被用于临床抗肿瘤药物疗效评估如化疗药、靶向药及免疫抑制剂,目前常用的评估方式为检测细胞活力,但未见通过检测特异性分子标记物进而靶向肿瘤干细胞进行抗crc-cscs药物特别是中药活性成分的筛选方法。目前虽有针对crc-cscs分子标记物开发的激酶抑制剂、单克隆抗体、car-t等抗crc-cscs的报道,但由于其毒副作用皆尚未获得美国fda批准进入临床研究。毒副作用低、价格便宜、多靶点作用的中药具有肯定的抗大肠癌功效,从中药筛选抗crc-cscs疗效确切的药效成分符合从全新的视角筛选我国中医药宝库中抗肠癌药物,为筛选抗crc-cscs中药建立新方法。
技术实现要素:
3.本发明基于现有技术不足,提供一种以肠癌干细胞为靶点应用人源肠癌类器官筛选中药活性成分的方法,通过筛选对肠癌干细胞具有抑制作用且诱导肠癌类器官凋亡的毒副作用低的中药有效成分,评估方法为类器官数量、生长抑制和活细胞数以及肠癌干细胞标记物分子的表达。
4.技术方案:1.从crc患者肠道活检标本中分离组织 肠镜或手术标本中取1mm3大小组织块后,放入预先准备好的含有primocin(500x)的d-pbs(不含ca
++
和mg
++
)储存液中,储存液没过组织块即可,于2h内送达实验室进行隐窝分离。
5.2.从组织中分离隐窝并计数。
6.2.1冰上解冻提前分装好的matrigel
®
。24孔板在37℃培养箱预热至少2h。
7.2.2将加入了primocin(500x)的d-pbs(不含ca
++
和mg
++
),含有15mmhepes和1%bsa的dmem/f-12置于冰上。
8.2.3在15ml离心管中,使用配置好的10ml预冷的d-pbs清洗组织样本,通过重力沉降组织(约5s),吸除上清液。
9.2.4重复上一步3次,最后1次吸除上清液时管中保留1ml液体。
10.2.5使用1ml无菌枪头将组织转移至一个1.5mlep管中。
11.2.6使用无菌眼科手术剪将组织剪碎成约5mm的小块,加入1mlgcdr重悬。
12.2.7将样品转移至新的15ml离心管中。
13.2.8再加入1mlgcdr清洗1.5mlep管,转移至装有样品的15ml离心管中。
14.2.9将15ml离心管中gcdr试剂补充至10ml,置于摇床上以37℃、中速(约40rpm)孵育60min。
15.2.10以290xg,离心5min,吸除上清液。
16.2.11加入1ml预冷的含有1%bsa的dmem,无菌枪头剧烈上下吹打20次后,将管中的样品通过70
µ
m细胞筛网转移至新的15ml离心管中。
17.2.12再使用1ml含有1%bsa的dmem润洗一遍旧的15ml离心管和细胞筛网。
18.3.隐窝-基质胶悬液铺板生长。
19.3.1计数。
20.a.取10
µ
l样品放在玻璃载玻片或培养皿表面上,使用倒置显微镜计数。
21.b.乘200以确定2ml样品中的隐窝总数。
22.c.计算25
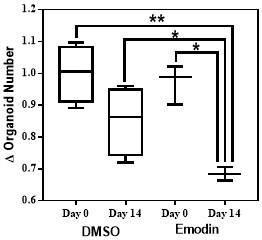
µ
l/孔中含有2000个隐窝能进行接种的孔数。
23.3.2离心200xg,5min,不破坏沉淀物前提下保留所需的上清液(根据上一步计算总体积数)。
24.3.3取出预热2h的24孔板,使用预先润湿的无菌枪头将样品与特殊的基质胶按1:1比例上下吹打10次以彻底混匀,注意避免气泡产生。
25.3.4使用提前润湿的200
µ
l无菌枪头取50
µ
l/孔体积的基质胶-隐窝悬液缓慢注入每孔中心。
26.3.5转移至37℃、5%co2饱和湿度的培养箱中培养30min等待基质胶完全凝固。此时从4℃冰箱拿出提前配置好的completeintesticulttmorganoidgrowthmedium培养液平衡至室温。
27.3.6在不破坏中心基质胶圆顶的前提下每孔加入750
µ
lcompleteintesticulttmorganoidgrowthmedium培养液及终浓度为10
µ
m的y-27632。
28.3.7在未使用的孔中加入无菌pbs(1ml/孔)。
29.3.8将24孔板放于37℃、5%co2饱和湿度的培养箱培养,每2天换一次completeintesticulttmorganoidgrowthmedium培养液。
30.4.给药。
31.类器官铺板培养约5-6d,待类器官分化成熟后,显微镜下计数并拍照,更换为含药培养基且每天更换一次含药培养基,期间定期拍照记录观察类器官变化。其中,所用药物及浓度如下:大黄素:10
µ
m(见实施示例1)、蟾毒灵:20nm,40nm(见实施示例2)。
32.5.药效总体评价及干细胞标记分子检测。
33.5.1关于肠癌类器官用药后对类器官数量及生长抑制、活细胞数的检测,其步骤如下。
34.a.将培养好的类器官如前所述接种入96孔细胞培养板,给药干预后,于收板前计数类器官数,拍照观察生长抑制情况。
35.b.采用calcein-am试剂检测用药后类器官活力及活细胞数:每孔加入终浓度为5
µ
m的calcein-am标记存活的类器官,放入37℃、5%co2饱和湿度的培养箱孵育。1h后使用酶标仪读值计算活细胞数,并于荧光显微镜下拍照。
36.5.2关于肠癌类器官中肿瘤干细胞标记分子klf4、lgr5、dclk1、sox2、cd133、aldh1、nanog、cd44、oct4表达的检测:移除旧培养基,加入1ml/孔的d-pbs,上下左右反复刮擦孔底并上下吹打10次充分破坏基质胶结构,转移至1.5ml离心管中,离心4℃,290xg,5min,弃上清。加入一定体积的裂解液重悬提取蛋白,离心4℃,10000rpm,10min;bca定量及变性。变性后进行聚丙烯酰胺凝胶电泳;转膜至pvdf膜上;封闭液封闭1-2h;洗膜,加入上述分子标记物一抗,使用β-actin/gapdh作为对照,在4℃震荡过夜,用含0.25%tween-20的tbst洗3次,每次5min,加入相应的辣根过氧化物酶标记的二抗(稀释倍数1:1000),室温孵育2h,tbst洗3次,每次5min,加入1:1的ecl发光液,用凝胶成像系统扫描并进行数据分析,计算分子标记物蛋白的表达量。
37.附图说明
38.附图1大黄素(emodin)显著抑制人源肠癌类器官(organoid)的生长注:与dmso组(对照)相比,于第7d大黄素干预后出现人源类器官的生长抑制,到第14d大黄素组人源肠癌类器官丧失类器官形态,降解为小细胞团。
39.附图2大黄素(emodin)显著降低人源肠癌类器官的数量注:与dmso组相比,10
µ
m大黄素给药干预14d后人源肠癌类器官数量显著降低,*p《0.05,**p《0.01。
40.附图3大黄素(emodin)显著降低人源肠癌类器官的活细胞数注:与dmso组相比,10
µ
m大黄素干预14d后人源肠癌类器官活细胞数显著降低,*p《0.05。
41.附图4大黄素(emodin)显著抑制人源肠癌类器官的干细胞活力注:10
µ
m大黄素给药干预14d后,calcein-am标记肠癌类器官的活细胞后荧光显微镜观察发现,与dmso组相比大黄素组人源肠癌类器官细胞活力显著降低、生长受到抑制。
42.附图5大黄素(emodin)显著抑制肠癌干细胞标记分子的表达注:大黄素干预14d后,收集类器官并进行蛋白印迹检测,结果表明大黄素显著降低了干细胞分子标记物如sox2/cd133/oct4的表达。
43.附图6蟾毒灵(bufalin)显著抑制人源肠癌类器官的生长注:与dmso组相比,于第6d大黄素(20nm,40nm)干预后出现人源类器官的生长抑制,到第11d蟾毒灵组人源肠癌类器官丧失类器官形态,并显著缩小,生长受到抑制。
44.附图7蟾毒灵(bufalin)显著降低人源肠癌类器官的数量注:与dmso组相比,40nm蟾毒灵于第2d干预后开始降低人源肠癌类器官的数量,到第9d两组大黄素干预后均出现人源肠癌类器官的数量降低,具有统计学意义(p《0.01)。
45.附图8蟾毒灵(bufalin)干预3d显著抑制肠癌干细胞标记分子的表达注:蟾毒灵干预3d后,收集类器官并进行免疫印迹检测,结果表明蟾毒灵显著降
低了干细胞标记分子cd133和aldh1的表达。
46.实施例1。
47.大黄素。
48.1.肠癌标本剪碎后使用d-pbs进行清洗,消化液中消化20 min 后离心重悬。
49.2.分离隐窝后计数,将200个隐窝每孔均匀平铺于96孔细胞培养板中,培养箱中凝固后加入培养基,培养箱中培养建立crc-pdos模型,每2天换液1次,每日于显微镜下观察其生长情况并拍照。
50.3.待类器官分化成熟后(约5-6 d),显微镜下计数后更换为含10
ꢀµ
m大黄素培养基,给药方法为每日更换新的含药培养基,给药后每3天拍照记录观察类器官生长情况。
51.4.大黄素组类器官出现显著的生长抑制及凋亡时,计数类器官后收板。calcein-am试剂检测用药后类器官活力及活细胞数:每孔加入终浓度为5
ꢀµ
m的calcein-am标记存活的类器官,放入37 ℃、5 % co2饱和湿度的培养箱孵育,1 h后荧光显微镜拍照并使用酶标仪检测发光值,计算活细胞数。
52.5. 癌类器官中肿瘤干细胞标记物klf4、lgr5、dclk1、sox2、cd133、aldh1、nanog、cd44、oct4表达的检测:充分破坏基质胶后将其转移至1.5 ml离心管中,离心弃上清后加入裂解液重悬提取蛋白,bca定量及变性后进行聚丙烯酰胺凝胶电泳,转膜后封闭1-2 h,洗膜后加入上述分子标记物一抗,使用β-actin/gapdh作为对照,在4 ℃震荡过夜后清洗,加入相应的辣根过氧化物酶标记的二抗(稀释倍数1:1000),室温孵育2h,加入1:1的ecl发光液,用凝胶成像系统扫描并进行数据分析,计算分子标记物蛋白的表达量。
53.6.显微镜观察可见大黄素组于第7 d出现生长抑制,肠癌类器官的隐窝结构模糊,于第11 d出现类器官结构崩塌,于第14 d出现类器官降解为散在性小细胞团,类器官结构消失(见图1)。大黄素干预14 d后类器官数量与干预第一天相比显著降低,与第一天对照组及第14 d对照组相比均具有显著性差异(见图2)。calcein-am标记后荧光显微镜发现大黄素显著降低类器官活细胞数(见图3和4)。蛋白印迹检测肠癌干细胞标记分子发现大黄素显著抑制sox2、cd133、oct4分子的表达(见图5),上述3种标记物分子与干细胞自我更新及干性维持相关,表明大黄素通过抑制人源肠癌类器官干性及自我更新相关分子从而达到抑制类器官生长。
54.实施例2。
55.蟾毒灵。
56.1.肠癌标本剪碎后使用d-pbs进行清洗,消化液中消化20 min 后离心重悬。
57.2.分离隐窝后计数,将200个隐窝每孔均匀平铺于96孔细胞培养板中,培养箱中凝固后加入培养基,培养箱中培养建立crc-pdos模型,每2 d换液1次,每日于显微镜下观察其生长情况并拍照。
58.3.待类器官分化成熟后(约5-6 d),显微镜下计数后更换为含20 nm和40 nm蟾毒灵培养基,给药方法为每日更换新的含药培养基,给药后每2 d拍照记录观察类器官生长情况。
59.4.蟾毒灵组类器官出现显著的生长抑制及凋亡时,计数类器官后收板。
60.5. 用calcein-am试剂检测类器官活力及活细胞数:每孔加入终浓度为5um的calcein-am标记存活的类器官,放入37 ℃、5 % co2饱和湿度的培养箱孵育,1 h后荧光显
微镜拍照并使用酶标仪检测发光值,计算活细胞数。
61.6. 癌类器官中肿瘤干细胞标记物klf4、lgr5、dclk1、sox2、cd133、aldh1、nanog、cd44、oct4表达的检测:充分破坏基质胶后将其转移至1.5 ml离心管中,离心弃上清后加入裂解液重悬提取蛋白,bca定量及变性后进行聚丙烯酰胺凝胶电泳,转膜后封闭1-2 h,洗膜后加入上述分子标记物一抗,使用β-actin/gapdh作为对照,在4 ℃震荡过夜后清洗,加入相应的辣根过氧化物酶标记的二抗(稀释倍数1:1000),室温孵育2 h,加入1:1的ecl发光液,用凝胶成像系统扫描并进行数据分析,计算分子标记物蛋白的表达量。
62.7.20 nm和40 nm蟾毒灵在干预6 d后表现出显著抑制人源肠癌类器官的生长,给药组体积较小,生长缓慢,随着给药时间的延长,于第11 d体积和数量均显著降低,40 nm组效果优于20 nm组(见图6)。calcein-am标记后荧光显微镜观察发现20 nm和40 nm蟾毒灵均显著降低类器官活细胞数,类器官降解为散在性小细胞团,类器官结构消失(见图7)。蛋白印迹检测肠癌干细胞标记分子发现蟾毒灵显著抑制cd133和aldh1分子的表达(见图8),表明蟾毒灵通过抑制人源肠癌类器官相关分子标记物从而达到抑制类器官生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1