促进干细胞增殖与繁殖之方法与流程
1.本揭示关于一种促进干细胞增殖之方法。详言之,本揭示提供一种使用免疫调节蛋白促进干细胞增殖之方法。
背景技术:
2.潜能干细胞(pluripotent stem cells)之特征为自我复制及分化之能力。干细胞通常藉由形态以及特征性标记物之存在来表征。干细胞分化可引起细胞形态之表型改变。干细胞分化亦可引起干细胞标记物或端粒酶活性之损失。干细胞分化可进一步促使获取三个胚胎胚层—外胚层、中胚层或内胚层中之一或多者所特有之标记物或形态。当前,使用消除分化细胞且促进未分化细胞扩增之培养试剂来繁殖未分化之富潜能干细胞。
3.然而,此项技术中需要开发一种促进未分化干细胞扩增之方法。
技术实现要素:
4.本揭示意外地发现灵芝(ganoderma)免疫调节蛋白或其重组体提供增殖或繁殖未分化干细胞且维持干细胞未分化之有益功效。
5.在一个态样中,本揭示提供一种增殖或繁殖未分化干细胞之方法,其包含使干细胞群体与有效量之灵芝免疫调节蛋白、其重组体或其片段接触。
6.在另一态样中,本揭示亦提供一种干细胞培养补充剂,其包含足以增殖或繁殖未分化干细胞之量的灵芝免疫调节蛋白、其重组体或其片段及化学成分确定之干细胞培养基。
7.在一个实施例中,本文所述之干细胞维持未分化。
8.在一个实施例中,本文所述之灵芝免疫调节蛋白或其重组体包含seq id no:3之氨基酸序列。在一个实施例中,灵芝免疫调节蛋白之重组体包含seq id no:4之氨基酸序列。在一个实施例中,灵芝免疫调节蛋白之片段包含选自由seq id no:1至2组成之群的氨基酸序列。
9.seq id no:1至4之序列如下列出。
[0010][0011]
在一个实施例中,灵芝免疫调节蛋白或其重组体或片段之量小于15μg/ml;较佳地,小于12.5μg/ml。在一些实施例中,灵芝免疫调节蛋白或其重组体或片段之量在约1.0μg/ml至约15μg/ml、约1.5μg/ml至约15μg/ml、约2.0μg/ml至约15μg/ml、约2.5μg/ml至约15μg/ml、约3.0μg/ml至约15μg/ml、约3.5μg/ml至约15μg/ml、约4.0μg/ml至约15μg/ml、约4.5μg/ml至约15μg/ml、约5.0μg/ml至约15μg/ml、约5.5μg/ml至约15μg/ml、约6.0μg/ml至约15μg/ml、约6.5μg/ml至约15μg/ml、约7.0μg/ml至约15μg/ml、约7.5μg/ml至约15μg/ml、约8.0μg/ml至约15μg/ml、约8.5μg/ml至约15μg/ml、约9.0μg/ml至约15μg/ml、约9.5μg/ml至约15μg/ml、约10.0μg/ml至约15μg/ml、约10.5μg/ml至约15μg/ml、约11.0μg/ml至约15μg/ml、约11.5μg/ml至约15μg/ml、1.0μg/ml至约12.5μg/ml、约1.5μg/ml至约12.5μg/ml、约2.0μg/ml至约12.5μg/ml、约2.5μg/ml至约12.5μg/ml、约3.0μg/ml至约12.5μg/ml、约3.5μg/ml至约12.5μg/ml、约4.0μg/ml至约12.5μg/ml、约4.5μg/ml至约12.5μg/ml、约5.0μg/ml至约12.5μg/ml、约5.5μg/ml至约12.5μg/ml、约6.0μg/ml至约12.5μg/ml、约6.5μg/ml至约12.5μg/ml、约7.0μg/ml至约12.5μg/ml、约7.5μg/ml至约12.5μg/ml、约8.0μg/ml至约12.5μg/ml、约1.5μg/ml至约10μg/ml、约1.5μg/ml至约8.5μg/ml、约1.5μg/ml至约8.0μg/ml、约1.5μg/ml至约7.5μg/ml、约1.5μg/ml至约7.0μg/ml、约1.5μg/ml至约6.5μg/ml、约1.5μg/ml至约6.0μg/ml范围内。在另一实施例中,灵芝免疫调节蛋白或其重组体或片段之量为约1.5μg/ml、约1.5625μg/ml、约3.0μg/ml、约3.125μg/ml、约6.25μg/ml或约12.5μg/ml。
[0012]
在一个实施例中,干细胞群体是人类来源的。
[0013]
在一个实施例中,干细胞群体包含诱导性富潜能干细胞(ips)群体、胚胎干细胞(es)群体、生殖细胞群体、组织特异性干细胞群体或成体干细胞群体。在一些实施例中,干细胞为胚胎干细胞、间叶干细胞(msc)、骨髓基质细胞、造血干细胞、脂肪来源干细胞、内皮干细胞、牙髓干细胞或神经干细胞。
[0014]
图式简单说明
[0015]
图1(a)及1(b)展示gmi对adsc增殖之作用。将adsc(5
×
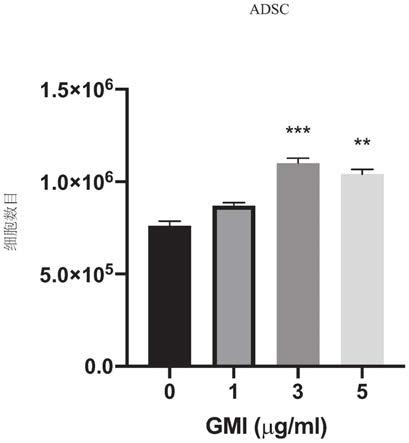
105个细胞)用不同浓度之gmi(0、1、3及5μg/ml)处理3天。在处理之后,收获细胞,且藉由血球计分析总细胞数目(b)。藉由光学显微镜拍摄相差影像(a)。一式三份地进行实验(n=3)。对比无gmi处理之对照细胞,**p《0.01及***p《0.001。
[0016]
图2展示在gmi处理之后adsc中之表面标记物之表现量的比较。将adsc(5
×
105个细胞)用不同浓度之gmi(0、1、3及5μg/ml)处理3天。在培育之后,收获细胞且用特异性msc阳性(cd29、cd146、cd166、cd106、cd90、cd105、cd73、cd44)及阴性(cd34、cd45、cd11b、cd19、hla-dr)表面标记物抗体染色。藉由流动式细胞测量术(bd accuri
tm c6 plus)分析结果。一式三份地进行实验(n=3)。
[0017]
图3(a)及3(b)展示对照adsc或经gmi处理之adsc中之分化能力。将adsc用不同浓度之gmi(0、3及5μg/ml)处理3天。在处理之后,将对照adsc(6
×
104个细胞)及经gmi处理之adsc(6
×
104个细胞)与生脂分化培养基一起培养21天(a)或与成骨分化培养基一起培养14天(b)。在所指示时间点拍摄adsc之相差影像。上图及中间图展示在生脂或成骨分化诱导之后改变的细胞形态。下图展示在生脂或成骨分化诱导之后的染色结果。成骨分化中比例尺等于100mm且生脂分化中等于50mm。
[0018]
图4(a)及4(b)展示gmi对bmsc增殖之作用。将bmsc(2
×
105个细胞)用不同浓度之gmi(0、1、3及5μg/ml)处理3天。在处理之后,收获细胞,且藉由血球计分析总细胞数目(b)。藉由光学显微镜拍摄相差影像(a)。一式三份地进行实验(n=3)。对比无gmi处理之对照细胞,*p《0.05及**p《0.01。
[0019]
图5展示在gmi处理之后bmsc中之表面标记物之表现量的比较。将bmsc(2
×
105个细胞)用不同浓度之gmi(0、1、3及5μg/ml)处理3天。在培育之后,收获细胞且用特异性msc阳性(cd29、cd146、cd166、cd106、cd90、cd105、cd73、cd44)及阴性(cd34、cd45、cd11b、cd19、hla-dr)表面标记物抗体染色。藉由流动式细胞测量术(bd accuri
tm c6 plus)分析结果。一式三份地进行实验(n=3)。
[0020]
图6(a)及6(b)展示对照bmsc或经gmi处理之bmsc中之分化能力。将bmsc用不同浓度之gmi(0、3及5μg/ml)处理3天。在处理之后,将对照bmsc(6
×
104个细胞)及经gmi处理之bmsc(6
×
104个细胞)与生脂分化培养基一起培养21天(a)或与成骨分化培养基一起培养14天(b)。在所指示时间点拍摄bmsc之相差影像。上图及中间图展示在生脂或成骨分化诱导之后改变的细胞形态。下图展示在生脂或成骨分化诱导之后的染色结果。成骨分化相片中比例尺等于100mm且生脂分化相片中等于50mm。
具体实施方式
[0021]
除非另外定义,否则本文中所用之所有技术及科学术语均具有与一般熟习本揭示所属技术者通常所理解之含义相同的含义。尽管与本文所述之彼等方法及材料类似或等效之方法及材料可用于实践或测试本揭示,但目前描述较佳方法及材料。本文所提及之所有公开案均以引用的方式并入本文中。
[0022]
在本技术案中,除非另外特定陈述,否则单数之使用包括复数,冠词“一(a/an)”意谓“至少一种”,且“或”之使用意谓“及/或”。
[0023]
如本文所用,“生长”是指尺寸、数目或体积变得更大、更长或更多或者增加之过程。
[0024]
如本文所用,“分化”是指使细胞或组织之组织或复杂性程度增加且伴有更专门之功能的发育过程。
[0025]
如本文所用,“有效量”意谓足以繁殖未分化干细胞且维持干细胞未分化之量。
[0026]
如本文所用,“个体”是指人类或非人类动物。
[0027]
如本文所用,“富潜能干细胞”是指可分化成形成身体器官、神经系统、皮肤、肌肉及骨架之三个胚胎胚层之全部细胞,但不分化成滋养层及胎盘之胚胎组分的细胞。
[0028]
如本文所用,“干细胞”是指具有能够自我更新(藉由细胞分裂而制得更多干细胞)之高增殖潜力的未分化细胞,其可产生可进行终末分化,分化成超过一种不同细胞表型之子细胞。
[0029]
如本文所用,“增殖”是指细胞生长且分裂产生子细胞且子细胞具有与该细胞相同之表型的过程。
[0030]
如本文所用,“繁殖”是指细胞群体藉由单细胞连续分裂成相同子细胞进行之扩增。
[0031]
如本文所用,“细胞培养”或“培养”是指细胞维持在人造(例如活体外)环境中。
[0032]
如本文所用,“细胞培养基”、“培养基(culture medium)”或“培养基(medium)”(及在各种情况下,复数种培养基)是指支持细胞培养及/或生长之营养组合物。
[0033]“化学成分确定之培养基”是指已知所有化学组分之适合于人类或动物细胞之活体外或活体外细胞培养的生长培养基。在一特定实施例中,化学成分确定之培养基完全不含动物来源组分且不含胎牛血清、牛血清白蛋白或人类血清白蛋白,因为此等产物来源于牛或人类来源且含有白蛋白与脂质之复杂混合物。
[0034]
意外地发现,干细胞与灵芝免疫调节蛋白或其重组体或片段一起培养可增殖或繁殖干细胞但不使其分化。亦即,灵芝免疫调节蛋白或其重组体或片段可增殖或繁殖未分化干细胞且在若干继代中维持其未分化。所得未分化干细胞是多潜能或富潜能的。
[0035]
因此,本揭示提供一种增殖或繁殖未分化干细胞之方法,其包含使干细胞群体与有效量之灵芝免疫调节蛋白或其重组体或其片段接触。
[0036]
干细胞之某些实施例包括胚胎干细胞、间叶干细胞(msc)、骨髓基质细胞、造血干细胞、脂肪来源干细胞、内皮干细胞、牙髓干细胞及神经干细胞。经工程改造之干细胞之一特定实施例为msc。
[0037]
灵芝免疫调节蛋白或其重组体或片段之制备已描述于us 7,601,808中。详言之,在us 7,601,808中,灵芝免疫调节蛋白称为gmi;灵芝免疫调节蛋白之重组体称为regmi;且灵芝免疫调节蛋白之片段称为seq id no:2及3。灵芝免疫调节蛋白或其重组体或片段的量小于15μg/ml,较佳12.5μg/ml。
[0038]
灵芝免疫调节蛋白或其重组体或片段可添加至包含必需矿质营养素、必需盐、必需氨基酸、一或多种补充剂及玻尿酸之化学成分确定之干细胞培养基中。示例性商购培养基包括经典调配物,诸如dmem、dmem:f12、rpmi及或其改良。
[0039]
另外,本揭示提供一种干细胞培养补充剂,其包含足以增殖或繁殖未分化干细胞之量的灵芝免疫调节蛋白、其重组体或其片段及化学成分确定之干细胞培养基。
[0040]
此项技术中已知用于活体外培养干细胞之化学成分确定之细胞培养基。灵芝免疫调节蛋白、其重组体或其片段可添加至化学成分确定之细胞培养基以增殖或繁殖未分化干细胞及化学成分确定之干细胞培养基。
[0041]
培养基可用于所有细胞加工步骤中,该等加工步骤包括冷冻保存、解冻、再悬浮、调节、扩增或维持细胞群体,尤其包含造血干细胞之细胞群体。
[0042]
藉由本文所述之培养基支持之细胞可根据由研究者决定之实验条件培养。然而,应了解既定动物细胞类型之最佳涂铺及培养条件可由一般技术者仅使用常规实验即可确定。
[0043]
提供以下实例以说明但不限制所主张之揭示。
[0044]
实例
[0045]
材料与方法
[0046]
人类骨髓来源及脂肪组织来源间叶干细胞之培养
[0047]
自56岁供体之骨髓中提取骨髓来源间叶干细胞(bmsc)且组织来源间叶干细胞自atcc(manassas,va,usa)获得。脂肪来源干细胞(adsc)是购自lonza。将adsc在含有msc补充剂(2%fbs、5ng/ml rhfgf碱性、5ng/ml rhfgf酸性及5ng/ml egf)及l-丙氨酰基-l-麸酰氨酸(2.4mm)之间叶干细胞基本培养基(美国菌种保存中心,atcc)下接种于10cm培养皿中。将bmsc在含有7%fbs、15ng/ml rhigf-1、125pg/ml rhfgf-b及l-丙氨酰基-l-麸酰氨酸(2.4mm)之间叶干细胞生长套组(atcc)下接种于10cm培养皿中。在接种后24小时以及随后每3天改变培养基。当达到汇合时,藉由使用0.15%胰蛋白酶在37℃下分离细胞4分钟,且收集之细胞每10天以初始细胞接种密度继代。藉由使用相差显微镜记录细胞形态。
[0048]
msc增殖
[0049]
将adsc(5
×
105个细胞)及bmsc(2
×
105个细胞)接种于10cm培养皿中,历时24小时,且接着用不同浓度之gmi(0、1、3及5μg/ml)处理72小时。在处理之后,将细胞用dpbs洗涤两次且与1ml阿库酶(accutase)一起在37℃下培育5分钟。在培育之后,收集细胞且用dpbs洗涤。最后,藉由血球计对总细胞数目计数。
[0050]
流动式细胞测量术分析
[0051]
藉由流动式细胞测量术,评估自不同继代收获之对照msc及经gmi处理之msc的细胞表面标记物表现。简言之,收集细胞,用dpbs洗涤且与含有1%牛血清白蛋白之非特异性阻断溶液一起培育30分钟。在阻断之后,将细胞用dpbs洗涤且离心以移除阻断溶液。接着,将细胞与荧光结合之抗人类抗体一起培育45分钟。特定言之,针对cd29(557332)、cd106(563525)、cd146(563619)及cd166(565461)之抗体是购自bd pharmingen;人类msc分析套组(562245)亦购自bd pharmingen。针对小鼠igg之抗体用作阴性染色同型对照。使染色msc再悬浮于dpbs中且藉由使用流动式细胞测量术(bd accuri
tm c6 plus)进一步分析。
[0052]
msc生脂及成骨分化
[0053]
为评估gmi处理是否影响msc之分化潜能,如先前描述将细胞接种在10cm培养皿中且与间叶干细胞生长套组(atcc)加不同浓度之gmi一起培育3天。在gmi处理之后,收获细胞且接种于24孔盘中,以进行生脂及成骨分化分析。分别藉由使用间叶干细胞生脂套组及间叶干细胞成骨套组(emd millipore corp.,ma,usa)进行生脂及成骨分化分析。在生脂分化条件下,将细胞用含有1mm地塞米松(dexamethasone)、0.5mm ibmx、10μg/ml胰岛素及100mm吲哚美辛(indomethacin)之生脂诱导培养基处理。在成骨分化条件下,将细胞用含有0.1mm地塞米松、0.2mm抗坏血酸2-磷酸盐及10mm甘油2-磷酸盐之成骨诱导培养基处理。当细胞100%汇合时,小心地自各孔抽吸培养基且添加0.5ml生脂诱导培养基或成骨诱导培养基。每2-3天用新鲜诱导培养基替换what。在诱导21天或14天之后bmsc可能分化成脂肪细胞或骨细胞。藉由以下实验进一步分析msc分化。
[0054]
组织学染色
[0055]
在生脂分化分析中,小心地自各孔抽吸培养基,且随后在室温下藉由4%三聚甲醛固定脂肪细胞30分钟。在固定之后,将各孔用pbs冲洗三次,且随后用水冲洗两次。将足够油红o溶液(0.4毫升/孔)添加至各孔中。随后,将培养盘在室温下培育50分钟。在培育之后,移除油红o溶液,且用1ml水冲洗孔三次。使用苏木精溶液(0.4毫升/孔)将细胞核染色5分钟。最后,藉由显微镜观测结果且在光学显微镜(放大率,
×
400)下拍摄。在成骨分化分析中,小心地自各孔抽吸培养基且藉由在室温下在冰冷70%乙醇中培育1小时来固定骨细胞。在固定之后,小心地抽吸乙醇且用水冲洗两次,持续5分钟。抽吸水且添加足够茜素红(alizarin red)溶液以覆盖孔(0.5毫升/孔),随后在室温下培育30分钟。在培育之后,移除茜素红溶液且用1ml水洗涤孔四次。随后,将1ml水添加至各孔中以防止细胞干燥。最后,藉由显微镜观测结果且在光学显微镜(放大率,
×
100)下拍摄。
[0056]
统计分析
[0057]
统计资料以平均值
±
sem呈现。藉由史都登氏t检验(student's t test)进行统计分析以在两个组之间进行比较,其中显著性设定在小于0.05之p值下。
[0058]
实例1
[0059]
低剂量gmi处理诱导adsc增殖
[0060]
此等实例中使用由mycomagic biotechnology co.,ltd.制造之gmi,且其自小孢灵芝(ganoderma microsporum)产生及改善(参见美国专利第7,601,808号,以全文引用的方式并入本文中)。人类脂肪来源干细胞(adsc,pt-5006)是购自lonza。先前研究指示gmi可抑制肿瘤生长且进一步诱导肿瘤细胞死亡,但没有证据显示gmi对adsc增殖之作用。为了解gmi对adsc增殖之作用,使用血球计进行细胞增殖分析。将脂肪来源干细胞(5
×
105个细胞)在含有msc补充剂(2%fbs、5ng/ml rhfgf碱性、5ng/ml rhfgf酸性及5ng/ml egf)及l-丙氨酰基-l-麸酰氨酸(2.4mm)之间叶干细胞基本培养基(美国菌种保存中心,atcc)下接种于10cm培养皿中。在培育24小时之后,将细胞用不同浓度之gmi(0、1、3及5μg/ml)处理72小时。在处理之后,藉由使用1ml阿库酶溶液收获细胞且藉由血球计对总细胞数目计数(图1b)。藉由光学显微镜(放大率,
×
100)拍摄相差影像(图1a)。图1a及1b展示gmi可能显著诱导adsc增殖。
[0061]
在gmi处理之后表面标记物持续在adsc上表现
[0062]
用于流动式细胞测量术分析之抗体,诸如抗cd29-pe(557332)、抗cd146-alexa fluor647(563619)、抗cd166-bb515(565461)及抗cd106-percp-cy5.5(563525),是购自bd biosciences。人类msc分析套组(562245)是购自bd biosciences。在细胞计数之后,进一步分析细胞之细胞表面标记物表现量。收获对照adsc及经gmi处理之adsc且进一步用抗cd29、抗cd106、抗cd146、抗cd166、抗cd90、抗cd105、抗cd73、抗cd44及阴性标记物混合抗体染色30分钟。在染色之后,将细胞用pbs洗涤两次且再悬浮于1ml pbs中。藉由流动式细胞测量术(bd accuri
tm c6 plus)评估对照细胞及经gmi处理之细胞的细胞表面标记物。评估八种msc特异性表面标记物cd29、cd106、cd146、cd166、cd90、cd105、cd73及cd44,及五种其他标记物cd34、cd11b、cd19、cd45及hla-dr。如图2中所示,在gmi处理之后,超过90%之对照及经gmi处理之adsc仍表现msc阳性标记物,诸如cd29、cd166、cd90、cd105、cd73及cd44。虽然adsc显示较低含量之cd146及cd106,但cd146及cd106表现群体不受gmi处理影响。另外,adsc上之
percp-cy5.5、抗cd73-apc、抗cd44-pe及经pe标记之阴性标记物混合抗体染色30分钟。在染色之后,用pbs洗涤细胞两次且再悬浮于1ml pbs中。藉由流动式细胞测量术(bd accuri
tm c6 plus)评估对照及经gmi处理之细胞的细胞表面标记物。评估八种msc特异性表面标记物cd29、cd106、cd146、cd166、cd90、cd105、cd73及cd44,及五种其他标记物cd34、cd11b、cd19、cd45及hla-dr。如图5中所示,在gmi处理之后,超过90%之对照及经gmi处理之bmsc仍表现msc阳性标记物,诸如cd29、cd166、cd90、cd105、cd73及cd44。虽然bmsc显示较低含量之cd146及cd106,但cd146及cd106表现群体不受gmi处理影响。另外,bmsc上之阴性表面标记物,诸如cd34、cd11b、cd19、cd45及hla-dr,藉由阴性对照混合抗体量测。如图5中所示,msc阴性标记物表现群体在gmi(5μg/ml)处理之后增加。
[0070]
经gmi处理之bmsc中保留生脂及成骨分化能力
[0071]
根据图4,gmi可诱导bmsc增殖。为了解gmi诱导之bmsc增殖是否影响其生脂及成骨分化能力,进行生脂及成骨分化分析。将bmsc用不同浓度之gmi(0、3及5μg/ml)处理3天。在gmi处理之后,收获bmsc细胞且接种于24孔盘中,以进行生脂分化及成骨分化分析。分别使用间叶干细胞生脂套组及间叶干细胞成骨套组(emd millipore corp.,ma,usa)进行生脂及成骨分化分析。当细胞100%汇合时,自各孔抽吸培养基且添加0.5ml生脂诱导培养基或成骨诱导培养基至孔中。每2-3天用新鲜诱导培养基替换培养基。在诱导21天或14天之后bmsc可能分化成脂肪细胞或骨细胞。在生脂分化分析(图6a)中,自各孔抽吸培养基,且随后藉由在室温下在4%三聚甲醛中培育脂肪细胞30分钟来固定脂肪细胞。在固定之后,用pbs冲洗各孔三次,且随后用水冲洗两次。抽吸水且将油红o溶液(0.4毫升/孔)添加至孔中。在室温下培育该等孔50分钟。在培育之后,移除油红o溶液且用1ml水冲洗孔三次。使用苏木精溶液(0.4毫升/孔)将细胞核染色5分钟。然后,藉由显微镜观测细胞且在光学显微镜(放大率,
×
400)下拍摄。在成骨分化分析(图6b)中,自各孔抽吸培养基且藉由在室温下在冰冷70%乙醇中培育1小时来固定骨细胞。在固定之后,移除乙醇且用水冲洗孔两次,持续5分钟。抽吸水且添加茜素红溶液以覆盖孔(0.5毫升/孔)。在室温下培育该等孔30分钟。在培育之后,移除茜素红溶液且用1ml水洗涤孔四次。将1ml水添加至各孔中以防止细胞干燥。最后,藉由显微镜观测结果且在光学显微镜(放大率,
×
100)下拍摄。如图6a及图6b中所示,经历脂肪生成之bmsc不仅将其形态改变为多边形或圆形形状,而且在细胞质中产生丰富的脂质微滴(以红色显示)。另一方面,藉由茜素染色,经历骨生成之bmsc展示对照及经gmi处理之细胞中之矿物质沈积。图6展示经gmi处理之bmsc保留生脂及成骨分化能力。
[0072]
虽然已结合上文所阐述之特定实施例来描述本揭示,但其许多替代方案及其修改及变化对于一般技术者而言将显而易见。所有此类替代方案、修改及变化被视为属于本揭示之范畴内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1