一种双功能化MOF材料及其制备和应用
一种双功能化mof材料及其制备和应用
技术领域
1.本发明属于材料制备技术领域,具体涉及一种双功能化mof材料及其制备和应用,用于富集细胞外囊泡(evs)。
背景技术:
2.金属有机骨架(mof)化合物是一类由无机金属离子和有机配体在一定条件下自组装形成的具有多维网孔结构的有机-无机纳米新型材料。有机配体提供mof材料中稳定的骨架结构,金属离子则作为骨架结构的节点,这意味着种类繁多的有机配体和金属离子可以实现mof材料的结构可调性,从而满足多个领域的应用需求。目前mof材料的合成方法包括溶剂热法、微波法以及扩散法等,这类材料具有比表面积大、孔隙率高、孔道可调节以及稳定性好等特点,因此在气体吸附与分离、催化以及储能等方面表现出了良好的应用前景。二硬脂酰磷脂酰乙醇胺(dspe)是一种具有两条酰基脂链尾的常用于脂质体合成的c18磷脂,dspe聚乙二醇(peg)化可以显著提高其稳定性,在peg末端加上一个反应性伯氨基,即得到dspe-peg-nh2,利用氨基可介导对其他材料的dspe修饰。dspe的两条酰基脂链尾可以通过非共价键作用力嵌插入磷脂双分子层中,因此经过dspe修饰的材料在生物标志物富集领域有潜在的价值。
3.evs是一类由细胞分泌至胞外的具有闭合的磷脂双分子层结构的纳米粒子,包括微泡、外泌体及凋亡小体三种亚型。evs的磷脂膜内含有代表供体细胞特定状态的核酸、蛋白质及代谢物等并广泛分布于体液中,通过受体细胞膜内吞以实现基于内含物质交换的细胞间交流。大量研究已经证实外泌体与癌症的转移密切相关,因此外泌体可以作为潜在的无创液体活检的生物标志物。但是现有的提取分离技术在很大程度上限制了外泌体的应用,目前基于超速离心、免疫亲和、聚合物共沉淀、尺寸排阻及微流控等原理的提取方法都有其不可避免的局限性,如耗时低效、步骤繁琐、纯度低以及易造成evs的物理性结构损伤等。目前,超速离心法仍是提取分离外泌体的金标准。
4.近年来,随着对mof材料的深入研究发现,其所具有的配位不饱和金属位点能够与evs磷脂双分子层结构中的磷酸基团形成金属螯合共价键,从而实现良好的外泌体富集效果。另外,有研究设计的带有dspe脂质尾的纳米探针能以非共价键作用的形式嵌插入磷脂双分子膜中,也对evs有高效的富集能力。
技术实现要素:
5.为了进一步提高mof材料对evs的富集能力,本发明提供了一种双功能化mof材料及其制备和应用,设计合成一种表面暴露出活性官能团的mof材料,并利用该官能团实现dspe修饰,所制备的mof-dspe材料能够从细胞培养液、尿液、血浆等生物样本中快速高效地富集evs。
6.按照本发明的技术方案,所述双功能化mof材料的制备方法,包括以下步骤,
7.s1:将金属盐溶于混合溶剂i中,所述金属盐为可溶性的锆盐、铈盐或铬盐;
8.s2:加入带有活性官能团的苯甲酸类化合物,反应制得mof材料;
9.s3:将反应性dspe-peg试剂溶于混合溶剂ii中,加入保护剂、活化剂和所述mof材料,反应制得所述双功能化mof材料。
10.进一步的,所述金属盐选自氯化盐、硝酸盐和硫酸盐中的一种或多种;如锆盐为氯化锆、硝酸锆和硫酸锆中的一种或多种。
11.进一步的,所述混合溶剂i为酸与水的混合溶液,所述酸选自甲酸、乙酸、盐酸、硫酸和硝酸中的一种或多种;优选为甲酸(产量可达85%),甲酸与水的体积比为1:2-10。
12.进一步的,所述步骤s2中,所述步骤s2中,活性官能团为羧基、氨基或双键;所述步骤s3中,反应性dspe-peg试剂的反应性基团为氨基、羧基或巯基。具体的,活性官能团为羧基,反应性基团为氨基;活性官能团为氨基,反应性基团为羧基;活性官能团为双键,反应性基团为巯基。
13.以活性基团为羧基为例,苯甲酸类化合物采用1,2,4-苯三甲酸,含有三个羧基的,合成mof材料会消耗掉2个,剩余一个暴露出来,而其他试剂的活性官能团是在反应过程中不与金属离子结合的,所以会剩余。
14.进一步的,所述步骤s2中,反应条件为室温(25
±
5℃)下,以500-800rpm/min的速度搅拌0.5-3min。
15.进一步的,所述金属盐与带有活性官能团的苯甲酸类化合物的摩尔比为1:0.5-1.5。
16.进一步的,所述步骤s3中,混合溶剂ii为25-35%(质量)的乙醇水溶液;保护剂为n-羟基琥珀酰亚胺;活化剂为碳二亚胺。
17.进一步的,所述保护剂与所述反应性dspe-peg试剂的质量比为4-6:1,所述活化剂所述反应性dspe-peg试剂的质量比为8-12:1.
18.进一步的,所述步骤s3中,mof材料与反应性dspe-peg试剂的质量比为1-10:1。
19.进一步的,所述步骤s3中,还加有缓冲液,所述缓冲液为tris-hcl缓冲液(ph=6.5)。
20.进一步的,所述步骤s3中,反应的条件为室温反应60-100h。
21.本发明以金属盐和带有活性官能团(如羧基、氨基及双键等)的苯甲酸类化合物为原料,首先制备得到表面带有活性官能团的mof材料,之后利用活性官能团与二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)试剂进行dspe修饰,即可制备得到dspe修饰后的双功能化mof-dspe材料。制备方法中的合成及修饰过程均在室温进行且无有机试剂参加反应,具有条件温和、操作简单及环境友好的优点。
22.dspe所带的两条疏水性脂肪酸尾与外泌体的磷脂膜具有较强的非共价键作用,而且金属离子(zr
4+
、ti
4+
和ni
4+
等)与带负电的磷酸酯基团之间也存在特异性金属螯合作用,因此所制备的材料可以用于快速高效富集生物样品中的evs,从而实现对evs内含物质的提取分析,同时以弱碱洗脱的方式还可以实现evs的快速分离。
23.本发明的第二方面提供了上述制备方法制得的双功能化mof材料。
24.本发明的第二方面提供了上述双功能化mof材料用于生物样本中富集细胞外囊泡的应用。
25.进一步的,所述生物样本为细胞培养液、尿液或血浆。
26.进一步的,结合分子生物学实验及液质联用技术对evs内含核酸及蛋白质进行提取和分析,同时以弱碱洗脱的方式可以实现evs的快速分离,这为evs的下游功能分析提供了可靠的方法,有利于evs生物学功能的深入研究。
27.具体的,所述应用的过程如下:
28.ss1:将双功能化mof材料、生物样本和壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液加入pbs中,得到混合体系,所述双功能化mof材料、生物样本和壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液的体积比为1:0.8-1.2:0.8-1.2;
29.ss2:将所述混合体系于室温混悬孵育0.5-3h;
30.ss3:将孵育后的混合体系离心弃上清,留下底部沉淀,离心的转速为4000-6000rpm/min;
31.ss4:用0.01%壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液清洗所述底部沉淀1次,再用pbs洗2-4次,完成对evs的富集。
32.本发明的技术方案相比现有技术具有以下优点:
33.本发明的制备方法分两个过程进行,一个是合成初始的mof材料过程,另一个是对mof材料的功能化修饰过程。前者能够高收率制备带有氨基、羧基等活性官能团的初始mof材料;后者则是根据活性官能团选择合适的dspe-peg反应试剂对mof材料进行功能化修饰。
34.本发明制备方法中的合成及修饰过程均在常温下进行,制备过程简单易操作,且反应过程中无有机溶剂参与,具有条件温和、重现性好等优点。
35.本发明所制备的mof材料和mof-dspe材料具有良好的物理和化学稳定性,能够长期分散在pbs中存于4℃。二者都对evs有富集作用,mof材料仅靠zr-o键与evs膜的磷酸基团的金属螯合作用力实现捕获富集过程,mof-dspe材料则还可以利用dspe脂质尾嵌插入磷脂双分子膜中实现非共价键形式的富集,从而实现其对evs的双功能富集。
36.本发明所制备材料可以在常温下高效富集细胞培养液中的evs。mof-dspe材料富集evs的能力明显优于mof材料。0.2mgmof-dspe材料能够在1h内富集evs达饱和,而0.2mg mof材料在5h内仍无法达吸附饱和,这种能力差异与二者富集外泌体的原理相符合。
附图说明
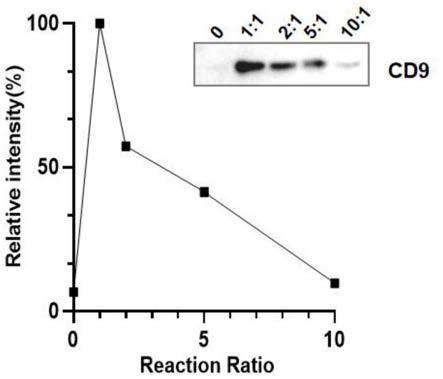
37.图1采用不同修饰反应比例制备的mof-dspe材料对细胞培养液中evs的富集效果比较图
38.图2为5种方法对细胞培养液中evs的富集效率对比分析和外泌体标志蛋白tsg101的westernblotting图。
39.图3为mof-dspe材料用于富集细胞培养液中evs后的mrna表达水平分析图。
40.图4为mof-dspe材料用于富集尿液中evs的lc/ms/ms分析图。
41.图5为用mof-dspe材料富集细胞培养液中的evs对huvec细胞的划痕实验结果图。
具体实施方式
42.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
43.实施例1
44.1)向25ml的圆底烧瓶中加入350mg的氯化锆;
45.2)向步骤1)的反应容器中加入3ml的甲酸和8ml的去离子水,在600rpm/min的速度下磁力搅拌1min;
46.3)向步骤1)的反应容器中加入350mg的1,2,4-苯三甲酸;
47.4)将上述反应体系置于室温,在600rpm/min的磁力搅拌速度下反应72h,使其呈均匀分散的白色浑浊溶液状态;
48.5)分次取反应产物转移至离心管中,以7000rpm/min的转速离心5min后弃去上清,收集白色沉淀;
49.6)用去离子水将步骤5)中得到的沉淀清洗2遍后置于烘箱干燥,得到的白色产物即为初始的mof材料;
50.7)取四个10ml离心管,分别加入10mg dspe-peg2000-nh2;
51.8)向步骤7)的反应容器中分别加入1ml 30%乙醇溶液并超声使其溶解;
52.9)向步骤7)的反应容器中分别加入50mg n-羟基琥珀酰亚胺(nhs)和100mg碳二亚胺(edc);
53.10)向步骤7)的反应容器中加入4ml tris-hcl缓冲液(ph=6.5);
54.11)向步骤7)的反应容器中分别加入10mg、20mg、50mg和100mg步骤6)的mof材料,匀速混悬下反应6h;
55.12)同步骤5);
56.13)用去离子水将步骤12)中得到的沉淀清洗2遍,之后用1ml pbs均匀分散,即可得四种修饰质量比的mof-dspe材料;
57.14)取四个1.5ml离心管,分别加入100μl步骤13)中的四种材料,并均加入100μl细胞培养液、100μl 0.1%壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液以及700μlpbs;
58.15)将步骤14)中的混合体系于室温混悬孵育1h;
59.16)将步骤15)中的体系于5000rpm/min离心弃上清,留下底部沉淀;
60.17)用1ml 0.01%壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液清洗步骤16)中的沉淀1次,再用pbs洗2次,即完成细胞培养液中evs的富集。
61.将步骤1)中的氯化锆替换为氯化铈、氯化铬、硝酸锆或硫酸锆,得到的mof-dspe材料,同样能够实现细胞培养液中evs的富集。
62.实施例2
63.1)向25ml的圆底烧瓶中加入350mg的氯化锆;
64.2)向步骤1)的反应容器中加入3ml的甲酸和8ml的去离子水,在600rpm/min的速度下磁力搅拌1min;
65.3)向步骤1)的反应容器中加入350mg的2-氨基对苯二甲酸;
66.4)将上述反应体系置于室温,在600rpm/min的磁力搅拌速度下反应72h,使其呈均匀分散的白色浑浊溶液状态;
67.5)分次取反应产物转移至离心管中,以7000rpm/min的转速离心5min后弃去上清,收集白色沉淀;
68.6)用去离子水将步骤5)中得到的沉淀清洗2遍后置于烘箱干燥,得到的白色产物即为初始的mof材料;
69.7)向10ml离心管中加入10mg dspe-peg2000-cooh;
70.8)向步骤7)的反应容器中加入1ml 30%乙醇溶液并超声使其溶解;
71.9)向步骤7)的反应容器中加入50mg n-羟基琥珀酰亚胺(nhs)和100mg碳二亚胺(edc);
72.10)向步骤7)的反应容器中加入4ml tris-hcl缓冲液(ph=6.5);
73.11)向步骤7)的反应容器中加入10mg步骤6)的mof材料,匀速混悬下反应6h;
74.12)同步骤5);
75.13)用去离子水将步骤12)中得到的沉淀清洗2遍,之后用1ml pbs均匀分散,即可得浓度为10mg/ml的mof-dspe材料;
76.14)向1.5ml离心管中加入100μl步骤13)中的材料、1ml尿液、100μl0.1%壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液;
77.15)将步骤14)中的混合体系于室温混悬孵育1h;
78.16)将步骤15)中的体系于5000rpm/min离心弃上清,留下底部沉淀;
79.17)用1ml 0.01%壬基酚聚氧乙烯醚/曲拉通x-100的pbs溶液清洗步骤16)中的沉淀1次,再用pbs洗2次,即完成尿液中evs的富集。
80.检测例
81.图1为采用不同修饰反应比例制备的mof-dspe材料对细胞培养液中evs的富集效果比较图(实施例1)。图中显示,以evs的标志蛋白cd9为量化标准,mof-dspe材料展现出了优于未修饰的材料的evs捕获能力,并且在mof材料与反应性dspe-peg试剂的质量比为1:1,2:1,5:1以及10:1的修饰条件下,比例为1:1有更好的富集效果。因此,后续实验采用该修饰比例制备mof-dspe材料并投入应用。
82.图2为5种方法对细胞培养液中evs的富集效率对比分析和外泌体标志蛋白tsg101的western blotting图(实施例1)。图中5种方法依次为(1)mof材料,(2)mof-dspe材料,(3)超速离心,(4)尺寸排阻,(5)聚合物共沉淀。以超速离心法提取evs的效率作为归一化标准,可以看到mof-dspe材料富集evs的效率显著高于其他4种方法,说明该材料具有良好的evs富集能力并且该富集方法能够用于evs蛋白表达水平的分析。
83.图3为mof-dspe材料(实施例1)用于富集细胞培养液中evs后的mrna表达水平分析图。用材料分别富集结直肠癌原位灶细胞株sw480、hct116和结直肠癌转移灶细胞株sw620细胞培养液中的evs并进行特定mrna的表达水平分析。由图可得,与原位灶细胞株相比,转移灶细胞培养液中的evs中含有较高水平的与癌症转移、侵袭以及血管形成等相关基因的mrna表达,这提示该材料富集evs的方法能够用于evs的rna表达分析。
84.图4为mof-dspe材料(实施例2)用于富集尿液中evs的lc/ms/ms分析图。用材料分别富集健康人和结直肠癌患者尿液中的evs并进行蛋白组学分析,从而寻找到二者的差异蛋白。
85.图5为分别用超速离心(uc)法和mof-dspe材料(实施例2)富集细胞培养液中的evs对huvec细胞的划痕实验结果图。分别用材料富集sw480和sw620细胞培养液中的evs,用碱洗脱分离后用于划痕实验观察其对huvec细胞迁移的影响,并与uc法进行比较。结果统计分别为自划痕后24h、36h和48h(每个时间点的数据从左到右依次为pbs、uc-exo-480、uc-exo-620、mof-exo-480和mof-exo-620),用以评估该方法提取分离的evs的生理活性。如图显示,
与对照组相比,用uc法和材料提取sw480和sw620细胞培养液的evs均能够促进huvec细胞的迁移,二者无显著差异。说明该方法提取分离的evs仍具有较好的生理活性。
86.由实施例和附图可见,该制备方法操作简单、条件温和,由此制备的mof-dspe材料能够通过共价与非共价协同作用实现对细胞培养液和尿液中evs的高效富集,从而通过pcr、westernblotting实验对其内含的具体rna和蛋白的表达水平进行分析,还可以结合lc/ms/ms技术进行evs的蛋白组学分析。同时分离后的evs仍具有生理活性,能够用于后续的功能分析。
87.显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1