一种金属缓蚀剂及其制备方法
1.本发明涉及金属材料技术领域,具体而言,涉及一种金属缓蚀剂及其制备方法。
背景技术:
2.金属材料广泛应用于各个领域,也是工业生产中不可缺少的原料,然而,由于自身性质,金属暴露在自然环境下易发生化学反应或电化学反应从而被腐蚀,导致金属材料性能的破坏,造成资源损失和安全隐患。
3.通过金属缓蚀剂防止金属腐蚀是目前工业应用中最佳的防腐蚀方法之一,相对于电化学防护和涂料防腐蚀技术等其他防腐蚀手段,具有成本低、效率高、实际操作简便以及应用范围广泛等优点,然而,传统金属缓蚀剂大多具有较大的毒性,容易造成环境重金属污染,并且存在着生产成本高、合成步骤繁琐、提取难度较大、防锈易造成二次污染等不利因素,使其在应用和推广方面仍存在一定局限性。
技术实现要素:
4.本发明解决的问题是现有金属缓蚀剂制作使用成本高、难度大、不环保中的至少一个方面。
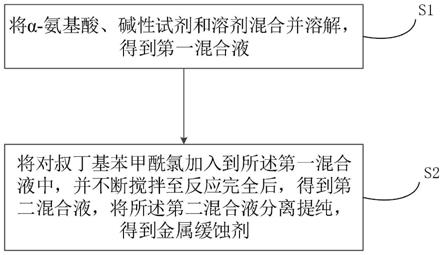
5.为解决上述问题,本发明提供一种金属缓蚀剂的制备方法,包括如下步骤:
6.步骤s1:将α
‑
氨基酸、碱性试剂和溶剂混合并溶解,得到第一混合液;
7.步骤s2:将对叔丁基苯甲酰氯加入到所述第一混合液中,并不断搅拌至反应完全后,得到第二混合液,将所述第二混合液分离提纯,得到金属缓蚀剂。
8.可选地,步骤s2中,得到所述第二混合液之后,还包括:将还原剂加入所述第二混合液中,再加入乙醇和水的混合液,加热并回流至反应完全后,经过分离提纯,制得金属缓蚀剂。
9.可选地,步骤s1中,所述α
‑
氨基酸包括甘氨酸、丙氨酸、脯氨酸、甲硫氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、赖氨酸或色氨酸中的一种。
10.可选地,步骤s2中,所述将对叔丁基苯甲酰氯加入到所述第一混合液中,并不断搅拌至反应完全后,得到第二混合液,包括:
11.将所述对叔丁基苯甲酰氯加入到所述第一混合液中,并不断搅拌至反应完全后,得到所述第二混合液,并向所述第二混合液中加入过量稀盐酸进行淬灭。
12.可选地,步骤s2中,所述分离提纯包括对所述第二混合液进行萃取后,再通过柱层析法提纯所述第二混合液。
13.可选地,步骤s1中,所述将α
‑
氨基酸、碱性试剂和溶剂混合并溶解,得到第一混合液,包括:
14.将所述α
‑
氨基酸、所述碱性试剂和所述溶剂混合并溶解,得到所述第一混合液,并将所述第一混合液置于冰水浴中。
15.可选地,步骤s2中,所述搅拌时间为6
‑
24h。
16.可选地,步骤s2中,所述对所述第二混合液进行萃取包括:利用乙酸乙酯对所述第二混合液进行萃取。
17.相对于现有技术,本发明所述的金属缓蚀剂的制备方法具有以下优势:
18.本发明通过α
‑
氨基酸、碱性试剂和对叔丁基苯甲酰氯三者的反应制备氨基酸酰胺化合物作为金属缓蚀剂,所述金属缓蚀剂中的n原子和/或s原子可与金属离子的d空轨道进行配位形成配位键,使所述金属缓蚀剂分子吸附在金属表面,在金属表面形成一个致密的单分子膜层,将腐蚀介质从金属表面隔离开,从而减缓了金属的腐蚀,本发明所述金属缓蚀剂的制备方法合成步骤短,反应条件温和,操作简便,使用α
‑
氨基酸、碱性试剂和对叔丁基苯甲酰氯作为原料,来源广泛,成本低廉,无毒无害,绿色环保。
19.本发明的另一目的在于提供一种金属缓蚀剂,采用所述的金属缓蚀剂的制备方法制得。
20.本发明所述的金属缓蚀剂相对于现有技术的优势与上述金属缓蚀剂的制备方法相同,在此不再赘述。
21.本发明的另一目的在于金属缓蚀剂的应用,采用所述的金属缓蚀剂作为添加剂用于金属表面处理。
22.本发明所述的金属缓蚀剂的应用相对于现有技术的优势与上述金属缓蚀剂的制备方法相同,在此不再赘述。
附图说明
23.构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
24.图1为本发明实施例的金属缓蚀剂的制备方法流程图;
25.图2为本发明实施例一的金属缓蚀剂的制备方法原理图一;
26.图3为本发明实施例一的q235钢表面形貌显微图一;
27.图4为本发明实施例一的q235钢表面形貌显微图二;
28.图5为本发明实施例一的q235钢表面形貌显微图三;
29.图6为本发明实施例二的q235钢表面形貌显微图。
具体实施方式
30.为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施例做详细的说明。
31.需要说明的是,在本技术实施例的描述中,术语“一些具体的实施例”的描述意指结合该实施例或示例描述的具体特征、结构、材料或特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施或实例。而且,描述的具体特征、结构、材料或特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
32.结合图1所示,本发明实施例提供了一种金属缓蚀剂的制备方法,包括如下步骤:
33.步骤s1:将α
‑
氨基酸、碱性试剂和溶剂混合并溶解,得到第一混合液;其中碱性试剂包括氢氧化钠、氢氧化钾等碱金属元素的氢氧化物,以及能够参与反应的其他碱性试剂。
34.步骤s2:将对叔丁基苯甲酰氯缓慢加入到所述第一混合液中,并不断搅拌至反应完全,反应温度由
‑
10℃
‑
5℃自然恢复到室温,得到第二混合液,将所述第二混合液分离提纯,得到金属缓蚀剂。其中对叔丁基苯甲酰氯缓慢加入到含有α
‑
氨基酸的第一混合液中,有利于控制反应温度,因对叔丁基苯甲酰氯与α
‑
氨基酸反应会释放热量,因此通过控制对叔丁基苯甲酰氯的加入速度,可防止热量集中释放,致使反应温度过高。
35.本发明通过α
‑
氨基酸、碱性试剂和对叔丁基苯甲酰氯三者的反应制备氨基酸酰胺化合物作为金属缓蚀剂,所述金属缓蚀剂中的n原子和/或s原子可与金属离子的d空轨道进行配位形成配位键,使所述金属缓蚀剂分子吸附在金属表面,在金属表面形成一个致密的单分子膜层,将腐蚀介质从金属表面隔离开,从而减缓了金属的腐蚀,本发明所述金属缓蚀剂的制备方法合成步骤短,反应条件温和,操作简便,使用α
‑
氨基酸、碱性试剂和对叔丁基苯甲酰氯作为原料,来源广泛,成本低廉,无毒无害,绿色环保。
36.本实施例中的金属缓蚀剂为氨基酸酰胺类化合物,是通过对叔丁基苯甲酰氯与α
‑
氨基酸反应合成,通常合成酰胺的方法有十多种,利用酰氯合成酰胺是其中的方法之一,酰氯合成酰胺相对于其他方法操作更为简便,且反应活性高,原子经济性高。
37.由于酰氯遇水易分解,变成对应的羧酸,但由于对叔丁基苯甲酰氯属于芳香酰氯,较为稳定,即使在水中也要较长时间才会完全分解,因此在发明实施例中选用对叔丁基苯甲酰氯在水体系中反应。在反应结束后,除了目标产物外,剩余物质通常为对叔丁基苯甲酸,该物质可回收,用于作为制备对叔丁基苯甲酰氯的原料,经济性好。
38.在一些具体的实施例中,步骤s1中,所述碱性试剂包括碱金属元素的氢氧化物。由此,利用碱金属元素的氢氧化物的还原性制备出氨基酸酰胺化合物金属缓蚀剂。
39.本实施例中,参与酰氯制备酰胺反应的碱性试剂,可以为无机碱或有机碱,但是采用碱金属元素的氢氧化物一类的无机碱有助于反应后续操作,简化操作步骤,利于反应物的分离提纯等。
40.在一些具体的实施例中,步骤s1中,所述α
‑
氨基酸包括甘氨酸、丙氨酸、脯氨酸、甲硫氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、赖氨酸或色氨酸中的一种。
41.其中,所述α
‑
氨基酸包括甘氨酸、丙氨酸、脯氨酸、甲硫氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、赖氨酸和色氨酸等,使用以上种类的氨基酸作为反应原料的实验步骤没有差异,其中,缓蚀效率由高到低排序为:甲硫氨酸(meth)>半胱氨酸(cys)>脯氨酸(pro)>丙氨酸(ala)>组氨酸(his)>赖氨酸(2lys)>苯丙氨酸(phen)>谷氨酸(glu)>色氨酸(tryp),即使用甲硫氨酸作为反应物制备金属缓蚀剂可以得到最佳的效果。
42.在一些具体的实施例中,步骤s2中,所述将对叔丁基苯甲酰氯加入到所述第一混合液中,并不断搅拌至反应完全后,得到第二混合液,包括:
43.将所述对叔丁基苯甲酰氯加入到所述第一混合液中,并不断搅拌至反应完全后,得到所述第二混合液,并向所述第二混合液中加入过量稀盐酸进行淬灭。
44.由此,消除反应中过量试剂,确保反应产物稳定。
45.在一些具体的实施例中,步骤s2中,所述分离提纯包括对所述第二混合液进行萃取后,再通过柱层析法提纯所述第二混合液。由此,经过简单操作分离出所需产物,方法简单,提纯率高。
46.在一些具体的实施例中,步骤s1中,所述将α
‑
氨基酸、碱性试剂和溶剂混合并溶
解,得到第一混合液,包括:
47.将所述α
‑
氨基酸、所述碱性试剂和所述溶剂混合并溶解,得到所述第一混合液,并将所述第一混合液置于冰水浴中。本实施例中,由于对叔丁基苯甲酰氯与α
‑
氨基酸反应时会释放大量的热,若反应体系的温度过高会引发副反应,产生不必要的产物,因此,在加入对叔丁基苯甲酰氯前,将第一混合液置于冰水浴中,低温环境有利于抑制反应活性,防止集中放热导致反应体系温度过高。现有技术中还存在采用低温缩合剂合成酰胺的方法,该方法通常需要在
‑
20℃甚至更低的温度下进行,对设备要求高,操作复杂,而采用对叔丁基苯甲酰氯合成酰胺的方法则通常在0~5℃下冷却即可,即如本实施例中采用冰水浴进行冷却,操作方便,反应温和,经济性好。
48.在一些具体的实施例中,步骤s2中,所述搅拌时间为6
‑
24h。由此,对叔丁基苯甲酰氯在第一混合液中均匀分散,反应更充分。
49.在一些具体的实施例中,步骤s2中,所述对所述第二混合液进行萃取包括:利用乙酸乙酯对所述第二混合液进行萃取。由此,提高萃取速率,有利于提纯反应产物。
50.本发明实施例所述金属缓蚀剂的制备方法合成步骤短,反应条件温和,操作简便,使用α
‑
氨基酸、碱性试剂和对叔丁基苯甲酰氯作为原料,来源广泛,成本低廉,无毒无害,绿色环保。
51.本发明实施例还提供了一种金属缓蚀剂,采用上述所述的金属缓蚀剂的制备方法制得。
52.本发明实施例所述的金属缓蚀剂相对于现有技术的优势与上述金属缓蚀剂的制备方法相同,在此不再赘述。
53.本发明实施例的在于提供一种金属缓蚀剂的应用,采用所述的金属缓蚀剂作为添加剂用于金属表面处理。特别适用于对金属表面的精细处理,包括对油气井进行酸化、对循环冷却水系统进行防腐蚀处理,对金属表面进行酸处理、对锅炉内部进行化学清洗等方面。
54.本发明实施例所述的金属缓蚀剂的应用相对于现有技术的优势与上述金属缓蚀剂的制备方法相同,在此不再赘述。
55.下面结合几个具体实施例,对本发明技术方案做进一步阐述,明确本发明的目的及优点。
56.实施例一:
57.本实施例金属缓蚀剂的制备方法按照以下步骤进行:
58.s1:用天平称取1.49g甲硫氨酸(meth)加入50ml圆底烧瓶中,用天平称取0.8g氢氧化钠,加入所述圆底烧瓶中,并加入5ml去离子水进行溶解,将所述圆底烧瓶置于冰水浴中。
59.s2:用注射器吸取对叔丁基苯甲酰氯1.81ml,缓慢注入所述圆底烧瓶,注入过程中保持搅拌,注入完毕后保持搅拌6小时,反应过程中温度由
‑
10℃自然恢复到室温状态,反应结束后,加入过量盐酸进行淬灭反应,然后用乙酸乙酯进行萃取,萃取完毕后用柱层析法分离出金属缓蚀剂。
60.本实施例采用甲硫氨酸(meth)作为反应原料,结合图2所示,以对叔丁基苯甲酰氯和甲硫氨酸为原料,加入氢氧化钠,以水为溶剂,反应过程中温度由
‑
10℃自然恢复到室温状态下,反应6小时,分离纯化后得到金属缓蚀剂。
61.为验证本实施例所述金属缓蚀剂的缓蚀效果,将q235钢置于含有不同浓度的金属
缓蚀剂的1moll
‑1hcl溶液中,进行多种试验:
62.1、失重实验,测量q235钢的腐蚀速度,结果如表1所示,从表1中可以看出,室温下q235钢在1moll
‑1hcl中的腐蚀速率为4.930gh
‑1m
‑2,在添加了上述金属缓蚀剂的溶液中的腐蚀速率为2.667gh
‑1m
‑2、1.574gh
‑1m
‑2、0.384gh
‑1m
‑2、0.180gh
‑1m
‑2,相较于在空白hcl溶液中,q235钢在添加了上述金属缓蚀剂的溶液中的腐蚀速率ν显著降低,并且上述金属缓蚀剂的浓度越大,q235钢的腐蚀速率越小,即金属缓蚀剂的缓蚀作用越强。
63.2、电化学实验,测量动电位极化参数从而反应腐蚀速率,在此使用塔菲尔外推法,结果如表2所示,表2为极化曲线的动力学参数,显示了测量获得的腐蚀电位、腐蚀电流密度和塔菲尔斜率,表2的结果表明,室温下q235钢在空白1moll
‑1hcl溶液中电流密度为68.61macm
‑2,在添加了上述金属缓蚀剂的溶液中的电流密度为28.51macm
‑2、21.61macm
‑2、17.23macm
‑2、12.29macm
‑2,腐蚀电流密度随金属缓蚀剂浓度增加而降低,在金属缓蚀剂浓度为100mgl
‑1时缓蚀效率达到82.12%。
64.3、电化学阻抗实验,测量阻抗参数,结果如表3所示,从表3中可以看出,溶液电阻随着上述金属缓蚀剂的浓度升高而降低;电荷转移电阻随着上述金属缓蚀剂的浓度升高而升高,同时常相位角元件值降低。电荷转移电阻的增大和电容的增加说明分子逐渐吸附在q235钢表面,逐渐替代表面的水分子,在金属表面形成一层吸附膜,阻碍了q235钢的电荷转移,从而抑制q235钢在hcl中的溶解,抑制q235钢的腐蚀。此外从实验数据可以看出,其缓蚀效率的变化趋势与动电位极化曲线呈现的变化趋势一致,也与失重法测试中结果呈现的趋势一致。
65.4、扫描电镜表面形貌分析,图3为未处理的q235钢表面形貌,图4为q235钢在1moll
‑1hcl溶液中浸泡6h后表面形貌,图5为q235钢在含有100mg上述金属缓蚀剂的1moll
‑1hcl溶液中浸泡6h后表面形貌,从中观察到空白hcl溶液中q235钢样品的表面遭到严重腐蚀,可看到许多明显的凹槽深坑,而在含有上述金属缓蚀剂的hcl溶液中,相较于在未添加缓蚀剂的样品,q235钢样品表面腐蚀程度显著降低。
66.综上所述,采用甲硫氨酸(meth)作为反应原料制得的氨基酸酰胺化合物作为金属缓蚀剂具有一定缓蚀效果。
67.实施例二:
68.本实施例与实施例一的区别在于:本实施例金属缓蚀剂的制备方法使用半胱氨酸(cys)代替甲硫氨酸(meth)作为反应原料。
69.本实施例金属缓蚀剂的制备方法按照以下步骤进行:
70.s1:用天平称取0.61g半胱氨酸(cys)加入50ml圆底烧瓶中,用天平称取0.4g氢氧化钠,加入所述圆底烧瓶中,并加入5ml去离子水进行溶解,将所述圆底烧瓶置于冰水浴中。
71.s2:用注射器吸取对叔丁基苯甲酰氯0.98ml,缓慢注入所述圆底烧瓶,注入过程中保持搅拌,注入完毕后保持搅拌24小时,反应过程中温度由5℃自然恢复到室温状态,反应结束后,加入过量盐酸进行淬灭反应,用乙酸乙酯进行萃取,萃取完毕后用柱层析法分离得到金属缓蚀剂。
72.为验证本实施例所述金属缓蚀剂的缓蚀效果,将q235钢置于含有不同浓度的上述金属缓蚀剂的1mollhcl溶液中,进行多种试验:
73.1、失重实验,测量q235钢的腐蚀速度,结果如表1所示,从表1中可以看出,q235钢
在添加了上述金属缓蚀剂的溶液中的腐蚀速率为4.902gh
‑1m
‑2、3.042gh
‑1m
‑2、1.653gh
‑1m
‑2、0.439gh
‑1m
‑2,相较于在空白hcl溶液中,q235钢在添加了上述金属缓蚀剂的溶液中的腐蚀速率ν显著降低,并且上述金属缓蚀剂的浓度越大,q235钢的腐蚀速率越小,即金属缓蚀剂的缓蚀作用越强。
74.表1
‑
q235钢在不含或含有不同浓度金属缓蚀剂的hcl溶液中的失重实验结果
[0075][0076]
2、电化学实验,测量动电位极化参数,结果如表2所示,表2的结果表明,在添加了上述金属缓蚀剂的溶液中的电流密度为58.74macm
‑2、39.19macm
‑2、17.79macm
‑2、9.64macm
‑2,腐蚀电流密度随金属缓蚀剂浓度增加而降低,在金属缓蚀剂浓度为100mgl
‑1时缓蚀效率达到85.99%。
[0077]
表2
‑
q235钢在不含或含有不同浓度金属缓蚀剂hcl中的动电位极化参数
[0078][0079]
3、电化学阻抗实验,测量阻抗参数,结果如表3所示,溶液电阻随着上述金属缓蚀剂的浓度升高而降低;电荷转移电阻随着上述金属缓蚀剂的浓度升高而升高,同时常相位角元件值降低,从实验数据可以看出,其缓蚀效率的变化趋势与动电位极化曲线呈现的变化趋势和失重法测试中结果呈现的趋势一致。
[0080]
表3
‑
hcl溶液中不添加或添加不同浓度金属缓蚀剂的阻抗参数
[0081][0082]
4、扫描电镜表面形貌分析,图6为q235钢在含有100mg上述金属缓蚀剂的1moll
‑1hcl溶液中浸泡6h后表面形貌,从中观察到在含有上述金属缓蚀的hcl溶液中,相较于在未添加缓蚀剂的样品,q235钢样品表面腐蚀程度显著降低,但相比较来说,使用以甲硫氨酸为原料的金属缓蚀剂q235钢表面比使用以半胱氨酸为原料的金属缓蚀剂的q235钢表面更为规则,更接近原始样品表面,说明以半胱氨酸为原料的金属缓蚀剂缓蚀效果差于以甲硫氨酸为原料的金属缓蚀剂。
[0083]
综上所述,采用半胱氨酸(cys)作为反应原料制得的氨基酸酰胺化合物作为金属缓蚀剂具有一定缓蚀效果。
[0084]
实施例三:
[0085]
本实施例与实施例一的区别在于:本实施例金属缓蚀剂的制备方法使用脯氨酸(pro)代替甲硫氨酸(meth)作为反应原料。
[0086]
本实施例金属缓蚀剂的制备方法按照以下步骤进行:
[0087]
s1:用天平称取1.15g脯氨酸(pro)加入50ml圆底烧瓶中,用天平称取0.8g氢氧化钠,加入所述圆底烧瓶中,并加入5ml去离子水进行溶解,将所述圆底烧瓶置于冰水浴中。
[0088]
s2:用注射器吸取对叔丁基苯甲酰氯1.81ml,缓慢注入所述圆底烧瓶,注入过程中保持搅拌,注入完毕后保持搅拌12小时,反应过程中温度由
‑
5℃自然恢复到室温状态,反应结束后,加入过量盐酸淬灭反应,然后用乙酸乙酯进行萃取,萃取完毕后用柱层析法分离得到金属缓蚀剂。
[0089]
实施例四:
[0090]
本实施例与实施例一的区别在于:本实施例金属缓蚀剂的制备方法使用丙氨酸(ala)代替甲硫氨酸(meth)作为反应原料。
[0091]
本实施例金属缓蚀剂的制备方法按照以下步骤进行:
[0092]
s1:用天平称取0.89g丙氨酸(ala)加入50ml圆底烧瓶中,用天平称取0.8g氢氧化钠,加入所述圆底烧瓶中,并加入5ml去离子水进行溶解,将所述圆底烧瓶置于冰水浴中。
[0093]
s2:用注射器吸取对叔丁基苯甲酰氯1.81ml,缓慢注入所述圆底烧瓶,注入过程中保持搅拌,注入完毕后保持搅拌18小时,反应过程中温度由
‑
2℃自然恢复到室温状态,反应
结束后,加入过量盐酸淬灭反应,然后用乙酸乙酯进行萃取,萃取完毕后用柱层析法分离得到金属缓蚀剂。
[0094]
实施例五:
[0095]
本实施例与实施例一的区别在于:本实施例金属缓蚀剂的制备方法使用组氨酸(his)代替甲硫氨酸(meth)作为反应原料。
[0096]
本实施例金属缓蚀剂的制备方法按照以下步骤进行:
[0097]
s1:用天平称取2.04g组氨酸(his)加入50ml圆底烧瓶中,用天平称取0.8g氢氧化钠,加入所述圆底烧瓶中,并加入5ml去离子水进行溶解,将所述圆底烧瓶置于冰水浴中。
[0098]
s2:用注射器吸取对叔丁基苯甲酰氯1.81ml,缓慢注入所述圆底烧瓶,注入过程中保持搅拌,注入完毕后保持搅拌20小时,反应过程中温度由0℃自然恢复到室温状态,反应结束后,加入过量盐酸淬灭反应,然后用乙酸乙酯进行萃取,萃取完毕后用柱层析法分离得到金属缓蚀剂。
[0099]
结合表4所示,表4为实施例三、实施例四和实施例五对应电化学阻抗筛选数据,可以观察到,采用脯氨酸(pro)、丙氨酸(ala)以及组氨酸(his)作为反应原料制得的氨基酸酰胺化合物作为金属缓蚀剂均具有一定缓蚀效果。
[0100]
表4
‑
hcl溶液中不添加或添加不同种类金属缓蚀剂的阻抗参数
[0101][0102]
更多的,还存在其他氨基酸可以作为反应物,也可以得到具有防腐蚀功效的金属缓蚀剂,例如苏氨酸、丝氨酸、酪氨酸、精氨酸等,但是需要更为复杂繁琐的步骤才能合成同类型化合物。相对于上述金属缓蚀剂的制备步骤,该化合物合成比较繁琐,不够简便快捷。
[0103]
虽然本公开披露如上,但本公开的保护范围并非仅限于此。本领域技术人员,在不脱离本公开的精神和范围的前提下,可进行各种变更与修改,这些变更与修改均将落入本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1