一种滋养层细胞及其在扩增人NK细胞中的应用的制作方法
一种滋养层细胞及其在扩增人nk细胞中的应用
技术领域
1.本技术涉及基因工程的技术领域,更具体地说,它涉及一种滋养层细胞及其在扩增人nk细胞中的应用。
背景技术:
2.自然杀伤细胞(nk细胞)是由骨髓中cd34+造血祖细胞产生的淋巴细胞。nk细胞主要存在于血液、肝脏、脾脏、骨髓中,但炎症、感染等因素可触发nk细胞迁移到几乎任何组织中。nk细胞是人体免疫系统中一类重要的免疫细胞,对外源病原体感染及由压力引起的具有恶变趋势的细胞能够迅速起反应并发挥杀伤作用,在机体抗病毒及抗肿瘤过程中处于关键地位。
3.相关技术中nk细胞主要通过以下机制介导细胞毒性。其中,研究最多的途径是脱颗粒,即nk细胞在与靶细胞相互作用时释放细胞毒性颗粒。该途径由激活细胞表面受体的信号触发,激活细胞表面受体如nkg2d、dnam1和天然细胞毒性受体nkp30、nkp44和nkp46等。另一途径是死亡受体途径,即肿瘤坏死因子(tnf)相关凋亡诱导配体(trail)
–
trail受体(trailr)途径以及fas-fas配体(fasl)途径(也称为cd95
–
cd95配体途径)。死亡受体途径不是触发细胞毒性颗粒的释放,而是通过靶细胞内的半胱天冬酶激活诱导细胞凋亡,以此诱导细胞毒性。
4.目前,nk细胞的来源很多,例如可以从外周血单个核细胞(pbmc)、脐带血、nk细胞系和人类胚胎干细胞(hesc)以及诱导多能干细胞(ipsc)作为起始材料制备得到nk细胞。而最主要的扩增nk细胞的方法有两种:第一种为通过多细胞因子共同刺激nk细胞的扩增;第二种为通过滋养层细胞培养扩增nk细胞。
5.多细胞因子共同刺激培养nk细胞的方法又可以分为两种:一是先将pbmc中的nk细胞分离之后再进行培养扩增,以获取高纯度nk细胞;二是直接培养pbmc细胞以扩增nk细胞。经滋养层细胞培养扩增nk细胞的方法中,常用的滋养层细胞包括基因工程改造后的k562细胞以及其它的人为建立的抗原递呈细胞(artificial antigen presenting cell,aapc),也有研究者用自体pbmc作为滋养细胞扩增nk细胞。
6.基于上述,虽然现有的多种nk细胞扩增方法能够满足临床治疗中所要求的剂量。但nk细胞的杀伤数据以及nk细胞的临床表现来看,nk细胞的活性还有较大的提升空间。
技术实现要素:
7.为了获得具有更高活性的nk细胞,本技术提供一种滋养层细胞及其在扩增人nk细胞中的应用。
8.第一方面,本技术提供一种滋养层细胞,采用如下的技术方案:
9.一种滋养层细胞,所述滋养层细胞表达细胞因子,所述细胞因子包括cd80、cd70、cd86、4-1bbl、cd40、cd58、cd83和mica;所述滋养层细胞为nih 3t3细胞。
10.优选的,所述cd80包括如seq id no 1所示的氨基酸序列。
11.优选的,所述cd70包括如seq id no 4所示的氨基酸序列。
12.优选的,所述cd86包括如seq id no 7所示的氨基酸序列。
13.优选的,所述4-1bbl包括如seq id no 10所示的氨基酸序列。
14.优选的,所述cd40包括如seq id no 13所示的氨基酸序列。
15.优选的,所述cd58包括如seq id no 16所示的氨基酸序列。
16.优选的,所述cd83包括如seq id no 19所示的氨基酸序列。
17.优选的,所述mica包括如seq id no 22所示的氨基酸序列。
18.第二方面,本技术提供一种细胞因子慢病毒载体,采用如下的技术方案:
19.一种细胞因子慢病毒载体,所述慢病毒载体用于制备上述滋养层细胞。
20.优选的,所述慢病毒载体包括cd80编码序列、cd70编码序列、cd86编码序列、4-1bbl编码序列、cd40编码序列、cd58编码序列、cd83编码序列和mica编码序列中的任意一种或至少两种的组合。
21.第三方面,本技术提供一种细胞因子慢病毒,采用如下的技术方案:
22.一种细胞因子慢病毒,所述细胞因子慢病毒包括上述细胞因子慢病毒载体。
23.优选的,所述细胞因子慢病毒由上述细胞因子慢病毒载体和辅助质粒共同导入哺乳动物细胞后得到。
24.优选的,所述哺乳动物细胞包括293细胞、293t细胞、293ft细胞中任意一种。
25.在一个具体的实施方式中,所述哺乳动物细胞为293细胞。
26.在一个具体的实施方式中,所述哺乳动物细胞为293t细胞。
27.在一个具体的实施方式中,所述哺乳动物细胞为293ft细胞。
28.第四方面,本技术提供一种上述滋养层细胞的制备方法,采用如下的技术方案:
29.一种上述滋养层细胞的制备方法,所述制备方法具体包括以下步骤:
30.构建上述细胞因子慢病毒载体,与辅助质粒共同导入哺乳动物细胞,得到上述细胞因子慢病毒;
31.将获得的细胞因子慢病毒侵染宿主细胞,进行转导,得到滋养层细胞。
32.第五方面,本技术提供一种nk细胞扩增培养基,采用如下的技术方案:
33.一种nk细胞扩增培养基,所述培养基包括上述滋养层细胞。
34.优选的,所述nk细胞培养基还包括基础培养液、血清、血浆或抗生素中的任意一种或至少两种的组合。
35.第六方面,本技术提供上述滋养层细胞、细胞因子慢病毒载体、细胞因子慢病毒、滋养层细胞的制备方法或nk细胞扩增培养基在扩增nk细胞中的应用。
36.综上所述,本技术具有以下有益效果:
37.1.本技术是基于滋养层细胞nih 3t3来进行nk细胞的激活和扩增,扩增后的nk细胞表现出良好的抗肿瘤活性,具有更好的安全性和理想的杀伤数据。
38.2.作为滋养层细胞的nih 3t3细胞,为正常的小鼠成纤维细胞,而不是类似k562可能存在潜在安全问题的癌细胞,降低了安全隐患。且以nih 3t3为基础的滋养细胞不含复制病毒,如ebv病毒等,因此,其较人源的滋养细胞也更为安全。
39.3.另外,nih3t3作为异种来源的细胞,其本身就是nk细胞的靶细胞,会被高细胞毒性的nk细胞清除,即便不经过辐照也无因残留引发的安全性问题。
40.4.同时,nih3t3细胞可以有效地进行工程化改造,以表达各种nk细胞激活分子,从而使nk细胞的纯度范围控制在70-90%左右。
附图说明
41.图1为nih 3t3细胞内各种细胞因子的表达情况。
42.图2为实施例1中nih 3t3细胞与pbmc细胞(来源于志愿者a)共培养后诱导产生nk细胞的检测结果(a:抗体同型对照组;b:抗体组)。
43.图3为实施例2中nih 3t3细胞与pbmc细胞(来源于志愿者b)共培养后诱导产生nk细胞的检测结果(a:抗体同型对照组;b:抗体组)。
44.图4为实施例1中nih 3t3细胞扩增的nk细胞表达抑制性受体kir2dl1的检测结果(a:抗体同型对照组;b:抗体组)。
45.图5为实施例2中nih 3t3细胞扩增的nk细胞表达抑制性受体kir2dl1的检测结果(a:抗体同型对照组;b:抗体组)。
46.图6为不同效靶比下实施例1扩增的nk细胞对胰腺癌细胞panc-1的杀伤结果。
47.图7为不同效靶比下实施例2扩增的nk细胞对胰腺癌细胞panc-1的杀伤结果。
48.图8为不同效靶比下实施例1扩增的nk细胞对胰腺癌细胞bxpc-3的杀伤结果。
49.图9为不同效靶比下实施例2扩增的nk细胞对胰腺癌细胞bxpc-3的杀伤结果。
具体实施方式
50.本技术提供一种滋养层细胞,所述滋养层细胞表达细胞因子,所述细胞因子包括cd80、cd70、cd86、4-1bbl、cd40、cd58、cd83和mica。具体的,所述滋养层细胞为nih 3t3细胞。其中,所述cd80包括如seq id no 1所示的氨基酸序列。所述cd70包括如seq id no 4所示的氨基酸序列。所述cd86包括如seq id no 7所示的氨基酸序列。所述4-1bbl包括如seq id no 10所示的氨基酸序列。所述cd40包括如seq id no 13所示的氨基酸序列。所述cd58包括如seq id no 16所示的氨基酸序列。所述cd83包括如seq id no 19所示的氨基酸序列。所述mica包括如seq id no 22所示的氨基酸序列。
51.本技术还提供一种细胞因子慢病毒载体,所述慢病毒载体用于制备上述滋养层细胞。具体的,所述慢病毒载体包括cd80编码序列、cd70编码序列、cd86编码序列、4-1bbl编码序列、cd40编码序列、cd58编码序列、cd83编码序列和mica编码序列中的任意一种或至少两种的组合。
52.另外,本技术还提供一种细胞因子慢病毒,所述细胞因子慢病毒包括上述细胞因子慢病毒载体。具体的,所述细胞因子慢病毒由上述细胞因子慢病毒载体和辅助质粒共同导入哺乳动物细胞后得到。一步地,所述哺乳动物细胞包括293细胞、293t细胞、293ft细胞中任意一种。
53.本技术提供一种上述滋养层细胞的制备方法,所述制备方法具体包括以下步骤:构建上述细胞因子慢病毒载体,与辅助质粒共同导入哺乳动物细胞,得到上述细胞因子慢病毒;将获得的细胞因子慢病毒侵染宿主细胞,进行转导,得到滋养层细胞。
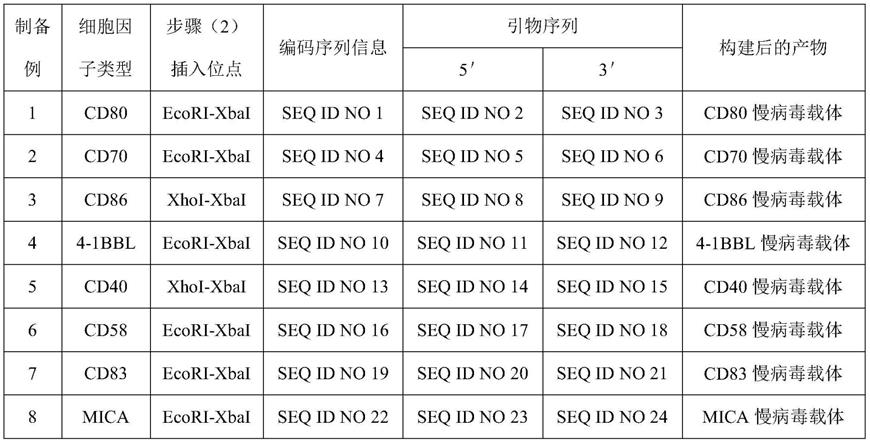
54.此外,本技术还提供一种nk细胞扩增培养基,所述培养基包括上述滋养层细胞。进一步地,所述nk细胞培养基还包括基础培养液、血清、血浆或抗生素中的任意一种或至少两
种的组合。
55.且本技术还提供了上述滋养层细胞、细胞因子慢病毒载体、细胞因子慢病毒、滋养层细胞的制备方法或nk细胞扩增培养基在扩增nk细胞中的应用。
56.本技术是基于滋养层细胞nih 3t3来进行nk细胞的激活和扩增,扩增后的nk细胞表现出良好的抗肿瘤活性和较好的安全性。另外,nih3t3作为异种来源的细胞,其本身就是nk细胞的靶细胞,会被高细胞毒性的nk细胞清除,即便不经过辐照也无因残留引发的安全性问题。
57.以下结合制备例1-24、实施例1-2、对比例1-2。附图1-9以及检测试验对本技术作进一步详细说明。
58.制备例
59.制备例1-8
60.制备例1-8分别提供了一种细胞因子慢病毒载体的构建方法。其区别之处在于制备的细胞因子慢病毒载体中细胞因子的种类不同。具体操作步骤如下:
61.(1)获取细胞因子的编码序列信息,设计引物并由第三方公司进行引物合成;
62.(2)以淋巴结细胞的cdna为模板,克隆细胞因子的编码区域,并经酶切后插入慢病毒载体ecori-xbai或xhoi-xbai位点,转化到e.coli;经测序正确后,摇菌、提取,获得细胞因子慢病毒载体;
63.其中,细胞因子编码序列信息的获取途径为ncbi数据库;淋巴结细胞市售可得。
64.上述制备例1-8对应的细胞因子种类、及其编码序列信息、及其对应的引物信息如表1所示。
65.表1各细胞因子的编码序列信息及其对应的引物信息
[0066][0067]
制备例9-16
[0068]
制备例9-16分别提供了一种细胞因子慢病毒载体的生产方法。其区别之处在于生产的细胞因子慢病毒载体的种类不同,具体操作步骤如下:
[0069]
(1)分别将制备例1-8获得的细胞因子慢病毒载体与混合包装质粒通过转染试剂-磷酸钙转染试剂共转染293细胞(人肾上皮细胞系),获得共转染后的293细胞;将共转染后的293细胞于37℃的co2培养箱内培养,分别于培养24h、48h、72h时取培养后的上清液,获得
共转染后的293细胞的上清液。其中,混合包装质粒包括vsv-g、gag-pol和rev的表达质粒。
[0070]
(2)收集步骤(1)培养后的共转染后的293细胞的上清液,并将收集后的上清液于4℃、25000r/min的条件下离心2h;弃去离心后的上层液,留沉淀;将获得的沉淀用rpmi1640培养基重悬,获得携带细胞因子基因的慢病毒,冻存于-80℃冰箱,备用。
[0071]
上述制备例9-16对应的细胞因子慢病毒载体如表2所示。
[0072]
表2制备例9-16对应的细胞因子慢病毒载体
[0073]
制备例编号慢病毒载体种类生产后的产物9制备例1-cd80慢病毒载体携带cd80基因的慢病毒10制备例2-cd70慢病毒载体携带cd70基因的慢病毒11制备例3-cd86慢病毒载体携带cd86基因的慢病毒12制备例4-4-1bbl慢病毒载体携带4-1bbl基因的慢病毒13制备例5-cd40慢病毒载体携带cd40基因的慢病毒14制备例6-cd58慢病毒载体携带cd58基因的慢病毒15制备例7-cd83慢病毒载体携带cd83基因的慢病毒16制备例8-mica慢病毒载体携带mica基因的慢病毒
[0074]
制备例17
[0075]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0076]
本制备例与制备例9的区别之处在于:转染试剂为脂质体转染试剂。
[0077]
制备例18
[0078]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0079]
本制备例与制备例9的区别之处在于:转染试剂为高分子聚合物转染试剂。
[0080]
制备例19
[0081]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0082]
本制备例与制备例9的区别之处在于:共转染的细胞为293t细胞(淋巴细胞)。
[0083]
制备例20
[0084]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0085]
本制备例与制备例9的区别之处在于:共转染的细胞为293ft细胞(人胚肾细胞)。
[0086]
制备例21
[0087]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0088]
本制备例与制备例9的区别之处在于:步骤(2)收集步骤(1)培养后的共转染后的293细胞的上清液,并于3000r/min的室温条件下离心10min,取上清液,向其中加入4
×
peg8000浓缩液(peg-8000的浓度为40%(w/v),nacl浓度为1.2m),混匀后4℃静置过夜。次日,于4℃、3000r/min的条件下离心30-60min;弃去离心后的上层液,留沉淀;将获得的沉淀用rpmi1640培养基重悬后冻存于-80℃冰箱,备用。
[0089]
制备例22
[0090]
本制备例提供了一种细胞因子慢病毒载体的生产方法。
[0091]
本制备例与制备例21的区别之处在于:步骤(2)中4℃、离心时的转速为1600g。
[0092]
制备例23
[0093]
本制备例提供了一种包括8种细胞因子的滋养层细胞(nih 3t3细胞)的制备方法。
8种细胞因子分别为cd80、cd70、cd86、4-1bbl、cd40、cd58、cd83、mica。利用的8种细胞因子慢病毒载体分别为制备例1-8制备且经制备例9-16生产的cd80慢病毒载体。cd70慢病毒载体。cd86慢病毒载体。4-1bbl慢病毒载体、cd40慢病毒载体、cd58慢病毒载体、cd83慢病毒载体、mica慢病毒载体。本制备例中,8种慢病毒载体转入nih 3t3细胞的顺序是可以变换的,不影响转入慢病毒载体后的nih3t3细胞对nk细胞的诱导效果。
[0094]
具体操作步骤如下:
[0095]
(1)复苏培养nih 3t3细胞:将购自atcc的nih 3t3细胞复苏,获得复苏后的nih 3t3细胞;
[0096]
(2)将步骤(1)获得的复苏后的nih 3t3细胞按照3
×
10
5-5
×
105个/孔接种于6孔板的孔中,同时向孔内加入制备例9获得的携带cd80基因的病毒液和制备例10获得的携带cd70基因的病毒液,病毒moi值控制在5-10;并加入终浓度为10ug/ml聚凝胺溶液,混匀后于37℃条件下进行转导培养,培养6h后更换含血清的培养基,继续培养24h;
[0097]
(3)将步骤(2)培养获得的培养物吸弃培养基上清,并按照步骤(2)的操作重新加入细胞因子慢病毒载体和聚凝胺,再次进行病毒转导培养,培养6h后更换含血清的培养基,继续培养24h;
[0098]
(4)重复上述操作,病毒转染后的第三天,消化细胞,并取部分细胞用于流式细胞仪分析,确定nih 3t3细胞中cd80细胞因子、cd70细胞因子的表达情况;
[0099]
(5)确定cd80细胞因子、cd70细胞因子在nth3t3细胞内表达后,继续按照上述步骤(1)-步骤(4)的操作,利用制备例11-16获得的携带cd86基因的病毒液、携带4-1bbl基因的病毒液、携带cd40基因的病毒液、携带cd58基因的病毒液、携带cd83基因的病毒液、携带mica基因的病毒液,将各基因依次转入nih 3t3细胞,从而获得表达8种细胞因子的nih 3t3细胞,并利用流式细胞仪检测,确认8种细胞因子在nih 3t3细胞内的表达情况。
[0100]
本制备例获得的感染了8种慢病毒的nih 3t3细胞中8种细胞因子的表达情况如图1所示。
[0101]
图1为nih 3t3细胞内各种细胞因子的表达情况。
[0102]
从图1可知,nih 3t3细胞可以高效表达cd80、cd70、cd86、4-1bbl、cd40、cd58、cd83以及mica细胞因子。
[0103]
实施例
[0104]
实施例1
[0105]
本实施例提供了一种利用nih 3t3细胞与pbmc细胞共培养扩增nk细胞的方法。其中,nih 3t3细胞为制备例23制得的包括8种细胞因子的nih 3t3细胞。pbmc细胞来源于健康志愿者a用于后续实验。具体操作步骤如下:
[0106]
(1)取正常培养的nih 3t3细胞,经胰酶消化接种至6孔板内,待nih 3t3细胞汇合度至80%~90%左右时,将孔内液体更换为含5%人血清+无血清培养基(例如x-vivo15)的培养系统内,同时按照按照2
×
10
6-3
×
106/ml的细胞浓度加入pbmc细胞,同时加入500-1000unit/ml重组白介素2(il2)于37℃环境下共培养。
[0107]
(2)共培养24h后,观察nih 3t3细胞与pbmc细胞共培养后的状态,发现培养基颜色偏黄,且pbmc细胞已具备形态且细胞密度高。按照培养体系中细胞密度为1
×
106~1.5
×
106/ml的比例添加含5%人血清的培养基和500~1000unit/ml il2,轻轻吹打混匀,继续培
养24h。
[0108]
(3)3-5d后,细胞计数,按照培养体系中细胞密度为1
×
106~1.5
×
106/ml的比例添加含5%人血清的培养基和500~1000unit/ml il2继续培养。
[0109]
(4)免疫细胞生长速度基本稳定,第6天开始,每天对半补加新鲜的含5%人血清的x-vivo15培养基和按照新补液的体积添加1000uni/ml il2,使第二天补液前的细胞密度维持在2
×
106~3
×
106/ml。根据培养液总体积更换大容量培养瓶或培养袋。此阶段可以不再使用自体血清进行培养,细胞可维持较好的长势,获得利用nih 3t3细胞与pbmc细胞共培养扩增的nk细胞。
[0110]
实施例2
[0111]
本实施例提供了一种利用nih 3t3细胞与pbmc细胞共培养扩增nk细胞的方法。其与实施例1的区别之处在于pbmc细胞的来源不同。本实施例中,pbmc细胞来源于健康志愿者b用于后续实验。
[0112]
对比例
[0113]
对比例1
[0114]
本对比例提供了一种利用纯细胞因子法扩增获得的nk细胞。具体扩增方法参考cn108676775a说明书实施例2的方案。该nk细胞以a549(人肺癌细胞)作为靶细胞,在效靶比为5:1时,培养过夜,nk细胞对a549细胞的杀伤率为26.17%。
[0115]
对比例2
[0116]
本对比例提供了一种利用表达多种细胞因子的k562细胞作为滋养层细胞扩增获得的nk细胞。具体扩增方法参考cn105985931a说明书中试验组的方案。该nk细胞以a549(人肺癌细胞)作为靶细胞,在效靶比为10:1时,培养90h的nk细胞对a549的杀伤率达到90.64%。
[0117]
检测试验
[0118]
检测试验一
[0119]
以实施例1-2培养至第14天的细胞作为检测对象,利用流式细胞仪,检测nih 3t3细胞与pbmc细胞共培养后诱导产生的nk细胞、以及该nk细胞表达抑制性受体kir2dl1的情况。
[0120]
检测结果如图2-5所示。
[0121]
其中,图2和图3为nih 3t3细胞与pbmc细胞共培养后诱导产生nk细胞的检测结果。
[0122]
图2为实施例1中nih 3t3细胞与pbmc细胞(来源于志愿者a)共培养后诱导产生nk细胞的检测结果(a:抗体同型对照组;b:抗体组)。
[0123]
图3为实施例2中nih 3t3细胞与pbmc细胞(来源于志愿者b)共培养后诱导产生nk细胞的检测结果(a:抗体同型对照组;b:抗体组)。
[0124]
其中,图4和图5为nih 3t3细胞扩增的nk细胞表达抑制性受体的检测结果。
[0125]
图4为实施例1中nih 3t3细胞扩增的nk细胞表达抑制性受体kir2dl1的检测结果(a:抗体同型对照组;b:抗体组)。
[0126]
图5为实施例2中nih 3t3细胞扩增的nk细胞表达抑制性受体kir2dl1的检测结果(a:抗体同型对照组;b:抗体组)。
[0127]
由图2和图3可知,本技术利用nih 3t3细胞与pbmc细胞共培养后诱导产生的nk细
胞形态健康、饱满。其中,nih 3t3细胞与pbmc细胞(来源于志愿者a)共培养后扩增的cd3-cd56+细胞比例为71.6%;nih 3t3细胞与pbmc细胞(来源于志愿者b)共培养后扩增的cd3-cd56+细胞比例为73.8%。
[0128]
另外,由图4和图5可知,本技术利用nih 3t3细胞与pbmc细胞共培养后诱导产生的nk细胞中抑制性受体kir2dl1重组蛋白(杀伤细胞免疫球蛋白样受体2dl1重组蛋白)的表达较低,说明本技术制备的nk细胞处于激活状态,有利于发挥强效杀伤作用。
[0129]
检测试验二
[0130]
分别以实施例1、实施例2扩增获得的nk细胞为检测对象,进行检测试验,检测其对胰腺癌细胞的杀伤能力。
[0131]
检测方法
[0132]
一.准备用于试验的nk细胞
[0133]
(1)取实施例1、实施例2培养至第14天的细胞悬液10ml,并于1000r/min条件下离心5min,弃上清;利用5ml pbs重悬洗涤细胞,并于1000r/min条件下离心5min,弃上清;利用500ul无血清x-vivo15培养基重悬细胞,同时按照说明书要求1
×
107个细胞对应1
×
107个磁珠,根据细胞数量加入cd3磁珠,并置于室温条件下50r/min的摇床上摇晃15min,使磁珠与细胞充分接触,获得带有磁珠的细胞悬液;
[0134]
(2)将步骤(1)获得的带有磁珠的细胞悬液用5ml pbs稀释,颠倒混匀后,置于磁力架上静置2min;小心将上清液转移至干净离心管内;利用pbs重复上述洗涤操作;两次,并将洗涤后的上清液转移至同一离心管内,获得从带有磁珠的细胞悬液中分离出的细胞悬液;
[0135]
(3)将步骤(2)获得的细胞悬液于1000r/min条件下离心5min,离心,弃上清;利用含5%人血清的x-vivo15培养基重悬阴性筛选后获得nk细胞,将其转移至培养皿内,按照终浓度为500-1000unit/ml向培养基中加入il2,37℃静置培养;
[0136]
(4)培养至第5天时,取nk细胞用于肿瘤细胞杀伤试验。
[0137]
二、准备胰腺癌细胞
[0138]
在杀伤试验的前三天,复苏稳定表达荧光素酶的胰腺癌细胞,并培养传代,使其在杀伤试验时处于最适生长状态。
[0139]
三、杀伤试验
[0140]
(1)消化计数胰腺癌细胞,按照细胞数5
×
104/孔将胰腺癌细胞接种于24孔板内;待胰腺癌细胞完全贴壁后,按照效靶比(e:t)为1.25:1、2.5:1、5:1、10:1的比例向24孔板内分别加入nk细胞,每个效靶比设置三个平行孔,混匀后将24孔板置于37℃的培养箱内,静置培养4h。
[0141]
(2)取步骤(1)培养的24孔板,于显微镜下观察胰腺癌细胞。
[0142]
(3)取步骤(1)培养的24孔板,吸弃培养基上清,用pbs轻轻洗涤孔内细胞2次,彻底吸干孔内液体;取100ul荧光素酶检测专用细胞裂解液裂解细胞,冰上静置10min,充分吹打孔底细胞后,将细胞裂解液转移至ep管内,并于4℃、14000r/min条件下离心5min;然后将离心后的上清液转移至干净的ep管内,获得细胞裂解产物;
[0143]
(4)检测:向酶标板内加入100ul荧光素酶底物,快速吸取细胞裂解产物20ul至底物孔内,立即上机检测;选择多功能酶标仪上荧光素酶报告基因检测方案,检测各孔内的荧光强度;并根据实验孔与对照孔荧光强度的比值,计算得出各效靶比下nk细胞对胰腺癌细
胞的杀伤能力。
[0144]
检测结果
[0145]
通过上述步骤(2)利用显微镜观察24孔板孔内的胰腺癌细胞,发现胰腺癌细胞的数量显著减少。
[0146]
杀伤检测结果如图6-9所示。
[0147]
图6为不同效靶比下实施例1扩增的nk细胞对胰腺癌细胞panc-1的杀伤结果。
[0148]
图7为不同效靶比下实施例2扩增的nk细胞对胰腺癌细胞panc-1的杀伤结果。
[0149]
图8为不同效靶比下实施例1扩增的nk细胞对胰腺癌细胞bxpc-3的杀伤结果。
[0150]
图9为不同效靶比下实施例2扩增的nk细胞对胰腺癌细胞bxpc-3的杀伤结果。
[0151]
由图6和图7可知,本技术利用nih 3t3细胞与pbmc细胞共培养后诱导产生的nk细胞对胰腺癌细胞panc-1具有显著的杀伤效果,仅在1.25:1效靶比下,对胰腺癌细胞panc-1可产生40-60%的杀伤率。另外,由图8和图9可知,本技术利用nih 3t3细胞与pbmc细胞共培养后诱导产生的nk细胞对胰腺癌细胞bxpc-3同样具有显著的杀伤效果,仅在1.25:1效靶比下,对胰腺癌细胞bxpc-3可产生45-75%的杀伤率。
[0152]
与对比例1、对比例2相比,本技术基于滋养层细胞nih 3t3来进行nk细胞的激活和扩增,扩增后的nk细胞可在体外培养较长时间且表现出良好的抗肿瘤活性。同时,本技术较对比例2中使用的k562滋养层细胞更加安全。
[0153]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1