一种简约式光合菌培养基及其应用的制作方法
1.本发明属于光合菌的培养技术领域,具体涉及一种简约式光合菌培养基及其应用。
背景技术:
2.光合细菌(photosynthetic bacteria,psb)是一类具有原始光合体系、能在厌氧或兼性厌氧环境中进行光合作用不产氧气的原核生物的总称。光合菌属于细菌门,真细菌纲的红螺菌菌目,红螺菌亚目,其中包括红色红螺菌(或称深红红螺菌)、度光红螺菌、巨大红螺菌、长形红螺菌、纤细红螺菌(或称细小红螺菌)、棕黄色红螺菌(或称黄褐红螺菌)等。此类细菌均生长于水和淤泥中,属厌氧或微嗜氧菌,在厌氧条件下,利用光能合成有机物。该类细菌的细胞呈螺旋状盘绕,长度不一,有不等数蜷曲.同种细胞的大小变化很大,有端生丛毛,能运动。细胞内含有菌紫素、菌绿素和类胡罗卜素等.故细菌呈红色、褐红色、绛红色或玫瑰色不一。其中,沼泽红假单胞菌呈柱状,偶有弯曲、有荚膜及极生鞭毛,能运动,细胞团块呈深浅不一的红色或紫红色,是最为常见的光合菌,也是不产氧光合细菌的代表种,广泛分布在自然界中,尤其是在高浓度腐败有机物质的水生环境中。同时,沼泽红假单胞菌也是我国早期允许使用的饲料级微生物之一,具有固氮、氨化、氨同化和反硝化等氮代谢机制,在水产养殖生产中应用广泛。光合菌生命力强、繁殖快,对其生长的营养要求不高;光合菌菌体富含类胡萝卜素、蛋白质、维生素b及辅酶q10,且具有无毒害作用等特点,在许多领域以及人类生活的诸多方面均发挥着越来越重要的作用,特别是在有机废水处理、生物产氢、生物制药等领域。近年来,光合菌培养方法的优化,尤其是高浓菌液培养技术的研究受到了广泛的重视。但是由于高浓光合菌液的培养技术,以及菌落数计数的简便检测、判断以及评价方法和标准建立的滞后,严重制约了光合菌的生物学应用。
3.当前,生产光合菌等微生物的最佳工艺是液体发酵,但一些企业由于缺乏液态发酵和后加工设备以及专业技术人员,而采用投资少、工艺简单的固体发酵法来生产微生态制剂,但此法生产的微生态产品有效微生物的含量低,易受杂菌污染,质量难以控制。因此,简化液体发酵的工艺具有重要的经济价值。
4.目前,光合菌的生产方式主要有两种。一种是露天培养,即利用密封的透明塑料瓶发酵菌株,这种方式的发酵量少,在小微企业和养殖户中应用较多,是光合菌养殖生产中的主要生产方式。还有一种是发酵罐生产,这种方法主要是在一些大型企业使用,由于成本高,操作复杂,而调水使用的光合菌等对培养物的纯度要求不高,因此这种生产方式相对较少。但是不论哪种生产方式,其生产的培养基都要精心挑选,因此,培养基的配方是决定光合菌生产的核心组成部分之一。
5.目前,有较多针对光合菌生产培养的培养基,比如中国专利cn202011561045.8的膜浓缩沼液、cn201910902322.8的光合细菌培养基、cn201810463733.7的光合细菌培养菌剂。但现有的培养基配方工艺复杂,对储运等条件要求高,对原料的等级要求高,导致成本高。而光合菌类产品虽然应用广泛,但其生产工艺简单,且对纯度等要求不高,因此其成本
很大程度上取决于培养基和生产操作。
技术实现要素:
6.为了克服上述现有技术的不足,本发明提出了一种简约式光合菌培养基,在保证维生素营养和矿物营养的前提下,简化了传统光合菌培养的分,从而大大降低了生产成本,短时间(3天)内可快速提高生产效率,可以迅速获得较高产量,具有很好的理论价值和实际生产意义。
7.为了实现上述目的,本发明所采用的技术方案是:
8.本发明提供了一种简约式光合菌培养基,所述培养基包括乙酸钠、氯化铵、硫酸镁、磷酸二氢钾、氯化亚铁、氯化钙和维生素,所述维生素包括vb1、烟酸vb3、对氨基苯甲酸、生物素和vb
12
;各所述原料的纯度均为农业肥料级,所述培养基的ph为6.5
‑
8.2。
9.光合菌的培养基通常包括基本的碳源、氮源、矿物质以及微生物营养等组分。其中,光合菌培养基的碳源最初采用的是碳酸氢盐,而由于碳酸氢钠在碳酸氢盐中的可溶性最好,因而以碳酸氢钠为主。但由于碳酸氢钠溶液的ph较高,对光合菌的生长也会带来一定的影响,同时,由于碳酸氢盐类的利用速度快,往往会导致后期培养的速度跟不上,使培养菌液的终浓度低,特别是活性细菌量低,并且会导致死菌在底部造成沉积。因此,光合菌培养基的碳源后面陆续被糖蜜等成分复杂的多糖所替代,虽然这些成分复杂的有机物碳源能很好的平衡光合菌在生长过程中的各种营养需求,但由于多糖成分复杂,且受到制糖工艺的影响,导致其供应跟不上。后来,经典的ormemerod培养基采用了苹果酸钠作为碳源,但由于成本较高,很早就被乳酸钠和乙酸钠代替。乳酸钠和乙酸钠对光合菌的生长影响基本相同,但前者的成本约为后者的4倍,所以前者常用于食品加工中,而后者才被应用于光合菌的培养中。
10.此外,光合菌培养基中往往还需要添加一定量的微量元素,但其所添加的微量元素一直以来都是沿用过去的酵母膏的做法,虽然效果好,但是成本高,且储藏和运输不方便,使这种原料渐渐不适应现代化生产的需要。
11.本发明简化了光合菌培养基的配方,使用离子铵作为氮源,并利用发酵过程中二氧化碳通过呼吸作用产生的co
32
‑
、hco3‑
等平衡了八大离子(k
+
、na
+
、ca
2+
、mg
2+
、cl
‑
、so
42
‑
、co
32
‑
、hco3‑
)的分配情况,还添加了fe
2+
,ca
2+
等矿物元素,且对维生素的添加进行了优化,最终研制一套新的光合菌培养基生产配方,既可降低生产风险,又可提高生产效率。同时,本发明使用的是各种农业肥料级原料(即工业级即可,无需分析纯),降低了原成本的70%左右(表1),从而极大的拓宽了该类制品的利润空间。由于成分简化,降低了生产操作强度,极大的促进了生产的进步。在提升光合菌批量培养以及生产实际应用方面都具有重要的意义。
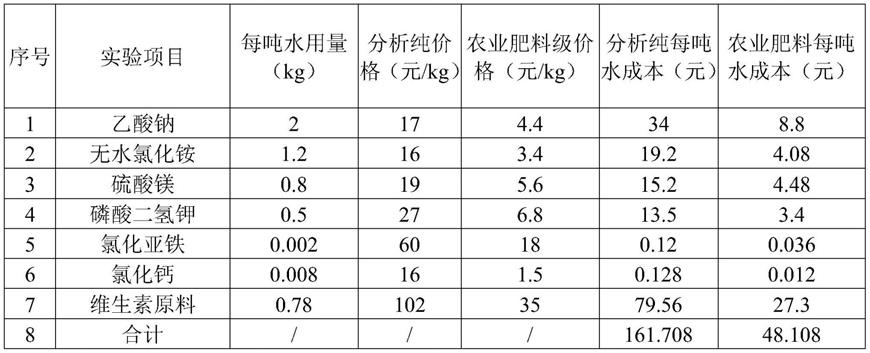
12.表1培养基中各种成分的价格成本核算表
[0013][0014]
优选地,上述的一种简约式光合菌培养基具体为:每升水中包含乙酸钠1.5
‑
3g、氯化铵1
‑
1.5g、硫酸镁0.6
‑
1.4g、磷酸二氢钾0.5
‑
0.8g、氯化亚铁0.002
‑
0.008g、氯化钙0.008
‑
0.02g;维生素的添加量为:vb
1 0.2
‑
0.5g、烟酸vb
3 0.15
‑
0.30g、对氨基苯甲酸0.05
‑
0.15g、生物素0.04
‑
0.10g、vb
12 0.05
‑
0.10g;各所述原料的纯度均为农业肥料级,所述培养基的ph为6.5
‑
8.2。
[0015]
作为本发明的一个优选实施方式,上述的一种简约式光合菌培养基具体为:每升水中包含乙酸钠2g、氯化铵1.2g、硫酸镁0.8g、磷酸二氢钾0.5g、氯化亚铁0.002g、氯化钙0.01g;维生素的添加量为:vb
1 0.30g、烟酸vb
3 0.250g、对氨基苯甲酸0.100g、生物素0.060g、vb
12 0.070g;各所述原料的纯度均为农业肥料级。
[0016]
优选地,所述培养基的ph为7.2
‑
7.8。进一步地,所述培养基的ph为7.8。
[0017]
优选地,上述简约式光合菌培养基的使用方法为:各所述维生素按比例配制成等规格后单独包装;所述氯化亚铁单独包装;所述乙酸钠、氯化铵、硫酸镁、磷酸二氢钾和氯化钙按比例配制成等规格后也单独包装;使用时,再按比例混合在一起制成培养基。
[0018]
本发明还提供了上述的简约式光合菌培养基在培养富集和分离光合菌中的应用。
[0019]
优选地,在分离光合菌时,需要将所述培养基制成双层培养基,所述双层培养基包括上层培养基和下层培养基,所述为上层培养基为添加琼脂制成的全固体培养基,所述下层培养基为添加琼脂制成的半固体培养基。
[0020]
与现有技术相比,本发明的有益效果是:
[0021]
本发明提供了一种简约式光合菌培养基,所述光合菌培养基包括乙酸钠、氯化铵、硫酸镁、磷酸二氢钾、氯化亚铁、氯化钙和维生素,其中维生素包括对氨基苯甲酸、生物素量为、vb3、vb
12
和vb1,本发明的培养基配方简单实用,生产效率高,对所用药品的等级并无特别要求,达到农业肥料级即可,且原料易得、便宜、来源稳定,在适宜条件范围内,对沼泽红假单胞菌、荚膜红细菌、深红红螺菌等红螺菌科光合细菌具有相同的富集作用,3天即可达到活菌数在1
×
109以上,适宜大规模生产化使用,应用于光合菌的培养富集以及分离中,可以加快培养的速度,提高生产效率,具有很好的理论价值和实际生产意义。
具体实施方式
[0022]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明
各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0023]
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
[0024]
实施例1一种简约式光合菌培养基
[0025]
每升水中包含乙酸钠2g、氯化铵1.2g、硫酸镁0.8g、磷酸二氢钾0.5g、氯化亚铁0.002g、氯化钙0.01g。
[0026]
维生素的添加量为:vb
1 0.30g、烟酸vb
3 0.250g、对氨基苯甲酸0.100g、生物素0.060g、vb
12 0.070g;ph为7.2
‑
7.8;上述各原料的纯度均为农业肥料级。
[0027]
各种维生素按比例配制成等规格后单独包装;氯化亚铁须单独包装;乙酸钠、氯化铵、硫酸镁、磷酸二氢钾、氯化钙按比例配制成等规格后也单独包装。使用时,再按比例混合在一起制成培养基。
[0028]
在进行富集时可以直接使用本培养基。在培养和分离过程中需要将本培养基制成双层培养基:上层培养基为全固体培养基,即在本培养基的基础上每升水中增加20g琼脂;下层为半固体培养基,即在本培养基的基础上每升水中增加10g琼脂。
[0029]
实施例2一种简约式光合菌培养基
[0030]
每升水中包含乙酸钠1.5g、氯化铵1g、硫酸镁0.6g、磷酸二氢钾0.5g、氯化亚铁0.002g、氯化钙0.008g;
[0031]
维生素的添加量为:vb
1 0.2g、烟酸vb
3 0.15g、对氨基苯甲酸0.05g、生物素0.04g、vb
12 0.05g;ph为7.2
‑
7.8;上述各原料的纯度均为农业肥料级。
[0032]
各种维生素按比例配制成等规格后单独包装;氯化亚铁须单独包装;乙酸钠、氯化铵、硫酸镁、磷酸二氢钾、氯化钙按比例配制成等规格后也单独包装。使用时,再按比例混合在一起制成培养基。
[0033]
在进行富集时可以直接使用本培养基。在培养和分离过程中需要将本培养基制成双层培养基:上层培养基为全固体培养基,即在本培养基的基础上每升水中增加20g琼脂;下层为半固体培养基,即在本培养基的基础上每升水中增加10g琼脂。
[0034]
实施例3一种简约式光合菌培养基
[0035]
每升水中包含乙酸钠3g、氯化铵1.5g、硫酸镁1.4g、磷酸二氢钾0.8g、氯化亚铁0.008g、氯化钙0.02g;
[0036]
维生素的添加量为:vb
1 0.5g、烟酸vb
3 0.30g、对氨基苯甲酸0.15g、生物素0.10g、vb
12 0.10g;ph为7.2
‑
7.8;上述各原料的纯度均为农业肥料级。
[0037]
各种维生素按比例配制成等规格后单独包装;氯化亚铁须单独包装;乙酸钠、氯化铵、硫酸镁、磷酸二氢钾、氯化钙按比例配制成等规格后也单独包装。使用时,再按比例混合在一起制成培养基。
[0038]
在进行富集时可以直接使用本培养基。在培养和分离过程中需要将本培养基制成双层培养基:上层培养基为全固体培养基,即在本培养基的基础上每升水中增加20g琼脂;下层为半固体培养基,即在本培养基的基础上每升水中增加10g琼脂。
[0039]
对比例1无矿物光合菌培养基
[0040]
每升水中包含乙酸钠2g、氯化铵1.2g、硫酸镁0.8g、磷酸二氢钾0.5g。
[0041]
维生素的添加量为:vb
1 0.30g、烟酸vb
3 0.250g、对氨基苯甲酸0.100g、生物素
0.060g、vb
12 0.070g。
[0042]
实验例1本发明的光合菌培养基对沼泽红假单胞菌的培养效果
[0043]
从2021年5月28日开始,分别使用实施例1的培养基、对比例1的培养基以及商业化光合菌培养基(购自南京绿邦生态科技有限公司)对沼泽红假单胞菌(rhodopseudomonas palustris)进行培养。
[0044]
培养过程中,按各培养基的配方将其配制在1000l的发酵罐内,培养基的ph均为7.8,然后加入30%(体积百分比)的预先培养好的沼泽红假单胞菌菌液(浓度为1.0
×
109cfu/ml),搅拌均匀后直接灌入10l透明塑料瓶中,现场取样,用紫外分光光度计在570nm波长下检测初始吸光值,之后置于自然光下进行培养,并适当遮荫,使光照维持在6000lx左右,气温为28℃,培养3h、23h、46.5h、67h后分别取样检测(每个实验组测三个重复)。
[0045]
由表2所示,本发明的培养基的菌液终浓度均大于2.0
×
10
10
cfu/ml(od>1.6)。基本在培养后46小时即达到平台期,且67小时时(约3天)还能保持生长态势,优于无矿物光合菌培养基和商业化的光合菌培养基。
[0046]
表2不同培养基对沼泽红假单胞菌规模化培养的实验结果统计
[0047][0048]
实验例2本发明的光合菌培养基对荚膜红细菌、沼泽红假单胞菌和深红红螺菌的培养效果
[0049]
从2021年5月31日开始,使用实施例1的培养基分别对荚膜红细菌(rhodobacter capsulatus)、沼泽红假单胞菌(rhodopseudomonas palustris)、深红红螺菌(rhodospirillum rubrum)进行培养,分别标记为rc组、rp组和rr组。
[0050]
培养过程中,按培养基的配方将其配制在1000l的发酵罐内,配液混匀培养,培养基的ph为7.8,然后往各实验组加入30%的菌液(1.0
×
109cfu/ml),搅拌均匀后直接灌入10l透明塑料瓶中,现场取样,用紫外分光光度计在570nm波长下检测吸光值,之后置于自然光下进行培养,并适当遮荫,使光照维持在6000lx左右,气温维持在28
‑
30℃,培养3.5h、14h、22h、44h、60h、86h、112h(4.5d)后分别取样检测。
[0051]
如表3所示,经过4.5d的培养后三种光合菌的培养都能达到1.0
×
10
10
cfu/ml(od>1.5)以上。
[0052]
表3不同光合菌规模化培养实验的检测数据统计
[0053][0054]
实验例3本发明的培养基对光合菌的分离效果
[0055]
于2021年3
‑
4月对花地河的污泥进行光合菌分离。取15g河底污泥加入50ml水中震荡,沉淀后取上清,将上清加入250ml无菌锥形瓶中,然后往瓶中注满实施例1的培养基,密封瓶口,置于培养箱中在30℃、光照3500~4500lx下厌氧富集培养。待液体培养物呈红色或红褐色后转移至新培养基(实施例1的培养基),重复2~3次。对富集得到的菌液进行梯度稀释,取适宜稀释度的菌液与冷却至40~50℃的双层培养基的下层混合,然后注入平皿中,制备较薄(1
‑
2cm)的一层平板,待下层培养基凝固后,注入上层培养基,并注满整个平皿。采用上述双层平板法多次分离后得到菌落形态一致的纯菌落,呈椭圆形,表面光滑、湿润,直径2~3mm,边缘整齐,淡黄色至鲜红色。菌液在光照充足且厌氧条件下呈鲜红色,好氧,菌液混浊有少许沉淀。最后将菌株穿刺接种于半固体培养基(实施例1的培养基加琼脂制备而成),保存备用。
[0056]
对该菌进行革兰氏染色,呈阴性,细胞呈卵状,在16
×
100倍光学显微镜下观察,可以看到大小为2.5~3.5μm
×
2μm的球形菌,极生鞭毛,能快速运动,以二分裂方式繁殖。
[0057]
对其外部形态和16srna序列进行检测,检测结果显示该菌可能是球形红细菌(rhodobacter sphaeroides),一种在环境保护中应用的光合菌,常用于有害重金属去除(白红娟,张肇铭,杨官娥,等.球形红细菌转化去除重金属镉及其机理研究[j].环境科学学报,2006,26(11):1809
‑
1814.)和降解有机污染物(王玉芬,张肇铭,胡筱敏,等.球形红细菌厌氧降解邻二氯苯及其机理研究[j].微生物学通报,2008(05):23
‑
30)等。
[0058]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1