包含变异的AAV9衣壳蛋白的重组腺相关病毒颗粒的制作方法
包含变异的aav9衣壳蛋白的重组腺相关病毒颗粒
技术领域
1.本发明涉及基因工程领域,具体而言,涉及一种包含变异的aav9衣壳蛋白的重组腺相关病毒颗粒。
背景技术:
2.腺相关病毒(adeno-associated virus,aav)是一类微小、无被膜及具有二十面体结构的病毒,也是目前发现的一类结构最简单的单链dna缺陷型病毒,需要辅助病毒(通常为腺病毒或疱疹病毒)来完成病毒包装。腺相关病毒是基因递送和表达的一个重要病毒工具。不同的腺相关病毒的血清型由于其具有不同的衣壳蛋白序列及空间构象,导致其识别结合的细胞表面受体也不同,因此感染的细胞、组织类型及感染效率也有较大的差别。
3.常规病毒包装服务要求中,除了提供检测腺相关病毒质粒的表达情况以外,有时也需要提供病毒的表达或者作用情况作为质检数据。通常腺相关病毒需在注射后3~4周后才能检测到其体内表达情况,时间较长,而感染体外细胞通常在2~4天能检测到表达。aav病毒表达检测受限于体内时长问题,而通常会选择体外感染细胞来进行表达检测。所以需要有一个能较低moi感染体外细胞的血清型。有鉴于此,特提出本发明。
技术实现要素:
4.本发明的第一目的在于提供一种重组腺相关病毒颗粒,其包含变异的aav9衣壳蛋白;
5.所述变异的aav9衣壳蛋白中插入有氨基酸片段seq id no:1~seq id no:4的任一种,插入位置以全长为736个氨基酸的野生型aav9衣壳蛋白为参考,介于第588和589位氨基酸之间。
6.本发明的第二目的在于提供一种腺相关病毒包装载体,其包含用于编码如上所述变异的aav9衣壳蛋白的核酸片段。
7.本发明的第三目的在于提供一种腺相关病毒载体系统,其包含一种或多种载体,其中至少一种载体为如上所述的腺相关病毒包装载体。
8.本发明的第四目的在于提供一种如上所述的重组腺相关病毒颗粒的制备方法,其包括:
9.将如上所述的腺相关病毒载体系统引入宿主细胞,并分离如此产生的病毒颗粒。
10.本发明的第五目的在于提供一种药物组合物,其包含如上所述的重组腺相关病毒颗粒和/或如上所述的腺相关病毒载体系统,以及药学上可接受的载体、赋形剂和稀释剂中的任意一种。
11.该重组腺相关病毒颗粒具有更强的感染能力,相比野生型aav9载体,大幅增加了感染阳性率。
附图说明
12.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
13.图1为本发明一个实施例中paav-short ubc-mscarlet-polya-p40-aav9-cap-flex-sv40 polya结构示意图;
14.图2为本发明一个实施例中文库病毒感染nih/3t3细胞的荧光图;a:光镜;b:红光,观察对象为mscarlet;c:绿光,观察目的为排除绿光污染;
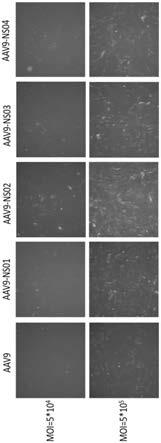
15.图3为本发明一个实施例中突变血清型与aav9病毒感染nih/3t3的荧光图;
16.图4为本发明一个实施例中突变血清型与aav9病毒感染nih/3t3的流式检测图。
具体实施方式
17.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
18.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
19.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
20.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
21.本发明涉及一种重组腺相关病毒颗粒,其包含变异的aav9衣壳蛋白;
22.所述变异的aav9衣壳蛋白中插入有氨基酸片段seq id no:1~seq id no:4的任一种,插入位置以全长为736个氨基酸的野生型aav9衣壳蛋白为参考,介于第588和589位氨基酸之间。
23.本发明所保护的重组腺相关病毒颗粒,其包含变异的aav9衣壳蛋白,但所含基因组可以来自任意aav病毒。“aav病毒”或“aav病毒颗粒”或“raav载体颗粒”指由至少一种aav衣壳蛋白和壳体化多核苷酸raav载体构成的病毒颗粒。“aav”是腺相关病毒的缩写,并且可用于指病毒本身或其衍生物。除非另有需要时,所述术语包括亚型及自然存在和重组形式。缩写“raav”指重组腺相关病毒,也称为重组aav载体(或“raav载”)。术语“aav”可以用于指代不同血清型的腺相关病毒,例如1型aav(aav1)、2型aav(aav2)、3型aav(aav3)、4型aav(aav4)、5型aav(aav5)、6型aav(aav6)、7型aav(aav7)、8型aav(aav8)、9型aav(aav9)、10型aav(aav10)、11型aav(aav11)、12型aav(aav12)、13型aav(aav13)、禽aav、牛aav、犬aav、马aav、灵长类aav、非灵长类aav和羊aav。“灵长类aav”指感染灵长类动物的aav,“非灵长类
aav”指感染非灵长类哺乳动物的aav,“牛aav”指感染牛哺乳动物的aav等。不同亚型aav的基因组序列,以及天然末端重复序列(itr)、rep蛋白和衣壳亚基的序列在本领域中已知。此类序列可在文献或公用数据库例如基因库中找到。
24.本发明所参考的野生型aav9衣壳蛋白(cap)的ncbi号为:ay530579。需要注意的是,上述野生型aav9衣壳蛋白的参考序列不构成对本发明所提及的变异的aav9衣壳蛋白的限制,除seq id no:1~seq id no:4之外,变异的aav9衣壳蛋白的其他氨基酸序列可以与野生型相同,也可以具有部分差异,例如,其他氨基酸序列为与参考序列具有至少约90%(例如,至少约92%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约99.5%、或100%)氨基酸序列同一性的氨基酸序列。容易理解,重组腺相关病毒颗粒优选是感染性raav病毒粒子,进一步的,相对于野生型的腺相关病毒颗粒(特别是aav9),至少提升约10%以上的感染能力(感染能力典型的采用本发明实施例中步骤3所采用方法进行评价),优选提升约15%、约20%、约25%、约30%、约35%、约40%、约50%、约60%、约70%、约80%、约90%、约100%、约110%或约120%以上。
25.在一些实施方式中,所述重组腺相关病毒颗粒的基因组中包含编码目的基因产物的核苷酸序列的异源核酸。
[0026]“异源”指源自和与之比较的其余实体基因型不同的实体。例如,通过基因工程技术引入源自不同物种的质粒或载体中的多核苷酸为异源多核苷酸。取自其天然编码序列并且与并非发现与之天然连接的编码序列操作性连接的启动子为异源启动子。因此,例如,包括编码异源基因产物的异源核酸的raav是包括在自然存在的野生型aav中一般不包括的核酸的raav,并且编码的异源基因产物是一般并非自然存在的野生型aav编码的基因产物。
[0027]
在一些实施方式中,所述目的基因产物为干扰rna或适配体。
[0028]
干扰rna可以选自例如sirna或shrna。
[0029]
在一些实施方式中,所述目的基因产物为多肽。
[0030]
例如,向靶细胞赋予某些所需特征的蛋白质,如允许细胞示踪的荧光蛋白、提供靶细胞中丢失或改变的活性的酶,等等。
[0031]
所述异源核酸的大小一般小于约4700碱基,且将包括例如编码受体个体或靶细胞中有缺陷或缺少的蛋白质的基因(核苷酸序列);编码具有所需生物或治疗效果(例如,抗细菌、抗病毒或抗肿瘤/抗癌功能)的蛋白质的基因;编码抑制或减少有害或另外不希望有的蛋白质的产生的rna的核苷酸序列(例如,编码如上所定义的rna干扰剂的核苷酸序列);和/或编码抗原蛋白的核苷酸序列。
[0032]
适合的异源核酸包括但不限于编码用于治疗以下疾病的蛋白质的核酸:内分泌、代谢、血液、心血管、神经、肌肉骨骼、泌尿、肺和免疫病症,包括如癌症、炎性病症、免疫病症、慢性和感染性病症。癌症例如骨、骨连接、肌肉、肺、气管、心脏、脾脏、动脉、静脉、血液、毛细血管、淋巴结、淋巴管、淋巴液、口腔、咽、食管、胃、十二指肠、小肠、结肠、直肠、肛门、阑尾、肝、胆、胰腺、腮腺、舌下腺、泌尿肾、输尿管、膀胱、尿道、卵巢、输卵管、子宫、阴道、外阴部、阴囊、睾丸、输精管、阴茎、眼、耳、鼻、舌、皮肤、脑、脑干、延髓、脊髓、脑脊液、神经、甲状腺、甲状旁腺、肾上腺、垂体、松果体、胰岛、胸腺、性腺、舌下腺以及腮腺中任一处病变生成的肿瘤;免疫病症例如系统红斑狼疮、多发性硬化症、i型糖尿病、银屑病、溃疡性结肠炎、sjogren综合征、硬皮病、多肌炎、类风湿关节炎、混合性结缔组织病、原发性胆汁性肝硬变、
自身免疫性溶血性贫血、桥本甲状腺炎、addisons病、白斑、graves病、自身免疫性重症肌无力、强直性脊柱炎、变应性骨关节炎、变应性血管炎、自身免疫性噬中性白细胞减少症、特发性血小板减少性紫癜、狼疮性肾炎、慢性萎縮性胃炎、自身免疫性不育、子宫内膜异位症、pasture病、天疱疮、盘状狼疮或致密沉积物疾病;感染性病症可以为病毒、细菌、真菌和寄生虫中的任一种感染,或其联合感染。
[0033]
适合的异源核酸包括但不限于编码包括但不限于以下的多种蛋白质中的任一种的那些:干扰素(例如,ifn-γ、ifn-α、ifn-β、ifn-ω、ifn-τ);胰岛素(例如,诺和灵、优泌林、优泌乐、来得时(humalog)、优乐停(lantus)等);促红细胞生成素(“epo”;例如,或(依泊汀-α);(达贝泊汀-α);(依泊汀-β);等等);抗体(例如,单克隆抗体)(例如,(利妥昔单抗);(英夫利昔单抗);(曲妥单抗);humiratm(阿达木单抗);(奥马佐单抗);(托西莫单抗);raptivatm(依法珠单抗);erbituxtm(西妥昔单抗);(贝伐单抗);等等),包括单克隆抗体的抗原结合片段(例如,(雷珠单抗));血液因子(例如,(阿替普酶)组织纤溶酶原活化蛋白;(重组人因子viia);因子viia;因子viii(例如,);因子ix;β-球蛋白;血红蛋白;等等);集落刺激因子(例如,(非格司亭;g-csf);neulasta(聚乙二醇化非格司亭);粒细胞集落刺激因子(g-csf)、粒细胞单核细胞集落刺激因子、巨噬细胞集落刺激因子、巨核细胞集落刺激因子;等等);生长激素(例如,生长激素(somatotropin),例如,等;人生长激素;等等);白介素(例如,il-1;il-2,包括例如,il-3、il-4、il-5、il-6、il-7、il-8、il-9;等);生长因子(例如,(beclapermin;pdgf);(曲弗明;bfgf);(安西司亭;干细胞因子);角质细胞生长因子;酸性成纤维细胞生长因子、干细胞因子、碱性成纤维细胞生长因子、肝细胞生长因子;等等);可溶性受体(例如,tnf-α结合可溶性受体,如(依那西普);可溶性vegf受体;可溶性白介素受体;可溶性γ/δt细胞受体;等等);酶(例如,α-葡糖苷酶;(imiglucarase;β-葡糖脑苷脂酶、(阿糖苷酶);酶激活剂(例如,组织型纤溶酶原激活剂);趋化因子(例如,ip-10;mig;groα/il-8;rantes;mip-1α;mip-1β;mcp-1;pf-4;等等);血管生成剂(例如,血管内皮生长因子(vegf);抗血管生成剂(例如,可溶性vegf受体);蛋白疫苗;神经活性肽,如血管舒缓激肽、缩胆囊肽、胃泌素、分泌素、催产素、促性腺激素释放激素、β-内啡肽、脑啡肽、p物质、生长激素释放抑制因子、催乳素、甘丙肽、生长激素释放激素、韩蛙皮素、强啡肽、神经降压素、胃动素、促甲状腺激素、神经肽y、黄体生成素、降血钙素、胰岛素、胰高血糖素、加压素、血管紧张素ii、促甲状腺激素释放激素、血管活性肠肽、睡眠肽等;其他蛋白,如溶解血栓剂、心钠肽、骨形态发生蛋白、促血小板生成素、松弛素、胶质细胞原纤维酸性蛋白、促卵泡激素、人α-1抗胰蛋白酶、白血病抑制因子、转化生长因子、胰岛素样生长因子、黄体生成素、巨噬细胞活化因子、肿瘤坏死因子、嗜中性白细胞趋化因子、神经生长因子、金属蛋白酶的组织抑制剂;血管活性肠肽、血管生成素、促血管素、纤维蛋白;水蛭素;白血病抑制因子;il-1受体拮抗剂(例如,(阿那白滞素));离子通道,例如,囊性纤维化跨膜传导调节蛋白(cftr);肌营养不良蛋白(dystrophin);utrophin(一种肿瘤抑制剂);溶酶体酶酸α-葡糖苷酶(gaa);等等。适合的核酸还包括编码任何上述蛋白的功能性片段的那些;以及编码任何上述蛋白的功能性变体的核酸。
[0034]
定义分别插入seq id no:1~seq id no:4任一项所述的多肽的重组腺相关病毒颗粒分别为病毒a、b、c、d。
[0035]
本发明还请求保护组合物,其含有a、b、c、d中的任意2种、3种或4种。优选的,其至
少含有b。
[0036]
本发明还涉及一种腺相关病毒包装载体,其包含用于编码如上所述变异的aav9衣壳蛋白的核酸片段。
[0037]
衣壳蛋白的核酸片段在本发明中通常用cap基因片段表示。
[0038]
本发明还涉及一种腺相关病毒载体系统,其包含一种或多种载体,其中至少一种载体为如上所述的腺相关病毒包装载体。
[0039]
在一些实施方式中,至少一种载体包含二型腺相关病毒的rep基因片段。
[0040]
aav的rep和cap基因指编码腺相关病毒的复制和壳体化蛋白的多核苷酸序列。rep和cap基因可位于相同或不同载体,如质粒上。
[0041]
在一些实施方式中,至少一种载体为包装载体,所述包装载体负责编码异源核酸以及两个末端反向重复序列;其中所述异源核酸为如上所述的异源核酸所定义。
[0042]
在一些实施方式中,至少一种载体为辅助病毒质粒,所述辅助病毒质粒允许哺乳动物细胞复制并包装aav病毒。
[0043]
在一些实施方式中,所述辅助病毒质粒中的辅助病毒选自腺病毒、疱疹病毒和痘病毒。
[0044]
在本领域中已知aav的多种此类辅助病毒,包括(例如)腺病毒、疱疹病毒和痘病毒(例如牛痘)。已知人、非人类哺乳动物和禽类来源的许多腺病毒并且可从保藏中心例如cctcc、cgmcc获得。疱疹家族的病毒包括(例如)单纯疱疹病毒(hsv)和埃-巴二氏病毒(epstein-barr viruses)(ebv)以及巨细胞病毒(cmv)和假狂犬病病毒(prv)。
[0045]
本发明还涉及如上所述的重组腺相关病毒颗粒的制备方法,其包括:
[0046]
将如上所述的腺相关病毒载体系统引入宿主细胞,并分离如此产生的病毒颗粒。
[0047]
可选的,还包括从中进一步分离纯化包含变异的aav9衣壳蛋白的感染性病毒颗粒。
[0048]
宿主细胞可以为本领域常见的哺乳动物(例如为鼠、兔、犬、猴、牛、羊、马、驴、人)细胞或细胞系。细胞优选为心脏、肌肉、肺(肺泡)、肝脏、中枢神经来源的,也可以为胚胎成纤维细胞,例如nih/3t3细胞。
[0049]
药物组合物,其包含如上所述的重组腺相关病毒颗粒和/或如上所述的腺相关病毒载体系统,以及药学上可接受的载体、赋形剂和稀释剂中的任意一种。
[0050]
药物组合物可用于治疗如上所提及的疾病。
[0051]
该药物组合物一般可以通过胃肠外(例如,通过肌内、皮下、肿瘤内、经皮、鞘内、静脉内等施用)途径施用。
[0052]
所述药物组合物本身不诱导产生对接受所述组合物的个体有害抗体,并且施用时没有不适当的毒性,或者有害抗体和毒性在生理可接受的范围内。药学上可接受的赋形剂包括但不限于液体如水、盐水、甘油及乙醇。药学上可接受的盐也可包括在内,例如,无机酸盐,如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等等;以及有机酸盐,如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等等。此外,这类媒介物中还可能存在辅助性物质,如润湿剂或乳化剂、ph缓冲物质等。广泛多种药学上可接受的赋形剂在本领域中是已知的并且不必在本文中详述。
[0053]
下面将结合实施例对本发明的实施方案进行详细描述。
[0054]
实施例
[0055]
通过构建aav9的肽段随机突变文库,筛选到插入了7个氨基酸的新的aav9突变体。
[0056]
1、突变体文库制备
[0057]
1.1化学合成aav9-7mer-nns以下两个片段:
[0058]
5'ccaccagagtgcccaannsnnsnnsnnsnnsnnsnnsgcacaggcgcag 3';
[0059]
5'cggtctgcgcctgtgcsnnsnnsnnsnnsnnsnnsnnttgggcactctg 3';
[0060]
其中nns代表随机编码序列。
[0061]
1.2将合成的aav9-7mer-nns正链与反链引物各加10μl(引物的终浓度为10mm)采用退火的方式来获得aav9-7mer-nns模板。退火程序为:95℃,5min;95℃,1min;92min,1min;4℃,60min。其中,第二步和第三步,每个循环降3℃,一共25个循环。
[0062]
1.3将质粒paav-short ubc-mscarlet-polya-p40-aav9-cap-flex-sv40polya(其结构和插入位点如图1所示)用bsmbi进行单酶切,酶切体系(50ul)如表1所示。
[0063]
表1
[0064][0065]
55℃酶切4h后进行1%琼脂糖凝胶电泳,紫外灯下用刀片将大片段切下并进行回收纯化。
[0066]
1.4将1.3步得到的纯化的酶切产物和1.2步得到的aav9-7mer-nns核苷酸序列采用t4 dna ligase进行连接。连接采用takara的t4 dna连接酶,10μl反应体系如表2所示,4℃过夜酶连。
[0067]
表2
[0068][0069]
1.5将10μl酶连产物加入到50μl文库专用电转感受态细胞(购自lucigen公司)中,混匀放置后转入已预冷的电极杯当中,使用伯乐公司的电转仪进行电转,电转完,向里面加入1ml在37℃预热的soc液体培养基,随后37℃复苏1小时后,进行离心涂布。
[0070]
1.6重复步骤1.4-1.5,直到克隆数量达到5
×
10
11
。
[0071]
2.文库病毒包装及筛选
[0072]
2.1 aav突变体文库病毒包装:按照每皿1.5
×
107个293aav包装细胞接种到15cm的细胞培养皿中,培养18-24h,当细胞贴壁后即可开始转染。采用pei转染试剂将含有aav9-7mer-nns插入片段的paav-short ubc-mscarlet-polya-p40-aav9-cap-flex-sv40 polya
–
insertion表达载体文库,包装质粒,辅助质粒转入到293aav细胞中,转染72h后,于荧光显微镜下计数aav-293细胞中载体文库细胞的比例,以确定病毒包装效率。待病毒包装完成后,用枪头反复吹打细胞,使所有细胞从培养皿上完全脱落下来,收集所有细胞样品。
[0073]
2.2病毒的纯化:将收集到的细胞样品在-80℃和37℃进行反复的冻融,离心,收集细胞上清,用0.45μm的pvdf滤器去除细胞碎片,随后,再采用aav纯化试剂盒对收集的重组aav病毒进行纯化来获取重组aav病毒。
[0074]
2.3重组aav病毒滴度的测定:取20μl浓缩病毒液,加1μl rnase-free dnase,混匀,37℃,孵育30min,10000rpm离心10min,取20μl上清加80μl稀释buffer至另一个无菌管中,混匀,100℃金属浴反应10min。自然冷却至室温,加入3μl蛋白酶k,37℃孵育60min,100℃金属浴反应10min,冷却至室温。将上述样品稀释后用做模板,采用实时定量pcr检测法测定重组aav病毒滴度。qpcr反应体系及反应条件为:95℃,10min;95℃,30s;60℃,30s,35个循环。
[0075]
2.4 aav病毒感染nih/3t3细胞:
[0076]
2.4.1细胞铺板:将nih/3t3细胞按40%汇合度接种到10cm细胞皿中,以每皿5
×
106细胞进行铺板,铺多个细胞培养皿。
[0077]
2.4.2病毒感染:用paav-short ubc-mscarlet-polya-p40-aav9-cap-flex-sv40 polya
–
insertion表达载体文库病毒感染nih/3t3细胞。
[0078]
2.4.3感染后48~72h的荧光图片如图2所示,从图中可以看到红光所占比例极少,只有少数细胞能感染上。
[0079]
2.5收集感染后的细胞,利用流式细胞分选仪进行荧光分选,选取红色荧光亮度在前5%的细胞作为筛选的目的细胞进行收集。分选收集后的细胞铺入细胞皿中,进行扩增后收集细胞。
[0080]
2.6将收集到的细胞抽提基因组后进行pcr扩增,pcr产物高通量测序。
[0081]
扩增引物:
[0082]
aav9-f:aactactaacccggtagcaacgg(载体上的正向引物)
[0083]
aav9-r:cgtccgtgtgaggaattttgg(载体上的反向引物)
[0084]
加入接头和标签序列的高通量测序使用引物如下:
[0085]
ngs-aav9-f:ttactatgccgctggtggctctagatgtgagaaagggatgtgctgcgagaaggctagaaactactaacccggtagcaacgg
[0086]
ngs-r1:
[0087]
gttcgtcttctgccgtatgctctacactgacctcaagtctgcacacgag aaggctagcgagtaatcgtccgtgtgaggaattttgg
[0088]
ngs-r2:
[0089]
gttcgtcttctgccgtatgctctacactgacctcaagtctgcacacgagaaggctagtctccggacgtccgtgtgaggaattttgg
[0090]
ngs-r3:gttcgtcttctgccgtatgctctacactgacctcaagtctgcacacgagaaggctagaatgagcgcgtccgtgtgaggaattttgg
[0091]
ngs-r4:gttcgtcttctgccgtatgctctacactgacctcaagtctgcacacgagaaggctagggaatctccgtccgtgtgaggaattttgg
[0092]
ngs-r5:gttcgtcttctgccgtatgctctacactgacctcaagtctgcacacgagaaggctagttctgaatttccgtccgtgtgaggaattttgg
[0093]
预期获得的测序序列为:
[0094]
aactactaacccggtagcaacggagtcctatggacaagtggccacaaaccaccagagtgcccaannsnnsnnsnnsnnsnnsnnsgcacaggcgcagaccggctgggttcaaaaccaaggaatacttccgggtatggtttggcaggacagagatgtgtacctgcaaggacccatttgggccaaaattcctcacacggacg
[0095]
分析高通量测序结果,将出现频率高的突变体分别命名为aav9-nsxx;如01号肽段则为:aav9-ns01。
[0096]
3、aav9突变体的筛选和验证
[0097]
3.1 aav9突变体的构建
[0098]
以天然血清型aav2/9为载体,在588-589为氨基酸处插入候选突变体aav9-nsxx等片段,获得新的血清型载体aav9-nsxx等,根据高通量的结果,构建了30多个突变体。
[0099]
3.2使用穿梭载体paav-cmv-egfp-wpre,分别以aav9-nsxx等作为血清型载体包装获得各种突变血清型的aav病毒。
[0100]
3.3使用wpre引物对以上病毒进行病毒滴度测定,并使用考染确认病毒vp1、vp2、vp3表达情况。
[0101]
3.4将paav-cmv-egfp-wpre的aav9-nsxx等病毒,以两种moi(5
×
104和5
×
105)分别感染nih/3t3细胞,其中感染效果较好的4个肽段的突变血清型与对照aav9的72h的荧光图如图3所示,aav9-ns01、aav9-ns02、aav9-ns03、aav9-ns04突变血清型病毒的感染效率均高于nih/3t3,同时利用流式细胞仪检测感染上细胞的阳性率如图4所示,在moi=5
×
104感染组,对照aav9血清型的感染细胞阳性率为3.1%;而aav9-ns01、aav9-ns02、aav9-ns03、aav9-ns04突变血清型病毒的感染阳性率分别为:6.9%,11.0%,9.9%,4.2%;在moi=5
×
105感染组,对照aav9血清型的感染细胞阳性率为28.2%;而aav9-ns01、aav9-ns02、aav9-ns03、aav9-ns04突变血清型病毒的感染阳性率分别为:59.7%,74.8%,52.1%,37.3%;在这4个肽段突变血清型中,aav9-ns02的效果最好,感染阳性率相对于对照aav9血清型明显提升,通过流式检测统计其倍数为2.7倍。aav9-ns01、aav9-ns02、aav9-ns03、aav9-ns04的氨基酸序列分别依次为avpygga(seq id no:1)、lrlntav(seq id no:2)、tktgnnh(seq id no:3)和wvtyqae(seq id no:4)。
[0102]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0103]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权
利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1