经遗传修饰的非人动物及其使用方法
经遗传修饰的非人动物及其使用方法
1.本技术是申请日为2013年09月06日、中国申请号为201380046265.9、发明名称为“经遗传修饰的非人动物及其使用方法”的发明申请的分案申请。
2.对相关申请的交叉引用
3.本技术要求2012年9月7日提交的美国临时申请流水号61/698,002,和2013年3月8日提交的美国临时申请流水号61/775,171的优先权,每篇的内容通过提及完整收入本文。
4.发明背景
5.生物医学研究的目的是更好地了解人生理学以及使用此知识来预防、治疗或治愈人疾病。由于对人受试者进行实验的实际和伦理障碍,许多研究是对小型动物模型(诸如小鼠)进行的。然而,小鼠并不是人,并且自动物实验获得的知识不总是适用于人。在此背景中,用人血液-淋巴样系统(hhls)再殖(repopulate)的小鼠代表一种用于在体内研究人造血和免疫功能的有用小型动物模型。
6.hhls小鼠是通过将人造血干细胞和祖细胞(hspc)和/或人胎儿组织移植入免疫应答的先天性和适应性分支有缺陷的接受者小鼠中生成的。在20世纪80年晚期开发出hhls小鼠的第一种模型(mosier等,1988,nature 335:256-259;mccune等,1988,science 241:1632-1639;kamel-reid和dick,1988,science 242:1706-1709),并且自此以后已经经历了一系列改良(legrand等,2006,journal of immunology 176:2053-2058;shultz等,2007,nature reviews immunology 7:118-130)。目前作为接受者用于人造血移入的小鼠品系共享三项特征。第一,它们由于编码prkdc蛋白的基因中的scid突变(mosier等,1988,nature 335:256-259;mccune等,1988,science 241:1632-1639),或者由于两个rag基因之一的删除(shultz等,2000,journal of immunology 164:2496-2507;traggiai等,2004,science 304:104-107)而缺乏b和t细胞。第二,编码细胞因子受体的共同γ链(γc)的il2rg基因的删除或突变消除il-15信号传导,并且导致nk细胞的缺失(traggiai等,2004,science 304:104-107;ito等,2002,blood100:3175-3182)。第三,小鼠巨噬细胞上表达的sirpa受体和人细胞上的cd47配体之间的相互作用对小鼠巨噬细胞提供抑制信号,并且为人异种移植物赋予吞噬细胞耐受性(takenaka等,2007,nature immunology 8:1313-1323;takizawa和manz,2007,nature immunology 8:1287-1289)。在使用含有sirpa基因中的天然多态性的nod遗传背景时(takenaka等,2007,nature immunology8:1313-1323;takizawa和manz,2007,nature immunology 8:1287-1289;legrand等,2011,proc natl acad sci usa 108:13224-13229)或者通过人sirpa基因的bac转基因表达(strowig等,2011,proc natl acad sci usa 108:13218-13223)实现小鼠细胞上表达的sirpa和人cd47之间的物种间相互作用。在使用nod scidγ
c-/-(nog(ito等,2002,blood 100:3175-3182)或nsg(ishikawa等,2005,blood 106:1565-1573))或hsirpa
tg rag2-/-γ
c-/-(srg(strowig等,2011,proc natl acad sci usa 108:13218-13223))小鼠作为接受者时在人hspc移植后实现高水平的人造血细胞移入。
7.虽然在这些接受者品系中观察到人多谱系造血发生,但是大多数人细胞类型的终末分化、稳态和/或效应器功能是亚最佳的。已经假设此状况是由于由小鼠组织分泌的细胞
因子和造血细胞上表达的人受体之间的交叉反应性降低或缺失所致(manz,2007,immunity 26:537-541;willinger等,2011,trends in immunology 32:321-327)。为了避开此限制,已经开发出数种策略来在小鼠宿主中投递人细胞因子。这些方法包括注射重组细胞因子(lapidot等,1992,science 255:1137-1141;van lent等,2009,j.immunol 183:7645-7655),细胞因子编码cdna的慢病毒投递(o’connell等,2010,plos one 5(8):e12009),质粒dna的水动力学注射(chen等,2009,proc natl acad sci usa 106:21783-21788),cdna的转基因表达(nicolini等,2004,leukemia 18(2):341-347;brehm等,2012,blood 119:2778-2788;takagi等,2012,blood 119:2768-2777)或细胞因子编码基因的敲入替换(rongvaux等,2011,proc natl acad sci usa 108:2378-2383;willinger等,2011,proc natl acad sci usa 108:2390-2395;rathinam等,2011,blood 118:3119-3128)。后一种方法具有人基因的更为生理性的表达的优点。此外,若人细胞因子在小鼠受体上不是完全交叉反应性的,则它能在小鼠细胞群体中诱导缺陷,并且对人细胞赋予额外的竞争优势。使用敲入基因替换策略,编码血小板生成素的基因(tpo)的人源化导致功能性人造血干细胞的维持更好和骨髓中的移入增加(rongvaux等,2011,proc natl acad sci usa108:2378-2383);编码白介素-3和gm-csf的基因(il3和csf2)的替换诱导小鼠肺泡巨噬细胞(am)的丧失和功能性人am的发生(willinger等,2011,proc natl acad sci usa 108:2390-2395);并且csf1基因(其编码m-csf)的替代导致多种组织中人单核细胞的数目增加(rathinam等,2011,blood 118:3119-3128)。
8.人和小鼠造血-淋巴样系统在许多方面不同(haley,2003,toxicology188:49-71;mestas和hughes,2004,j immunol 172:2731-2738)。两个物种间的主要差异之一在于它们的白血球(wbc)微分。人血液富含髓样细胞,占总wbc的50-75%。比较而言,小鼠血液以淋巴细胞占优势,并且仅20-30%的wbc是髓样谱系的。此物种差异(尚未了解其功能和进化意义)在常规hhls小鼠(诸如nog/nsg或srg)中没有重演。实际上,人髓样发生在这些宿主中是特别有缺陷的,其中髓样细胞仅占人wbc的5-10%。
9.具有功能性人免疫系统的小鼠的一项应用是开发和测试人疫苗。在历史上,免疫应答的体内诱导相对低效(2004,traggiai等,science 304:104-107;2002,ito等,blood 100:3175-3182;2005,ishikawa等,blood 106:1565-1573;2005,shultz等,j immunol 174:6477-6489;2006,baenziger等,proc natl acad sci usa 103:15951-15956)。数项研究已经报告了感染后成功的病原体特异性免疫应答。虽然报告了50%左右的小鼠在登革热病毒感染后生成病毒特异性igm和igg(2007,kuruvilla等,virology 369:143-152),但是其它研究报告了在hiv和ebv感染后生成抗原特异性igm和igg的小鼠的频率低于20%(2006,baenziger等,proc natl acad sci usa 103:15951-15956;2008,yajima等,j infect dis 198:673-682)。在用佐剂和抗原免疫后,抗原特异性免疫球蛋白的类别转换在历史上也是低效的,仅一部分经免疫动物显示抗原特异性igg应答(2004,traggiai等,science 304:104-107;2002,ito等,blood 100:3175-3182;2005,ishikawa等,blood 106:1565-1573;2005,shultz等,j immunol 174:6477-6489;2009,watanabe等,int immunol 21:843-858;2010,becker等,plos one 5)。这些研究包括nsg和balb/c rag2-/-γ
c-/-小鼠和不同佐剂/抗原组合。
10.本领域中需要能够支持和维持人造血细胞移入的人源化非人动物。本发明解决本
领域中没有得到满足的这种需要。
11.发明概述
12.一般而言,本发明涉及表达人m-csf、人il-3、人gm-csf、人sirpa或人tpo中至少一种的经遗传修饰的非人动物及其使用方法。如此,在一个实施方案中,本发明是经遗传修饰的非人动物,其包含基因组,该基因组包含编码下组中至少一种的至少一种核酸:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,其中所述至少一种核酸与启动子可操作连接,且其中所述动物表达至少一种选自下组的多肽:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。在另一个实施方案中,本发明是经遗传修饰的非人动物,其包含基因组,该基因组包含编码人m-csf的核酸、编码人il-3的核酸、编码人gm-csf的核酸、编码人sirpa的核酸和编码人tpo的核酸,其中编码人m-csf、人il-3、人gm-csf、人sirpa和人tpo的核酸中每种与启动子可操作连接,且其中所述动物表达人m-csf多肽、人il-3多肽、人gm-csf多肽、人sirpa多肽和人tpo多肽。在一些实施方案中,经遗传修饰的非人动物是免疫缺陷的。在一些实施方案中,经遗传修饰的非人动物不表达重组活化基因2(rag-2-/-)。在一些实施方案中,经遗传修饰的非人动物不表达il2受体γ链(γ链-/-)。在一些实施方案中,经遗传修饰的非人动物不表达rag-2,并且经遗传修饰的非人动物不表达il2受体γ链(rag-2-/-γ链-/-)。在一些实施方案中,经遗传修饰的非人动物是啮齿动物。在一些实施方案中,经遗传修饰的非人动物是小鼠。在一个实施方案中,经遗传修饰的非人动物还包含至少一种人造血细胞。在一个实施方案中,经遗传修饰的非人动物还包含至少一种人癌细胞。在一些实施方案中,人癌细胞是白血病细胞或黑素瘤细胞。
13.在另一个实施方案中,本发明是一种在经遗传修饰的非人动物中移入造血干细胞和祖细胞(hspc)的方法,其中所述动物表达下组中至少一种:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,所述方法包括下述步骤:对表达下组中至少一种的经遗传修饰的动物施用至少一种hspc:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。在一些实施方案中,hspc是人hspc。在一个实施方案中,经遗传修饰的非人动物是啮齿动物。在一个实施方案中,经遗传修饰的非人动物是小鼠。在一个实施方案中,经遗传修饰的非人动物是免疫缺陷的。在一个实施方案中,经遗传修饰的免疫缺陷非人动物不表达重组活化基因2(rag-2-/-)。在一个实施方案中,经遗传修饰的免疫缺陷非人动物不表达内源il2受体(γ链-/-)。在一个实施方案中,经遗传修饰的免疫缺陷非人动物不表达内源rag-2且不表达内源γ链(rag-2-/-γ链-/-)。在一个实施方案中,经遗传修饰的动物包含人癌细胞。在一个实施方案中,人癌细胞是白血病细胞或黑素瘤细胞。
14.在另一个实施方案中,本发明是经遗传修饰的rag-2-/-、γ链-/-小鼠,其具有基因组,该基因组包含编码下组中至少一种的至少一种核酸:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,其中所述至少一种核酸与至少一种启动子可操作连接,其中所述小鼠表达至少一种选自下组的多肽:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。在一个实施方案中,经遗传修饰的非人动物包含基因组,该基因组具有编码人m-csf的核酸、编码人il-3的核酸、编码人gm-csf的核酸、编码人sirpa的核酸和编码人tpo的核酸,其中编码人m-csf、人il-3、人gm-csf、人sirpa和人tpo的核酸中每种与启动子可操作连接,且其中所述动物表达人m-csf多肽、人il-3多肽、人gm-csf多肽、人sirpa多肽和人tpo多肽。在一个实施方案中,经遗传修饰的非人动物是啮齿动物。在一个实施方案中,经遗传修饰的非人动物是小鼠。在
一个实施方案中,经遗传修饰的非人动物包含人造血细胞。在一个实施方案中,经遗传修饰的非人动物包含人癌细胞。在一些实施方案中,人癌细胞是白血病细胞或黑素瘤细胞。
15.本技术涉及下述实施方案。
16.1.一种经遗传修饰的非人动物,其包含基因组,该基因组包含编码下组中至少一种的至少一种核酸:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,其中所述至少一种核酸与启动子可操作连接,且其中所述动物表达至少一种选自下组的多肽:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。
17.2.实施方案1的经遗传修饰的非人动物,其包含基因组,该基因组包含编码人m-csf的核酸、编码人il-3的核酸、编码人gm-csf的核酸、编码人sirpa的核酸和编码人tpo的核酸,其中编码人m-csf、人il-3、人gm-csf、人sirpa和人tpo的核酸中每种与启动子可操作连接,且其中所述动物表达人m-csf多肽、人il-3多肽、人gm-csf多肽、人sirpa多肽和人tpo多肽。
18.3.实施方案1的经遗传修饰的非人动物,其中所述动物是免疫缺陷的。
19.4.实施方案3的经遗传修饰的免疫缺陷非人动物,其中所述动物不表达重组活化基因2(rag-2-/-)。
20.5.实施方案3的经遗传修饰的免疫缺陷非人动物,其中所述动物不表达il2受体γ链(γ链-/-)。
21.6.实施方案3的经遗传修饰的免疫缺陷非人动物,其中所述动物不表达rag-2,且其中所述动物不表达il2受体γ链(rag-2-/-γ链-/-)。
22.7.实施方案1的经遗传修饰的非人动物,其中所述动物是啮齿动物。
23.8.实施方案1的经遗传修饰的非人动物,其中所述动物是小鼠。
24.9.实施方案1的经遗传修饰的动物,其进一步包含人造血细胞。
25.10.实施方案1的经遗传修饰的动物,其进一步包含人癌细胞。
26.11.实施方案10的经遗传修饰的动物,其中所述人癌细胞是白血病细胞或黑素瘤细胞。
27.12.一种在经遗传修饰的非人动物中移入造血干细胞和祖细胞(hspc)的方法,其中所述动物表达下组中至少一种:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,所述方法包括下述步骤:对表达下组中至少一种的经遗传修饰的动物施用至少一种hspc:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。
28.13.实施方案12的方法,其中所述经遗传修饰的非人动物是啮齿动物。
29.14.实施方案12的方法,其中所述经遗传修饰的非人动物是小鼠。
30.15.实施方案12的方法,其中所述经遗传修饰的非人动物是免疫缺陷的。
31.16.实施方案15的方法,其中所述经遗传修饰的免疫缺陷非人动物不表达重组活化基因2(rag-2-/-)。
32.17.实施方案15的方法,其中所述经遗传修饰的免疫缺陷非人动物不表达内源il2受体(γ链-/-)。
33.18.实施方案15的方法,其中所述经遗传修饰的免疫缺陷非人动物不表达内源rag-2且不表达内源γ链(rag-2-/-γ链-/-)。
34.19.实施方案12的方法,其中所述经遗传修饰的动物包含人癌细胞。
35.20.实施方案19的方法,其中所述人癌细胞是白血病细胞或黑素瘤细胞。
36.21.一种经遗传修饰的rag-2-/-、γ链-/-小鼠,其具有基因组,该基因组包含编码下组中至少一种的至少一种核酸:人m-csf、人il-3、人gm-csf、人sirpa和人tpo,其中所述至少一种核酸与至少一种启动子可操作连接,其中所述小鼠表达至少一种选自下组的多肽:人m-csf、人il-3、人gm-csf、人sirpa和人tpo。
37.22.实施方案21的经遗传修饰的非人动物,其包含基因组,该基因组包含编码人m-csf的核酸、编码人il-3的核酸、编码人gm-csf的核酸、编码人sirpa的核酸和编码人tpo的核酸,其中编码人m-csf、人il-3、人gm-csf、人sirpa和人tpo的核酸中每种与启动子可操作连接,且其中所述动物表达人m-csf多肽、人il-3多肽、人gm-csf多肽、人sirpa多肽和人tpo多肽。
38.23.实施方案21的经遗传修饰的非人动物,其中所述动物是啮齿动物。
39.24.实施方案21的经遗传修饰的非人动物,其中所述动物是小鼠。
40.25.实施方案21的经遗传修饰的非人动物,其进一步包含人造血细胞。
41.26.实施方案21的经遗传修饰的非人动物,其进一步包含人癌细胞。
42.27.实施方案26的经遗传修饰的非人动物,其中所述人癌细胞是白血病细胞或黑素瘤细胞。
43.附图简述
44.在结合附图阅读时会更好地理解本发明的优选实施方案的以下详细描述。为了例示本发明,在图中显示了目前优选的实施方案。然而,应当理解本发明不限于图中显示的实施方案的精确排列和手段。
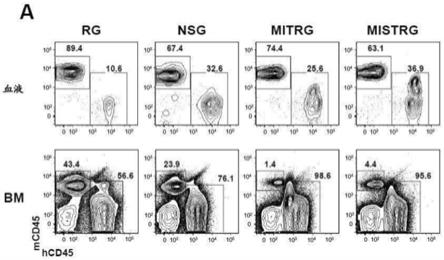
45.图1(包括图1小图a-图1小图e)描绘了实验结果,其显示了mistrg小鼠支持高水平的人造血移入。通过肝内注射100,000个人胎儿肝-(fl-)cd34
+
细胞移入经x射线预先条件化的指定品系的新生小鼠。在7-9周后在血液中及在10-12周后在bm中测量人移入水平(hcd45
+
细胞)。(图1小图a)指定接受者小鼠的血液和bm中小鼠和人cd45
+
细胞的频率的代表性流式细胞术分析。门控区旁边的数字指示总cd45
+
细胞间的百分比。(图1小图b)来自19项独立实验的血液移入水平(%hcd45
+
细胞)的组合数据。在每项实验中,将单一fl-cd34
+
细胞样品拆分,并注射入相应品系的小鼠中。每个符号代表一只小鼠个体,并且红色棒指示均值数值(n=56-155;ns,不显著;*p《0.05tukey检验(关于完全统计学分析,见图6))。灰色的水平线指示10%hcd45
+
细胞。(图1小图c)来自组(图6小图b)的一个代表性小鼠子集(图6小图c)的bm中的移入水平(n=12-16;*p《0.05tukey检验;还可见图6小图d-图6小图e)。(图1小图d)在将200,000个fl-cd34
+
细胞肝内注射入非照射新生mistrg小鼠中后3个月血液和bm中的hcd45
+
细胞移入的代表性流式细胞术分析。(图1小图e)如(图1小图d)中移植的mistrg小鼠的血液和bm中的人cd45
+
细胞移入水平(n=16)。在此情况中,显示了所有小鼠(包括血液hcd45
+
《10%的小鼠)的bm。
46.图2(包括图2小图a-图2小图k)描绘了实验结果,其显示了mistrg小鼠支持淋巴样和非淋巴样组织中的有效髓样发生和维持。(图2小图a)在x射线预先条件化后通过肝内注射fl-cd34
+
细胞作为新生儿移入的,指定接受者小鼠的血液中的人造血细胞(hcd45
+
)间的人髓样细胞(hcd33
+
)百分比。每个符号代表一只小鼠个体,并且红色棒标示均值数值(n=20-113;图7小图a中显示了统计学分析)。(图2小图b)相同小鼠中的人wbc组成(n=20-113
只小鼠/组;n=8名人供体;误差棒标示sem)。(图2小图c)指定接受者小鼠的非髓样组织中人髓样细胞(hcd68
+
)的免疫组织学染色。黑色棒代表20μm,并且显示的图像代表每组分析的至少三只小鼠。(图2小图d和图2小图e)人单核细胞子集的代表性流式细胞术分析(图2小图d)和频率(图2小图e),这是通过接受者小鼠的血液中的hcd45
+
cd33
+
细胞间cd14和cd16表达鉴定的(n=8-12只小鼠/组;误差棒标示sem)。(图2小图f和图2小图g)自mitrg接受者的bm分离并用lps(图2小图f)或r848(图2小图g)体外刺激的人单核细胞的细胞因子生成(误差棒标示一式三份的sd;代表3项独立实验)。(图2小图h)mitrg小鼠的血液中存在的人细胞对表达gfp的大肠杆菌的体外吞噬(n=7)。(图2小图i、图2小图j、图2小图k)用lps(图2小图i;90分钟,n=15-18)处理的,或用单核细胞增生利斯特氏菌(listeria monocytogenes)(图2小图j;第2天,n=6-15)或流感a/pr8 h1n1(图2小图k;第3天,n=3-5)感染的小鼠的血清中通过elisa或肺中通过rt-pcr测量的体内细胞因子生成。(图2小图a、图2小图j、图2小图k)通过单因素anova,接着tukey事后检验计算的p值(*p《0.05);(图2小图i)以log10转化的数值通过非配对student t检验计算的p值。
47.图3(包括图3小图a-图3小图i)描绘了实验结果,其显示了mistrg小鼠有效支持人nk细胞的发生和功能。(图3小图a)移入nsg、mitrg、和mistrg小鼠的肝中人il-15和il-15rαmrna表达的定量rt-pcr分析(n=7-8;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。将表达相对于小鼠hprt标准化。(图3小图b)自移入mitrg的骨髓纯化的人细胞群体中人il-15和il-15rαmrna表达的定量rt-pcr分析(n=4-5,误差棒标示sem)。将表达相对于人hprt标准化,并且相对于hcd14
+
hcd16-细胞显示。(图3小图c和图3小图d)移入nsg、mitrg、和mistrg中人nk细胞(hnkp46
+
hcd3-)的代表性流式细胞术分析(对hcd45
+
mcd45-细胞门控,淋巴细胞门;接近有轮廓区域的数字标示细胞的百分比)(图3小图c)和绝对数或频率(图3小图d)(n=8-16;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。(图3小图e)来自保持未处理或用脂质体包囊的氯膦酸盐处理连续3天以消减吞噬细胞的移入mistrg小鼠的人肝nk(hnkp46
+
hcd3-)和t细胞(hcd3
+
,作为对照显示)的绝对数目(n=8;通过未配对student t检验计算的p值;ns,不显著)。(图3小图f)以1:1比率i.v.注射经标记的lcl721.221(hla i类阴性)和lcl721.45(i类阳性)细胞,并且使用12小时后在脾中回收的经标记的细胞间hla i类阳性或阴性的比例计算特异性nk细胞细胞毒性(n=8,通过未配对student t检验计算的p值)。(图3小图g)在利斯特氏菌感染后2天nsg和mistrg小鼠的肝中人ifnγmrna表达的定量rt-pcr分析(n=8-9,通过未配对student t检验计算的p值)。将表达相对于小鼠hprt标准化。(图3小图h和图3小图i)来自未感染的或经利斯特氏菌感染的nsg和mistrg小鼠的ifnγ表达和脱粒(cd107a
+
)人肝nk细胞的代表性流式细胞术分析(图3小图h)和频率(图3小图i)(n=4-11;通过单因素anova计算的p值)。结果是自2项(图3小图a、图3小图e-图3小图i)、3项(图3小图b)、或4项(图3小图c、图3小图d)实验组合的。
48.图4(包括图4小图a-图4小图f)描绘了实验结果,其显示了mistrg中的人髓样细胞浸润肿瘤,并且支持其生长。在移入或非移入nsg和mistrg小鼠的体侧中植入人黑素瘤细胞系me290。用vegf抑制剂avastin
tm
处理一些小鼠。在11天后测量并解剖肿瘤以进行分析。(图4小图a)肿瘤中人造血细胞的浸润,其通过编码人造血(ptprc,编码cd45)和髓样(itgam,编码cd11b)标志物的mrna的表达来测定(n=6-7;通过非配对student t检验计算的p值)。(图4小图b和图4小图d)来自nsg、mistrg和患者的肿瘤中人髓样细胞标志物的代表性免疫组织
化学照片。(图4小图c)cd163
+
细胞的密度的量化(n=3份样品/组,3片计数的载玻片/样品)。(图4小图e和图4小图f)指定小鼠组中的肿瘤的代表性照片(图4小图e)和体积(图4小图f)(n=7-24只小鼠/组)。通过student t检验(图4小图a)或通过单因素anova(图4小图c,图4小图e),接着通过tukey事后检验计算p值(*p《0.05)。
49.图5描绘了髓样发生和hsc功能中牵涉的细胞因子。造血干细胞发育成髓样细胞的示意图和已知调节此过程的细胞因子的非穷举列表。阴影标示人和小鼠细胞因子之间的氨基酸同一性百分比。氨基酸同一性百分比是物种间蛋白质保守的最客观测量,但是它不总是与功能性物种间体内交叉反应性相关联。黑色矩形标示mistrg中遗传人源化的细胞因子。hsc,造血干细胞;mpp,多能祖先;cmp,共同髓样祖先;gmp,粒细胞/巨噬细胞祖先;mep,巨核细胞/红细胞祖先。
50.图6(包括图6小图a-图6小图e)描绘了接受者小鼠中移入水平的统计学分析的结果。(图6小图a)图1小图a中呈现的数据(接受者小鼠的血液中hcd45
+
细胞的百分比)的统计学分析(单因素anova,接着是tukey事后检验;ns,不显著)。(图6小图b)在移植后7-9周达到血液中至少10%hcd45
+
细胞的移入水平的接受者小鼠的数目。(图6小图c)图1小图c中用于bm分析的小鼠的血液移入水平。(图6小图d)图1小图c中呈现的数据(接受者小鼠的bm中hcd45
+
细胞的百分比)的统计学分析,类似于(图6小图a)。(图6小图e)图1小图c中显示的接受者小鼠的bm(2根股骨和2根胫骨)中hcd45
+
细胞的绝对数目。mistrg的bm中的细胞数目减少是由于在该年龄(移植后10-12周)小鼠的尺寸较小,并且是由图10中详细描述的贫血的第一临床体征引起的。
51.图7(包括图7小图a-图7小图h)描绘了实验结果,其评估mistrg小鼠中增强的人髓样发生。(图7小图a)图2小图a中呈现的数据(接受者小鼠的血液中hcd33
+
细胞的百分比)的统计学分析(单因素anova,接着是tukey事后检验;ns,不显著)。(图7小图b和图7小图c)接受者小鼠的bm中人髓样细胞(hcd33
+
)的频率(图7小图b)和统计学分析(图7小图c)。(图7小图d)mistrg的血液中人淋巴样和髓样谱系的代表性流式细胞术分析。(图7小图e和图7小图f)mistrg和人供体的bm(图7小图e)和血液(图7小图f)中人单核细胞(cd33
高
ssc
低
cd66-)和粒细胞(cd33
+
ssc
高
cd66
+
)的代表性流式细胞术分析。(图7小图g和图7小图h)接受者小鼠的肺(图7小图g)和肝(图7小图h)中人髓样细胞(hcd33
+
)的绝对数目(n=8-12;通过单因素anova,接着是tukey事后检验计算的p值,*p《0.05)。
52.图8(包括图8小图a和图8小图b)描绘了实验结果,其显示了mistrg小鼠中增强的人单核细胞子集发生。(图8小图a)人单核细胞子集的代表性流式细胞术分析,这是通过指定接受者小鼠的bm、脾、肺和肝中hcd45
+
cd33
+
细胞间cd14和cd16的表达鉴定的。(图8小图b)接受者小鼠的肺和肝中hcd33
+
细胞间的频率(误差棒代表sem)和单核细胞子集的绝对数目(n=12只小鼠/组;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。
53.图9(包括图9小图a和图9小图b)描绘了实验结果,其显示了人单核细胞子集在mistrg和人供体中是相似的。mistrg接受者和人供体的血液(图9小图a)和bm(图9小图b)中指定人单核细胞子集延伸的免疫表型。显示了用同种型对照抗体和特异性抗体进行的染色。
54.图10(包括图10小图a-图10小图i)描绘了实验结果,其显示了人髓样细胞破坏人对小鼠吞噬耐受性。(图10小图a)将经cfse标记的小鼠rbc转移入指定小鼠中,并且在指定
时间点测量经标记细胞的频率。(图10小图b)用氯膦酸盐预先处理移入mistrg以消减吞噬细胞或不然,并且转移并监测经cfse标记的小鼠rbc,如(图10小图a)中的(p值,通过第1-3天的重复测量anova测量的氯膦酸盐效果)。这些结果显示了转移的小鼠rbc在体内被mistrg而非nsg中存在的吞噬细胞快速清除。(图10小图c)非移入小鼠(n=9-15)或用人fl-cd34
+
细胞移入后8-10周(n=11-37)的血液中的rbc计数。p值指示每种基因型的非移入小鼠和移入小鼠之间的比较(student非配对t检验)。(图10小图d)人移入水平(血液中hcd45
+
细胞的百分比)和rbc计数之间的关联(n=13-22)。(图10小图e)非移入或移入mistrg的血液中小鼠(mter119
+
)和人(hcd235a
+
)红系细胞的流式细胞术分析,其显示了移入mistrg的血液中的几乎所有红系细胞是小鼠起源的,并且人红系细胞几乎不能检出。(图10小图f)指定品系的移入小鼠的代表性照片和脾重量(n=3-22),其显示了移入mistrg小鼠中的脾大。使用来自balb/c小鼠的脾作为对照(p值,单因素anova;*,p《0.05,与所有其它组比较,tukey事后检验)。(图10小图g)用h&e染色的移入nsg和mistrg的脾的组织学切片,其显示了具有脾大的mistrg小鼠中红髓的扩大。(图10小图h)小鼠红系祖先(mter119
+
mcd71
+
)的流式细胞术分析,其占移入mistrg的脾中的细胞的多达80%。(图10小图i)非移入和移入mistrg的血液涂片显示了网织红血球的富集。总之,这些结果强烈提示了mistrg中的贫血源自人对小鼠吞噬耐受性的缺失,并且大量的髓外小鼠红血球生成不能补偿对mrbc的破坏。结果代表每组(图10小图c,10e-10i)和2项独立实验(图10小图a,图10小图b)中检查的至少5只小鼠。
55.图11(包括图11小图a和图11小图b)描绘了实验结果,其显示了mistrg小鼠提供人il-15/il-15rα。(图11小图a)移入nsg、mitrg、和mistrg小鼠的肺中人il-15和il-15rαmrna表达的定量rt-pcr分析(n=7-8;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。将表达相对于小鼠hprt标准化。(图11小图b)来自移入mistrg小鼠的血液的人细胞群体(hcd45
+
mcd45-)上il-15rα表达的流式细胞术分析(代表n=4)。直方图分别代表用同种型对照或用il-15rα抗体进行的染色。结果代表两项实验或是自两项实验组合的。
56.图12(包括图12小图a和图12小图b)描绘了实验结果,其显示了mistrg小鼠中增强的人nk细胞发生。(图12小图a和图12小图b)移入nsg、mitrg、和mistrg小鼠中人nk细胞(hnkp46
+
hcd3-)的频率(图12小图a)和绝对数目(图12小图b)(n=8-16;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。结果是自4项实验组合的。
57.图13(包括图13小图a-图13小图f)描绘了实验结果,其显示了展现出增强的成熟的真正人nk细胞存在于mistrg小鼠中。(图13小图a)来自人供体和移入mistrg的人血液nk细胞上的cd94和cd161表达的流式细胞术分析(n=3)。直方图代表用同种型对照抗体或用cd94/cd161抗体进行的染色。(图13小图b)来自人供体或来自移入mistrg小鼠的人血液nk细胞上的kir表达的流式细胞术分析(n=3)。数字指示kir
+
细胞的频率。(图13小图c和图13小图d)来自移入nsg、mitrg、和mistrg小鼠的人nk细胞上的cd16表面表达(n=4-8;通过单因素anova计算的p值;*,p《0.05tukey事后检验)。(图13小图e和图13小图f)来自移入nsg和mistrg小鼠的人肝nk(hnkp46
+
hcd3-)和t细胞(hcd3
+
)的胞内穿孔蛋白表达(n=3;通过非配对student t检验计算的p值)。mfi,均值荧光强度。结果代表1项(图13小图a和图13小图b)、2项(图13小图e和图13小图f)、或4项(图13小图c和图13小图d)实验或是自1项(图13小图a和图13小图b)、2项(图13小图e和图13小图f)、或4项(图13小图c和图13小图d)实验组合的。
biology,humana press,2004。虽然可以在本发明的实施或测试中使用与本文中描述的方法和材料类似或等同的任何方法和材料,但是描述了优选的方法和材料。
66.如本文中使用的,下述每项术语具有此部分中与其有关的意义。
67.冠词“一个”和“一种”在本文中用于指一个/种或超过一个/种(即至少一个/种)该冠词的语法对象。举例而言,“一个/种元件”意指一个/种元件或超过一个/种元件。
68.如本文中使用的,“约”在提及可测量的数值(诸如量、时间持续量等)时意图涵盖规定数值的
±
20%或
±
10%,更优选
±
5%,甚至更优选
±
1%,且仍更优选
±
0.1%的变化,因为此类变化对于实施公开的方法是合适的。
69.术语“异常的”在生物体、组织、细胞或其成分的背景中使用时指在至少一种可观察到的或可检出的特征(例如年龄、治疗、天数时间、等)上与那些展现“正常的”(预期的)相应特征的生物体、组织、细胞或其组分不同的那些生物体、组织、细胞或其组分。对于一种细胞或组织类型而言正常或预期的特征对于一种不同细胞或组织类型而言可能是异常的。
70.如本文中使用的,术语“抗体”指能够特异性结合抗原上的特定表位的免疫球蛋白分子。抗体可以是自天然来源或自重组来源衍生的完整免疫球蛋白,并且可以是完整免疫球蛋白的免疫反应性部分。本发明中的抗体可以以多种形式存在,包括例如多克隆抗体、单克隆抗体、胞内抗体(“内抗体”(intrabody))、fv、fab和f(ab)2,以及单链抗体(scfv)、重链抗体(诸如骆驼抗体)、和人源化抗体(harlow等,1999,using antibodies:a laboratory manual,cold spring harbor laboratory press,ny;harlow等,1989,antibodies:a laboratory manual,cold spring harbor,new york;houston等,1988,proc.natl.acad.sci.usa 85:5879-5883;bird等,1988,science 242:423-426)。
71.如本文中使用的,术语“癌症”定义为以异常细胞的不受控制的增殖和/或生长为特征的疾病。癌细胞可以局部扩散或经由血流和淋巴系统扩散至身体的其它部分。本文中的癌症包括实体瘤和造血恶性两者。适合于本发明的各种癌症的例子包括但不限于乳腺癌、前列腺癌、卵巢癌、宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、骨癌、脑癌、淋巴瘤、白血病、肺癌、骨髓发育异常综合征(myeloidysplastic syndrome)、骨髓增殖性病症等等。
[0072]“组成性”表达是基因产物在细胞的大多数或所有生理条件下在活细胞中生成的状态。
[0073]
基因的“编码区”由分别与通过基因转录生成的mrna分子的编码区同源或互补的基因的编码链的核苷酸残基和基因的非编码链的核苷酸组成。
[0074]
mrna分子的“编码区”也由mrna分子中与mrna分子的翻译期间转运rna分子的反密码子区匹配或编码终止密码子的核苷酸残基组成。如此,编码区可以包含构成不存在于由mrna分子编码的成熟蛋白质中的氨基酸残基(例如蛋白质输出信号序列中的氨基酸残基)的密码子的核苷酸残基。
[0075]“疾病”指动物的一种健康状态,其中动物不能维持稳态,且其中如果疾病没有改善,那么动物的健康不断恶化。
[0076]
比较而言,动物中的“病症”指动物能够维持稳态,但是动物的健康状态不及其没有病症时有利的健康状态。保持不处理,病症不必然引起动物健康状态的进一步降低。
[0077]
如果疾病或病症的症状的严重性,患者经历此类症状的频率,或者这两者降低,那
么疾病或病症是“减轻的”。
[0078]
化合物的“有效量”或“治疗有效量”指足以对接受化合物施用的受试者提供有益效果的化合物量。投递媒介物的“有效量”指足以有效结合或投递化合物的量。
[0079]“编码”指多核苷酸(诸如基因、cdna、或mrna)中的特定序列核苷酸充当在生物学过程中合成其它聚合物和大分子的模板的固有特性,所述其它聚合物和大分子具有限定序列核苷酸(即rrna、trna和mrna)或限定序列氨基酸及源自其的生物学特性。如此,如果与基因对应的mrna的转录和翻译在细胞或其它生物学系统中生成蛋白质,那么所述基因编码蛋白质。编码链(其核苷酸序列与mrna序列相同,并且通常在序列表中提供)和非编码链(用作转录基因或cdna的模板)两者可以称为编码蛋白质或所述基因或cdna的其它产物。
[0080]
如本文中使用的,“内源”指来自生物体、细胞、组织或系统内部或在生物体、细胞、组织或系统内部生成的任何材料。
[0081]
如本文中使用的,术语“外源”指自生物体、细胞、组织或系统外部引入或在生物体、细胞、组织或系统外部生成的任何材料。
[0082]
术语“表达构建体”和“表达盒”在本文中用于指含有期望的核酸人编码序列且含有一种或多种对于表达可操作连接的编码序列必需或期望的调节元件的双链重组dna分子。
[0083]
如本文中使用的,术语“片段”在应用于核酸或多肽时指较大的核酸或多肽的亚序列。核酸的“片段”可以是长度至少约15个核苷酸;例如,至少约50个核苷酸至约100个核苷酸;至少约100至约500个核苷酸,至少约500至约1000个核苷酸,至少约1000个核苷酸至约1500个核苷酸;或约1500个核苷酸至约2500个核苷酸;或约2500个核苷酸(和中间的任何整数数值)。多肽的“片段”的长度可以是至少约15个核苷酸;例如至少约50个氨基酸至约100个氨基酸;至少约100至约500个氨基酸,至少约500至约1000个氨基酸,至少约1000个氨基酸至约1500个氨基酸;或约1500个氨基酸至约2500个氨基酸;或约2500个氨基酸(和中间的任何整数数值)。
[0084]
如本文中使用的,术语“基因”和“重组基因”指包含编码多肽的可读框的核酸分子。此类天然的等位变异通常可以导致给定基因的核苷酸序列的1-5%变异。可以通过对许多不同个体中感兴趣的基因测序来鉴定备选等位基因。这可以通过使用杂交探针鉴定多个个体中的相同遗传基因座容易地实施。作为天然等位变异的结果且不改变功能活性的任何和所有此类核苷酸变异和所得的氨基酸多态性或变异意图在本发明的范围内。
[0085]
如本文中使用的,“同源的”指两种聚合分子间,例如两种核酸分子(例如两种dna分子或两种rna分子)间或两种多肽分子间的亚基序列相似性。当两种分子两者中的亚基位置被相同的单体亚基占据时,例如如果两种dna分子每种中的一个位置被腺嘌呤占据,那么它们在所述位置处是同源的。两种序列间的同源性是匹配或同源位置的数目的正函数,例如如果两种化合物序列中的半数(例如长度为10个亚基的聚合物中的5个位置)位置是同源的,那么两种序列是50%同源的,如果90%的位置(例如10个中的9个)是匹配或同源的,那么两种序列共享90%同源性。举例而言,dna序列5
’‑
attgcc-3’和5
’‑
tatggc-3’共享50%同源性。
[0086]
如本文中使用的,术语“人造血干细胞和祖细胞”和“人hspc”指人自我更新多能造血干细胞和造血祖细胞。
[0087]“诱导型”表达是基因产物响应细胞中的信号存在而在活细胞中生成的状态。
[0088]
如本文中使用的,“指导材料”包括可以用于传达试剂盒中本发明的化合物、组合物、载体、或投递系统用于实现本文所述各种疾病或病症的减轻的有用性的出版物、记录、图、或任何其它表达介质。任选地或备选地,指导材料可以描述减轻哺乳动物细胞或组织中的疾病或病症的一种或多种方法。例如,本发明的试剂盒的指导材料可以附于装有本发明的鉴定的化合物、组合物、载体、或投递系统的容器或与装有鉴定的化合物、组合物、载体、或投递系统的容器一起运输。或者,指导材料可以与容器分开运输,以便接受者协同使用指导材料和化合物。
[0089]
如本文中使用的,术语“可操作连接的”指与第二多核苷酸处于功能性关系中的多核苷酸。通过将两种多核苷酸描述为“可操作连接的”意指单链或双链核酸模块包含以如下的方式在核酸模块内排列的两种多核苷酸,使得两种多核苷酸中的至少一种能够对另一种施加其被表征的生理效应。举例而言,与基因的编码区可操作连接的启动子能够促进编码区的转录。优选地,在编码期望蛋白质的核酸进一步包含启动子/调节序列时,启动子/调节序列位于期望蛋白质编码序列的5’端,从而其驱动期望蛋白质在细胞中的表达。编码期望蛋白质的核酸和它的启动子/调节序列共同构成“转基因”。
[0090]
如本文中使用的,术语“多核苷酸”定义为核苷酸的链。此外,核酸是核苷酸的聚合物。如此,如本文中使用的,核酸和多核苷酸可互换。本领域技术人员具有如下的一般知识,即核酸是多核苷酸,其可以水解成单体“核苷酸”。单体核苷酸可以水解成核苷。如本文中使用的,多核苷酸包括但不限于通过本领域中可用的任何手段获得的所有核酸序列,包括但不限于重组手段,即使用普通的克隆技术和pcr等等自重组文库或细胞基因组克隆核酸序列,及通过合成手段。
[0091]
如本文中使用的,术语“肽”、“多肽”和“蛋白质”可互换使用,并且指由通过肽键共价连接的氨基酸残基构成的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对可以构成蛋白质或肽序列的氨基酸的最大数目没有放置限定。多肽包括包含通过肽键彼此连接的两个或更多个氨基酸的任何肽或蛋白质。如本文中使用的,术语指短链(例如其在本领域中通常又称为肽、寡肽和寡聚物)和较长的链(其在本领域中一般称为蛋白质,其中有许多类型)两者。例如,“多肽”包括生物学活性片段、基本上同源的多肽、寡肽、同二聚体、异二聚体、多肽变体、经修饰的多肽、衍生物、类似物、融合蛋白、等等。多肽包括天然肽、重组肽、合成肽、或其组合。术语“肽”通常指短多肽。术语“蛋白质”通常指大多肽。
[0092]
如本文中使用的,术语“后代”指子孙后代,并且包括自亲本细胞衍生的分化的或未分化的后代细胞。在一种用法中,术语后代指与亲本遗传相同的后代细胞。在另一种使用中,术语后代指与亲本遗传且表型相同的后代细胞。在又一种用法中,术语后代指已经自亲本细胞分化的后代细胞。
[0093]
如本文中使用的,术语“启动子”指与要转录的核酸序列(诸如编码期望分子的核酸序列)可操作连接的dna序列。启动子一般位于要转录的核酸序列的上游,并且提供rna聚合酶和其它转录因子特异性结合的位点。在特定的实施方案中,启动子一般位于转录的核酸序列的上游以生成期望的分子,并且提供rna聚合酶和其它转录因子特异性结合的位点。包括的启动子可以是组成性启动子或可以提供诱导型表达;并且可以提供遍在、组织特异性或细胞类型特异性的表达。
[0094]
范围:贯穿本公开内容,本发明的各个方面可以以范围形式呈现。应当理解,范围形式的描述仅仅为了方便和简短,并且不应解释为对本发明范围的硬性限制。因而,应当认为范围的描述具体公开所有可能的亚范围以及所述范围内的单个数值。例如,应当认为诸如1至6的范围的描述具体公开亚范围,诸如1至3、1至4、1至5、2至4、2至6、3至6等,以及所述范围内的单个数字,例如1、2、2.7、3、4、5、5.3、和6。不管范围的宽度如何这都适用。
[0095]“重组多肽”是在表达重组多核苷酸后生成的多肽。
[0096]
如本文中使用的,术语“调节元件”指控制核酸序列表达的一些方面的核苷酸序列。例示性的调节元件例示性包括增强子、内部核糖体进入位点(ires)、内含子;复制起点、多聚腺苷酸化信号(pa)、启动子、增强子、转录终止序列、和上游调节域,其促成核酸序列的复制、转录、转录后加工。本领域普通技术人员能够仅用常规实验在表达构建体中选择和使用这些和其它调节元件。可以使用公知的方法重组或合成生成表达构建体。
[0097]
如本文中使用的,术语“特异性结合”就抗体而言意指识别特定抗原,但是基本上不识别或结合样品中的其它分子的抗体。例如,特异性结合来自一种物种的抗原的抗体也可以结合来自一种或多种物种的所述抗原。但是,此类跨物种反应性自身不改变抗体作为特异性的分类。在另一个例子中,特异性结合抗原的抗体也可以结合抗原的不同等位形式。然而,此类交叉反应性自身不改变抗体作为特异性的分类。
[0098]
在一些例子中,术语“特异性结合”可以提及抗体、蛋白质、或肽与第二化学种类的相互作用使用,指相互作用依赖于化学种类上特定结构(例如抗原决定簇或表位)的存在;例如,抗体识别并结合特定的蛋白质结构而非一般性蛋白质。若抗体对表位“a”是特异性的,则在含有经标记的“a”和抗体的反应中含有表位a的分子(或游离的、未标记的a)的存在会降低与抗体结合的经标记的a的量。
[0099]
如本文中使用的,术语“合成抗体”意指使用重组dna技术生成的抗体,诸如例如通过噬菌体表达的抗体,如本文中描述的。该术语还应当解释为意指已经通过合成编码抗体的dna分子(该dna分子表达抗体蛋白质)生成的抗体,或规定抗体的氨基酸序列,其中已经使用本领域中可用且公知的合成dna或氨基酸序列技术获得所述dna或氨基酸序列。
[0100]“变体”在该术语在本文中使用时指在序列上分别与参照核酸序列或肽序列不同,但是保留参照分子的必要生物学特性的核酸序列或肽序列。核酸变体的序列变化可以不改变由参照核酸编码的肽的氨基酸序列,或者可以导致氨基酸替代、添加、删除、融合和截短。肽变体的序列变化通常是有限的或保守的,从而参照肽和变体的序列总体上极其相似,且在许多区域中相同。变体和参照肽在氨基酸序列上可以相差任意组合的一处或多处替代、添加、删除。核酸或肽变体可以是天然存在的,诸如等位变体,或者可以是已知不天然存在的变体。可以通过诱变技术或通过直接合成来生成核酸和肽的非天然存在变体。
[0101]
如本文中使用的,术语“经遗传修饰的”意指其生殖细胞包含外源人核酸或人核酸序列的动物。作为非限制性例子,经遗传修饰的动物可以是转基因动物或敲入动物,只要动物包含人核酸序列。
[0102]
如本文中使用的,“敲入”意指将非人动物中染色体基因座处编码的遗传信息用不同dna序列替换的遗传修饰。
[0103]
描述
[0104]
本发明涉及经遗传修饰的非人动物,其表达人m-csf、人il-3/gm-csf、人sirpa和
人tpo(本文中称为mist)。本发明还涉及生成本文中描述的经遗传修饰的非人动物的方法和使用本文中描述的经遗传修饰的非人动物的方法。在一些实施方案中,经遗传修饰的非人动物是小鼠。在一些实施方案中,经遗传修饰的非人动物是免疫缺陷小鼠。在一个具体的实施方案中,免疫缺陷小鼠是rag2-/-γ
c-/-小鼠。在另一个具体的实施方案中,本发明的经遗传修饰的非人动物表达人m-csf、人il-3/gm-csf、和人tpo,而且不表达rag2或γc(本文中称为mitrg)。在另一个具体的实施方案中,本发明的经遗传修饰的非人动物表达人m-csf、人il-3/gm-csf、人sirpa和人tpo,而且不表达rag2或γc(本文中称为mistrg)。在一些实施方案中,将人造血细胞移入本文中描述的经遗传修饰的非人动物。
[0105]
在多个实施方案中,移入有人造血细胞的本发明的经遗传修饰的非人动物可用于体内评估造血和免疫细胞的生长和分化,用于体内评估人造血,用于体内评估癌细胞,用于体内评估免疫应答,用于体内评估疫苗和疫苗接种方案,用于测试调控癌细胞生长或存活的药剂的效果,用于体内评估癌症的治疗,用于免疫介质(包括人抗体)的体内生成和收集,及用于测试调控造血和免疫细胞功能的药剂的效果。
[0106]
经遗传修饰的非人动物
[0107]
本发明包括经遗传修饰的非人动物,其表达下述至少一项:人m-csf、人il-3/gm-csf、人sirpa、人tpo、及其任意组合。在一些实施方案中,表达人核酸的经遗传修饰的非人动物还表达相应的非人动物核酸。在其它实施方案中,表达人核酸的经遗传修饰的非人动物还不表达相应的非人动物核酸。在一些实施方案中,经遗传修饰的动物是敲除一种或多种基因(以使动物成为免疫缺陷动物)的动物,如本文中别处描述的。为了创建经遗传修饰的非人动物,可以将编码人蛋白质的核酸以如下形式掺入重组表达载体中,所述形式适合于在非人宿主细胞中表达人蛋白质。在多个实施方案中,重组表达载体包含一种或多种与编码人蛋白质的核酸以如下方式可操作连接的调节序列,所述方式容许核酸转录成mrna及mrna翻译成人蛋白质。术语“调节序列”是本领域公认的,并且意图包括启动子、增强子和其它表达控制元件(例如多聚腺苷酸化信号)。此类调节序列是本领域技术人员已知的,并且记载于1990,goeddel,gene expression technology:methods in enzymology 185,academic press,san diego,calif。应当理解,表达载体的设计可以依赖于诸如要转染的宿主细胞的选择和/或要表达的人蛋白质的量等因素。
[0108]
例如,可以通过将编码人蛋白质的核酸(通常与合适的调节元件,诸如组成性或组织特异性增强子连接)导入卵母细胞中(例如通过显微注射),并容许卵母细胞在雌性孕育动物中发育来创建经遗传修饰的动物。内含子序列和多聚腺苷酸化信号也可以包含在转基因中以提高转基因的表达效率。用于生成经遗传修饰的动物(特别是诸如小鼠等动物)的方法在本领域中已经变得常规,并且记载于例如美国专利no.4,736,866和4,870,009及1986,hogan等,a laboratory manual,cold spring harbor,n.y.,cold spring harbor laboratory。可以使用经遗传修饰的建立者动物来培育别的携带转基因的动物。可以将携带编码本发明的人蛋白质的转基因的经遗传修饰的动物与携带其它转基因的其它经遗传修饰的动物进一步育种,或与敲除动物(例如不表达一种或多种其基因的敲除动物)育种。在多个实施方案中,本发明的经遗传修饰的动物是小鼠、大鼠或家兔。
[0109]
在一些实施方案中,本发明的经遗传修饰的动物自非人动物的天然启动子和天然调节元件表达一种或多种人核酸。在其它实施方案中,本发明的经遗传修饰的动物自天然
人启动子和天然调节元件表达人核酸。熟练技术人员会理解,本发明的经遗传修饰的动物包括自任何启动子表达至少一种人核酸的经遗传修饰的动物。可用于本发明的启动子的例子包括但不限于dna pol ii启动子、pgk启动子、泛素启动子、清蛋白启动子、球蛋白启动子、卵清蛋白启动子、sv40早期启动子、劳氏肉瘤病毒(rsv)启动子、逆转录病毒ltr和慢病毒ltr。可用于本发明的启动子和增强子表达系统还包括诱导型和/或组织特异性表达系统。
[0110]
在一些实施方案中,本发明包括经遗传修饰的免疫缺陷动物,其具有包含与启动子可操作连接的编码人多肽的核酸的基因组,其中动物表达编码的人多肽。在多个实施方案中,本发明包括经遗传修饰的免疫缺陷非人动物,其具有包含表达盒的基因组,所述表达盒包含编码至少一种人多肽的核酸,其中所述核酸与启动子和多聚腺苷酸化信号可操作连接,并且进一步含有内含子,且其中所述动物表达编码的人多肽。
[0111]
在多个实施方案中,使用各种方法将人核酸序列导入免疫缺陷动物中以生成表达人基因的经遗传修饰的免疫缺陷动物。此类技术是本领域中公知的,并且包括但不限于原核显微注射、胚胎干细胞的转化、同源重组和敲入技术。可以使用的用于生成经遗传修饰的动物的方法包括但不限于那些记载于sundberg和ichiki(2006,genetically engineered mice handbook,crc press),hofker和van deursen(2002,genetically modified mouse methods and protocols,humana press),joyner(2000,gene targeting:a practical approach,oxford university press),turksen(2002,embryonic stem cells:methods and protocols in methods mol biol.,humana press),meyer等(2010,proc.nat.acad.sci.usa107:15022-15026),及gibson(2004,a primer of genome science 2
nd ed.sunderland,massachusetts:sinauer),美国专利no.6,586,251,rathinam等(2011,blood 118:3119-28),willinger等,(2011,proc natl acad sci usa,108:2390-2395),rongvaux等,(2011,proc natl acad sci usa,108:2378-83)及valenzuela等(2003,nat biot 21:652-659)的。
[0112]
在一些实施方案中,本发明的组合物和方法包含经遗传修饰的免疫缺陷动物,其单独或与nk细胞数目和/或功能缺陷(例如由于il2受体γ链缺陷(即γ
c-/-)所致)组合在b细胞和/或t细胞数目和/或功能上有缺陷,且具有包含与启动子可操作连接的人核酸的基因组,其中所述动物表达编码的人多肽。可以通过诸如表达构建体对植入前胚胎的dna注射等方法或者通过使用干细胞(诸如胚胎干(es)细胞或诱导的多能干(ips)细胞)实现本发明的经遗传修饰的动物的生成。
[0113]
在一个实施方案中,人核酸由人基因的天然调节元件表达。在其它实施方案中,人核酸由非人动物的天然调节元件表达。在其它实施方案中,自遍在启动子表达人核酸。可用于本发明组合物和方法的表达构建体的遍在启动子的非限制性例子包括3-磷酸甘油酸激酶(pgk-1)启动子、β-肌动蛋白启动子、rosa26启动子、热休克蛋白70(hsp70)启动子、编码延长因子1α的ef-1α基因(ef1)启动子、真核启动因子4a(eif-4a1)启动子、氯霉素乙酰基转移酶(cat)启动子和cmv(巨细胞病毒)启动子。
[0114]
在其它实施方案中,自组织特异性启动子表达人核酸。可用于本发明组合物和方法的表达构建体中的组织特异性启动子的非限制性例子包括造血系统中表达的基因的启动子,诸如m-csf启动子、il-3启动子、gm-csf启动子、sirpa启动子、tpo启动子、ifn-β启动
子、威斯科特-奥尔德里奇综合征(wiskott-aldrich syndrome)蛋白(wasp)启动子、cd45(又称作白细胞共同抗原)启动子、flt-1启动子、endoglin(cd105)启动子和icam-2(胞内粘附分子2)启动子。可用于本发明组合物和方法中的这些和其它启动子是本领域中已知的,如abboud等(2003,j.histochem&cytochem.51:941-949),schorpp等(1996,nar 24:1787-1788),mcburney等(1994,devel.dynamics,200:278-293)及majumder等(1996,blood 87:3203-3211)中例示的。继包含启动子之后,本发明的多个实施方案中包括一种或多种别的调节元件,诸如增强子元件或内含子序列。可用于本发明组合物和方法中的增强子的例子包括但不限于巨细胞病毒(cmv)早期增强子元件和sv40增强子元件。可用于本发明组合物和方法中的内含子序列的例子包括但不限于β珠蛋白内含子或通用内含子。可用于本发明的一些实施方案的其它别的调节元件包括但不限于转录终止序列和mrna多聚腺苷酸化(pa)序列。
[0115]
在一些实施方案中,将人核酸表达构建体导入植入前胚胎的方法包括将表达构建体线性化,之后将其注射入植入前胚胎中。在优选的实施方案中,将表达构建体注射入受精的卵母细胞中。可以在交配后那天自排卵过度的雌性收集受精的卵母细胞,并注射表达构建体。将注射后的卵母细胞培养过夜或直接转移入0.5天p.c.假孕雌性的输卵管中。用于排卵过度、收获卵母细胞、表达构建体注射和胚胎转移的方法是本领域中已知的,并且记载于manipulating the mouse embryo(2002,a laboratory manual,3
rd edition,cold spring harbor laboratory press)。可以通过dna分析(例如pcr、southern印迹、dna测序、等)或者通过蛋白质分析(例如elisa、western印迹、等)对后代评估导入的核酸的存在。
[0116]
在其它实施方案中,可以使用公知的方法(诸如电穿孔、磷酸钙沉淀和脂转染)将表达构建体转染入干细胞(es细胞或ips细胞)中。可以通过dna分析(例如pcr、southern印迹、dna测序、等)或者通过蛋白质分析(例如elisa、western印迹、等)对细胞评估导入的核酸的存在。然后,可以将测定为已经掺入表达构建体的细胞显微注射入植入前胚胎中。关于可用于本发明组合物和方法的本领域中已知的方法的详细描述参见nagy等(2002,manipulating the mouse embryo:a laboratory manual,3
rd edition,cold spring harbor laboratory press),nagy等(1990,development 110:815-821),美国专利no.7,576,259,美国专利no.7,659,442,美国专利no.7,294,754,及kraus等(2010,genesis 48:394-399)。
[0117]
可以将本发明的经遗传修饰的非人动物与免疫缺陷动物杂交以创建表达至少一种人核酸的免疫缺陷动物。本发明的多个实施方案提供了在基本上所有其细胞中包含人核酸的经遗传修饰的动物,以及在一些但非所有其细胞中包含人核酸的经遗传修饰的动物。可以将人核酸的一个或多个拷贝(彼此相邻或远离)整合入经遗传修饰的动物的细胞的基因组中。
[0118]
在一些实施方案中,本发明是移入有至少一种人造血细胞的经遗传修饰的非人小鼠。在其它实施方案中,本发明是在经遗传修饰的非人动物中移入人造血细胞的方法。可用于本发明组合物和方法的移入的人造血细胞包括任何人造血细胞。可用于本发明的人造血细胞的非限制性例子包括但不限于hsc、hspc、白血病启动细胞(lic)、和任何分化阶段的任何谱系的造血细胞,包括任何谱系的终末分化的造血细胞。此类造血细胞可以衍生自人供体的任何组织或位置,包括但不限于骨髓、外周血、肝、胎儿肝、或脐带血。此类造血细胞可
以分离自任何人供体,包括健康供体,以及具有疾病(诸如癌症,包括白血病)的供体。
[0119]
在其它实施方案中,本发明是在经遗传修饰的非人动物中移入人造血细胞的方法。在一些实施方案中,移入人造血细胞的经遗传修饰的非人动物是免疫缺陷动物。在本发明的经遗传修饰的动物中移入造血细胞以移入动物中人造血细胞的存在为特征。在具体的实施方案中,在免疫缺陷动物中移入造血细胞以与合适的对照动物相比提供造血细胞的移入动物中分化的人造血细胞的存在为特征。
[0120]
在一些实施方案中,在人造血细胞外还给本发明的动物移植人癌细胞(例如人实体瘤等)。在多个实施方案中,人癌细胞可以是癌细胞系或自患者分离的原代人癌细胞,其来自许多不同类型的癌症之任一种(作为非限制性例子,包括黑素瘤、乳腺癌、肺癌等)。在一些实施方案中,自同一患者分离人癌细胞和hspc,并将其移植入同一非人动物中。
[0121]
本发明的多个实施方案中提供的经遗传修饰的非人动物具有各种效用,诸如但不限于用作造血细胞的生长和分化的模型,用于体内评估人造血,用于体内评估癌细胞,用于免疫应答的体内研究,用于体内评估疫苗和疫苗接种方案,用于测试调控癌细胞生长或存活的药剂的效果,用于体内评估癌症的治疗,用于免疫介质(诸如抗体)的体内生成和收集,及用于测试影响造血和免疫细胞功能的药剂的效果。
[0122]
在经遗传修饰的和/或免疫缺陷的非人动物中移入人造血细胞在传统上需要施用造血细胞前的条件化(conditioning),即用高频电磁放射(一般使用γ或x射线放射)对接受者动物的亚致死照射,或用放射模拟药物(诸如白消安(busulfan)或氮芥)处理。认为条件化减少宿主造血细胞的数目,创建适合于移入人造血细胞的微环境因素,和/或为人造血细胞移入创建微环境小生境。用于条件化的标准方法是本领域中已知的,诸如记载于本文及j.hayakawa等,2009,stem cells,27(1):175-182的。依照本发明的实施方案提供了在免疫缺陷动物中移入人造血细胞的方法,其包括在施用造血细胞前照射或不照射动物的情况中对免疫缺陷动物提供人造血细胞。依照本发明的实施方案提供了在免疫缺陷动物中移入人造血细胞的方法,其包括在施用造血细胞前在对动物施用或不施用放射模拟药物(诸如白消安或氮芥)的情况中对本发明的经遗传修饰的非人动物提供人造血细胞。
[0123]
在一些实施方案中,依照本发明的实施方案的在经遗传修饰的非人动物中移入造血细胞的方法包括对本发明的经遗传修饰的动物提供人造血细胞,如本文别处描述的。在一些实施方案中,本发明的经遗传修饰的非人动物是在非人b细胞数目和/或功能,非人t细胞数目和/或功能,和/或非人nk细胞数目和/或功能方面缺陷的免疫缺陷动物。在其它实施方案中,免疫缺陷动物具有重度联合免疫缺陷(scid)。scid指以t细胞的缺失和b细胞功能的缺乏为特征的状况。scid的例子包括:x连锁scid,其以il2rg基因中的γ链基因突变和淋巴细胞表型t(-)b(+)nk(-)为特征;和常染色体隐性scid,其以jak3基因突变和淋巴细胞表型t(-)b(+)nk(-)、ada基因突变和淋巴细胞表型t(-)b(-)nk(-)、il-7rα链突变和淋巴细胞表型t(-)b(+)nk(+)、cd3δ或ε突变和淋巴细胞表型t(-)b(+)nk(+)、rag1/rag2突变和淋巴细胞表型t(-)b(-)nk(+)、artemis基因突变和淋巴细胞表型t(-)b(-)nk(+)、cd45基因突变和淋巴细胞表型t(-)b(+)nk(+)为特征。在一些实施方案中,本发明的经遗传修饰的非人动物是rag1-/-。
[0124]
在一些实施方案中,依照本发明的实施方案的在经遗传修饰的动物中移入造血细胞的方法包括对具有重度联合免疫缺陷突变(prkdc
scid
)(通常称为scid突变)的经遗传修
饰的非人动物提供人造血细胞。scid突变是公知的,并且位于小鼠染色体16上,如记载于bosma等(1989,immunogenetics 29:54-56)的。在scid突变方面纯合的小鼠以功能性t细胞和b细胞的缺失、淋巴细胞减少症、低球蛋白血症和正常造血微环境为特征。例如,可以通过使用公知的方法检测scid突变标志物来检测scid突变。
[0125]
在其它实施方案中,依照本发明的实施方案的在经遗传修饰的动物中移入造血细胞的方法包括对单独或与重度联合免疫缺陷(scid)突变组合具有il2受体γ链缺陷的经遗传修饰的免疫缺陷非人动物提供人造血细胞。术语“il2受体γ链缺陷”指减少的il2受体γ链。减少的il2受体γ链可以是由于基因删除或突变所致。例如,可以通过使用公知的方法检测il2受体γ链基因删除或突变和/或检测减少的il2受体γ链表达来检测减少的il2受体γ链。
[0126]
在天然存在的人核酸和氨基酸序列外,该术语还涵盖人核酸和氨基酸序列的变体。如本文中使用的,术语“变体”定义人的分离的天然存在的遗传突变体或人的重组制备的变异,它们与相应的野生型人相比各含有一处或多处突变。例如,此类突变可以是一处或多处氨基酸替代、添加、和/或删除。术语“变体”还包括非人直向同系物。在一些实施方案中,本发明的变体多肽与野生型人多肽具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0127]
使用本文中别处描述的技术测定两种序列间的百分比同一性。可以使用标准分子生物学技术(诸如定点诱变和pcr介导的诱变)来引入突变。本领域技术人员会认识到可以在不改变人蛋白质的功能特性的情况中引入一处或多处氨基酸突变。
[0128]
可以在人蛋白质中做出保守氨基酸替代以生成人蛋白质变体。保守氨基酸替代是公认的用一种氨基酸替代另一种具有相似特征的氨基酸。例如,每种氨基酸可以描述为具有一种或多种下述特征:电正性、电负性、脂肪族、芳香族、极性、疏水性和亲水性。保守替代是用一种具有规定的结构或功能特征的氨基酸替代另一种具有相同特征的氨基酸。酸性氨基酸包括天冬氨酸、谷氨酸;碱性氨基酸包括组氨酸、赖氨酸、精氨酸;脂肪族氨基酸包括异亮氨酸、亮氨酸和缬氨酸;芳香族氨基酸包括苯丙氨酸、甘氨酸、酪氨酸和色氨酸;极性氨基酸包括天冬氨酸、谷氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺、精氨酸、丝氨酸、苏氨酸和酪氨酸;并且疏水性氨基酸包括丙氨酸、半胱氨酸、苯丙氨酸、甘氨酸、异亮氨酸、亮氨酸、甲硫氨酸、脯氨酸、缬氨酸和色氨酸;并且保守替代包括每组内氨基酸间的替代。氨基酸也可以就相对大小而言描述,通常认为丙氨酸、半胱氨酸、天冬氨酸、甘氨酸、天冬酰胺、脯氨酸、苏氨酸、丝氨酸、缬氨酸都是较小的。
[0129]
人变体可以包含合成的氨基酸类似物、氨基酸衍生物和/或非标准氨基酸,例示性包括但不限于α-氨基丁酸、瓜氨酸、刀豆氨酸、氰丙氨酸、二氨基丁酸、二氨基庚二酸、二羟基苯丙氨酸、黎豆氨酸、高精氨酸、羟脯氨酸、正亮氨酸、正缬氨酸、3-磷酸丝氨酸、高丝氨酸、5-羟基色氨酸、1-甲基组氨酸、甲基组氨酸、和鸟氨酸。
[0130]
人变体由与编码野生型人的核酸具有高度同一性的核酸编码。编码人变体的核酸的互补物在高严格性条件下与编码野生型人的核酸特异性杂交。
[0131]
术语“核酸”指任何形式的具有超过一个核苷酸的rna或dna分子,包括单链、双链、寡核苷酸或多核苷酸。术语“核苷酸序列”指单链形式的核酸中寡核苷酸或多核苷酸的核苷酸排序。
[0132]
可以使用公知的方法分离或重组或合成生成编码人变体的核酸。
[0133]
人造血细胞的分离、对宿主动物施用人造血细胞和用于评估其移入的方法是本领域中公知的。可以自任何含有造血细胞的组织(诸如但不限于脐带血、骨髓、外周血、细胞因子或化学疗法动员的外周血和胎儿肝)获得用于对宿主动物施用的造血细胞。可以通过经由各种路径(诸如但不限于静脉内、肝内、腹膜内、股骨内和/或胫骨内)的施用将造血细胞施用入新生儿或成年动物中。
[0134]
可以通过多种方法之任一种评估本发明的经遗传修饰的动物中的人造血细胞移入,诸如但不限于在施用造血细胞后的一个或多个时间点时接受人造血细胞施用的动物中的细胞的流式细胞术分析。
[0135]
分离人造血细胞、对宿主动物施用人造血细胞、及评估宿主动物中的人造血细胞移入的例示性方法记载于本文及pearson等(2008,curr.protoc.immunol.81:1-15),ito等(2002,blood 100:3175-3182),traggiai等(2004,science 304:104-107),ishikawa等(2005,blood 106:1565-1573),shultz等(2005,j.immunol.174:6477-6489)及holyoake等(1999,exp hematol.27:1418-27)。
[0136]
在本发明的一些实施方案中,自初始来源材料分离人造血细胞以获得在特定的造血细胞群体(例如hsc、hspc、lic、cd34
+
、cd34-、谱系特异性标志物等)方面富集的细胞群体。分离的造血细胞可以是或不是纯的群体。在一个实施方案中,对可用于本发明组合物和方法的造血细胞消减具有特定标志物(诸如cd34)的细胞。在另一个实施方案中,通过选择标志物(诸如cd34)富集可用于本发明组合物和方法的造血细胞。在一些实施方案中,可用于本发明组合物和方法的造血细胞是cd34
+
细胞构成约1-100%细胞的细胞群体,尽管在某些实施方案中,也可以使用cd34
+
细胞构成小于1%的总细胞的细胞群体。在某些实施方案中,可用于本发明组合物和方法的造血细胞是cd34
+
细胞构成约1-3%的总细胞的t细胞消减细胞群体、cd34
+
细胞构成约50%的总细胞的谱系消减细胞群体、或cd34
+
细胞构成约90%的总细胞的cd34
+
正选择细胞群体。
[0137]
就在表达至少一种人基因的经遗传修饰的非人动物中产生人造血和/或免疫系统而言,认为造血细胞的施用数目不是限制性的。如此,作为非限制性例子,造血细胞的施用数目的范围可以为约1x103至约1x107,尽管在多个实施方案中,也可以使用更多或更少。作为另一个非限制性例子,hspc的施用数目的范围在接受者是小鼠时可以为约3x103至约1x106个cd34
+
细胞,尽管在多个实施方案中,也可以使用更多或更少。对于其它物种的接受者,可以仅使用常规实验测定需要施用的细胞数目。
[0138]
一般地,在超出施用的人造血细胞的寿命的时间点时,在经遗传修饰的非人动物中存在的人造血细胞的数目(或百分比)大于对非人动物施用的人细胞的数目(或百分比)时可以认为移入是成功的。例如,可以通过检测接受者动物中的人dna,或者通过检测完整的人造血细胞,诸如通过检测人细胞表面标志物(诸如例如cd45)来实现施用的造血细胞的后代的检测。将人造血细胞从第一接受者连续转移入第二接受者中及在第二接受者中移入人造血细胞是初级接受者中的移入的又一种任选测试。可以在施用人造血细胞后1-4个月时通过流式细胞术以血液、脾或骨髓中0.05%或更多的人cd45
+
细胞来检测移入。可以使用细胞因子(例如gm-csf)动员干细胞,例如如记载于watanabe(1997,bone marrow transplantation 19:1175-1181)的。
实施例
[0139]
通过参考下述实施例进一步详细描述本发明。提供这些实施例仅仅是为了例示的目的,并非意图限制,除非另有规定。如此,本发明绝不应当解释为限于下述实施例,而是应当解释为涵盖任何和所有变型,其由于本文中提供的教导而变得显而易见。
[0140]
在不进一步描述的情况中,认为本领域普通技术人员能使用前述描述和下述例示性实施例生成并利用本发明的化合物,并且实施要求保护的方法。因此,下述工作例明确指出本发明的优选实施方案,并且不应解释为以任何方式限制公开内容的剩余部分。
[0141]
实施例1:人血液-淋巴样系统小鼠中的功能性先天性免疫应答和实体瘤支持
[0142]
如本文中描述的,用人血液-淋巴样系统(hhls)再殖的小鼠代表一种用于预测性人临床前体内研究的有力工具。当前hhls小鼠的一项主要限制是对于先天性免疫至关重要的人细胞的缺陷发生。在这里,报告了一种新颖的小鼠品系,其中多种编码细胞因子的基因是遗传上人源化的。这些人源化细胞因子协同起作用以有效支持人造血和人单核细胞/巨噬细胞和nk细胞的发生和功能。在肿瘤微环境中,人巨噬细胞获得免疫抑制性表型,并且支持人癌生长。凭借更完整且功能性的人先天性免疫系统,此新颖的hhls小鼠模型具有促进人先天性免疫的生理学和病理学的体内研究的特殊潜力。
[0143]
单核细胞和巨噬细胞是先天性免疫应答的主要细胞组分(auffray等,2009,annual review of immunology 27,669)。在一个方面,这些细胞能够感测感染并通过多种多样的机制(诸如吞噬作用或促炎性因子的分泌)介导直接的抗微生物功能。在另一个方面,单核细胞/巨噬细胞能获得免疫抑制功能,其对于炎症的消退和组织修复是重要的。此外,这些抗炎性特性可以被肿瘤浸润性巨噬细胞共同选择,并且经由多种多样的机制对发展中的肿瘤提供存活优点(allavena和mantovani,2012,clinical and experimental immunology 167,195;qian和pollard,2010,cell 141,39)。
[0144]
经常使用小型动物模型(诸如小鼠)研究体内哺乳动物免疫应答。然而,物种间存在免疫功能的根本差异(mestas和hughes,2004,journal of immunology 172,2731;rongvaux等,2013,annual review of immunology 31,635)。特别地,单核细胞/巨噬细胞群体间存在主要的表型和功能性物种特异性差异,并且一般地,自小鼠研究获得的知识仅部分适用于人(auffray等,2009,annual review of immunology 27,669;rongvaux等,2013,annual review of immunology 31,635;chow等,2011,nature reviews immunology 11,788)。体内研究人造血和免疫功能的特异性的一种有希望的办法在于使用携带人血液-淋巴样系统(hhls)的小鼠(rongvaux等,2013,annual review of immunology 31,635;shultz等,2012,nature reviews immunology 12,786)。然而,数种人免疫细胞类型(诸如单核细胞/巨噬细胞和nk细胞)的发生和功能在当前hhls小鼠中很大程度上有缺陷(rongvaux等,2013,annual review of immunology 31,635)。这些缺陷最可能是由于小鼠细胞因子对相应人受体的降低的交叉反应性所致(manz,2007,immunity 26,537)。为了避免此限制,开发了一种策略,将编码细胞因子的小鼠基因用其人对应物替换(willinger等,2011,trends in immunology 32,321),并且此办法导致个别人细胞类型的发生和功能的显著改善(图16)(rathinam等,2011,blood 118,3119;willinger等,2011,proceedings of the national academy of sciences 108,2390;rongvaux等,2011,proceedings of the national academy of sciences 108,2378)。
[0145]
造血是一种受到紧密调节的发育过程,其中多能造血干细胞分化成更定型的祖先,然后分化成成熟的血液细胞(kondo等,2003,annual review of immunology 21,759;doulatov等,2012,cell stem cell 10,120)。此过程需要支持连续发育步骤的特定细胞因子(图5)。多种人源化细胞因子间的协同可能会是在小鼠中完全重演人髓形成需要的。如此,生成了一种新颖的小鼠品系,称作mistrg,其中编码m-csf(rathinam等,2011,blood 118,3119)、il-3/gm-csf(willinger等,2011,proceedings of the national academy of sciences108,2390)和tpo(rongvaux等,2011,proceedings of the national academy of sciences 108,2378)的基因在hsirpatg rag2-/-il-2rγ-/-背景(traggiai等,2004,science 304,104;strowig等,2011,proceedings of the national academy of sciences 108,13218)中被其人对应物(willinger等,2011,trends in immunology32,321)替换。
[0146]
遵循标准方案(traggiai等,2004,science 304,104),以亚致死方式照射新生mistrg小鼠及其同窝出生mitrg(缺乏hsirpa转基因),并移植人胎肝衍生的cd34
+
细胞。共享相同的遗传背景但缺乏所有人源化等位基因的rag2-/-il2-rγ-/-(rg)小鼠和商品化nod-scid il2-rγ-/-(nsg)小鼠充当对照。血液移入水平(hcd45
+
细胞百分比;(图1小图a和图1小图b;和图6小图a))在rg中较低,而在nsg接受者中较高,如先前报告的(strowig等,2011,proceedings of the national academy of sciences 108,13218;brehm等,2010,clinical immunology 135,84)。血液hcd45
+
细胞的百分比在mistrg中及在nsg中是相似的。与rg相比,血液移入在mitrg中也显著增加,提示组合基因人源化克服对经由sirpα/cd47交叉反应性诱导吞噬细胞耐受性的需要(strowig等,2011,proceedings of the national academy of sciences 108,13218;takenaka等,2007,nature immunology 8,1313;legrand等,2011,proceedings of the national academy of sciences 108,13224),这可能通过减弱小鼠先天性应答实现。选择在血液中具有至少10%人cd45
+
细胞的小鼠进行进一步的实验(图6小图b)。在骨髓(bm)中,hcd45
+
细胞的百分比在大多数的这两种mistrg接受者中超过90%并达到多至99%(图1小图a和图1小图c;及图6小图c至图6小图e),并且bm中的高移入效率不依赖于sirpα/cd47相互作用。为了测试人源化细胞因子在更具竞争性的条件中支持人造血的能力,将人cd34
+
细胞移植入非照射mistrg中。此方案在所有接受者的血液和bm中生成人cd45
+
细胞(图1小图d和图1小图e),并且显著地,半数的小鼠显示出与在x射线预条件化后移入的接受者中测量到的最高水平一样高的嵌合性(比较图1小图e与图1小图b和图1小图c)。本文中描述的数据显示了mistrg中多种细胞因子的遗传替换创建人造血能几乎完全置换骨髓中的小鼠造血的微环境,并且消除对病理学诱导性照射的需要。
[0147]
接着,评估mistrg小鼠支持人髓生成的能力。与rg和nsg相比,人髓样细胞(hcd33
+
)在mistrg的血液和骨髓中以显著更高的比例存在(图2小图a;和图7小图a至图7小图c)。mistrg中比例增加的髓样细胞导致血液组成类似于人血液的生理组成,其富含髓样细胞,并且根本上不同于富含淋巴样的小鼠血液的组成(mestas和hughes,2004,journal of immunology 172,2731;rongvaux等,2013,annual review of immunology 31,6354)(图2小图b;和图7小图d)。虽然单核细胞(cd33
高
ssc
低
cd66-)和粒细胞(cd33
+
ssc
高
cd66
+
)两者都存在于bm中(图7小图e),但是外周血中的人髓样细胞群体主要由单核细胞构成(图7小图f),
提示人粒细胞的终末分化和自bm外出或外周存活在此小鼠环境中仍然是亚最佳的。然而,重要的是,人髓样细胞大量存在于mistrg的非淋巴样组织,诸如肺、肝和结肠中,如通过免疫组织化学(hcd68
+
细胞;(图2小图c))或通过流式细胞术(hcd33
+
;(图7小图g和图7小图h))显示的,并且显著超过在nsg小鼠中找到的人髓样细胞数目约10倍。
[0148]
在人中,已经基于cd14和cd16标志物的表达在表型和功能上描述了三种单核细胞子集(auffray等,2009,annual review of immunology 27,669;cros等,2010,immunity 33,375)。人单核细胞的所有三种亚群(cd14
+
cd16-、cd14
+
cd16
+
和cd14
dim
cd16
+
)存在于mistrg的淋巴样和非淋巴样组织(诸如肺和肝)中(图2小图d和图2小图e;及图8小图a和图8小图b)。比较而言,在nsg中,在频率较低的髓样细胞外,仅能一致地检出cd14
+
cd16-和在一定程度上cd14
+
cd16
+
单核细胞,而cd14
dim
cd16
+
细胞仅被勉强呈现。mistrg中找到的单核细胞亚群的延伸免疫表型(cd33、cd11b、cd115、cd62l和cx3cr1)与人外周血中的等同子集紧密相当(图9)。自mitrg的bm分离的人cd14
+
cd16-和cd14
+
cd16
+
单核细胞响应tlr4和tlr7/8配体(分别为lps和r848)生成高水平的炎性细胞因子(图2小图f和图2小图g)。在对mitrg的wbc实施的体外测定法中,cd14
+
cd16-和cd14
+
cd16
+
细胞两者都具有较高的吞噬表达gfp的大肠杆菌的能力,而cd14
dim
cd16
+
单核细胞具有有限的吞噬细胞能力(图2小图h),再次反映人血液中相应的亚群的生理学特性(cros等,2010,immunity 33,375)。在用lps体内攻击或分别用细菌性和病毒性人病原体单核细胞增生利斯特氏菌和甲型流感感染时,mistrg小鼠以人炎性细胞因子(分别为tnfα、il-6和ifnγ)的稳健生成响应,而nsg小鼠显示显著更低(低约1个对数)的响应(图2小图i至图2小图k)。这些结果证明了mistrg中发生的人单核细胞子集在体外和在体内是功能性的。然而,小鼠中存在功能性人吞噬细胞的一个缺点是破坏人对小鼠吞噬细胞耐受性,小鼠rbc对所述吞噬细胞耐受性特别易感(图10小图a和图10小图b)。这种对小鼠rbc的破坏导致贫血(图10小图c至图10小图i),并且将移入小鼠的寿命限于10-12周(mistrg)或12-16周(mitrg)。
[0149]
髓样细胞能经由生成细胞因子来支持其它免疫细胞的发生和分化。评估mistrg小鼠的髓样区室是否是人细胞因子(诸如il-15)的来源。与此想法一致,发现了在与nsg比较时,人il-15和il-15rα的mrna表达在mistrg中增加大于10倍(图3小图a;和图11小图a)。为了更为详细地限定mistrg中人il-15/il-15rα的细胞来源,测量纯化的人细胞群体中人il-15和il-15rα转录物的丰度。人il-15rαmrna的表达在人髓样细胞(hcd33
+
)中比在非髓样细胞(hcd33-)中更高(图3小图b)。特别地,cd14
+
cd16
+
单核细胞显示il-15和il-15rα转录物两者的富集(图3小图b)。通过流式细胞术确认来自mistrg的人髓样细胞的表面上人il-15rα蛋白质的表达(图11小图b)。
[0150]
基于这些发现,评估mistrg小鼠是否支持依赖于il-15反式呈现的人免疫细胞(诸如nk细胞)的发生(ma等,2006,annual review of immunology 24,657;soderquest等,2011,blood 117,4511)。当前hhls小鼠模型中人nk细胞的有效发生需要人il-15/il-15rα的外源药理学投递(huntington等,2009,journal of experimental medicine 206,25;chen等,2009,proceedings of the national academy of sciences 106,21783;pek等,2011,immunobiology 216,218)23-25),因为小鼠il-15在体内不足以支持人nk细胞。如先前报告的(huntington等,2009,journal of experimental medicine 206,25;chen等,2009,proceedings of the national academy of sciences 106,21783;pek等,2011,
immunobiology 216,218),在移入nsg中观察到很少的人nk细胞(hnkp46
+
hcd3-)(图3小图c和图3小图d;及图12小图a和图12小图b)。比较而言,人nk细胞在移入mistrg的多种组织中容易检出,并且与nsg相比增加约10倍(图3小图c和图3小图d;及图12小图a和图12小图b)。除了骨髓外,mitrg比mistrg具有更少的人nk细胞,这最可能是由于先前报告的人nk细胞在外周中的存活对人sirpα的需求(legrand等,2011,proceedings of the national academy of sciences 108,13224)。mistrg小鼠中的hnkp46
+
hcd3-细胞代表真正的nk细胞,因为它们紧密模拟人对照表达典型的nk细胞表面标志物cd94、cd161、和杀伤抑制受体(kir)(图12小图a和图12小图b)。在其对发生的影响外,il-15还促进nk细胞的成熟。一致地,发现了与nsg相比,成熟标志物cd16的表面表达和溶解性颗粒蛋白穿孔蛋白的量在来自mistrg的nk细胞上更高(图13小图c至图13小图f)。
[0151]
目前不知道人体内il-15反式呈现的细胞来源,但是人髓样细胞能在体外支持人nk细胞增殖(huntington等,2009,journal of experimental medicine 206,25)。为了测试由人单核细胞/巨噬细胞进行的人il-15反式呈现是否支持mistrg中改善的人nk细胞发生,用脂质体包囊的氯膦酸盐(clodronate)处理小鼠以消减吞噬细胞(图14)。吞噬细胞的消减还诱导人nk细胞的显著减少(图3小图e),提示人单核细胞/巨噬细胞的确是一种至关重要的细胞类型,其反式呈现il-15以在体内支持人nk细胞稳态。
[0152]
nk细胞通过杀死缺乏mhc i类表达的细胞(自失)(raulet,2006,seminars in immunology 18,145),及通过生成关键的细胞因子ifnγ(vivier等,2008,nature immunology 9,503)参与针对病原体的先天性防御。与较高的穿孔蛋白表达(图13小图e和图13小图f)一致,与nsg相比在mistrg中在体内观察到显著增强的针对缺乏mhc i类的人细胞的nk细胞细胞毒性活性(图3小图f)。nk细胞是利斯特氏菌感染后的早期ifnγ来源。因而,发现了肝中的人ifnγmrna表达在感染后2天在mistrg中比在nsg中高超过10倍(图3小图g)。在单细胞分辨率上,来自经利斯特氏菌感染的mistrg的nk细胞在没有离体再刺激的情况中以比在nsg(图3小图i)中显著更高的频率显示了人ifnγ的生成(图3小图h)。mistrg中的nk细胞在利斯特氏菌感染后也具有溶解活性(脱粒),如通过cd107a的质膜暴露显示的(图3小图h)。总体上,经由有效生成人髓样细胞得到的mistrg支持人nk细胞的发生、分化、和功能,由此克服当前hhls小鼠模型的一项主要限制。
[0153]
接着,评估人髓样细胞在肿瘤微环境的背景中的作用。因此,使用人黑素瘤细胞系me290作为肿瘤模型(valmori等,1998,journal of immunology 160,1750)。临床观察显示了髓样细胞在数种实体瘤中浸润肿瘤,并且高密度的浸润性巨噬细胞与大多数类型的癌症中的不良患者预后有关(qian和pollard,2010,cell 141,39;coussens等,science 339,286;egeblad等,2010,developmental cell 18,884;nelson和bissell,2006,annual review of cell and developmental biology 22,287;bingle等,2002,t journal of pathology 196,254)。因而,在mistrg中比在nsg中在肿瘤中检出更高的人髓样细胞浸润,如通过人ptprc和itgam mrna(分别编码cd45和cd11b)表达显示的(图4小图a)。极其类似患者中的人肿瘤,表达巨噬细胞标志物cd163和cd14的细胞在mistrg中在肿瘤中是丰富的,但是在nsg中在相同肿瘤中几乎检测不到(图4小图b和图4小图c;及图15)。大多数cd163
+
细胞也表达低水平的hla-dr和高水平的cd206(图4小图b和图4小图d),即一种一般与“m2样”巨噬细胞有关的免疫表型(hao等,2012,clinical&developmental immunology2012,948098;
tang,2013,cancer lett 332,3)。
[0154]
m2亚型的巨噬细胞经由多种效应器机制(包括对癌细胞的增殖信号、抗凋亡信号、促血管生成活性、实现癌细胞自原发性肿瘤外出和转移的形成)促进肿瘤进展(qian和pollard,2010,cell 141,39;coussens等,science 339,286;egeblad等,2010,developmental cell 18,884)。评估肿瘤中的巨噬细胞浸润可以促进mistrg中的肿瘤生长。显著地,观察到移入有cd34
+
的mistrg中的肿瘤(其在很大程度上被人cd163
+
hla-dr
低
cd206
+
巨噬细胞浸润)的大小显著大于nsg中的肿瘤,其没有被人巨噬细胞浸润且是非移入nsg或mistrg小鼠中看到的相同的较小尺寸(图4小图e和图4小图f)。巨噬细胞支持肿瘤生长的机制之一是经由生成促进血管化和免疫抑制的细胞因子或酶。vegf是一种重要的多功能性肿瘤支持性分子(kandalaft等,current topics in microbiology and immunology 344,129;motz和coukos,immunity 39,61),并且为了测试此因子是否牵涉mistrg中的肿瘤生长,用人vegf抑制剂avastin
tm
处理小鼠。此处理完全逆转肿瘤生长表型(图4小图f),证明mistrg中的髓样细胞经由vegf依赖性机制支持黑素瘤生长。总体上,这些结果显示了mistrg小鼠重演人巨噬细胞在肿瘤发生中的作用,并且满足对如下模型的重要需求,所述模型容许体内研究人肿瘤和人巨噬细胞之间的相互作用,尤其是在肿瘤发生开始时。
[0155]
本文描述的数据已经证明了在mistrg小鼠中提供多种人细胞因子导致对人造血和对人免疫细胞功能的直接或间接支持的协同影响(图16)。hhls小鼠的mistrg模型提供了体内研究人先天性免疫应答的独特机会。
[0156]
现在描述材料和方法。
[0157]
小鼠品系
[0158]
在rag2-/-γc-/-balb/c x 129遗传背景中具有人sirpα的bac转基因表达或具有编码tpo、il-3/gm-csf和m-csf的基因的敲入替换的小鼠的生成已有报告(rathinam等,2011,blood 118,3119;willinger等,2011,proceedings of the national academy of sciences 108,2390;rongvaux等,2011,proceedings of the national academy of sciences 108,2378;strowig等,2011,proceedings of the national academy of sciences 108,13218)。将这些品系杂交以获得mitrg(m-csfh/hil-3/gm-csfh/htpoh/hrag2-/-γc-/-)和mistrg(m-csfh/hil-3/gm-csfh/hhsirpatgtpoh/hrag2-/-γc-/-)小鼠。那些小鼠是能活的,健康的且能育的。在无特定病原体的条件下在用饮用水中的恩氟沙星(enrofloxacin)(baytril,0.27mg/ml)连续处理的情况中维持小鼠。nod scidγc-/-(nsg)小鼠获自jackson laboratory。
[0159]
人hspc制备和对接受者小鼠的移入
[0160]
将人造血干细胞和祖细胞移入接受者小鼠,如描述的(rathinam等,2011,blood 118,3119;willinger等,2011,proceedings of the national academy of sciences 108,2390;rongvaux等,2011,proceedings of the national academy of sciences 108,2378;traggiai等,2004,science 304,104;strowig等,2011,proceedings of the national academy of sciences 108,13218)。将胎儿肝样品切成小碎片,于37℃用胶原酶d(roche,100ng/ml)处理45分钟,并制备细胞悬浮液。通过密度梯度离心(淋巴细胞分离介质,mp biomedicals),接着通过用抗人cd34微珠(miltenyi biotec)进行的正免疫磁性选择来纯化人cd34
+
细胞。将细胞在含有10%dmso的fbs中冷冻,并在液氮中保持。
[0161]
对于移入,将新生幼畜(在生命的头2天内)以亚致死照射(x射线照射;rg,2次180cgy相隔4小时;nsg,1次100cgy;mistrg,1次150cgy),并用22号针(hamilton company)将20μl pbs中的100,000个fl-cd34
+
细胞注射入肝中。在特定的实验中(图1小图d和图1小图e),将200,000-300,000个细胞注射入非照射的mistrg新生接受者中。在7-9周后对小鼠采血,并且通过流式细胞术测量人cd45
+
细胞的百分比。选择人cd45
+
细胞占总的(小鼠和人组合的)cd45
+
群体至少5%(rg)或10%(nsg、mitrg和mistrg)的小鼠供进一步实验用。在移植后9-12周将小鼠处死或用于实验。
[0162]
遵照耶鲁大学人调查委员会和耶鲁科研动物护理和使用委员会方案实施所有实验。
[0163]
人细胞群体的免疫表型分析
[0164]
为了制备wbc,用ack裂解缓冲液将肝素化的血液处理两次以消除rbc。用ack裂解缓冲液处理脾和骨髓(自股骨和胫骨冲出)的单细胞悬浮液。通过机械分离组织,并用100u/ml胶原酶iv和0.02mg/ml dna酶i(sigma)于37℃将组织消化1小时,接着进行密度梯度离心来分离肝和肺白细胞。
[0165]
对于facs分析,使用针对下述抗原的抗体:
[0166]
小鼠抗原:cd45(克隆30-f11)、cd71(ri7217)、ter119
[0167]
人抗原:cd1c(bdca1,克隆l161),cd3(ucht1),cd11b(icrf44),cd11c(3.9),cd14(m5e2),cd16(3g8),cd19(hib19),cd33(wm53),cd45(hi30),cd62l(dreg-56),cd66(asl-32),cd94(dx22),cd107a(h4a3),cd115(9-4d2-1e4),cd123(6h6),cd141(bdca3,m80),cd161(hp-3g10),cd235a(hi264),cd303(bdca2,201a),nkp46(9e2),il-15rα(jm7a4),cx3cr1(2a9-1),hla-a,b,c(w6/32),hla-dr(l243),ifnγ(b27)kir2dl1/s1(hp-ma4),kir2dl2/l3(dx27),kir3dl1(dx9),穿孔蛋白(dg9)。
[0168]
人谱系混合物:cd3,cd15,cd19,cd56,nkp46
[0169]
所有抗体获自biolegend,bd biosciences或miltenyi biotec。在lsrii流式细胞仪(bd biosciences)上用facsdiva获得数据,并用flowjo软件分析数据。
[0170]
对于组织学分析,将脾、肺、肝和结肠组织在ihc锌固定剂(bd biosciences)或4%低聚甲醛中固定过夜,并在石蜡中包埋。用苏木精和曙红染色切片,或者用抗人cd68抗体(克隆pgm1),接着用缀合有hrp的二抗染色切片,并用过氧化物酶底物3,3
’‑
二氨基联苯胺显现。
[0171]
体外吞噬测定法
[0172]
将表达gfp的大肠杆菌在lb培养基中于37℃培养过夜至1.5-1.8的od600,在该点时将细菌稀释,并培养1-2小时至约1.0的od600。将大肠杆菌用pbs清洗三次,并于37℃在200μl的体积中以每1x107个wbc约2x108个大肠杆菌与来自mitrg小鼠的wbc一起温育4小时。在温育后,用pbs清洗细胞,并通过流式细胞术分析细胞。
[0173]
体外tlr刺激和体内感染
[0174]
自小鼠的bm分离人单核细胞子集。简言之,自6只小鼠的后腿和脊柱回收并合并bm细胞。通过磁性分离(easysep cd33选择试剂盒,stemcell technologies)富集人cd33
+
细胞。在facsaria细胞分选仪(bd biosciences)上纯化cd14
+
cd16-和cd14
+
cd16
+
子集。将200μl培养基中的100,000个细胞在tlr4配体lps(大肠杆菌0111:b4,sigma-aldrich,100ng/ml)
或tlr7/8配体r848(invivogen,10μg/ml)存在下培养过夜。
[0175]
对于体内刺激,腹膜内注射100μl pbs中的35μg lps(大肠杆菌0111:b4,sigma-aldrich),并在90分钟后收集血清。
[0176]
通过静脉内注射用3x103个菌落形成单位(cfu)的单核细胞增生利斯特氏菌(菌株10403s)感染小鼠。感染后48小时,收获血清和组织,分别用于elisa和qpcr。将来自未感染的或经感染的小鼠的肝淋巴细胞于37c
°
/5%co2在含有莫能菌素(golgistop,bd biosciences)和抗人cd107a抗体的培养基中温育4小时。然后,将细胞针对表面抗原染色,使用cytofix/cytoperm试剂盒(bd biosciences)透化,并在胞内人ifnγ方面染色。
[0177]
用2x10
4 pfu甲型流感/pr8(h1n1)病毒鼻内感染小鼠,并在感染后第3天收获肺供qpcr分析用。
[0178]
使用elisa max标准试剂盒(biolegend),遵循制造商的用法说明测量小鼠血清和培养物上清液中的细胞因子浓度(人tnfα、il-6和il-1β)。
[0179]
rbc分析
[0180]
在hemavet 950(drew scientific)上测量rbc计数。用wright-giemsa染色血液涂片。对于小鼠rbc转移实验,自rg小鼠获得血液,用cfse(20μm,于37℃15分钟)标记,用pbs清洗三次,并通过框后静脉内注射来注射200μl经标记的rbc。在5分钟后对小鼠采血以通过流式细胞术测定ter119
+
细胞中cfse阳性细胞的初始频率(第0天,100%)。然后,在指定的时间点时对它们采血,并且作为第0天数值的百分比计算经cfse标记的ter119
+
细胞的维持。
[0181]
吞噬细胞的体内消减
[0182]
通过静脉内框后注射100μl加载有氯膦酸盐的脂质体(van rooijen和sanders,1994,journal of immunological methods 174,83)来消减吞噬细胞。每天3次注射氯膦酸盐-脂质体,并在最后一次注射后24小时分析小鼠肝中的人nk细胞。对于rbc吞噬测定法,在经cfse标记的rbc转移前3天和1天注射氯膦酸盐-脂质体。
[0183]
定量rt-pcr
[0184]
用trizol试剂(invitrogen)依照制造商的用法说明自组织或纯化的细胞提取总rna,并用于用superscript第一链合成系统(invitrogen)进行的cdna合成。用购自abi的引物-探针套组在7500快速实时pcr系统上实施定量rt-pcr。使用比较阈值循环法计算表达值,并相对于小鼠hprt或人hprt标准化,如指示的。
[0185]
体内nk细胞细胞毒性测定法
[0186]
遵循先前报告的方案(strowig等,2010,blood 116,4158)测定人nk细胞体内细胞毒性。将lcl721.221(hla i类阴性)和lcl721.45(i类阳性)细胞以1:1比率混合,用celltrace violet(invitrogen)标记,并静脉内注射(1x107个细胞/小鼠)入移入nsg或mistrg小鼠中。在12小时后处死小鼠,制备脾的单细胞悬浮液,并通过流式细胞术分析。测量紫色细胞中hla i类阳性和阴性的比例,并且以(mhc i类阳性
–
mhc i类阴性)x 100/mhc i类阳性计算特异性裂解(pecific lysis)。
[0187]
肿瘤发生
[0188]
将人黑素瘤细胞系me290(valmori等,1998,journal of immunology 160,1750)培养至约90%汇合,并在小鼠的体侧中在麻醉下皮下注射细胞(每只小鼠约700万个细胞)。对于一些实验,在肿瘤植入当天开始,隔天用抗人vegf抗体avastin
tm
(roche;静脉内100μg)
处理小鼠。在11天后测量肿瘤的大小,并且使用下述公式计算体积:体积=0.5*长度2*宽度。
[0189]
在oct(optimum cutting temperature,最佳切割温度,sakura finetek)中冷冻患者和小鼠组织。将冷冻切片(7μm)序贯地用triton-100x 0.1%处理15分钟,用透明质酸酶0.03%处理15分钟,用背景消除剂(innovex bioscience)处理15分钟,用fc受体封闭剂(innovex bioscience)处理15分钟,并用背景消除剂再处理15分钟。然后,将切片用在补充有5%bsa和0.01%皂角苷的pbs中稀释的一抗于室温染色1小时,清洗,并用二抗于室温染色40分钟。将核用4’,6-二脒基-2-苯基吲哚(1μg/ml)染色2分钟。
[0190]
一抗:人cd14(1:200,uchm1,abd serotec);人cd163(1:200,edhu-1,abd serotec);人cd206(1:100,15-2,abd serotec);人hla-dr(1:100,ln3,biolegend)。对于cd163/cd206组合染色,在组织染色前用alexa fluor 488或568抗体标记试剂盒(molecular probes)标记这两种抗体。
[0191]
二抗:山羊抗大鼠alexa fluor 568;山羊抗小鼠alexa fluor 488;山羊抗小鼠alexa fluor 588或山羊抗小鼠alexa fluor 647(1:700,molecular probes)。
[0192]
在经由nis-element ar软件(nikon instruments inc)操作的eclipse ti倒置显微镜系统(nikon instruments inc.)上实施免疫荧光成像。
[0193]
对于cd163
+
细胞浸润密度的量化,选择来自3名不同黑素瘤患者、3只nsg和3只mistrg的肿瘤。自每个肿瘤,针对人cd163染色3份冷冻切片。自每个染色的切片获得3幅代表性照片,总计来自每组(患者、mistrg和nsg)的27幅代表性照片。对于每幅照片,使用nis-element ar软件(niko instruments inc.)对cd163
+
细胞计数。使用“分开通道+覆盖”显示并通过在每个分开的通道上和覆盖上同时缩放来分析每幅照片。
[0194]
统计学分析
[0195]
使用单因素anova,接着是tukey事后检验、双尾非配对student t检验或重复测量anova用graphpad prism 5软件实施统计学分析。
[0196]
实施例2:可以在mistrg中移入人髓样新生物
[0197]
髓样白血病是一种影响髓样谱系细胞的癌症类型。髓样白血病分类成不同类型,包括急性髓样白血病(acute myeloid leukemia,aml)、骨髓增殖性病症(myeloproliferative disorder,mpd)、慢性髓-单核细胞性白血病(chronic myelo-monocytic leukemia,cmml)和骨髓增生异常综合征(myelodysplastic syndrome,mds)。发生髓样白血病的风险随年龄而升高,并且这些疾病的发病率可能随群体变老而增加。虽然临床上有治疗性和支持性护理办法,但是需要更好地了解此组疾病和新颖的疗法。
[0198]
用于研究人白血病的方法之一依赖于患者样品对免疫缺陷小鼠的异种移植。然而,目前可用的接受者小鼠对于此目的不是最佳的:仅能成功移入aml样品的一个子集;并且迄今为止尚未报告mpd、cmml或mds(包括rcud、raeb i和raeb ii)的稳健移入。如此,需要接受者小鼠的优化品系以实现更好的人髓样白血病移入。
[0199]
本文中证明了mistrg支持更好的人造血细胞移入,这导致骨髓中人造血对小鼠造血的几乎完全替换。本文中还显示了能在mistrg中移入自aml、cmml和mds患者分离的样品(图17)。
[0200]
因此,本文中描述的经遗传修饰的非人动物代表人髓样白血病的一种新颖的体内
动物模型,其对于下述各项会是有用的:(i)研究疾病的细胞和分子发病机制;(ii)鉴定具有预测或预后价值的生物标志物;(iii)鉴定用于疗法的新颖靶物;及(iv)在临床前和患者特异性背景中测试疗法。
[0201]
在此通过提及将本文中引用的每一篇专利、专利申请、和出版物的公开内容完整收入本文。虽然本发明已经参考具体的实施方案公开,但是显而易见的是,本领域技术人员可以在不偏离本发明的真正精神和范围的情况下想到本发明的其它实施方案和变型。所附权利要求书意图解释为包含所有此类实施方案和等同变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1