一种阿美替尼关键中间体的合成方法和应用与流程
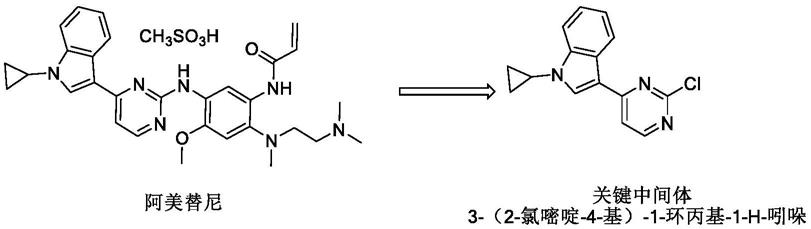
1.本发明属于化学药物合成技术领域,具体涉及一种阿美替尼关键中间体的合成方法和应用。
背景技术:
2.阿美替尼,商品名,阿美乐,是我国自主研发的针对靶点egfr的靶向药物。是国内首个、全球第二个肺癌第三代egfr靶向药。2020年3月18日,阿美替尼获国家药监局批准上市,用于既往egfr-tki治疗进展且t790m阳性的晚期nsclc(非小细胞肺癌)患者的治疗。这也是全球首个二线治疗中位无进展生存期(pfs)超过1年的第三代egfr肺癌靶向药。其化学结构如下:
[0003][0004]
该化合物合成路线主要有三条,其中2017年(ep3205650a1)首次发表了3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚合成工艺,该工艺使用吲哚与环丙基硼酸偶联得到化合物c;化合物c与2,4-二氯嘧啶(化合物d)反应得到化合物3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(tm);该合成工艺需要进行多次柱层析,且需要使用无水氯化铝,无水无氧条件;三废处理成本较高,工业化难度较大;其合成路线如下:
[0005][0006]
2021年在bioorganic and medicinal chemistry发表了3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚最新合成方法,其合成路线如下:
[0007][0008]
该合成路线虽然有效规避了无水氯化铝的使用,但是在生产过程中,依然需要进行柱层析操作;无法进行商业化生产。
[0009]
2019年在cn109761960a的专利中提到3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚的合成,该合成方法首先使用吲哚与2,4-二氯嘧啶相互作用得到化合物g,化合物g再与环丙基硼酸作用得到目标产物,其合成路线如下:
[0010][0011]
该合成路线存在生产成本高,反应后处理繁琐等问题。
[0012]
因此,开发一种适合工业化生产的阿美替尼关键中间体的制备方法具有重要现实意义。
技术实现要素:
[0013]
本发明所要解决的技术问题是针对上述现有技术的不足,提供一种阿美替尼关键中间体的合成方法,该方法具有步骤少、收率高、三废少、成本低等特点,能够实现商业化生产。
[0014]
第一方面,本发明提出了一种阿美替尼关键中间体的合成方法,包括如下步骤:以2,4-二氯嘧啶和吲哚为原料,经过碳碳键形成反应及碳氮键偶联反应得到式(
ⅴ
)所示的阿美替尼关键中间体3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚。
[0015]
本发明的阿美替尼关键中间体的合成方法,实验条件简单易控制,非常适合工业化生产放大,节约时间成本,物料成本并且收率高,大大减少了三废的排放,具有显著的工业价值。
[0016]
作为本发明的具体实施方式,所述阿美替尼关键中间体的合成方法,包括如下步骤:
[0017]
s101:如公式(1)所示,将吲哚溶解,在保护气体氛围下,调节其温度为-20℃~0℃,然后加入格式试剂并搅拌,再加入2,4-二氯嘧啶并进行反应,分液后收集有机相并将其进行重结晶,干燥后得到化合物(ⅲ)。
[0018]
s102:如公式(2)所示,将所述化合物(ⅲ)溶解,然后与催化剂、联吡啶、碳酸钠及环丙基化试剂混合后反应,过滤并分别收集滤饼和滤液,用乙腈淋洗滤饼,将滤液浓缩并干燥后用乙酸乙酯溶解,再加入正己烷析晶后过滤,用乙腈重结晶,得到式(
ⅴ
)所示的阿美替尼关键中间体3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚,
[0019][0020]
作为本发明的具体实施方式,可以用乙腈将所述化合物(ⅲ)溶解,乙腈的质量相对于化合物(ⅲ)的质量的10倍~12倍;优选为相对于化合物(ⅲ)的10倍。
[0021]
作为本发明的具体实施方式,在所述步骤s101中,加入2,4-二氯嘧啶后升温至20℃~75℃并进行反应3h~10h。
[0022]
反应温度可以为例如20℃,40℃,60℃,75℃及其任意组合的范围,优选为升温至60℃~75℃。
[0023]
反应时间可以为3h,5h,8h,10h及其任意组合的范围,根据反应进行的情况进行控制,例如中控送检,待中控hplc结果2,4-二氯嘧啶小于1.0%时,更加优选2,4-二氯嘧啶中控结果小于0.5%时,反应结束。
[0024]
作为本发明的具体实施方式,在所步骤s102中,将所述化合物(ⅲ)溶解,然后与催化剂、联吡啶、碳酸钠及环丙基化试剂混合后反应时,先升温至30℃~70℃进行反应,反应结束后降温至20℃~30℃。
[0025]
作为本发明的具体实施方式,在所述步骤s101中,吲哚的用量相对于2,4-二氯嘧啶用量为1.5eq~2.5eq。
[0026]
作为本发明的具体实施方式,在所述步骤s102中,所述环丙基化试剂至少选自环丙基硼酸或环丙基硼酯中的一种;和/或,所述环丙基化试剂用量为1.2eq~2.5eq(相对于化合物i)。
[0027]
作为本发明的具体实施方式,吲哚、格式试剂和2,4-二氯嘧啶的摩尔比为(1.5~2.5):(1.5~2.5):1,例如1.5:1.5:1.0、1.5:2:1.0、2:1.5:1.0、2:2:1.0、2.5:1.5:1.0、1.5:2.5:1.0、2.5:2.0:1.0、2.0:2.5:1.0和2.5:2.5:1.0;优选为2.5:2.5:1.0。
[0028]
作为本发明的具体实施方式,加入乙腈进行重结晶时,乙腈的质量为2,4-二氯嘧啶质量的2倍~4倍。
[0029]
在本发明中,干燥是为了除去多余的水分,可以采用本领域常规的方法和条件,本发明对此不作特别限定。例如,干燥温度可以为30℃~50℃,优选为40℃~50℃;干燥方式可以采用真空干燥或鼓风干燥,优选真空干燥,真空度不大于-0.08mpa;干燥时间可以为12h~24h。
[0030]
作为本发明的具体实施方式,在所述步骤s101中,溶解吲哚所用溶剂为甲基四氢呋喃和/或四氢呋喃,优选地,每克吲哚使用10ml/g~20ml/g所述甲基四氢呋喃和/或四氢呋喃,更优选为15ml/g~20ml/g,例如15ml/g,16ml/g,17ml/g,18ml/g,19ml/g,20ml/g。
[0031]
作为本发明的具体实施方式,所述保护气体选自氮气或氩气中的一种。
[0032]
作为本发明的具体实施方式,在所述步骤s102中,溶解所述化合物(ⅲ)所用溶剂为甲基四氢呋喃和/或四氢呋喃。
[0033]
优选地,每克所述化合物(ⅲ)使用15ml/g~20ml/g所述甲基四氢呋喃和/或四氢呋喃。
[0034]
作为本发明的具体实施方式,在所述步骤s101中,所述格式试剂至少选自甲基格式试剂、乙基格式试剂和异丙基格式试剂中的一种。
[0035]
作为本发明的具体实施方式,在所述步骤s102中,所述催化剂至少选自醋酸铜、氯化铜、碘化铜中的一种。
[0036]
作为本发明的具体实施方式,所述催化剂的摩尔用量相对于化合物(ⅲ)的摩尔用量为1.0eq~1.2eq;优选为1.0eq。
[0037]
作为本发明的具体实施方式,所述联吡啶的摩尔用量相对于化合物(ⅲ)的摩尔用量为0.9eq~1.1eq,优选为1.0eq。
[0038]
作为本发明的具体实施方式,所述碳酸钠的摩尔用量相对于化合物(ⅲ)的摩尔用量为1.9eq~2.1eq,优选为2.0eq。
[0039]
作为本发明的具体实施方式,在所述步骤s101中,加入2,4-二氯嘧啶进行反应后还包括如下步骤:用饱和氯化铵进行淬灭反应。
[0040]
优选地,淬灭温度为0℃~5℃,例如0℃,1℃,2℃,3℃,4℃和5℃。
[0041]
作为本发明的具体实施方式,将所述化合物(ⅲ)溶解,然后与催化剂、联吡啶、碳酸钠及环丙基化试剂混合后反应时,持续通入空气,优选地,空气通入速率为1l/min~10l/min。
[0042]
第二方面,本发明提出了所述的阿美替尼关键中间体的合成方法在合成阿美替尼及其相关药物中的应用。
附图说明
[0043]
图1为实施例1化合物iii的hnmr检测图谱;
[0044]
图2为实施例1化合物iii的cnmr检测图谱;
[0045]
图3为实施例1化合物v的hnmr检测图谱;
[0046]
图4为实施例1化合物v的cnmr检测图谱。
具体实施方式
[0047]
为使本发明更加容易理解,下面将结合实施例和附图来详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。
[0048]
实施例1:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0049]
(1)化合物(iii)的合成
[0050][0051]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至-20℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,滴加过程中产生大量甲烷气体(注意反应釜排气)。滴完,保温约0.5h,加入化合物i(2.00kg),升温至20-30℃搅拌约0.5h。升温至20℃~40℃,搅拌反应10h,取样中控,hplc中控结果小于1.0%,停止加热,降温至10℃以下。
[0052]
控温5℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,有机相加入水洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,合并有机相,有机相加入无水硫酸钠(2.00kg)干燥2h左右,过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩成半固体状态,加入乙腈(4.00kg),升温至回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,过滤,滤饼再次加入到反应釜中,加入乙腈(4.00kg),升温至回流打浆2-3h,降温至20-30℃,再降温至0-5℃搅拌析晶4h左右,过滤,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12~24h,得到黄色固体物质化合物iii,质量为2.23kg;hplc结果为97.41%。
[0053]
图1为化合物iii的hnmr检测图谱;图2为化合物iii的cnmr检测图谱;
[0054]
氢谱检测结果显示,化合物iii具有8个氢原子,其中有7个芳香环上的氢原子,12.098位置氢原子为吲哚环氮原子连接的氢原子,与结构相同;即所得化合物中间体为目标化合物。
[0055]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0056][0057]
向50l反应釜中依次加入乙腈(20.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3-4h分别再投入第二次和第三次e04(每批0.30kg)。加完后保温反应8h(8h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<0.5%,体系会逐渐变成深蓝色,随着鼓泡反应(1l/min)进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0058]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置,分层,收集有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物2.00kg,纯度>99.75%,单杂<0.2%,质量收率100%。
[0059]
图3为化合物v的hnmr检测图谱;图4为化合物v的cnmr检测图谱。
[0060]
通过对核磁结果进行分析,化合物具有12个氢原子,其中7个氢原子属于芳香环上氢原子,另外5个氢原子属于环丙烷上氢原子。
[0061]
实施例2:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0062]
(1)化合物(iii)的合成
[0063]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至-10℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,并产生大量甲烷气体(注意反应釜排气)。滴完,保温0.5h,加入化合物i(2.00kg),升温至20-30℃搅拌0.5h。升温至40-60℃,搅拌反应10.0h,反应8h取样中控,hplc中控至原料化合物i<1.0%,停止加热,降温至20-30℃。
[0064]
控温5℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,加入水(12.00kg)洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,有机相加入无水硫酸钠(2.00kg)搅拌干燥2.0h,离心机过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩干,加入乙腈(6.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,离心,滤饼返釜,加入乙腈(6.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4.0h左右,离心,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h,得到黄色固体物质,2.00kg;
hplc结果99.03%;
[0065]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0066]
向50l反应釜中依次加入乙腈(24.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3.0-4.0h分别再投入第二次和第三次化合物iv(每批0.30kg)。加完后保温反应8.0-16.0h(8.0h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<3.0%,体系会逐渐变成深蓝色,随着鼓泡反应进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0067]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置15分钟,分层,收集有机相,水层再加入ea(6.00kg),搅拌萃取0.5h,静置15分钟,分层,水相弃去,合并有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物1.90kg,纯度>99.75%,单杂<0.2%,质量收率95.00%。
[0068]
实施例3:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0069]
(1)化合物(iii)的合成
[0070]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至-5℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,并产生大量甲烷气体(注意反应釜排气)。滴完,保温0.5h,加入化合物i(2.00kg),升温至20-30℃搅拌0.5h。升温至50-60℃,搅拌反应8.0-10.0h,反应8h取样中控,hplc中控至原料化合物i<1.0%,停止加热,降温至20-30℃。
[0071]
控温10℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,加入水(12.00kg)洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,有机相加入无水硫酸钠(2.00kg)搅拌干燥2.0h,离心机过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩干,加入乙腈(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,离心,滤饼返釜,加入乙腈
②
(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4.0h左右,离心,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h,得到黄色固体物质,2.02kg;hplc结果99.00%;
[0072]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0073]
向50l反应釜中依次加入乙腈(22.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3.0-4.0h分别再投入第二次和第三次化合物iv(每批
0.30kg)。加完后保温反应8.0-16.0h(8.0h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<3.0%,体系会逐渐变成深蓝色,随着鼓泡反应进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0074]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置15分钟,分层,收集有机相,水层再加入ea(6.00kg),搅拌萃取0.5h,静置15分钟,分层,水相弃去,合并有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物2.00kg,纯度>99.75%,单杂<0.2%,质量收率100%。
[0075]
实施例4:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0076]
(1)化合物(iii)的合成
[0077]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至0℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,并产生大量甲烷气体(注意反应釜排气)。滴完,保温0.5h,加入化合物i(2.00kg),升温至20-30℃搅拌0.5h。升温至60-75℃,搅拌反应8.0-10.0h,反应8h取样中控,hplc中控至原料化合物i<1.0%,停止加热,降温至20-30℃。
[0078]
控温5℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,加入水(12.00kg)洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,有机相加入无水硫酸钠(2.00kg)搅拌干燥2.0h,离心机过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩干,加入乙腈(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,离心,滤饼返釜,加入乙腈
②
(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4.0h左右,离心,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h,得到黄色固体物质,2.02kg;hplc结果99.00%;
[0079]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0080]
向50l反应釜中依次加入乙腈(20.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3.0-4.0h分别再投入第二次和第三次化合物iv(每批0.30kg)。加完后保温反应8.0-16.0h(8.0h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<3.0%,体系会逐渐变成深蓝色,随着鼓泡反应进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0081]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置15分
钟,分层,收集有机相,水层再加入ea(6.00kg),搅拌萃取0.5h,静置15分钟,分层,水相弃去,合并有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物2.00kg,纯度>99.75%,单杂<0.2%,质量收率100%。
[0082]
实施例5:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0083]
(1)化合物(iii)的合成
[0084]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至-5℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,并产生大量甲烷气体(注意反应釜排气)。滴完,保温0.5h,加入e02(2.00kg),升温至20-30℃搅拌0.5h。升温至60-75℃,搅拌反应8.0-10.0h,反应8h取样中控,hplc中控至原料化合物i<1.0%,停止加热,降温至20-30℃。
[0085]
控温10℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,加入水(12.00kg)洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,有机相加入无水硫酸钠(2.00kg)搅拌干燥2.0h,离心机过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩干,加入乙腈(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,离心,滤饼返釜,加入乙腈
②
(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4.0h左右,离心,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h,得到黄色固体物质,2.02kg;hplc结果99.00%;
[0086]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0087]
向50l反应釜中依次加入乙腈(24.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3.0-4.0h分别再投入第二次和第三次e04(每批0.30kg)。加完后保温反应8.0-16.0h(8.0h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<3.0%,体系会逐渐变成深蓝色,随着鼓泡反应进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0088]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置15分钟,分层,收集有机相,水层再加入ea(6.00kg),搅拌萃取0.5h,静置15分钟,分层,水相弃去,合并有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩
干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物2.00kg,纯度>99.75%,单杂<0.2%,质量收率100%。
[0089]
实施例6:3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0090]
(1)化合物(iii)的合成
[0091]
向50l反应釜中依次加入2-methf(17.20kg)、化合物ii(3.93kg),氮气保护下,降温至-5℃。使用氮气将罐装ch3mgbr(11.86kg)控温慢慢压入反应体系中,控温0-10℃,并产生大量甲烷气体(注意反应釜排气)。滴完,保温0.5h,加入e02(2.00kg),升温至20-30℃搅拌0.5h。升温至60-75℃,搅拌反应8.0-10.0h,反应8h取样中控,hplc中控至原料化合物i<1.0%,停止加热,降温至20-30℃。
[0092]
控温10℃以下,向反应液中加入氯化铵水溶液(2.00kg),加完反应液,搅拌淬灭1.0h,静置,分层,水层加入2-methf(2.00kg),萃取,静置分层,水相弃去,合并有机相,加入水(12.00kg)洗涤,静置分层,水层弃去,有机相加入饱和盐水(6.00kg)洗涤,静置分层,水相弃去,有机相加入无水硫酸钠(2.00kg)搅拌干燥2.0h,离心机过滤,滤饼用2-methf(2.00kg)洗涤,收集滤液,30-50℃减压浓缩干,加入乙腈(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4h左右,离心,滤饼返釜,加入乙腈
②
(4.00kg),升温至78-82℃回流打浆2-3h,降温至室温,再降温至0-5℃搅拌析晶4.0h左右,离心,滤饼用乙腈(2.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h,得到黄色固体物质,2.02kg;hplc结果99.00%;
[0093]
(2)3-(2-氯嘧啶-4-基)-1-环丙基-1-h-吲哚(化合物v)的合成
[0094]
向50l反应釜中依次加入乙腈(22.00kg)、化合物iii(2.00kg)、无水醋酸铜(1.74kg)、2,2-联吡啶(1.36kg)、碳酸钠(1.84kg)、化合物iv(0.30kg,第一次),使用鼓泡器持续通入空气,升温至50-55℃,每隔3.0-4.0h分别再投入第二次和第三次e04(每批0.30kg)。加完后保温反应8.0-16.0h(8.0h开始hplc取样中控,取样过滤取液体送检),hplc中控至原料化合物iii<3.0%,体系会逐渐变成深蓝色,随着鼓泡反应进行会有部分溶剂损耗,反应釜需盐水冷凝,若体系溶剂挥发较多需往体系补加适量溶剂乙腈。
[0095]
停止加热及鼓泡,降温至20-30℃,离心,滤饼乙腈(2.00kg)淋洗至滤液颜色基本无色,收集滤液30-50℃减压浓缩干,加入ea(20.00kg)、水(20.00kg)搅拌0.5h,静置15分钟,分层,收集有机相,水层再加入ea(6.00kg),搅拌萃取0.5h,静置15分钟,分层,水相弃去,合并有机相,加入10%冰醋酸溶液(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入15%氨水(9.00kg)搅拌15分钟,静置15分钟分层,水相弃去,有机相加入饱和盐水(9.00kg)搅拌15分钟,静置15分钟,水相弃去,有机相加入无水硫酸钠(2.00kg)、活性炭(0.20kg),室温搅拌干燥4.0h,过滤,滤饼用ea(2.00kg)漂洗,合并滤液,30-50℃减压浓缩干,加入无水乙醇(6.00kg)升温至75-80℃回流搅拌溶解,2.0-3.0h缓慢梯度降温至室温(每小时降温20-25℃),再降温至-5-5℃搅拌析晶8.0h,过滤,滤饼用预冷至0℃以下的的无水乙醇(1.00kg)漂洗,滤饼30-50℃鼓风或减压干燥12.0h以上,得类白色固体产物2.00kg,纯度>99.75%,单杂<0.2%,质量收率100%。
[0096]
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何
限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1