一种二氢嘧啶氨基水解酶及其应用的制作方法
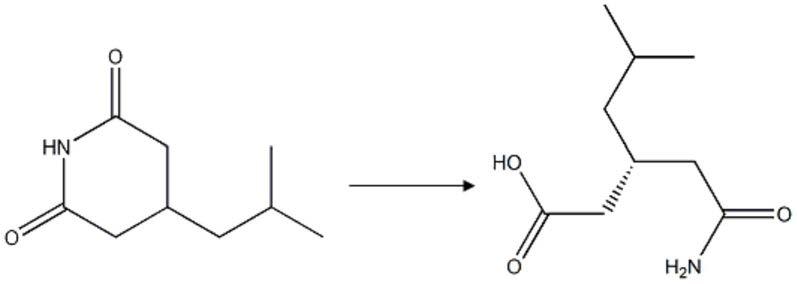
1.本发明属于生物催化技术领域,涉及一种制备普瑞巴林手性中间体的技术,具体涉及一种利用二氢嘧啶氨基水解酶制备(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的方法。
背景技术:
2.普瑞巴林(pregabalin)化学名为(s)
‑3‑
氨甲基
‑5‑
甲基己酸,结构式如下,是美国warner
‑
lambert公司研发的新一代γ
‑
氨基丁酸(γ
‑
gaba)受体激动剂,主要用于治疗外周神经痛以及辅助性治疗局限性部分癫痫发作,其中s
‑
构型的药理活性是r
‑
构型的10倍,因此合成光学纯的手性普瑞巴林对于增强药物疗效、减少非活性对映体引发的副作用具有重要意义。
[0003][0004]
目前已报道的普瑞巴林合成方法有不少,但主要是通过不对称催化剂、手性配体的化学不对称合成法,或者是使用化学试剂或商品酶对反应过程中的消旋中间体进行手性拆分。通过高效酶催化潜手性化合物直接获得手性中间体是最经济、有效的途径。其中二氢嘧啶氨基水解酶底物谱较为广泛,可以水解一些酰亚胺、二氢嘧啶和海因,然而它们更倾向于水解一些环酰亚胺类物质。普瑞巴林的手性中间体(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸可以通过水解3
‑
异丁基戊二酰亚胺获得,而3
‑
异丁基戊二酰亚胺是环酰亚胺类化合物。
[0005][0006]
因此,推测高选择性、高活性的二氢嘧啶氨基水解酶直接水解3
‑
异丁基戊二酰亚胺可以获得手性中间体(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸。
技术实现要素:
[0007]
基于上述推测,发明人对于多种微生物来源的二氢嘧啶氨基水解酶(dihydropyrimidinase,ec.3.5.2.2)进行了筛选,包括41种二氢嘧啶氨基水解酶。利用大肠杆菌表达这些二氢嘧啶氨基水解酶,并通过发酵菌体催化3
‑
异丁基戊二酰亚胺发生水解反应,检测反应液中(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的含量,进行目标二氢嘧啶氨基水解
酶的筛选。
[0008]
经过筛选,发现荧光假单胞菌pseudomonas fluorescens来源的两种二氢嘧啶氨基水解酶seq id no:1(ncbi登录号:wp_011030900.1)和seq id no:3(ncbi登录号:wp_011334810.1)能够催化3
‑
异丁基戊二酰亚胺反应生成(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸。
[0009]
因此,本发明的第一个目的在于提供一种酶催化法制备(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的技术方案。
[0010]
一种制备(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的方法,其包括如下步骤:以3
‑
异丁基戊二酰亚胺为底物,使用二氢嘧啶氨基水解酶seq id no:1或者seq id no:3催化开环反应,得到(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸。
[0011]
其中,第一种二氢嘧啶氨基水解酶的氨基酸序列为seq id no:1:
[0012]
mssrtvirgglvitasdeihadvliedgrvaalaatgtpaaeaftaenvidasgkyvipggvdghthmempfggtyaadtfetgtraaawggtttivdfaiqsvghslregldawhakaegncaidygfhmivsdvnqetlkemdllveegvtsfkqfmaypgvfysddgqilramqraaengglimmhaengiaidvlveqalargetdprfhgevrkalleaeathrairlaqvagaplyvvhvsateavaeltrardeglpvfgetcpqylflstdnlaepdfegakyvcstplrpkehqaalwrglrtndlqvvstdhcpfcfsgqkelgrgdfsripngmpgvenrmdllhqavveghigrrrwieiacatparmfglypkkgtiapgadadivvydphaeqvisaethhmnvdysayegrritgrvetvlsrgepvvtereytgrkghgaytpratcqylt(seq id no:1);
[0013]
第二种二氢嘧啶氨基水解酶的氨基酸序列为seq id no:3:
[0014]
msllirgativthdesyradvycadgvikaigenldipagaevldgsgqylmpggidphthmqlpfmgtvasedfysgtaaglaggttsiidfvipnpqqslleafhqwrgwaeksasdygfhvaitwwseqvreemaelvshhginsfkhfmayknaimaaddtlvasferclelgavptvhaengelvyhlqrklmaqgitgpeahplsrpsqvegeaasrairiaetigtplylvhvstkealdeityarskgqpvygevlaghlllddsvyqhpdwqtaagyvmsppfrprghqdalwhglqsgnlhttatdhccfcaeqkaagrddfskipngtagiedrmavlwdegvnsgrlsmqdfvaltstntakifnlyprkgairvgadadlvlwdpqgtrtisakthhqqvdfnifegktvtgvpshtvsqgrvvwadgdlraergagryierpaypavfdllskraeqhkptavkr(seq id no:3)。
[0015]
在一种实施方式中,上述二氢嘧啶氨基水解酶seq id no:1或者seq id no:3可以呈酶的形式例如游离酶或固定化酶,也可以呈其表达微生物菌体形式。
[0016]
上述微生物可以是任何适合于表达上述二氢嘧啶氨基水解酶的微生物,例如选自枯草芽孢杆菌、毕赤酵母、酿酒酵母、大肠杆菌。
[0017]
优选地,所述微生物是大肠杆菌,更优选大肠杆菌bl21(de3)。
[0018]
本发明的第二个方面提供了一种编码上述二氢嘧啶氨基水解酶seq id no:1或者seq id no:3的基因。当上述二氢嘧啶氨基水解酶的表达宿主是大肠杆菌时,上述二氢嘧啶氨基水解酶seq id no:1的编码基因的核苷酸序列可以为seq id no:2,但不限于此;上述二氢嘧啶氨基水解酶seq id no:3的编码基因的核苷酸序列可以是为seq id no:4,但不限于此。
[0019]
上述编码基因可以克隆在一种质粒载体,用于转化微生物宿主细胞。
[0020]
在一种实施方式中,上述质粒载体选自pet系列,例如选自pet22b、pet24a、pet28a等,但并不受限于此。
[0021]
本发明的第三个方面提供了一种大肠杆菌,其转化了包含上述二氢嘧啶氨基水解
酶编码基因的质粒。
[0022]
上述酶促反应的反应体系可以是ph6
‑
9的缓冲液,例如tris
‑
hcl缓冲液或者磷酸缓冲液等,但并不受限于此。
[0023]
在反应过程中,控制反应体系ph7.0
‑
9.0、优选ph7.5
‑
8.5、更优选ph7.5左右;反应温度25
‑
50℃、优选28
‑
48℃、更优选30
‑
45℃、更优选35
‑
40℃、最优选40℃左右。
[0024]
本发明筛选出的二氢嘧啶氨基水解酶seq id no:1和seq id no:3可以催化底物3
‑
异丁基戊二酰亚胺发生水解反应,开环生成(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸,开辟了一种生物催化法生产普瑞巴林手性中间体(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的新途径。
附图说明
[0025]
图1是本发明实施例中底物反应8小时后的hplc检测谱图。
[0026]
图2是本发明实施例催化反应结束后hplc检测的产物手性色谱图。
具体实施方式
[0027]
发明人从已报到的41种二氢嘧啶氨基水解酶中筛选能用于合成(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的二氢嘧啶氨基水解酶。这41种二氢嘧啶氨基水解酶包括如下ncbi登录号/genbank登录号:wp_011030900.1(streptomyces coelicolor a3(2))、wp_011334810.1(pseudomonas fluorescens pfo
‑
1)、eub75082.1(pseudomonas sp.gm41)、adu69230.1(pantoea sp.at
‑
9b)、aby99529.1(pseudomonas putida gb
‑
1)、arw18102.1(komagataeibacter europaeus)、add28645.1(meiothermus ruber dsm 1279)、smc02439.1(rubrobacter radiotolerans dsm 5868)、smb90978.1(peptoniphilus asaccharolyticus dsm20463)、smb99550.1(thermanaeromonas toyohensis tobe)、ado81913.1(ilyobacter polytropus dsm 2926)、aew05800.1(sulfobacillus acidophilus dsm 10332)、efq24407.1(aminomonas paucivorans dsm 12260)、afz32681.1(gloeocapsa sp.pcc 7428)、aev96856.1(niastella koreensis gr20
‑
10)、ock09729.1(thalassospira sp.ko164)、eed66725.1(comamonas testosteroni kf
‑
1)、apa99167.1(nocardia seriolae)、cdm58815.1(rhizobium favelukesii)、adp81169.1(frankia inefficax)、arw10815.1(acetobacter ascendens)、apr94628.1(pandoraea thiooxydans)、odp29750.1(paenibacillus nuruki)、acl62933.1(methylobacterium nodulans ors 2060)、oaz72086.1(acetobacter pasteurianus)、kxa69515.1(megasphaera sp.mjr8396c)、kxb88395.1(veillonella sp.dnf00869)、ajy49223.1(halomonas sp.ko116)、adw67334.1(granulicella tundricola mp5actx9)、adh91532.1(starkeya novella dsm 506)、adg98040.1(segniliparus rotundus dsm 44985)、acx38503.1(escherichia coli dh1)、aci50717.1(gluconacetobacter diazotrophicus pa1 5)、acb68161.1(burkholderia ambifaria mc40
‑
6)、abr61199.1(sinorhizobium medicae wsm419)、abo58457.1(burkholderia vietnamiensis g4)、abm31567.1(acidovorax citrulli aac00
‑
1)、acu60912.1(chitinophaga pinensis dsm2588)、acv29453.1(anaerococcus prevotii dsm 20548)、abx35502.1(delftia acidovorans sph
‑
1)、erl25429.1(mitsuokella sp.oral taxon 131str.w9106)。最终得到两种野生型
二氢嘧啶氨基水解酶具有该功能,它们均来源于荧光假单胞菌pseudomonas fluorescens,其中ncbi登录号为wp_011030900.1的二氢嘧啶氨基水解酶seq id no:1的氨基酸数量有467个,ncbi登录号为wp_011334810.1的二氢嘧啶氨基水解酶seq id no:3的氨基酸数量有479个。
[0028]
由于它们的氨基酸序列明确,因此本领域技术人员很容易获得其编码基因、包含这些基因的表达盒和质粒、以及包含该质粒的转化体。
[0029]
这些基因、表达盒、质粒、转化体可以通过本领域技术人员所熟知的基因工程构建方式获得。
[0030]
为了在微生物宿主例如基因工程中最常用的大肠杆菌宿主中最佳地表达二氢嘧啶氨基水解酶seq id no:1或者seq id no:3,本发明对其表达基因进行了密码子优化。
[0031]
密码子优化是可用于通过增加感兴趣基因的翻译效率使生物体中蛋白质表达最大化的一种技术。不同的生物体由于突变倾向和天然选择而通常示出对于编码相同氨基酸的一些密码子之一的特殊偏好性。例如,在生长快速的微生物如大肠杆菌中,优化密码子反映出其各自的基因组trna库的组成。因此,在生长快速的微生物中,氨基酸的低频率密码子可以用用于相同氨基酸的但高频率的密码子置换。因此,优化的dna序列的表达在快速生长的微生物中得以改良。
[0032]
经过密码子优化,二氢嘧啶氨基水解酶seq id no:1的编码基因可以是seq id no:2,二氢嘧啶氨基水解酶seq id no:3的编码基因可以是seq id no:4。
[0033]
当作为生物催化剂用于制备(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸时,本发明的二氢嘧啶氨基水解酶以及添加的葡萄糖二氢嘧啶氨基水解酶可以呈现酶的形式或者菌体的形式。所述酶的形式包括游离酶、固定化酶,包括纯化酶、粗酶、发酵液、载体固定的酶等;所述菌体的形式包括存活菌体和死亡菌体。
[0034]
纯的二氢嘧啶氨基水解酶seq id no:1和seq id no:3用于催化水解反应时,一般只能一次性使用,使得(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸的生产成本较高。为了提高反应工艺经济性,有必要重复利用该二氢嘧啶氨基水解酶。
[0035]
生物催化领域公知,与游离酶法相比,应用固定化酶技术具有生产过程简化、生产效率提高等优点。同时,由于酶可多次使用,且酶的稳定性提高,从而有效提高了单位酶的生产力;其次,固定化酶极易与底物、产物分开,简化了提纯工艺,产率较高,产品质量较好。
[0036]
本发明采用离子交换树脂作为固定化载体分别对二氢嘧啶氨基水解酶seq id no:1和seq id no:3进行固定化,能够重复多次用于底物3
‑
异丁基戊二酰亚胺的水解开环反应。
[0037]
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
[0038]
实施例
[0039]
实施例中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
[0040]
材料和方法
[0041]
实施例中的全基因合成、引物合成及测序皆由苏州金唯智生物科技有限公司完成。
[0042]
实施例中的分子生物学实验包括质粒构建、酶切、连接、感受态细胞制备、转化、培养基配制等等,主要参照《分子克隆实验指南》第三版(j.萨姆布鲁克,d.w.拉塞尔(美)编著,黄培堂等译,科学出版社,北京,2002)进行。必要时可以通过简单试验确定具体实验条件。
[0043]
pcr扩增实验根据质粒或dna模板供应商提供的反应条件或试剂盒说明书进行。必要时可以通过简单试验予以调整。
[0044]
lb培养基:10g/l胰蛋白胨,5g/l酵母提取物,10g/l氯化钠,ph7.2。(lb固体培养基另加20g/l琼脂粉。)
[0045]
tb培养基:24g/l酵母提取物、12g/l胰蛋白胨、16.43g/l k2hpo4·
3h2o、2.31g/l kh2po4、5g/l甘油,ph7.0
‑
7.5。(tb固体培养基另加20g/l琼脂粉。)
[0046]
底物和产物hplc检测方法:
[0047]
1、含量检测
[0048]
色谱仪:岛津lc
‑
2010
[0049]
柱子:c18 column
[0050]
流动相:乙腈:水(20:80,v/v;ph 2.5,磷酸调ph)
[0051]
流速:1.0ml/min
[0052]
检查测器,uv 210
[0053]
柱温箱:30℃。
[0054]
2、手性ee检测
[0055]
色谱仪:岛津lc
‑
2010
[0056]
柱子:chiralpack ad
‑
rh column(daicel)
[0057]
流动相:乙腈:水(50:50,v/v;ph 2.5,磷酸调ph)
[0058]
流速:0.5ml/min
[0059]
检查测器,uv 210
[0060]
柱温箱:30℃。
[0061]
实施例1:构建表达二氢嘧啶氨基水解酶的重组大肠杆菌
[0062]
1.1根据pseudomonas fluorescens(荧光假单胞菌)来源的二氢嘧啶氨基水解酶的氨基酸序列seq id no:1(ncbi登录号wp_011030900.1),进行适于大肠杆菌表达的密码子优化,优化后的基因序列为seq id no:2。全基因合成该基因序列,在两端设计酶切位点nde i和xhoi,并亚克隆到载体pet24a(购自novagen)上相应位点,从而获得重组质粒pet24a
‑
ih
‑
1。将构建好的重组质粒pet24a
‑
ih
‑
1用电转化法转入大肠杆菌bl21(de3)感受态,得到表达二氢嘧啶氨基水解酶seq id no:1的重组大肠杆菌bl21(de3)/pet24a
‑
ih
‑
1。
[0063]
1.2参照步骤1.1,构建表达二氢嘧啶氨基水解酶seq id no:3的重组大肠杆菌bl21(de3)/pet24a
‑
ih
‑
2。
[0064]
1.3参照步骤1.1,分别构建表达其他微生物来源的二氢嘧啶氨基水解酶(genbank登录号或ncbi登录号wp_011334810.1、eub75082.1、adu69230.1、aby99529.1、arw18102.1、add28645.1、smc02439.1、smb90978.1、smb99550.1、ado81913.1、aew05800.1、efq24407.1、afz32681.1、aev96856.1、ock09729.1、eed66725.1、apa99167.1、cdm58815.1、adp81169.1、arw10815.1、apr94628.1、odp29750.1、acl62933.1、oaz72086.1、kxa69515.1、kxb88395.1、
ajy49223.1、adw67334.1、adh91532.1、adg98040.1、acx38503.1、aci50717.1、acb68161.1、abr61199.1、abo58457.1、abm31567.1、acu60912.1、acv29453.1、abx35502.1、erl25429.1)的重组大肠杆菌bl21(de3)/pet24a
‑
ih
‑
3至bl21(de3)/pet24a
‑
ih
‑
41。
[0065]
实施例2:二氢嘧啶氨基水解酶的筛选
[0066]
2.1菌株发酵
[0067]
分别挑取各个二氢嘧啶氨基水解酶表达菌株单菌落,分别接种至3ml含50μg/ml硫酸卡那霉素的lb培养基中,37℃,200rpm培养过夜。分别按照1v/v%接种量分别转接至200ml tb培养基中,37℃,250rpm培养至od
600 0.6
‑
0.8时,加入0.5mm iptg,28℃,200rpm培养过夜。然后4℃,10000rpm,离心10min,收集菌体冷冻备用。
[0068]
2.2催化(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸合成
[0069]
反应体系:0.1m tris
‑
hcl缓冲液(ph7.5)1l、10wt%底物3
‑
异丁基戊二酰亚胺、5%w/v冻融菌体,30℃反应24小时,hplc检测底物样品浓度和产物,筛选有产物(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸出现的菌株。
[0070]
经过hplc检测验证,发现bl21(de3)/pet24a
‑
ih
‑
1和bl21(de3)/pet24a
‑
ih
‑
2催化的反应液中出现了(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸吸收峰。
[0071]
实施例3:二氢嘧啶氨基水解酶的提取和固定化
[0072]
3.1二氢嘧啶氨基水解酶表达菌株的摇瓶发酵:分别配制液体培养基tb(ph7.2),分装于500ml三角摇瓶,装液量100ml,然后在高压灭菌锅中于121℃加热灭菌20min。从工程菌bl21(de3)/pet24a
‑
ih
‑
1或bl21(de3)/pet24a
‑
ih
‑
2的lb平板上用接种环挑取数个菌落,接种于tb摇瓶中,接种前在tb培养基中加入100μg/ml卡那霉素,于37℃、220rpm摇床培养至od
600
=5
‑
6,加入0.2mm iptg于28℃诱导24h左右。
[0073]
3.2酶的提取分离:取发酵液50ml装入离心管中;8000rpm离心去上清液得到菌体,按菌体200g/l加纯化水重悬,悬浮菌体用冰浴冷却,进行超声破碎(电压400w,超声时间3s,间隔时间5s,工作次数80次)得粗酶液,放置于冰浴中待用。
[0074]
粗酶液采用ni
‑
ntg亲和层析柱(南京金瑞斯生物,产品编号:l00250/l00250
‑
c)纯化目的蛋白。缓冲液预平衡ni
‑
ntg亲和层析柱,使用10个柱体积的洗涤缓冲液(50mm ph 8.0tris
‑
hcl,300mm nacl,50mm咪唑)清洗,之后用洗脱缓冲液(50mm ph 8.0tris
‑
hcl,300mm nacl,250mm咪唑)将目的蛋白从ni柱中洗脱。
[0075]
3.3酶固定化:采用环氧型离子交换树脂lx
‑
1000ep对酶进行固定化,方法如下:用0.05m磷酸缓冲液(ph8.0)反复清洗固定化载体lx
‑
1000ep(西安蓝晓科技有限公司)。按酶蛋白:载体比大约1:12
‑
15的比例,置于0.1m磷酸钾缓冲液(ph8.0),在20
‑
25℃条件下,150rpm振摇;1min后停止振摇,检测并调整ph8.0左右,继续振摇18h;停止振摇,在相同温度下静置24h;除去上清,用0.02m磷酸钾缓冲液(ph8.0)在20
‑
25℃条件下振摇2min;除去上清,再次以相同缓冲液振摇洗涤45min;除去上清,再次用0.02m磷酸钾缓冲液(ph8.0)清洗,用真空泵抽干,即得固定化酶,在2℃
‑
8℃条件下保存备用。
[0076]
实施例4:酶法合成(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸
[0077]
反应体系(1l):0.1m tris
‑
hcl缓冲液(ph7.5)1l、10wt%底物3
‑
异丁基戊二酰亚胺,10wt%固定化二氢嘧啶氨基水解酶seq id no:1,用6m naoh校正ph7.5。在30℃的条件下反应8小时后,取100μl反应液,12000rpm离心5分钟,对上清液进行超滤,滤液进行hplc检
测产物的转化情况,结果见图1,反应8小时后有至少60%的底物已经转化为产物,12小时转化率达到95%以上。
[0078]
固定化二氢嘧啶氨基水解酶seq id no:3的催化反应结果与上述结果相似。
[0079]
实施例5:酶法合成(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸
[0080]
反应体系(1l):0.1m tris
‑
hcl缓冲液(ph7.5)1l、10wt%底物3
‑
异丁基戊二酰亚胺,10wt%固定化二氢嘧啶氨基水解酶seq id no:1,用6m naoh校正ph8.5。在40℃的条件下搅拌反应24个小时后,过滤获得反应液,反应液减压蒸馏,浓缩至剩余约1/5体积,降温至0
‑
5℃,搅拌析晶lh,过滤、干燥得目标产物化合物。利用hplc检测(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸手性纯度。结果如图2所示,产物(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸晶体中,r
‑
构型的ee值为99.5%以上。说明固定化二氢嘧啶氨基水解酶seq id no:1或seq id no:3的立体选择性很高,其可以催化制备高手性纯度的普瑞巴林中间体(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸。
[0081]
固定化二氢嘧啶氨基水解酶seq id no:3的催化反应结果相似,也得到了高光学纯度的(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸。
[0082]
以上实验表明,二氢嘧啶氨基水解酶seq id no:1和seq id no:3能够催化3
‑
异丁基戊二酰亚胺进行开环反应,得到(r)
‑3‑
(氨甲酰甲基)
‑5‑
甲基己酸,且都具有高度的立体选择性,可用于制备高手性纯度的普瑞巴林中间体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1