LINC01996在诊断过敏性气道炎症中的应用的制作方法
linc01996在诊断过敏性气道炎症中的应用
技术领域
1.本发明属于生物医药领域,具体涉及linc01996在诊断过敏性气道炎症中的应用。
背景技术:
2.过敏性鼻炎
‑
哮喘综合征(combined allergic rhinitis and asthma syndrome,caras)是由世界变态反应组织(world allergy organisation,wao)提出的新的医学诊断概念,指同时发生的、临床或亚临床的上呼吸道过敏(过敏性鼻炎,allergic rhinitis,ar)和下呼吸道过敏(支气管哮喘,bronchial asthma,ba)所致慢性过敏性炎症和高反应性症状。ar是发生在鼻粘膜的变态反应性疾病,表现为卡他性炎症造成的鼻分泌物亢进、鼻粘膜肿胀、水样清涕、鼻塞,高反应性造成的鼻痒、喷嚏。ba表现为气道脱屑性炎症、高反应性(ahr)及气流受限所致喘息、气急、胸闷和咳嗽等。某些caras伴有过敏性结膜炎,症状如眼痒、流泪等。往往鼻部表现在晨起加剧,而哮喘症状在夜间加重。caras是多种因素诱导的呼吸系统病症加剧而急性起病的疾病过程,可突然发作,可自行缓解或经过治疗后缓解,但易感于某些内外因素而反复发作,对健康和生活质量有着明显的负面影响。caras是呼吸系统常见病、多发病,好发于任何年龄,四季皆可发作,遗传因素之外,环境因素、职业接触粉尘、饮食习惯不佳、喝酒、吸烟、药物过敏等危险因素使caras的发病率逐年上升,引起医学界关注。目前,caras在诊断上采用过敏性鼻炎和哮喘联合诊断的方式。关于可用于诊断过敏性鼻炎
‑
哮喘综合征的生物标志物的研究报道较少。
技术实现要素:
3.本发明的目的在于针对现有技术的不足,提供可用于诊断过敏性鼻炎
‑
哮喘综合征的标志物。
4.为实现上述目的,本发明采用了如下技术方案:
5.一方面,本发明提供了用于测量生物样本中生物标志物的表达水平的试剂在制备用于诊断受试者的过敏性气道炎症的产品中的用途,所述的生物标志物包括linc01996。
6.在某些实施方案中,所述的过敏性气道炎症包括过敏性鼻炎、哮喘病、过敏性鼻炎
‑
哮喘综合征。作为一种优选的实施方案,所述的过敏性气道炎症为过敏性鼻炎
‑
哮喘综合征。
7.在一个实施方案中,与未患病的对照受试者的生物标志物的参考值范围相比,所述linc01996的表达水平降低指示所述的受试者患有过敏性气道炎症。
8.另一方面,本发明提供了一种用于诊断受试者的过敏性气道炎症的方法。所述的方法包含a)测量来源于受试者的生物样本中linc01996的水平;和b)结合linc01996的相应参考值范围分析linc01996的水平,其中与未患病的对照受试者的linc01996的参考值范围相比,生物样本中linc01996的差异表达指示受试者患有过敏性气道炎症。参考值范围可表示在一个或多个未患过敏性气道炎症的受试者(例如健康受试者)的一个或多个样本中所发现的linc01996的水平。或者,参考值可表示在一个或多个患有过敏性气道炎症的受试者
的一个或多个样本中所发现的linc01996的水平。
9.在本发明中,linc01996的表达水平可通过微阵列分析、聚合酶链式反应(pcr)、逆转录酶聚合酶链式反应(rt
‑
pcr)、northern印迹、southern印迹或基因表达的系列分析(sage)检测。
10.在某些实施方案中,所述的生物样本为血液。
11.在某些实施方案中,所述的试剂包括引物、探针、微阵列。
12.在一个实施方案中,所述的探针包含荧光标记、生物发光标记、化学发光标记、比色标记或同位素标记。
13.另一方面,本发明还提供了一种用于诊断受试者的过敏性气道炎症的产品,所述的产品包含用于检测生物样本中linc01996的表达水平的试剂。
14.在某些实施方案中,所述的过敏性气道炎症包括过敏性鼻炎、哮喘病、过敏性鼻炎
‑
哮喘综合征。作为一种优选的实施方案,所述的过敏性气道炎症为过敏性鼻炎
‑
哮喘综合征。
15.在某些实施方案中,所述的产品包括试剂盒、芯片、试纸。
16.在一个实施方案中,所述的试剂盒包含呈电子或纸质形式的信息,所述信息包含使linc01996的检测水平与所述的过敏性气道炎症相关的说明。
17.另一方面,本发明还提供了一种用于执行一种计算机实施的用于诊断疑似患有过敏性气道炎症的患者的方法的诊断系统,所述的计算机执行包含以下的步骤:
18.1)接受所输入的患者数据,包含来自所述患者的生物样本中linc01996的表达水平值;
19.2)分析生物标志物的水平并与生物标志物的相应参考值范围相比,若所述患者的linc01996的水平低于未患病的对照受试者的参考值范围提示所述患者患有过敏性气道炎症;
20.3)显示关于所述患者的诊断信息,
21.其中所述诊断系统包含:
22.1)用于存储数据的存储组件,其中所述存储组件具有用于确定存储在其中的受试者诊断的指令;
23.2)用于处理数据的计算机处理器,其中所述计算机处理器被耦合到所述存储组件并且被配置成执行存储在所述存储组件中的指令以便接收患者数据并根据一种或多种算法分析患者数据;以及
24.3)用于显示关于所述患者的诊断信息的显示器组件。
25.在某些实施方案中,所述的过敏性气道炎症包括过敏性鼻炎、哮喘病、过敏性鼻炎
‑
哮喘综合征。作为一种优选的实施方案,所述的过敏性气道炎症为过敏性鼻炎
‑
哮喘综合征。
附图说明
26.图1是rna电泳图;
27.图2是内参gapdh基因实时扩增曲线图及产物溶解曲线图,其中,图a为gapdh基因实时扩增曲线图,图b为产物溶解曲线图;
28.图3是linc01996基因实时扩增曲线图及产物溶解曲线图,其中,图a为linc01996基因实时扩增曲线图,图b为产物溶解曲线图;
29.图4是linc01996差异表达的柱状图;
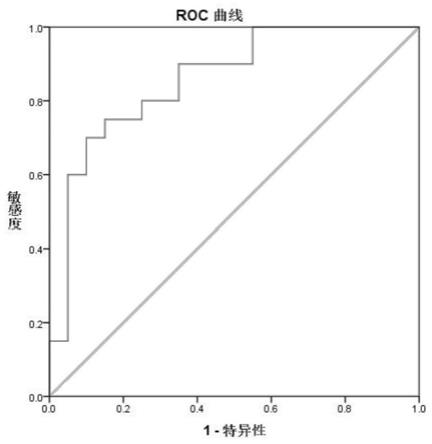
30.图5是linc01996的roc曲线图。
具体实施方式
31.除非另外指明,否则本发明的实践将采用所属领域技能内的药理学、化学、生物化学、重组dna技术和免疫学的常规方法。在以下文献中全面解释了这些技术:《实验免疫学手册(handbookof experimental immunology)》,第i
‑
iv卷(d.m.weir和c.c.blackwell编,布莱克威尔出版公司(blackwell scientific publications));a.l.lehninger,《生物化学(biochemistry)》(worth publishers公司,现行版);sambrook等人,《分子克隆:实验室手册(molecular cloning:a laboratory manual)》(第3版,2001);《酶学方法(methods inenzymology)》(s.colowick和n.kaplan编,学术出版公司(academic press,inc.))。
32.一、定义
33.在描述本发明时,以下术语将被采用并打算如下文所指示定义。
34.在本发明的上下文中,“生物标志物”是指相比于从对照受试者(例如诊断呈阴性的个人、正常或健康受试者或未患病的受试者)获取的可比样本,在从患有过敏性气道炎症的患者获取的样本中差异表达的生物化合物,如多核苷酸。生物标志物可为可检测到和/或定量的核酸、核酸片段、多核苷酸或寡核苷酸。
35.术语“多核苷酸”、“寡核苷酸”、“核酸”和“核酸分子”在本文中用于包括任何长度的聚合物形式的核苷酸(核糖核苷酸或脱氧核糖核苷酸)。此术语仅指代分子的一级结构。因此,所述术语包括三链、双链和单链dna以及三链、双链和单链rna。它还包括修饰,如通过甲基化和/或通过加帽,和未修饰形式的多核苷酸。更具体地说,术语“多核苷酸”、“寡核苷酸”、“核酸”和“核酸分子”包括多脱氧核糖核苷酸(含有2
‑
脱氧
‑
d
‑
核糖)、多核糖核苷酸(含有d
‑
核糖)和任何其它类型的多核苷酸(它是嘌呤或嘧啶碱基的n
‑
或c
‑
糖苷)。不意图在术语“多核苷酸”、“寡核苷酸”、“核酸”和“核酸分子”之间存在长度区别,并且这些术语可互换使用。
36.如果一个样本中多核苷酸的量在统计学上显著不同于另一个样本中多核苷酸的量,那么多核苷酸在两个样本之间是差异表达的。举例来说,如果多核苷酸存在量为其在另一个样本中的存在量的至少约120%、至少约130%、至少约150%、至少约180%、至少约200%、至少约300%、至少约500%、至少约700%、至少约900%或至少约1000%,或如果其在一个样本中可检测到并且在另一个样本中无法检测到,那么多核苷酸在两个样本中是差异表达的。
37.术语“受试者”、“个体”和“患者”在本文中可互换使用并且是指需要诊断、预后、治疗或疗法的任何哺乳动物受试者,尤其人类。其它受试者可包括牛、犬、猫、天竺鼠、兔、大鼠、小鼠、马等等。在一些情况下,本发明的方法应用于实验动物、兽医学应用和动物疾病模型(包括(但不限于)啮齿动物,包括小鼠、大鼠和仓鼠;以及灵长类动物)的开发中。
38.如本文所用,“生物样本”是指从受试者分离的组织、细胞或流体的样本,包括(但不限于)例如血液、血沉棕黄层、血浆、血清、血细胞(例如外周血单个核细胞(pbmc)、杆状核
细胞、嗜中性粒细胞、单核细胞或t细胞)、粪便物、尿液、骨髓、胆汁、脊髓液、淋巴液、皮肤样本、皮肤、呼吸道、肠道和泌尿生殖道的外部分泌物、泪液、唾液、乳汁、器官、活检体以及体外细胞培养物成分的样本,包括(但不限于)由细胞和组织在培养基中生长产生的条件培养基,例如重组细胞和细胞组分。在本发明的具体实施例中,所述的生物样本为血液。
39.如本文所用,“诊断”一般包括关于受试者是否可能罹患给定疾病、病症或功能障碍的判定。所属领域的技术人员通常基于一个或多个诊断指标(即,生物标志物)进行诊断,诊断指标的存在、不存在或量指示疾病、病症或功能障碍存在或不存在。
40.本文所用的“引物”是指可以在扩增方法(如聚合酶链式反应(pcr))中使用来基于对应于目的基因(例如,linc01996序列或其一部分)的多核苷酸序列扩增核苷酸序列的寡核苷酸。通常,用于扩增多核苷酸序列的至少一条pcr引物对于该多核苷酸序列是序列特异性的。引物的确切长度取决于多种因素,包括温度、引物来源和所用的方法。例如,对于诊断和预后应用,根据靶序列的复杂性,寡核苷酸引物通常含有至少10、或15、或20、或25或更多个核苷酸,但是其可以含有更少核苷酸或更多核苷酸。确定引物合适长度中涉及的因素是本领域技术人员熟知的。具体实施方案中所用的引物如本文的表4所示,其中标明了它们的具体应用。在本文中,术语“引物对”表示与靶dna分子的相反链杂交或与位于待扩增的核苷酸序列侧翼的靶dna区域杂交的引物对。在本文中,术语“引物位点”表示与引物杂交的靶dna或其它核酸的区域。
41.如本文所用,术语“探针”是指能够选择性结合特定预期目标生物分子的任何分子。在一些实施方案中,本文中,术语“探针”是指可间接地或直接地、共价地或非共价地结合至本文公开的任何底物和/或反应产物和/或蛋白酶的任何分子或与其相关,并且其相关或结合可使用本文公开的方法检测。在一些实施方案中,探针是荧光探针、抗体或基于吸光度的探针。如果是基于吸光度的探针,发色团pna(对硝基苯胺)可用作检测和/或定量本文公开的靶核酸序列的探针。在一些实施方案中,探针可以是包含荧光分子或底物的核酸序列,该荧光分子或底物在暴露于酶时变为发荧光的,并且该核酸序列与一种核酸序列的片段互补。
42.二、执行本发明的模式
43.在详细描述本发明之前,应理解,本发明不限于特定配制品或工艺参数,因此当然可变化。还应理解,本文所用的术语仅出于描述本发明的具体实施方案的目的,并且不是限制性的。
44.尽管在本发明的实践中可使用与本文所述的方法和材料类似或等效的许多方法和材料,但是本文描述了优选的材料和方法。
45.本发明涉及用于诊断过敏性鼻炎
‑
哮喘综合征的标志物及其应用。具体来说,本发明人已发现一种生物标志物,其表达谱可用于诊断过敏性气道炎症。
46.生物标志物
47.可用于本发明实践的生物标志物包括来自基因或基因的rna转录物的核苷酸序列的多核苷酸,其包括(但不限于)linc01996。生物标志物的差异表达与过敏性气道炎症相关联并因此,生物标志物的表达谱可用于诊断过敏性气道炎症。
48.在本发明中,生物标志物例如linc01996(geneid:400568)包括gene及其突变。该术语涵盖生物标志物的天然发生变体(例如剪接变体)。
49.检测和测量生物标志物
50.在本发明中,生物标志物可通过所属领域中已知的任何合适的方法测量。生物标志物的表达水平的测量可为直接或间接的。举例来说,可直接定量rna或蛋白质的丰度水平。或者,可通过测量cdna、经扩增的rna或dna的丰度水平或通过测量rna或指示生物标志物的表达水平的其它分子(例如代谢物)的数量或活性间接测定生物标志物的量。
51.在一个实施方案中,生物标志物的表达水平是通过测量生物标志物的多核苷酸水平来测定。特定生物标志物基因的转录物水平可由生物样本中所存在的mrna或来源于其的多核苷酸的量来测定。多核苷酸可通过多种方法检测和定量,所述方法包括(但不限于)微阵列分析、聚合酶链式反应(pcr)、逆转录酶聚合酶链式反应(rt
‑
pcr)、northern印迹、southern印迹和基因表达的系列分析(sage)。参见例如draghici《dna微阵列的数据分析工具(dataanalysistools for dnamicroarrays)》,chapman and hall/crc,2003;simon等人《dna微阵列研究的设计和分析(design and analysis of dna microarray investigations)》,springer,2004;《实时pcr:当前技术和应用(real
‑
time pcr:current technology andapplications)》,logan,edwards和saunders编,caister academic press,2009;bustin《定量pcr的a
‑
z(a
‑
z ofquantitative pcr)》(iul生物技术,第5期),internationaluniversity line,2004;velculescu等人(1995)《科学》270:484
‑
487;matsumura等人(2005)《细胞微生物学(cell.microbiol.)》7:11
‑
18;《基因表达的系列分析(sage):方法和方案(分子生物学方法)(serial analysis of gene expression(sage):methods andprotocols(methods in molecular biology))》,humana press,2008;其以全文引用的方式并入本文中。
52.试剂盒、微阵列
53.本发明提供了用于诊断过敏性气道炎症的试剂盒,其中,所述的试剂盒可用于检测本发明的生物标志物。试剂盒可包括一种或多种用于检测生物标志物的试剂、用于盛放从疑似患有过敏性气道炎症的人类受试者分离的生物样本的容器;以及用于使试剂与生物样本或一部分生物样本反应以检测生物样本中至少一种过敏性气道炎症生物标志物的存在或量的印刷说明书。试剂可封装在单独的容器中。
54.试剂盒可包含一个或多个用于容纳试剂盒中所含组合物的容器。组合物可呈液体形式或可冻干。用于组合物的合适容器包括例如瓶子、小瓶、注射器和试管。容器可由多种材料形成,包括玻璃或塑料。试剂盒还可包含药品说明书,其含有诊断过敏性气道炎症方法的书面说明。
55.微阵列是通过选择包含多核苷酸序列的探针并随后将这类探针固定于固体支撑物或表面而制备。举例来说,探针可包含dna序列、rna序列或dna和rna的共聚物序列。探针的多核苷酸序列还可包含dna和/或rna类似物或其组合。举例来说,探针的多核苷酸序列可为基因组dna的完全或部分片段。探针的多核苷酸序列还可为合成的核苷酸序列,如合成寡核苷酸序列。探针序列可以酶促方式在体内、以酶促方式在体外(例如通过pcr)或以非酶促方式在体外合成。
56.下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
57.实施例1real time pcr检测过敏性鼻炎
‑
哮喘综合征患者血液样本中目的基因表达量的变化
58.一、实验目的
59.用sybr greenⅰreal time pcr方法检测过敏性鼻炎
‑
哮喘综合征患者血液样本中目的基因lncrna转录水平的变化情况。
60.二、实验材料
61.1.样本清单
62.本研究招募了20个过敏性鼻炎
‑
哮喘综合征患者和20个正常人,临床信息如表1所示,采集血液样本用于分析研究。
63.表1参与这项研究的人员的基本临床信息
[0064][0065]
2.实验主要试剂
[0066]
表2使用试剂清单
[0067][0068]
3.实验主要仪器
[0069]
表3使用仪器清单
[0070][0071][0072]
三、实验方法
[0073]
1.引物设计
[0074]
1.1 real time pcr检测目的基因引物。以下引物在博迈德公司合成。
[0075]
表4引物序列
[0076][0077]
2.实验过程
[0078]
2.1提取样本总rna
[0079]
①
每0.25ml液体样本(血清,血浆,脑脊液等)加入0.75ml裂解液rls,用加样枪吹打液体样品几次以帮助裂解样品中细胞。每5~10
×
106个细胞至少加入0.75ml裂解液rls。裂解液rls和液体样品的终体积比总是3:1。
[0080]
②
在ep管中加入0.75ml裂解液rls,再加入0.25ml血液样本,用力连续震摇30s,混匀,在15
‑
30℃条件下孵育10min以使核蛋白体完全分解。
[0081]
③
每0.75ml裂解液rls加0.2ml氯仿,剧烈震荡15s并室温下放置5min。
[0082]
④
于4℃12000rpm离心10min,样品会分成三层:下层有机相,中间层和上层无色的水相,rna存在于上层水相中。水相层的容量大约为所加rls体积的70%,把水相转移到新管中,进行下一步操作。
[0083]
⑤
加入1倍体积70%乙醇(请先检查是否已加入无水乙醇!),颠倒混匀(此时可能会出现沉淀)。得到的溶液和可能沉淀一起转入吸附柱ra中(吸附柱套在收集管内)。
[0084]
⑥
12000rpm离心45s,弃掉废液,将吸附柱重新套回收集管。
[0085]
⑦
加0.5ml去蛋白液re,12000rpm离心45s,弃掉废液。
[0086]
⑧
加入0.5ml漂洗液rw(请先检查是否已加入无水乙醇!),12000rpm离心45s,弃掉废液。
[0087]
⑨
加入0.5ml漂洗液rw,12000rpm离心45s,弃掉废液。
[0088]
⑩
将吸附柱ra放回孔收集管中,13000rpm离心2min,尽量除去漂洗液,以免漂洗液中残留乙醇抑制下游反应。
[0089]
取出吸附柱ra,放入一个rnase free离心管中,根据预期rna产量在吸附膜的中间部位加30
‑
50ul rnase free water(事先在65
‑
70℃水浴中加热效果更好),室温放置2min,12000rpm离心1min。如果需要较多rna,可将得到的溶液重新加入离心吸附柱中,离心1min,或者另外加入再加30ul rnase free water,离心1min,合并两次洗脱液。
[0090]
2.2逆转录合成lncrnacdna
[0091]
采用fastquant cdna第一链合成试剂盒(货号:kr106)进行lncrna反转录,首先去除基因组dna反应,在试管中加入5
×
gdna buffer 2.0ul,totalrna 1ug,加rnase free ddh2o使总体积至10ul,水浴锅中42℃加热3min,再将10
×
fast rt buffer 2.0ul,rt enzyme mix 1.0ul,fq
‑
rt primer mix2.0ul,rnase free ddh2o 5.0ul,混合后加入上述试管中一起混合共20ul,水浴锅中42℃加热15min,95℃加热3min,合成的cdna需要长期保存时,请于
‑
20℃或更低温度保存。
[0092]
2.3 mrna荧光定量检测
[0093]
2.3.1仪器及分析方法
[0094]
用abi 7300型荧光定量pcr仪,采用2
‑
△△
ct
法进行数据的相对定量分析。
[0095]
2.3.2操作过程如下:
[0096]
(一)反应体系:用superreal premix plus(sybr green)(货号:fp205),进行扩增,实验操作按产品说明书进行。realtime反应体系为:
[0097]
表5 realtime反应体系
[0098]
试剂使用量2
×
superreal premix plus10μl上游引物(10um)0.6μl
下游引物(10um)0.6μl50
×
rox reference dye
△
2μldna模板2ul灭菌蒸馏水4.8ul
[0099]
(二)扩增程序为:95
°
15min,(95℃10sec,55℃30sec,72℃32sec)
×
40个循环,95℃15sec,60℃60sec,95℃15sec)。
[0100]
(三)引物筛选
[0101]
将各样本cdna混合后,以此为模板进行10倍梯度稀释,稀释后样品各取2μl作模板,分别用目的基因引物和内参基因引物进行扩增,同时在60
‑
95℃进行融解曲线分析,根据扩增效率高和溶解曲线单峰原则进行引物筛选。
[0102]
(四)样品realtimepcr检测
[0103]
将各样品cdna 10倍稀释后取2μl作模板,分别用目的基因引物和内参基因引物进行扩增(见表五)。同时在60
‑
95℃进行溶解曲线分析。
[0104]
表6样品realtimepcr检测设计
[0105]
模板样品cdna样品cdna重复检测孔道数33引物目的基因引物内参基因引物
[0106]
(五)数据统计
[0107]
将运行程序下机所导出的原始结果ct值按照上样顺序进行整理,得到各个样本每个基因的三个复孔原始ct值,在excel中分别求出目的基因与内参基因的三个复孔ct值的平均值,分别计算对照组(癌旁组织)和试验组(胃癌组织)中目的基因相对于内参基因的表达,采用graphpad软件进行统计分析,两者之间的差异采用t检验。
[0108]
四、实验结果
[0109]
1.rna浓度检测结果及1.5%琼脂糖rna电泳检测结果
[0110]
表7 rna浓度及纯度结果
[0111]
[0112][0113]
注:
[0114]
rna溶于水中会导致a260/280比值偏低
[0115]
a:浓度未达标准;b:a260/a280不合格;c:电泳图不合格;h:合格样本评判标准:
[0116]
(1)浓度>30ng/ul
[0117]
(2)1.8<a260/a280<2.0
[0118]
(3)电泳图可以看到较清晰三条带(第三条可能会看不到)
[0119]
表8电泳上样情况
[0120]
[0121]
[0122][0123]
rna电泳图如图1所示,其中m表示dna marker:dm2000,从下往上依次为100,250,500,750,1000和2000bp,其中750bp为亮带。
[0124]
2.各样品realtimepcr检测结果及分析
[0125]
各样本实时扩增曲线图和样本扩增产物溶解曲线图如图2、3所示。
[0126]
统计结果如图4所示,与健康对照组相比,过敏性鼻炎
‑
哮喘综合征组样本中linc01996表达下调。
[0127]
实施例2 linc01996的诊断效能验证
[0128]
采用spss软件绘制受试者工作曲线(roc),分析auc值、敏感性和特异性,判断指标单独的诊断效能。
[0129]
如表9、图5所示,linc01996具有较高的诊断效能(auc值为0.858,敏感性值为0.750,特异性值为0.850),提示linc01996可用于诊断过敏性鼻炎
‑
哮喘综合征。
[0130]
表9 roc曲线下方的区域
[0131][0132]
以上结合附图详细描述了本技术的优选实施方式,但是,本技术并不限于上述实施方式中的具体细节,在本技术的技术构思范围内,可以对本技术的技术方案进行多种简单变型,这些简单变型均属于本技术的保护范围。
[0133]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本技术对各种可能的组合方式不再另行说明。
[0134]
此外,本技术的各种不同的实施方式之间也可以进行任意组合,只要其不违背本技术的思想,其同样应当视为本技术所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1