通用供体细胞和相关方法
1.相关申请
2.本技术要求2017年7月12日提交的标题为universal donor cells and related methods的美国发明申请号15/648,337的优先权,其通过引用整体并入本文。
3.领域
4.本文涉及基因表达、基因组工程化和基因/细胞治疗领域。
5.背景
6.人多能干细胞(hpsc)是一种生成用于移植到患者体内的任何成体细胞类型的有用工具。原则上,基于hpsc的细胞疗法具有治疗大多数(即使不是全部)退行性疾病的潜力,然而,此类疗法的成功可能受受试者的免疫应答限制。免疫系统用增加特异性的分层防御来保护生物体免受感染。简而言之,物理屏障防止病原体诸如细菌和病毒进入生物体。如果病原体突破了这些屏障,则先天性免疫系统会提供立即但非特异性反应。如果病原体成功地逃避了先天性反应,则脊椎动物拥有第二层保护,即被先天性反应激活的适应性免疫系统。适应性免疫系统产生更加特异性的反应。此时,免疫系统在感染期间将其反应适应至提高其对病原体的识别。在病原体被消除后,这种改善的反应会以免疫记忆的形式得以保留,并在每次遇到这种病原体时使适应性免疫系统发动更快和更强的攻击。适应性免疫反应是抗原特异性的,并且需要在称为抗原呈递的过程中识别特异性"非自身"抗原。抗原特异性允许产生针对特定病原体或病原体感染细胞调整的反应。干扰素γ(ifn-γ)在抵抗传染性和非传染性疾病中起着至关重要的作用。人免疫反应中ifn-γ的主要来源是t细胞。nk细胞、巨噬细胞和ifn-在先天性和获得性免疫中均起重要作用。
7.主要组织相容性复合物(mhc)是调节免疫系统必不可少的一组细胞表面蛋白。mhc分子的主要功能是与源自病原体的抗原结合并将其展示在细胞表面上,以被适当的t细胞识别。mhc基因家族分为三个亚组:i类、ii类和iii类。人mhc也称为hla(人白细胞抗原)复合物(通常简称为hla)。天然杀伤(nk)细胞是在先天性免疫和适应性免疫间的交界处起作用的淋巴细胞。nk细胞通过其效应器功能(诸如细胞毒性和细胞因子分泌)以及通过调节先天性和适应性免疫反应,直接有助于免疫防御。当靶细胞或宿主细胞遇到nk细胞时,可能会有几种结果。nk响应的程度由nk细胞上激活和抑制受体的数量和类型,以及靶细胞上激活和抑制配体的量和类型来确定。参见图1。在情形a中,当靶细胞没有人类白细胞抗原(hla)i类抗原且没有nk激活配体时,表达mhc-i类抑制性受体和激活配体受体的nk细胞不攻击靶细胞(无反应,或未经许可)。在情形b中,当靶细胞表达hla-i类抗原但没有激活配体时,表达抑制性受体和激活受体的nk细胞不能攻击靶标。在情形c中,当靶细胞下调hla-i类抗原或没有hla-i类抗原并表达nk激活配体时,表达抑制性受体和激活性受体的nk细胞攻击靶细胞。在情形d中,当靶细胞表达自身hla-i类抗原和nk激活配体两者时,则表达抑制性受体和激活受体的nk细胞的反应水平通过对nk细胞的抑制性信号和激活性信号的平衡来确定。haynes等人,the immune system in health and disease,part 15:immune-mediated,inflammatory,and rheumatologic disorders,372e introduction to the immune system。
8.在过去,克服宿主对同种异体细胞的免疫反应的努力集中于适应性免疫响应,即干扰t细胞与外源细胞上呈递的mhc-i类抗原之间的粘附。这样,crispr和talen系统已用于生成功能丧失遗传修饰,并从而制备不表达一种或多种经典的mhc/hla基因的干细胞。然而,这些细胞及其衍生的细胞仍然容易受到宿主先天免疫反应(nk细胞)的攻击。参见,如,parham等人(2005)nat rev immunol.5(3):201-214。为了克服宿主的先天免疫反应,其他人试图将致耐受性因子重新导回靶细胞中;关注点是“失去自我”。参见wo2016183041a2,其公开内容通过引用整体并入。申请人惊讶地发现,逃避宿主的nk介导的免疫反应的关键不是“失去自我”,而是nk细胞激活配体在靶细胞上的表达和量级。
9.因此,仍然需要用于开发靶细胞的组合物和方法,这些靶细胞缺乏一些或全部经典的hla表达,但是不被nk细胞攻击进行裂解。
10.概述
11.本文公开了通过提供通用供体细胞系来克服移植物排斥、特别是基于细胞的移植疗法中同种异体免疫移植物排斥的策略。在一个实施方案中,提供了缺乏一些或所有典型hla-i类细胞表面蛋白表达和nk激活配体表达的人多能干细胞。在一个实施方案中,提供了缺乏一些或所有典型hla-i类细胞表面蛋白表达和nk激活配体表达的源自人多能干细胞的细胞,诸如胰腺细胞。在一个实施方案中,提供了通过提供经移植的胰腺细胞来预防细胞移植物排斥的方法,其中至少一种mhc基因(诸如β-2-微球蛋白(b2m))和至少一种nk激活配体基因(诸如细胞内粘附分子1(icam-1))已被破坏、缺失、修饰或抑制。在另一个实施方案中,提供了通过提供经移植的胰腺细胞来预防细胞移植物排斥的方法,其中至少一种mhc基因(诸如b2m)和至少一种nk激活配体蛋白(诸如icam-1)已被破坏、缺失、修饰或抑制。b2m的破坏、缺失、修饰或抑制导致所有hla i类表面表达和功能存在缺陷。
12.附图简述
13.图1是来自haynes等人的复制图,参见上述,其中的图372e-4(其整体并入本文)显示了不同的情形(a nk介导的对靶细胞的反应。在靶细胞上不存在mhc-i类且不存在nk激活配体的情况下,nk细胞上的抑制性和激活受体不参与,并且nk细胞保持无反应(情形a)。在靶细胞上存在mhc-i类但不存在nk激活配体的情况下,nk细胞上的抑制性受体参与,但nk细胞保持无反应(情形b)。在靶细胞上不存在自身-mhc-i类但存在nk激活配体的情况下,nk细胞上的抑制性受体不参与但nk细胞上的激活受体参与,并且nk细胞攻击(情形c)。在靶细胞上存在mhc-i类和nk激活配体的情况下,nk细胞上的抑制性和激活受体参与,并且结果通过信号平衡来确定。
14.图2a显示了在没有ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,野生型(wt)hes细胞上的b2m细胞表面蛋白表达的代表性流式细胞术分析。阴影区是没有抗体染色的本底表达。暴露于ifn-γ增加了wt hes细胞中b2m细胞表面蛋白表达。
15.图2b显示了在无ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,b2m敲除(b2m-/-)hes细胞上的b2m细胞表面蛋白表达的代表性流式细胞术分析。b2m-/-hes细胞具有极其少的b2m细胞表面蛋白表达,其在暴露于ifn-γ之后未显著改变。
16.图3a显示了在无ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,使用泛hla i类抗体,wt hes细胞上hla-abc细胞表面蛋白表达的代表性流式细胞术分析。阴影区是没有抗体染色的背景表达。
pec上的cd155细胞表面蛋白表达的代表性流式细胞术分析。c线是没有抗体染色的本底表达。在暴露于ifn-γ后,wt pec具有与wt处理的pec对照类似的cd155细胞表面蛋白表达。基因符号pvr(别名:cd155、necl-5、hved)。抗体来自milteneyi biotech inc.,目录号130-105-905。
29.图11显示了在未暴露于ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,wt pec上的ceacam1(别名:cd66a、bgp、bgp1)细胞表面蛋白表达的代表性流式细胞术分析。c线是没有抗体染色的本底表达。与未处理的对照相比,暴露于ifn-γ轻度增加了wt pec中的ceacam1细胞表面蛋白表达。抗体来自milteneyi biotech inc.,目录号130-098-858。
30.图12显示了在未暴露于ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,wt pec上的bat3细胞表面蛋白表达的代表性流式细胞术分析。c线是没有抗体染色的本底表达。未处理对照中的wt pec具有与暴露于ifn-γ的wt pec类似的bat3细胞表面蛋白表达。基因符号bag6(别名:bat3,hla-b-相关转录物3)。抗体来自abcam,inc.,目录号ab210838。
31.图13显示了在未暴露于ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,wt pec上的cadm1(别名:necl2、tslc1、igsf4、ra175)细胞表面蛋白表达的代表性流式细胞术分析。c线是没有抗体染色的本底表达。在暴露于ifn-γ之后,wt pec具有与未处理的对照类似的cadm1细胞表面蛋白表达。抗体来自mbl international corp.,目录号cm004-4。
32.图14显示了在未暴露于ifn-γ(b线)的情况下和在暴露于ifn-γ(a线)之后,wt pec上的cd112细胞表面蛋白表达的代表性流式细胞术分析。c线是没有抗体染色的本底表达。在暴露于ifn-γ之后,wt pec具有与未处理的对照类似的cd112细胞表面蛋白表达。基因符号pvrl2(别名:cd112、nectin-2、pvrr2、hveb)。抗体来自milteneyi biotech inc.,目录号130-109-056。
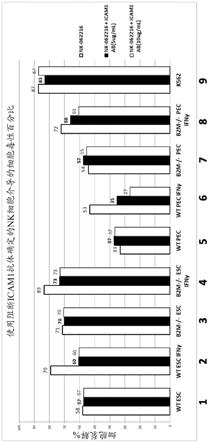
33.图15是显示在靶细胞中用抗-icam1抗体阻断icam-1表达之后,nk细胞裂解靶细胞减少的条形图(从左至右用于nk细胞毒性测定的细胞:wt hesc,暴露于ifn-γ的wt hesc,b2m-/-hesc,暴露于ifn-γ的b2m-/-hes,wt pec,暴露于ifn-γ的wt pec,b2m-/-pec,暴露于ifn-γ的b2m-/-pec,k562-对照细胞系用于nk细胞毒性测定)。从左至右,每组的三个条代表:nk-062216;nk-062216+icam1 ab(5μg/ml);nk-062216+icam1 ab(10μg/ml)。
34.序列表
35.如37c.f.r.1.822所定义,使用核苷酸碱基的标准字母缩写和氨基酸的三字母代码显示了所附序列表中所列的核酸和氨基酸序列。每个核酸序列仅显示一条链,但是互补链应理解为通过对展示链的任何引用而包含。序列表以ascii文本文件sequence_listing(11kb)的形式于2018年7月3日提交,其通过引用并入本文。
36.详述
37.mhc-i类分子是主要组织相容性复合物(mhc)分子的两个主要类别之一(另一类是mhc-ii类)。它们的功能是将非自身蛋白的肽片段从细胞内展示给细胞毒性t细胞;这将触发免疫系统对借助mhc-i类蛋白展示的特定非自身抗原的立即反应。在人类中,对应于mhc-1类的hla是hla-a、hla-b、hla-c、hla-e、hla-f和hla-g。人类hla-e、hla-f和hla-g是非典型的mhc i类分子,其特征是有限的多态性和比典型旁系同源物(hla-a、-b和-c)低的细胞表面表达。所有mhc i类蛋白必需与β2-微球蛋白(b2m)缔合以产生功能性异二聚体mhc i类蛋白复合物,之后在细胞表面上进行功能表达。mhc-i类分子也可以用作nk细胞的抑制性配
体。细胞表面mhc-i类的正常水平降低激活了nk细胞的杀伤作用。
38.在过去,认为由于假定的mhc-i类抑制信号的主导性质,带有mhc-i类抑制性配体的靶细胞在暴露于nk细胞时会逃避攻击(参见图1,情形b,复制自harrison’s principles of internal medicine 19e(第1卷和第2卷)a major histocompatibility complex,part 15,其中的图372e-4)。但是,申请人惊奇地发现相反的情况是正确的。
39.已经显示,细胞暴露于ifn-γ增加了mhc-i类分子的mrna表达以及还有mhc i类蛋白复合物在细胞表面上的表达。预期mhc-i类表达的这种增加抑制了nk细胞。申请人发现当暴露于ifn-γ时野生型(wt)hes细胞(已经显示出增加了hes细胞的细胞表面上的mhc-i类分子,图2a和3a)具有增加的nk细胞介导的细胞毒性。参见图15,显示了nk细胞介导的毒性(裂解)从58%增加到79%(比较图15中条件1和2中的第一直条)。当wt pec细胞暴露于ifn-γ时,情况同样如此,细胞的b2m和hla-abc表达也增加,参见图4a和5a,nk介导的毒性(裂解)从33%增加至53%(比较图15中的条件5和6中的第一直条)。这一数据表明,克服宿主的nk细胞免疫反应的关键不是过表达抑制性mhc-i类信号,而是阻断nk激活配体信号。
40.为了在强调的nk细胞介导的细胞毒性的背景下进一步检验该假设,申请人制备了b2m-/-(敲除)hes细胞(类似于图1情形c)。如预期的那样,b2m-/-消除了hes细胞(图2b和3b)和pec(图4b和5b)上mhc i类分子的细胞表面表达。同样如预期的那样,相对于wt细胞,b2m-/-细胞表现出增加的nk细胞介导的裂解,对于hes细胞而言为58%至71%,并且对于pec而言为33%至54%(比较图15中条件1vs.3或5vs.7中的第一直条)。申请人发现,b2m-/-hes细胞或pec对ifn-γ的暴露进一步增加了nk细胞介导的毒性(裂解)的百分比(比较图15中条件2vs.4和6vs.8中的第一直条)。相应地,申请人发现nk细胞激活配体细胞表面表达(图6b和7b)和mrna表达(图8)在暴露于ifn-γ下增加。该数据表明靶细胞上的nk细胞激活配体在nk细胞的细胞毒性中起关键作用,并导致这样的假设,即在减少的mch i类表达的背景下,例如在b2m-/-的背景下,抑制nk细胞激活配体表达可以防止nk细胞介导的细胞毒性。
41.为了确定是否可以通过抑制nk激活配体对靶细胞的作用来降低nk细胞的毒性,申请人在wt和b2m-/-hes细胞以及pec中阻断了nk激活配体的表达,例如使用icam1阻断抗体阻断靶细胞表面上的icam1蛋白。申请人惊奇地发现靶细胞的细胞裂解减少(比较图15中条件2、4、6和8的第一直条与第二直条和第三直条)。因此,申请人发现可以通过阻断nk激活配体来减少nk细胞的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断icam1表达是产生具有双重敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,申请人可以将靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转换为a。具体而言,本发明的细胞、组织和器官抑制或没有hla-i类细胞表面蛋白表达(b2m-/-),以及抑制或没有nk激活配体细胞表面蛋白表达(如icam1-/-)。抑制细胞表面蛋白表达可以通过敲除基因或使用抗体阻断蛋白表达来实现。干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。双或多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类,以及几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。此外,为了完全消除nk激活,申请人预期将需要通过靶细胞中的基因敲除(如,hes细胞源性细胞疗法)或通过使
用阻断抗体或其他目前已知或未来开发的策略,来消除或减少多个nk激活配体的表达。
42.nk细胞激活配体阻断剂
43.根据本发明的一方面,提供了抑制nk细胞功能的治疗方法。根据本发明的另一方面,提供了抑制至少一种免疫反应的治疗方法。每种方法涉及向需要治疗的受试者施用抑制nk细胞功能的药剂。在一些实施方案中,该药剂是抗体。在一些实施方案中,抗体选择性结合至靶细胞上的nk细胞激活配体。
44.考虑了可以使用各种类型的试剂,包括抗体和阻断蛋白,来干扰nk细胞与靶细胞的nk激活配体之间的粘附。
45.在某些实施方案中,此类nk激活配体选自表1。
46.表1:天然杀伤(nk)激活配体
47.[0048][0049]
nk激活配体进一步描述于pegram et al.,,activating and inhibitory receptors of nk cells immunology and cell biology(2011)89,216
–
224,其通过引用
整体并入本文。
[0050]
低免疫原性hes细胞及由其衍生的细胞
[0051]
hla是由大型基因家族编码的细胞表面分子,并且可以分为i类和ii类分子。hla-i类分子存在于每个有核细胞的表面上,并且是本文所述发明的焦点。移植期间的供体(靶)细胞和接受者的免疫细胞(如t细胞)之间的hla错配通常会导致免疫排斥或移植物排斥。hla-i类复合物在结构上由由hla-i类肽(如hla-a、hla-b和hla-c)组成的多态性重链和轻链β-2-微球蛋白(β2m或b2m)组成。在不存在b2m的情况下,i类hla无法正确组装,也不会在细胞表面或细胞膜上表达。在本文所述的发明中,申请人通过破坏b2m基因(添加或去除一些碱基对,从而在mrna/蛋白质中产生移码和功能丧失突变)并从而从hesc中的细胞表面耗竭hla-1类表达来产生hes细胞系及由其衍生的细胞。
[0052]
通过额外破坏编码nk激活配体(诸如icam1)的基因,上述方法还可以用于产生或生成hes细胞系及由其衍生的细胞。因此,在本发明的一个实施方案中,提供了组合物和方法以制备缺少至少一种hla-i类抗原和至少一种nk激活配体的靶细胞,并从而产生低免疫原性细胞。此类低免疫原性细胞被预期更不容易被移植了此类细胞的受试者免疫排斥。移植时,这种低免疫原性细胞应植入(不被排斥)。在一个实施方案中,此类靶细胞能够在几乎不需要接受者免疫抑制的情况下移植并存活。
[0053]
在一个实施方案中,hesc细胞及其衍生的细胞中hla-i类表达和nk激活配体表达的抑制、减少和/或缺失(或hla-i类缺陷和nk激活配体缺陷)可以用作移植疗法的通用供体细胞来源。这些双重敲除(hla-i类缺陷和nk激活配体缺陷)可以普遍移植,而无需次要组织相容性复合物(mihc)匹配、人白细胞抗原(hla)匹配或免疫抑制。
[0054]
本文公开了新型体外来源的低免疫原性组合物和细胞。特别地,在某些实施方案中,本文公开的本发明涉及干细胞,其基因组已经被改变(修饰)以减少或缺失一种或多种mhc-i类基因以及一种或多种nk激活配体基因的关键组分。在某些实施方案中,本文公开的发明涉及胰腺谱系细胞,诸如胰腺内胚层细胞、胰腺上皮细胞、胰腺祖细胞、胰腺前体内分泌细胞、胰腺内分泌细胞、胰腺前-β细胞或胰腺β细胞,其基因组已经被改变(修饰)以减少或缺失一种或多种mhc-i类基因和一种或多种nk激活配体基因的关键组分,从而产生低免疫原性胰腺-谱系类型细胞。天然杀伤激活配体包括但不限于表1中列出的来自类别1、2、3或其组合的配体。天然杀伤激活配体包括例如icam-1、ceacam1、cadm1、mica和micb。mhc-i类基因包括hla-a、hla-b、hla-c、hla-e、hla-f、hla-g和b2m。在某些方面,mhc-i类和/或mhc-ii类基因的此类减少的表达或敲除通过直接和/或间接靶向nlrc5、b2m和ciita基因及mhc增强体的其他组分(增强体是在增强子处组装的高阶蛋白质复合物并调节靶基因的表达,如mhc-i类或mhc-ii类的转录调节剂)来完成。
[0055]
本文还公开了制备低免疫原性细胞的方法,所述方法包括调节由细胞表达的一种或多种nk激活配体的表达和调节细胞的一种或多种mhc-i类和/或mhc-ii类的表达,从而制备低免疫原性细胞。在某些方面,调节一种或多种mhc-i类和/或mhc-ii类复合物的细胞表面蛋白表达包括减少、抑制和/或干扰一种或多种mhc-i类和/或mhc-ii类基因或蛋白的表达。在某些实施方案中,调节一种或多种mhc-i类和/或mhc-ii类复合物的表达包括从细胞的至少一个等位基因缺失编码mhc-i类或mhc-ii类的一种或多种转录调节物的一种或多种基因。例如,在某些实施方案中,此类方法包括缺失编码选自lrc5、ciita、b2m及其组合的
mhc-i类或mhc-ii类基因的一种或多种转录调节物的一种或多种基因。在某些方面,调节一种或多种nk激活配体的表达包括缺失、抑制或减少编码nk激活配体的一种或多种基因的表达。在某些实施方案中,此类nk激活配体选自表1。在某些实施方案中,此类nk激活配体选自表1中类别1、2、3或其组合。在某些实施方案中,此类nk激活配体选自表1中类别1、2和3。在某些实施方案中,此类nk激活配体选自表1中类别1和3。在某些实施方案中,此类nk激活配体选自表1中类别1和2。在某些实施方案中,此类nk激活配体选自表1中类别2和3。在某些实施方案中,此类nk激活配体选自icam-1、ceacam1、cadm1mica、micb及其组合。
[0056]
在某些实施方案中,经移植的低免疫原性细胞在不含动物来源的产物的培养基中,如xenofree产物。
[0057]
本发明涵盖了以技术人员可获得的任何方式(例如,利用大范围核酸酶或内切脱氧核糖核酸酶、锌指核酸酶(zfn或znf)、基于转录激活因子-样效应物的核酸酶(talen)或成簇规律间隔的短回文重复(crispr/cas或crispr/cas9)系统或传统的同源重组技术中的任一种)改变靶多核苷酸序列。此类crispr/cas系统可采用多种cas蛋白(haft等人plos comput biol.2005;l(6)e60)。在一些实施方案中,crispr/cas系统是crispr i类系统。在一些实施方案中,crispr/cas系统是crispr ii类系统。在一些实施方案中,crispr/cas系统是crispr v类系统。掺入双重引导rna和融合至foki核酸酶的无催化活性的cas9蛋白的nextgen
tm crispr(transposagen inc.,lexington kentucky)还可用于改变靶核苷酸序列。本领域技术人员现在已知或之后发现的其他靶向多核苷酸序列以减少或消除靶细胞中的表达的方法可用于生成本文所述的低免疫原性细胞。
[0058]
在一些实施方案中,改变导致靶核苷酸序列表达减少。在一些实施方案中,改变是纯合改变。在一些实施方案中,改变是杂合改变。
[0059]
在一些实施方案中,靶核苷酸序列是基因组序列。在一些实施方案中,靶核苷酸序列是人基因组序列。在一些实施方案中,靶核苷酸序列是哺乳动物基因组序列。在一些实施方案中,靶核苷酸序列是脊椎动物基因组序列。
[0060]
在一些实施方案中,低免疫原性细胞是胚胎干细胞。在某些实施方案中,低免疫原性细胞是多能干细胞。在某些实施方案中,低免疫原性细胞是诱导的多能干细胞、重编程细胞、去分化或转分化的细胞。在某些实施方案中,低免疫原性细胞是多能胰腺祖细胞。在某些实施方案中,低免疫原性细胞是单激素细胞或多激素细胞。在某些实施方案中,低免疫原性细胞是中内胚层细胞、定形内胚层细胞、pdx1-阴性前肠内胚层细胞、pdx1-阳性前肠内胚层细胞、胰腺内胚层细胞、内分泌祖细胞/前体细胞、内分泌细胞、适当指定的内分泌细胞、不成熟的内分泌细胞或功能性β-细胞。在一些实施方案中,低免疫原性细胞可以是同质或异质细胞群。在一些实施方案中,低免疫原性细胞是产生一种或多种目标生物活性的物质的细胞。低免疫原性细胞当初次移植时可能最初没有治疗活性,如胰腺祖细胞或pdx1-阳性胰腺内胚层,但一旦移植它们进一步发育并成熟以及具有治疗作用。
[0061]
在一些实施方案中,低免疫原性细胞可以是能够从包括但不限于任何细胞、组织或器官的人多能干细胞中衍生的任何细胞,并且可包括皮肤细胞、β细胞(即位于langerhans胰岛的胰腺中的细胞)、副甲状腺细胞、肠细胞、内分泌细胞心脏细胞、脑细胞、肾细胞、肝细胞、消化道和附属消化器官的细胞、唾腺细胞、肾上腺细胞、前列腺细胞、肺细胞、胰腺细胞、骨细胞、免疫细胞、造血细胞、血管细胞、眼细胞、结缔组织细胞、肌肉骨骼细
胞、骨组织、肌肉骨骼组织、角膜组织、皮肤组织、心瓣膜、血管、免疫细胞、结缔组织、肺组织、皮肤、角膜、肾、肝、肺、胰腺、心脏和肠。
[0062]
在一些实施方案中,低免疫原性细胞可以是混悬液或细胞聚集物中的单独(单个)细胞。在一些实施方案中,低免疫原性细胞包括全能细胞。在一个实施方案中,低免疫原性细胞包括多能细胞。在一个实施方案中,低免疫原性细胞包括单能细胞。
[0063]
在一些实施方案中,低免疫原性细胞源自缺乏功能性hla-i类表达和nk激活配体表达的多能细胞群。衍生的细胞可选自任何细胞、组织或器官,并且可包括皮肤细胞、β细胞(即位于langerhans胰岛的胰腺中的细胞)、副甲状腺细胞、肠细胞、内分泌细胞心脏细胞、脑细胞、肾细胞、肝细胞、消化道和附属消化器官的细胞、唾腺细胞、肾上腺细胞、前列腺细胞、肺细胞、胰腺细胞、骨细胞、免疫细胞、造血细胞、血管细胞、眼细胞、结缔组织细胞、肌肉骨骼细胞、骨组织、肌肉骨骼组织、角膜组织、皮肤组织、心瓣膜、血管、免疫细胞、结缔组织、肺组织、皮肤、角膜、肾、肝、肺、胰腺、心脏和肠。
[0064]
待移植的低免疫原性细胞、组织和/或器官可以是接受移植物的受试者同系的或同种异体的。
[0065]
在一个实施方案中,低免疫原性细胞是人多能细胞。在一个实施方案中,低免疫原性细胞是人胰腺-谱系细胞。在一个实施方案中,低免疫原性细胞是人胰腺内胚层细胞。在一个实施方案中,低免疫原性细胞是人胰腺前体细胞。在一个实施方案中,低免疫原性细胞是人胰腺祖细胞。在一个实施方案中,低免疫原性细胞是人胰腺内分泌细胞。在一个实施方案中,低免疫原性细胞是人胰腺内分泌前体细胞。在一个实施方案中,低免疫原性细胞是人胰腺内分泌前-β细胞。在一个实施方案中,低免疫原性细胞是人胰腺β细胞。在一个实施方案中,低免疫原性细胞是人胰腺单激素或多激素细胞。在一个实施方案中,低免疫原性细胞是人胰岛素表达细胞。
[0066]
在一个实施方案中,低免疫原性细胞是公知的可公开获得的多能细胞系。本文描述的发明在所有hes细胞和ipsc系,以及至少hesc如cyt49、cyt25、cyt203和cyt212都是有用的。多能细胞系包括可从wicell(万维网www.wicell.org/home/stem-cell-lines/order-stem-cell-lines/obtain-stem-cell-li nes.cmsx)商业购买而获得的那些细胞,并且特别包括bg01、bg02和bg03。
[0067]
在一个实施方案中,低免疫原性细胞基本上类似于在d'amour et al.“production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells”(nov.1,2006)nature biotechnology 24,1392-1401(其通过引用整体并入本文)中所描述的细胞。d
′
amour等人描述了5步分化方案:第1阶段(主要导致定形内胚层产生)、第2阶段(主导导致pdx1-阴性前肠内胚层产生)、第3阶段(主要导致pdx1-阳性前肠内胚层产生)、第4阶段(主要导致胰腺内胚层也称为多能胰腺祖细胞或胰腺内分泌祖细胞产生)和第5阶段(主要导致表达激素的内分泌细胞产生)。在一个实施方案中,低免疫原性细胞基本上类似于美国专利no.7,510,876、7,695,965、7,985,585、8,586,357、8,633,024和8,129,182中描述的低免疫原性细胞(其通过引用整体并入本文)。
[0068]
在一个实施方案中,低免疫原性细胞基本上类似于通过引用整体并入本文的schulz et al.a scalable system for production of functional pancreatic progenitors from human embryonic stem cells,plos one 7:51-17(2012)中描述的细
胞。schulz等人描述了hesc扩增和堆积方法及混悬基分化系统。具体地,未分化的多能细胞在动态旋转混悬培养中聚集成簇,然后经四阶段方案而全体分化持续两周。简而言之,从hes细胞聚集物混悬液中,将hesc单层用accutase(innovative cell technologies)解离,收集并以1x106个细胞/ml重混悬在stempro hesc sfm(life technologies;合并的dmem/f12,含glutamax、stempro hesc补充剂、bsa和1%(v/v)青霉素/链霉素;省略fgf-2和2-巯基乙醇)中。将单细胞混悬液分配到未经tc处理的6孔板(5.5ml/孔)中并在innova 2000旋转器(new brunswick scientific)上以95rpm旋转,或分配到500ml nalgene过滤器接收器储存瓶(150ml/瓶)并在sartorius certomat rm-50旋转器(配置有5cm旋转轴)上以65rpm旋转。将细胞在37℃/8%co2孵育箱中旋转过夜,并形成大约100-200μm的聚集物。对于直径为100-200μm的聚集物,6孔培养皿可以使用60-140rpm的转速;500ml瓶可以使用5-20rpm的旋转速度。悬浮聚合物的分化涉及从d’amour做的很少修改。在阶段2期间包括tgf-βri激酶抑制剂iv,并且在阶段3期间将视黄酸替换为更稳定的类维生素a类似物ttnpb(3nm)。将生长因子kgf(50ng/ml)和egf(50ng/ml)添加到阶段-4以保留细胞团块。在阶段4还包括头蛋白(50ng/ml)。在一个实施方案中,低免疫原性细胞基本上类似于美国专利no.8,008,075和8,895,300(其通过引用整体并入本文)中所述的那样。
[0069]
在一个实施方案中,低免疫原性细胞基本上类似于通过引用整体并入本文的agulnick et al.insulin-producing endocrine cells differentiated in vitro from human embryonic stem cells function in macroencapsulation devices in vivo stem cells translationalmedicine 4:1
–
9(2015)中描述的细胞。agulnick等人描述了经修改的用于制备胰腺祖细胞的方法,使得73%
–
80%的细胞群体由pdx1-阳性(pdx1+)和nkx6.1+胰腺祖细胞组成。胰腺祖细胞进一步分化为可重现地含有73%
–
89%内分泌细胞的胰岛-样细胞(ic),所述内分泌细胞中的约40%
–
50%表达胰岛素。这些胰岛素阳性细胞中的很大一部分是单激素阳性的,并表达转录因子pdx1和nkx6.1。agulnick等人描述了一个方案,其中schulz等人的2012方案通过在阶段3(第5
–
7天)用激活素a、wnt3a和调蛋白(heregulin)β1另外处理以及在阶段4(第7
–
13天)用激活素a和调蛋白β1另外处理被改进。在一个实施方案中,低免疫原性细胞基本上类似于美国专利no.8,859,286中描述的细胞(其通过引用整体并入本文)。
[0070]
人胚胎干细胞的生长、传代和增殖可基本上按照美国专利no.7,964,402;8,211,699;8,334,138;8,008,07;和8,153,429所述来进行。
[0071]
标准制备方案
[0072]
下表2公开了用于产生源自hesc的胰腺内胚层细胞(pec)的标准制备方法。
[0073][0074][0075]
hesc agg.:hesc聚集物;xf ha:含glutamax的dmem/f12,补充有10%v/v的xeno-free knockout血清替代物、1%v/v非必需氨基酸、1%v/v青霉素/链霉素(所有都来自life technologies)、10ng/ml调蛋白-1β(peprotech)和10ng/ml激活素a(r&d systems);sp:hesc sfm(life technologies);r0.2fbs:rpmi 1640(mediatech);0.2%fbs(hyclone)、1x glutamax-1(life technologies)、1%v/v青霉素/链霉素;its:1:5000或1:1000稀释的胰岛素-转铁蛋白-硒(life technologies);a100:100ng/ml重组人激活素a(r&d systems);w50:50ng/ml重组小鼠wnt3a(r&d systems);k25:25ng/ml重组人kgf(r&d systems);iv:2.5μm tgf-βri激酶抑制剂iv(emd bioscience);db:dmem hi glucose
(hyclone),补充有0.5x b-27补充物(life technologies)、1x glutamax和1%v/v青霉素/链霉素;ctt3:0.25μm kaad-环巴胺(toronto research chemicals)和3nm ttnpb(sigma-aldrich);n50:50ng/ml重组人头蛋白(r&d systems);k50:50ng/ml重组人kgf(r&d systems);e50:50ng/ml重组人egf(r&d systems)。
[0076]
钙黄绿素释放测定
[0077]
钙黄绿素释放测定是一种用于研究nk细胞细胞毒性的非放射性替代方法。靶细胞吸收荧光染料(钙黄绿素am)并将在细胞质中转化为活性荧光染料,该荧光染料仅在裂解后才从细胞中释放出来。裂解的细胞将荧光染料释放到上清液中,然后收集上清液,并在荧光计中定量荧光量。根据在存在或不存在nk细胞(效应器)、阻断抗体或两者的情况下孵育后上清液中存在的荧光量计算细胞裂解百分比。
[0078]
特异性裂解可通过使用以下公式来计算:裂解%=100
×
[(有抗体下的平均荧光-平均自发荧光)/(平均最大荧光-平均自发荧光)]。通过用去污剂(1%triton x-100)孵育的细胞的裂解来确定最大荧光,并且自发裂解是在没有任何抗体或效应细胞的情况下用靶细胞获得的荧光。
[0079]
来源于多能干细胞的多种细胞组合物及其方法在本文中描述并且可见于申请人的以下美国专利申请:10/486,408,标题为methods for culture of hesc on feeder cells,2002年8月6日提交;11/021,618,标题为definitive endoderm,2004年12月23日提交;11/115,868,标题为pdx1 expressing endoderm,2005年4月26日提交;11/165,305,标题为methods for identifying factors for differentiating definitive endoderm,2005年6月23日提交;11/573,662,标题为methods for increasing definitive endoderm differentiation of pluripotent human embryonic stem cells with pi-3kinase inhibitors,2005年8月15日提交;12/729,084,标题为pdx1-expressing dorsal and ventral foregut endoderm,2005年10月27日提交;12/093,590,标题为markers of definitive endoderm,2005年11月14日提交;11/993,399,标题为embryonic stem cell culture compositions and methods of use thereof,2006年6月20日提交;11/588,693,标题为pdx1-expressing dorsal and ventral foregut endoderm,2006年10月27日提交;11/681,687,标题为endocrine progenitor/precursor cells,pancreatic hormone-expressing cells and methods of production,2007年3月2日提交;11/807,223,标题为methods for culture and production of single cell populations of hesc,2007年5月24日提交;11/773,944,标题为methods of producing pancreatic hormones,2007年7月5日提交;11/860,494,标题为methods for increasing definitive endoderm production,2007年12月24日提交;12/099,759,标题为methods of producing pancreatic hormones,2008年4月8日提交;12/107,020,标题为methods for purifying endoderm and pancreatic endoderm cells derived form human embryonic stem cells,2008年4月21日提交;12/618,659,标题为encapsulation of pancreatic lineage cells derived from human pluripotent stem cells,2009年11月13提交;12/765,714和13/761,078,两者标题均为cell compositions from dedifferentiated reprogrammed cells,2010年4月22日和2013年2月6日提交;11/838,054,标题为compositions and methods useful for culturing differentiable cells,2007年8月13日提交;12/264,
760,标题为stem cell aggregate suspension compositions and methods of differentiation thereof,2008年11月4日提交;13/259,15,标题为small molecules supporting pluripotent cell growth,2010年4月27日提交;pct/us11/25628,标题为loading system for an encapsulation device,2011年2月21日提交;13/992,931,标题为agents and methods for inhibiting pluripotent stem cells,2010年12月28日提交;以及以下美国外观设计申请:29/408,366,2011年12月12日提交;29/408,368,2011年12月12日提交;29/423,365,2012年5月31日提交;和2013年3月13日提交的29/447,944;美国申请号14/201,630,标题为3-dimensional large capacity cell encapsulation device assembly,2014年3月7日提交;和美国申请号14/106,330,标题为in vitro differentiation of pluripotent stem cells to pancreatic endoderm cells(pec)and endocrine cells,2013年12月13日提交;pct/us2016/061442,标题为pdx1pancreatic endoderm cells in cell delivery devices and methods thereof,2016年11月10日提交;所有上述通过引用整体并入本文。
[0080]
本文描述了源自多能干细胞的多种细胞组合物及其方法,并且可以见于申请人独家许可的申请中:美国专利公开号2009/0269845,标题为pluripotent cells,2008年4月24日提交;美国专利公开号2011/0014703,标题为differentiation of human embryonic stem cells,2010年7月20日提交;美国专利公开号2011/0014702,标题为differentiation of human embryonic stem cells,2010年7月19日提交;美国专利公开号2011/0151561,标题为differentiation of human embryonic stem cells,2010年12月16日提交;美国专利公开号2010/0112692,标题为differentiation of human embryonic stem cells,2009年10月22日提交;美国专利公开号2012/0052576,标题为differentiation of pluripotent stem cells,2011年8月17日提交;美国专利公开号2010/0112693,标题为differentiation of human pluripotent stem cells,2009年10月23日提交;美国专利公开号2011/0151560,标题为differentiation of human embryonic stem cells,2010年12月16提交;美国专利公开号2010/0015100,标题为differentiation of human embryonic stem cells,2008年7月31日提交;美国专利公开号2009/0170198,标题为differentiation of human embryonic stem cells,2008年11月25日提交;美国专利公开号2015/0329828,标题为use of small molecules to enhance mafa expression in pancreatic endocrine cells,2015年5月07日提交;美国专利公开号u.s.2013/0330823,标题为differentiation of human embryonic stem cells into pancreatic endocrine cells,2013年6月06日提交;国际专利公开号wo2013/192005,标题为differentiation of human embryonic stem cells into pancreatic endocrine cells,2013年6月13日提交;美国专利公开号u.s.2014/0242693,标题为suspension and clustering of human pluripotent stem cells for differentiation into pancreatic endocrine cells,2013年12月30日提交;美国专利公开号u.s.2014/0295552,标题为suspension and clustering of human pluripotent stem cells for differentiation into pancreatic endocrine cells,2014年6月17日提交;国际专利公开号wo 2015/065524,标题为suspension and clustering of human pluripotent stem cells for differentiation into pancreatic endocrine cells,2014年5月21日提交;美国专利公开号u.s.2013/0330823,
6:813
–
819;minasi等人,1993,j.exp.med.177:1451
–
1459;braun等人,1990,biology of reproduction 43:684
–
693)。可用于该目的的其他基因包括但不限于组成型活性形式的半胱天冬酶3、8和9,bax,颗粒酶,白喉毒素,假单胞菌a毒素,蓖麻毒素,和其他毒素基因在本文其他地方公开。用于将此类基因递送给人的适当构建体的产生对于技术人员而言是容易显而易见的,并且描述于例如sambrook等人(1989,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)和ausubel等人(1997,current protocols in molecular biology,john wiley&sons,new york)中。
[0091]
为了杀伤细胞,将转移到低免疫原性细胞中的基因置于适当的启动子序列的控制之下是很重要的,使得可以在添加适当诱导剂到细胞(施用给哺乳动物)后实现对该基因表达的诱导。这样的诱导型启动子序列包括但不限于在向细胞添加金属后诱导的启动子、类固醇诱导型启动子等。在一个优选的实施方案中,可以采用蜕皮激素启动子系统。在该实施方案中,将蜕皮激素启动子克隆在蜕皮激素受体蛋白序列的上游,所述蜕皮激素受体蛋白序列位于第二启动子序列的上游,所述第二启动子序列驱动可操作地连接至所需基因例如所需毒素的蜕皮激素结合位点的表达。启动子的诱导诱导了毒素表达,从而实现对毒素基因所在细胞的杀伤。
[0092]
当以离体方式转导细胞时,在其中转导了用于细胞杀伤的基因的细胞可以通过为细胞提供除转导基因外的选择性标记来选择(即,与不包含该基因的细胞分离)。选择性标记是本领域众所周知的,并且描述于例如sambrook等人(1989,molecular cloning:a laboratory manual,cold spring harbor,n.y.)中。
[0093]
低免疫原性细胞耗竭可进一步通过将寡核苷酸(例如但不限于反义分子)或核酶引入低免疫原性细胞群中来实现,所述寡核苷酸或核酶能够诱导低免疫原性细胞死亡或诱导低免疫原性细胞功能受损。此类寡核苷酸包括靶向低免疫原性细胞的基本功能的那些,在本文中定义为杀伤低免疫原性细胞或损害低免疫原性细胞在刺激t细胞方面的功能的寡核苷酸。低免疫原性细胞的此类功能包括但不限于b71和b72、cd40等的共刺激功能。因此,可用于本发明方法的寡核苷酸和核酶包括但不限于针对这些靶标的那些。
[0094]
如本文所述,低免疫原性细胞的耗竭包括低免疫原性细胞功能的受损。低免疫原性细胞功能受损包括进行或不进行物理去除或耗竭低免疫原性细胞的所有形式的低免疫原性细胞受损。因此,低免疫原性细胞功能受损包括使用阻断对低免疫原性细胞功能至关重要的低免疫原性细胞表面分子的功能的抗体。
[0095]
可选地,阻断低免疫原性细胞表面分子功能的肽(所述阻断导致低免疫原性细胞功能损害)可以用于有效耗竭宿主生物体中的低免疫原性细胞。此类肽包括但不限于被设计成特异性结合低免疫原性细胞表面上的受体分子的那些,以及被设计成例如抑制这些细胞中必需的酶促功能的那些。
[0096]
类似地,经设计用于与本文所述相同目的的基因和寡核苷酸也作为工具包括在本发明的方法中。因此,如此术语在本文所定义的,损害低免疫原性细胞的生物功能的肽、寡核苷酸和基因也被考虑用于本文所公开的本发明的方法中。
[0097]
本发明还涵盖了使用适当的低免疫原性细胞耗竭成分的药物组合物来实施本发明的方法的用途,所述组合物包含适当的低免疫原性细胞耗竭成分和药学上可接受的载体。在一些实施方案中,细胞耗竭成分是包含抗体和毒素的嵌合成分。
[0098]
如本文所用,术语“药学上可接受的载体”意指可以与适当的低免疫原性细胞耗竭成分组合并且在组合后可以用于将适当的低免疫原性细胞耗竭成分施用给哺乳动物的化学成分。
[0099]
可用于本发明方法中的药物组合物可以口服固体制剂、眼用、栓剂、气雾剂、局部用或其他类似制剂的形式全身施用。除了低免疫原性细胞耗竭成分之外,此类药物组合物还可含有药学上可接受的载体和其他已知增强和促进药物施用的成分。根据本发明的方法,也可以使用其他可能的制剂,诸如纳米颗粒、脂质体、重新密封的红细胞和基于免疫学的系统来施用适当的低免疫原性细胞耗竭成分。
[0100]
将“自杀基因”引入细胞的方法公开于us20060222633中,其通过引用整体并入本文。
[0101]
本发明包括耗竭哺乳动物宿主中低免疫原性细胞的方法。在将低免疫原性细胞移植到宿主中之后,该方法包括使低免疫原性细胞与细胞耗尽成分接触以实现低免疫原性细胞功能受损或杀伤低免疫原性细胞,从而耗竭哺乳动物宿主中的低免疫原性细胞。
[0102]
在另一方面,低免疫原性细胞耗竭成分选自毒素、抗体、放射性分子、核酸、肽、肽模拟物和核酶。
[0103]
在一方面,毒素是免疫毒素。毒素选自蓖麻毒素、白喉毒素和假单胞菌外毒素a。
[0104]
在另一个实施方案中,抗体选自:对cd1a有特异性的抗体、对cd11c有特异性的抗体、对mhcii有特异性的抗体、对cd11b有特异性的抗体、对dec205有特异性的抗体、对b71有特异性的抗体、对b72有特异性的抗体、对cd40有特异性的抗体、对i型凝集素有特异性的抗体和对ii型凝集素有特异性的抗体。
[0105]
在又一个实施方案中,核酸分子选自基因和寡核苷酸。
[0106]
在另一个实施方案中,放射性分子是放射性标记的抗体。
[0107]
在另一个实施方案中,抗原耗竭成分是包含抗体和毒素的嵌合成分。毒素可选自蓖麻毒素、白喉毒素和假单胞菌外毒素a。
[0108]
在另一个实施方案中,抗体选自对cd1a有特异性的f抗体、对cd11c有特异性的抗体、对mhcii有特异性的抗体、对cd11b有特异性的抗体、对dec205有特异性的抗体、对b71有特异性的抗体、对b72有特异性的抗体、对cd40有特异性的抗体、对i型凝集素有特异性的抗体和对ii型凝集素有特异性的抗体。
[0109]
组合产品
[0110]
本文所述的实施方案还公开了组合产品,其是指负载有低免疫原性细胞或治疗剂的装置,即,每个单独可以是候选医疗装置或细胞产物,但是一起使用它们可以制成组合产品。在一个实施方案中,组合产品是指负载有低免疫原性细胞的穿孔装置。这被称为“组合产品”或“穿孔组合产品”。装置(穿孔或没有穿孔)可以是本文所述的任何大细胞递送装置,包括但不限于如以下中所述的那些细胞包封装置:美国专利号8,278,106和9,526,880,pct申请号pct/us2016/0061442和美国外观设计专利号d714956、d718472、d718467、d718466、d718468、d718469、d718470、d718471、d720469、d726306、d726307、d728095、d734166、d734847、d747467、d747468、d747798、d750769、d750770、d755986、d760399、d761423、d761424(其通过引用整体并入)。负载至装置(穿孔或没有穿孔的)中的细胞可以是以上讨论的任何低免疫原性细胞,包括但不限于定形内胚层,pdx1-阳性内胚层,pdx1-阳性前肠内
胚层,胰腺内胚层,表达pdx1和nkx6.1的胰腺内胚层细胞,内分泌祖细胞,表达nkx6.1和ins的内分泌祖细胞,不成熟的β细胞,表达nkx6.1、ins和mafb的不成熟的β细胞,成熟的内分泌细胞,表达ins、gcg、sst和pp的成熟的内分泌细胞及成熟的β细胞,和表达ins和mafa的成熟的β细胞。
[0111]
负载有植入体内时成熟的胰腺内胚层或胰腺低免疫原性祖细胞的穿孔递送装置旨在减少糖尿病患者的胰岛素依赖性和/或减少低血糖。这包括但不限于高风险i型糖尿病患者,其低血糖未察觉、不稳定(脆性)或已接受器官移植以及其可以耐受或已经接受免疫抑制疗法。如基本上在pct申请号pct/us2016/0061442(通过引用整体并入)中所述,主要的作用方法是经由直接促进宿主血管化的可渗透、耐用、可植入的医疗装置中所含的人胰腺内胚层细胞(pec)或胰腺低免疫原性祖细胞进行的。pec低免疫原性细胞在植入后分化并成熟为治疗性葡萄糖反应性、释放胰岛素的低免疫原性细胞。这样,穿孔的组合产品支持人胰岛素的分泌。穿孔的组合产品限制了pec低免疫原性细胞在体内的分布(外出)。穿孔的组合产品将被植入允许足够的血管移植的位置中,以维持在装置内的治疗性低免疫原性细胞群并促进胰岛素和其他胰腺产物向血流的分布。穿孔的组合产品旨在用常规手术工具植入和外植,并提供两年或更长时间的治疗剂量。该装置旨在在配制、保质期、处理和手术植入期间保留足够剂量的pec低免疫原性细胞产物,以实现临床功效并确保细胞产品位于组织囊内,以满足安全性要求。
[0112]
敲入
[0113]
在某些实施方案中,可以将致耐受性因子插入或重新插入基因组编辑的干细胞系中,以产生免疫免除的通用供体干细胞系。在某些实施方案中,本文公开的通用干细胞已经进一步修饰以表达一种或多种致耐受性因子。示例性致耐受性因子包括但不限于以下中的一种或多种:hla-c、hla-e、hla-f、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂和il-35。任何基因编辑方法都可用于促进将致耐受性因子(诸如上述致耐受性因子)插入aavs1基因座中,以主动抑制免疫排斥。
[0114]
具体地,在某些实施方案中,本文公开的本发明涉及干细胞,其基因组已被改变以减少或缺失至少一种mhc-i类基因和至少一种nk激活配体基因的关键组分并且其已经被进一步改变以增加一种或多种致耐受因子的表达。在某些实施方案中,本文公开的发明涉及干细胞,其基因组已被改变以减少或缺失至少一种mhc-i类基因和至少一种nk激活配体基因的关键组分,并且其已经被进一步改变以增加hla-c、hla-e、hla-f、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂和il-35中的一种或多种的表达。
[0115]
实施方案
[0116]
参考下面的编号段落描述本发明的其他实施方案。
[0117]
涉及阻断抗体:组合物
[0118]
段落1:一种组合物,其包含缺乏至少一种人白细胞抗原(hla)-i类基因的多能来源的细胞和至少一种结合至天然杀伤(nk)细胞激活配体的药剂。
[0119]
段落2:如段落1所述的组合物,其中所述药剂是抗体。
[0120]
段落3:如段落1所述的方法,其中所述hla-i类基因是b2m。
[0121]
段落4:如段落1-3所述的组合物,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0122]
段落5:如段落1-2所述的组合物,其中所述nk细胞激活配体是icam-1和ceacam1。
[0123]
段落6:如段落1-2所述的组合物,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0124]
段落7:如段落1-2所述的组合物,其中所述多能来源的细胞还表达蛋白质,其在细胞死亡诱导剂的存在下表达时,所述诱导剂能够杀伤所述多能细胞。
[0125]
段落8:如段落7所述的组合物,其中所述细胞死亡诱导剂是更昔洛韦。
[0126]
段落9:如段落1-8中任一项所述的组合物,其中所述多能来源的细胞还过表达一种或多种致耐受性因子。
[0127]
段落10:如段落9所述的组合物,其中致耐受性因子是hla-c、hla-e、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂或il-35。
[0128]
段落11:如段落9所述的组合物,其中致耐受性因子是hla-c、hla-e和hla-g。
[0129]
涉及阻断抗体:方法
[0130]
段落1:一种预防人多能来源的细胞的细胞移植物排斥的方法,其包括向需要治疗的受试者以有效抑制所述受试者的nk细胞攻击的量施用包含缺乏至少一种hla-i类基因的靶细胞群和至少一种结合靶细胞上的nk细胞激活配体的药剂的组合物,从而预防人多能来源的细胞的细胞移植物排斥。
[0131]
段落2:如段落1所述的方法,其中所述药剂是抗体。
[0132]
段落3:如段落1所述的方法,其中所述受试者的对nk细胞激活配体的免疫反应被抑制。
[0133]
段落4:如段落1所述的方法,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica或micb。
[0134]
段落5:如段落1所述的方法,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0135]
段落6:如段落1所述的方法,其中所述受试者是人。
[0136]
段落7:如段落2所述的方法,其中所述抗体是人抗体。
[0137]
涉及hes细胞双重敲除:组合物
[0138]
段落1:一种包括多能来源的细胞的体外细胞群,其中所述多能来源的细胞缺乏至少一种hla-i类基因和至少一种天然杀伤(nk)细胞激活配体基因。
[0139]
段落2:如段落1所述的体外细胞群,其中所述hla-i类基因是b2m。
[0140]
段落3:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0141]
段落4:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1和ceacam1。
[0142]
段落5:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0143]
段落6:如段落1-5所述的体外细胞群,其中所述多能来源的细胞还表达蛋白,其当在细胞死亡诱导剂的存在下表达时,所述诱导剂能够杀伤所述多能来源的细胞。
[0144]
段落7:如段落6所述的体外细胞群,其中所述细胞死亡诱导剂是更昔洛韦。
[0145]
段落8:如段落1-7中任一项所述的体外细胞群,其中所述多能来源的细胞还过表
达一种或多种致耐受性因子。
[0146]
段落9:如段落8所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂、il-35或其组合。
[0147]
段落10:如段落9所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e和hla-g。
[0148]
涉及多能干细胞三重敲除:组合物
[0149]
一种包含经修饰的基因组的人多能干细胞,其包含:第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中b2m表面表达和/或活性;(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性;和(c)第三基因组修饰,其中ceacam1基因已被编辑以减少或消除细胞中ceacam1表面表达和/或活性。
[0150]
涉及敲除转录调节物:组合物
[0151]
段落12:一种多能来源的细胞,其包含一种或多种mhc-i类或mhc-ii类基因或蛋白复合物及一种或多种nk细胞激活配体相对于野生型多能干细胞的经调节的表达,其中所述多能干细胞的编码mhc-i类或mhc-ii类的一种或多种转录调节物的一种或多种基因和nk细胞激活配体基因从所述细胞的至少一个等位基因中缺失。
[0152]
段落13:一种多能干细胞,其包含一种或多种nk细胞激活配体相对于野生型人多能干细胞的经调节的表达。
[0153]
段落14:一种人多能干细胞,其不表达b2m或icam-1。
[0154]
段落15:一种人多能干细胞,其不表达ciita或icam-1。
[0155]
段落16:一种人多能干细胞,其不表达lrc5或icam-1。
[0156]
段落17:一种人多能干细胞,其不表达nlrc5、ciita和b2m中的一种或多种,并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0157]
段落18:一种人多能干细胞,其不表达hla-a、hla-b和hla-c的一种或多种,并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0158]
段落19:一种人多能干细胞,其不表达一种或多种mhc-i类抗原和一种或多种nk细胞激活配体中的一种或多种,以及还具有一种或多种致耐受性因子插入所述细胞的至少一个等位基因的安全港基因座中。
[0159]
段落20:一种包含经修饰的基因组的人多能干细胞,其包含第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性以及其中icam-1基因已被编辑以减少或消除细胞中的icam-1表面表达和/或活性。
[0160]
段落21:一种包含经修饰的基因组的人多能干细胞,其包含:第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性;和(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性。
[0161]
涉及hes双重敲除细胞:组合物
[0162]
段落1:一种包含多能细胞的体外细胞群,其中所述多能细胞缺乏至少一种功能性mhc-i类细胞表面蛋白和至少一种功能性天然杀伤(nk)细胞激活配体细胞表面蛋白。
[0163]
段落2:如段落1所述的体外细胞群,其中所述mhc-i类细胞表面蛋白是hla-a、hla-b、hla-c或其组合。
[0164]
段落3:如段落1-2所述的体外细胞群,其中所述mhc-i类细胞表面蛋白是b2m。
[0165]
段落4:如段落1-3中任一项所述的体外细胞群,其中所述多能细胞缺乏至少两种功能性nk细胞激活配体细胞表面蛋白。
[0166]
段落5:如段落1-4中任一项所述的体外细胞群,其中所述多能细胞缺乏至少三种功能性nk细胞激活配体细胞表面蛋白。
[0167]
段落6:如段落1-5中任一项所述的体外细胞群,其中nk细胞激活配体细胞表面蛋白是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0168]
段落7:如段落1-5中任一项所述的体外细胞群,其中所述nk细胞激活配体细胞表面蛋白是icam-1和ceacam1。
[0169]
段落8:如段落1-7中任一项所述的体外细胞群,其中所述多能细胞还表达蛋白,其当在细胞死亡诱导剂的存在下表达时,所述诱导剂能够杀伤多能细胞。
[0170]
段落9:如段落1-8中任一项所述的体外细胞群,其中所述蛋白是单纯疱疹病毒、胸苷激酶或胞嘧啶脱氨酶,其在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤所述多能细胞。
[0171]
段落10:如段落8-9中任一项所述的体外细胞群,其中所述细胞死亡诱导剂是更昔洛韦。
[0172]
涉及hes双重敲除细胞:组合物
[0173]
段落1:一种包含多能细胞的体外细胞群,其中相对于原始基因型或相对于野生型人细胞,所述多能细胞具有表达减少的至少一种mhc-i类细胞表面蛋白以及功能和/或表达减少的至少一种nk激活配体细胞表面蛋白。
[0174]
段落2:一种包含多能细胞的体外细胞群,其中相对于原始基因型或相对于野生型人细胞,所述多能细胞具有表达减少的一种或多种hla-a、hla-b和hla-c细胞表面蛋白以及功能和/或表达减少的至少一种nk激活配体细胞表面蛋白。
[0175]
段落3:一种包含多能细胞的体外细胞群,其中所述多能细胞缺乏功能性hla细胞表面蛋白表达、nk激活配体细胞表面蛋白表达以及具有以下蛋白:其当在细胞死亡诱导剂的存在下在多能细胞中表达时,所述诱导剂能够杀伤所述多能细胞。
[0176]
段落4:一种干细胞,其中一种或多种hla-i类细胞表面蛋白和一种或多种nk激活配体细胞表面蛋白的表达相对于野生型干细胞被调节。
[0177]
段落5:一种多能细胞,其中一种或多种hla-i类细胞表面蛋白、一种或多种nk激活配体细胞表面蛋白和一种或多种致耐受性细胞表面蛋白因子的表达相对于野生型多能细胞被调节,并且其中所述多能细胞还表达当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤多能细胞的蛋白。
[0178]
段落6:一种包含多能细胞的体外细胞群,其中所述多能细胞相对于野生型多能细胞缺乏功能性mhc-i类基因和天然杀伤(nk)细胞激活配体基因以及其中所述多能细胞过表达致耐受性细胞表面蛋白因子,并且其中所述多能细胞还表达以下蛋白:当其在细胞死亡诱导剂的存在下表达时,所述诱导剂能够杀伤多能细胞。
[0179]
涉及pec双重敲除细胞:组合物
[0180]
段落1:一种包含胰腺内胚层(pec)细胞的体外细胞群,其中所述pec细胞缺乏至少一种功能性hla-i类基因和至少一种天然杀伤(nk)细胞激活配体基因。
[0181]
段落2:如段落1所述的体外细胞群,其中所述至少一种hla-i类基因是b2m。
[0182]
段落3:如段落1-2所述的体外细胞群,其中所述至少一种nk细胞激活配体是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0183]
段落4:如段落1-2所述的体外细胞群,其中所述至少一种nk细胞激活配体是icam-1和ceacam1。
[0184]
段落5:如段落1-2所述的体外细胞群,其中所述至少一种nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0185]
段落6:如段落1-5所述的体外细胞群,其中所述pec细胞还表达当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤pec细胞的蛋白。
[0186]
段落7:如段落6所述的体外细胞群,其中所述细胞死亡诱导剂是更昔洛韦。
[0187]
段落8:如段落6所述的体外细胞群,其中所述基因是单纯疱疹病毒、胸苷激酶或胞嘧啶脱氨酶,其当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤pec细胞。
[0188]
段落9:如段落1-8中任一项所述的体外细胞群,其中所述pec细胞还过表达一种或多种致耐受性细胞表面蛋白。
[0189]
段落10:如段落1-9所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂、il-35或其组合。
[0190]
段落11:如段落1-9所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e和hla-g。
[0191]
段落12:一种包含胰腺内胚层(pec)细胞的体外细胞群,其中所述pec细胞缺乏至少一种功能性mhc-i类基因、mhc-ii类基因和天然杀伤(nk)细胞激活配体基因。
[0192]
段落13:一种包含胰腺内胚层(pec)细胞的体外细胞群,其中所述pec细胞缺乏至少一种功能性mhc-i类基因和mhc-ii类基因并缺乏至少两种天然杀伤(nk)细胞激活配体基因。
[0193]
段落14:一种胰腺内胚层(pec)细胞,其中一种或多种hla-i类基因和一种或多种nk激活配体基因相对于野生型pec细胞被调节。
[0194]
段落15:一种胰腺内胚层(pec)细胞,其中一种或多种hla-i类细胞表面蛋白、一种或多种nk激活配体和一种或多种致耐受性因子的表达相对于野生型pec细胞被调节,并且其中所述胰腺内胚层细胞还表达当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤pec细胞的蛋白。
[0195]
段落16:一种胰腺内胚层(pec)细胞,其不表达b2m或icam-1。
[0196]
段落17:一种胰腺内胚层(pec)细胞,其不表达ciita或icam-1。
[0197]
段落18:一种胰腺内胚层(pec)细胞,其不表达lrc5或icam-1。
[0198]
段落19:一种胰腺内胚层(pec)细胞,其不表达nlrc5、ciita和b2m中的一种或多种,并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0199]
段落20:一种胰腺内胚层(pec)细胞,其不表达hla-a、hla-b和hla-c中的一种或多种,并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0200]
段落21:一种胰腺内胚层(pec)细胞,其不表达一种或多种mhc-i类细胞表面蛋白和一种或多种nk细胞激活配体,并且还具有一种或多种致耐受性因子插入所述细胞的至少一个等位基因的安全港基因座中。
[0201]
段落22:一种包含经修饰的基因组的胰腺内胚层(pec)细胞,其包含第一基因组修
饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性以及其中icam-1基因已被编辑以减少或消除细胞中的icam-1表面表达和/或活性。
[0202]
段落23:一种包含经修饰的基因组的胰腺内胚层(pec)细胞,其包含:第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性;和(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性。
[0203]
段落24:一种包含经修饰的基因组的胰腺内胚层(pec)细胞,其包含:第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中b2m表面表达和/或活性;(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性;和(c)第三基因组修饰,其中ceacam1基因已被编辑以减少或消除细胞中ceacam1表面表达和/或活性。
[0204]
涉及低免疫原性细胞
[0205]
段落1:一种包含低免疫原性细胞的体外细胞群,其中所述低免疫原性细胞缺乏至少一种功能性hla-i类细胞表面蛋白和至少一种功能性nk细胞激活配体细胞表面蛋白。
[0206]
段落2:如段落1所述的体外细胞群,其中所述hla-i类细胞表面蛋白是b2m。
[0207]
段落3:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0208]
段落4:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1和ceacam1。
[0209]
段落5:如段落1-2所述的体外细胞群,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0210]
段落6:如段落1-5所述的体外细胞群,其中所述低免疫原性细胞还表达蛋白,其当在细胞死亡诱导剂的存在下表达时,所述诱导剂能够杀伤低免疫原性细胞。
[0211]
段落7:如段落1-6中任一项所述的体外细胞群,其中所述低免疫原性细胞还过表达一种或多种致耐受性因子。
[0212]
段落8:如段落1-7所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e、hla-g、pd-l1、ctla-4-ig、cd47、ci-抑制剂、il-35及其组合。
[0213]
段落9:如段落1-7所述的体外细胞群,其中所述致耐受性因子是hla-c、hla-e和hla-g。
[0214]
段落10:一种包含低免疫原性细胞的体外细胞群,其中所述低免疫原性细胞缺乏至少一种功能性mhc-i类基因和至少一种nk细胞激活配体基因。
[0215]
段落11:一种包含低免疫原性细胞的体外细胞群,其中所述低免疫原性细胞缺乏至少一种功能性mhc-i类基因、mhc-ii类基因和nk细胞激活配体基因。
[0216]
段落12:如段落10或11所述的体外细胞群,其中所述mhc-i类基因是hla-a、hla-b、hla-c或其组合。
[0217]
段落13:如段落10、11或12所述的体外细胞群,其中所述mhc-i类基因是b2m。
[0218]
段落14:如段落10-13中任一项所述的体外细胞群,其中所述低免疫原性细胞缺乏至少两种功能性nk细胞激活配体基因。
[0219]
段落15:如段落10-13中任一项所述的体外细胞群,其中所述低免疫原性细胞缺乏至少三种功能性nk细胞激活配体基因。
[0220]
段落16:如段落10-13中任一项所述的体外细胞群,其中nk细胞激活配体是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0221]
段落17:如段落10-13中任一项所述的体外细胞群,其中所述nk细胞激活配体是icam-1和ceacam1。
[0222]
段落18:如段落10-13中任一项所述的体外细胞群,其中所述nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0223]
段落19:如段落10-18中任一项所述的体外细胞群,其中所述低免疫原性细胞还表达蛋白,其当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤低免疫原性细胞。
[0224]
段落20:如段落7-15中任一项所述的体外细胞群,其中所述低免疫原性细胞是hes细胞或胰腺谱系细胞。
[0225]
段落21:一种低免疫原性细胞,其中一种或多种hla-i类细胞表面蛋白和一种或多种nk激活配体细胞表面蛋白的表达相对于野生型低免疫原性细胞被调节。
[0226]
段落22:一种低免疫原性细胞,其中一种或多种hla-i类细胞表面蛋白、一种或多种nk激活配体和一种或多种致耐受性细胞表面蛋白因子的表达相对于野生型低免疫原性细胞被调节,并且其中多能细胞还表达以下蛋白:其当在细胞死亡诱导剂的存在下表达时,该诱导剂能够杀伤低免疫原性细胞。
[0227]
段落23:一种低免疫原性干细胞,其包含一种或多种mhc-i类或mhc-ii类细胞表面蛋白和一种或多种nk细胞激活配体相对于野生型多能干细胞的经调节的表达,其中多能干细胞具有编码一种或多种mhc-i类或mhc-ii类的转录调节物的一种或多种基因和nk细胞激活配体基因从所述细胞的至少一个等位基因中缺失。
[0228]
段落24:一种低免疫原性细胞,其包含一种或多种nk细胞激活配体相对于野生型人低免疫原性细胞的经调节的表达。
[0229]
段落25:一种人低免疫原性细胞,其不表达b2m或icam-1。
[0230]
段落26:一种人低免疫原性细胞,其不表达ciita或icam-1。
[0231]
段落27:一种人低免疫原性细胞,其不表达lrc5或icam-1。
[0232]
段落28:一种人低免疫原性细胞,其不表达nlrc5、ciita和b2m中的一种或多种并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0233]
段落29:一种人低免疫原性细胞,其不表达hla-a、hla-b和hla-c中的一种或多种并且还不表达icam-1、ceacam1、cadm1、mica和micb中的一种或多种。
[0234]
段落30:一种人低免疫原性细胞,其不表达一种或多种mhc-i类细胞表面蛋白和一种或多种nk细胞激活配体中的一种或多种,并且还具有一种或多种致耐受性因子插入所述细胞的至少一个等位基因的安全港基因座中。
[0235]
段落31:一种包含经修饰的基因组的低免疫原性细胞,其包含第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性和其中icam-1基因已被编辑以减少或消除细胞中的icam-1表面表达和/或活性。
[0236]
段落32:一种包含经修饰的基因组的低免疫原性干细胞,其包含:第一基因组修饰,其中b2m基因已被编辑以减少或消除细胞中的b2m表面表达和/或活性;和(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性。
[0237]
段落33:一种包含经修饰的基因组的低免疫原性干细胞,其包含:第一基因组修
饰,其中b2m基因已被编辑以减少或消除细胞中b2m表面表达和/或活性;(b)第二基因组修饰,其中icam-1基因已被编辑以减少或消除细胞中icam-1表面表达和/或活性;和(c)第三基因组修饰,其中ceacam1基因已被编辑以减少或消除细胞中ceacam1表面表达和/或活性。
[0238]
用于双重敲除的方法
[0239]
段落1:一种减少移植物排斥的方法,其包括:
[0240]
a)向需要移植物的受试者施用有效量的包含胰腺内胚层细胞群的移植物,其中至少一种hla-i类细胞表面蛋白和至少一种nk细胞激活配体细胞表面蛋白的功能被破坏。
[0241]
段落2:如段落1所述的方法,其中hla-i类细胞表面蛋白是b2m。
[0242]
段落3:如段落1-2所述的方法,其中nk细胞激活配体细胞表面蛋白是icam-1、ceacam1、cadm1、mica、micb或其组合。
[0243]
段落4:如段落1-2所述的方法,其中nk细胞激活配体是icam-1和ceacam1。
[0244]
段落5:如段落1-2所述的方法,其中nk细胞激活配体是icam-1、ceacam1、cadm1、mica和micb。
[0245]
段落6:一种耗竭细胞群中的低免疫原性细胞的方法,所述方法包括使所述低免疫原性细胞与低免疫原性细胞耗竭成分接触以实现所述低免疫原性细胞功能受损或杀伤所述低免疫原性细胞,从而耗竭所述细胞群中的所述低免疫原性细胞。
[0246]
段落7:如权利要求6所述的方法,其中所述低免疫原性细胞缺乏至少一种功能性hla-i类细胞表面蛋白和至少一种nk激活配体表达。
[0247]
段落8:一种从宿主哺乳动物中移除低免疫原性细胞的方法,所述方法包括:(a)转移低免疫原性细胞至所述宿主哺乳动物;和(b)使宿主与低免疫原性细胞耗竭成分接触以实现低免疫原性细胞功能受损或杀伤所述低免疫原性细胞,从而移除宿主哺乳动物中的所述低免疫原性细胞。
[0248]
段落9:如段落8所述的方法,其中至少一种hla-i类细胞表面蛋白和至少一种nk激活配体的功能被削弱。
[0249]
段落10:一种增加靶细胞群中的nk激活配体的方法,其包括使靶细胞群暴露于ifn-γ刺激,从而相比野生型增加靶细胞中的nk激活配体。
[0250]
涉及mhc-i类基因和nk细胞激活配体基因的功能被破坏或抑制的多能细胞:组合物
[0251]
段落1:一种包含多能细胞的体外细胞群,其中至少一种主要组织相容性复合物(mhc)-i类基因和至少一种天然杀伤(nk)细胞激活配体基因的功能被破坏或抑制。
[0252]
段落2:如段落1所述的体外细胞群,其中所述mhc基因编码β-2微球蛋白(b2m)。
[0253]
段落3:如段落1所述的体外细胞群,其中所述nk细胞激活配体是icam1、cd58、pvr、ceacam1、cadm1、mica、micb或其组合。
[0254]
段落4:如段落1所述的体外细胞群,其中所述nk细胞激活配体是icam1和cd58。
[0255]
段落5:如段落1所述的体外细胞群,其中所述nk细胞激活配体是icam1、cd58、cd155、ceacam1、cadm1、mica和micb。
[0256]
段落6:如段落1所述的体外细胞群,其中所述多能细胞是人胚胎干细胞。
[0257]
段落7:如段落1所述的体外细胞群,其中所述多能细胞分化为胰腺内胚层细胞。
[0258]
段落8:如段落1所述的体外细胞群,其中所述多能细胞还包含当在细胞死亡诱导
剂的存在下表达时所述诱导剂能够杀伤细胞的蛋白。
[0259]
段落9:如段落1所述的体外细胞群,其中使用基因组编辑应用破坏所述mhc-i类基因。
[0260]
段落10:如段落9所述的体外细胞群,其中所述基因组编辑应用是锌指核酸酶(zfn)、聚簇的规则间隔短回文重复(crispr)/cas或转录激活因子样效应物核酸酶(talen)系统。
[0261]
段落11:如段落1所述的体外细胞群,其中使用基因组编辑应用破坏所述nk细胞激活配体。
[0262]
段落12:如段落1所述的体外细胞群,其中使用抗-nk细胞激活配体剂破坏所述nk细胞激活配体。
[0263]
段落13:如段落8所述的体外细胞群,其中所述诱导剂是抗体。
[0264]
涉及mhc-i类基因和nk细胞激活配体基因的功能被破坏或抑制的涉及胰腺谱系细胞:组合物
[0265]
段落14:一种包含胰腺谱系细胞的体外细胞群,其中至少一种主要组织相容性复合物(mhc)-i类基因和至少一种天然杀伤(nk)细胞激活配体的功能被破坏或抑制。
[0266]
段落15:如段落14所述的体外细胞群,其中所述mhc-i类基因编码b2m。
[0267]
段落16:如段落14所述的体外细胞群,其中所述nk细胞激活配体是icam1、cd58、cd155、ceacam1、cadm1、mica、micb或其组合。
[0268]
段落17:如段落14所述的体外细胞群,其中所述nk细胞激活配体是icam1和cd58。
[0269]
段落18:如段落14所述的体外细胞群,其中所述nk细胞激活配体是icam1、cd58、cd155、ceacam1、cadm1、mica和micb。
[0270]
段落19:如段落14所述的体外细胞群,其中胰腺谱系细胞是定形内胚层、前肠内胚层、胰腺内胚层细胞、内分泌前体或胰岛素产生细胞。
[0271]
段落20:如段落14所述的体外细胞群,其中胰腺谱系细胞还表达当在细胞死亡诱导剂的存在下表达时所述诱导剂能够杀伤细胞的蛋白。
[0272]
预防胰腺细胞的细胞移植物排斥的方法
[0273]
段落21:一种预防人胰腺细胞的细胞移植物排斥的方法,其包括:
[0274]
a.提供不表达至少一种主要组织相容性复合物(mhc)-i类细胞表面蛋白和不表达至少一种天然杀伤(nk)激活配体的人胰腺细胞群;和
[0275]
b.移植人胰腺细胞群至哺乳动物受试者中,其中不存在mhc-i类细胞表面蛋白和nk激活配体表达预防细胞移植物排斥。
[0276]
段落22:如段落21所述的方法,其中所述主要组织相容性复合物(mhc)-i类细胞表面蛋白是β-2微球蛋白(b2m)或是hla-abc细胞表面蛋白。
[0277]
段落23:如段落21所述的方法,其中所述nk细胞激活配体是icam1、cd58、cd155、pvr、ceacam1、cadm1、mica、micb或其组合。
[0278]
段落24:如段落21所述的方法,其中所述人胰腺细胞群是胰腺内胚层细胞(pec)。
[0279]
段落25.如段落21所述的方法,其中所述人胰腺细胞群还包含以下蛋白:其当在细胞死亡诱导剂的存在下由人细胞群表达时所述诱导剂能够杀伤人胰腺细胞群。
[0280]
产生胰岛素的方法
[0281]
段落26.一种产生胰岛素的方法,其包括:
[0282]
a)提供不表达至少一种主要组织相容性复合物(mhc)-i类细胞表面蛋白和不表达至少一种天然杀伤(nk)激活配体的人胰腺内胚层细胞群;和
[0283]
b)移植人胰腺内胚层细胞群至哺乳动物受试者中,其中所述胰腺内胚层细胞在哺乳动物受试者中成熟并响应于葡萄糖刺激而产生胰岛素。
[0284]
段落27:如段落26所述的方法,其中所述主要组织相容性复合物(mhc)-i类细胞表面蛋白是β-2微球蛋白(b2m)或是hla-abc细胞表面蛋白。
[0285]
段落28.如段落26所述的方法,其中所述nk细胞激活配体是icam1、cd58、cd155、pvr、ceacam1、cadm1、mica、micb或其组合。
[0286]
段落29:如段落26所述的方法,其中所述人胰腺细胞群还包含当在细胞死亡诱导剂的存在下由人胰腺细胞群表达时所述诱导剂能够杀伤人胰腺细胞群的蛋白。
[0287]
段落30.如段落29所述的方法,其中所述蛋白是单纯疱疹病毒胸苷激酶,并且所述剂是更昔洛韦。
[0288]
一种制备低免疫原性干细胞的方法,该方法包括调节低免疫原性干细胞的一种或多种mhc-i类细胞表面蛋白和一种或多种nk激活配体的表达,并从而制备低免疫原性干细胞。
[0289]
一种制备低免疫原性干细胞的方法,该方法包括在干细胞上调节一种或多种mhc-i类细胞表面蛋白、一种或多种nk激活配体的表达以及调节一种或多种致耐受性因子的表达,并从而制备低免疫原性干细胞。
[0290]
一种调节干细胞上一种或多种mhc-i类细胞表面蛋白和nk细胞激活配体细胞表面蛋白的表达的方法,其包括从细胞的至少一个等位基因中缺失编码mhc-i类基因的一种或多种转录调节物和nk细胞激活配体的一种或多种基因,并从而调节一种或多种mhc-i类细胞表面蛋白和nk细胞激活配体细胞表面蛋白的表达。
[0291]
一种包含经修饰的基因组的低免疫原性干细胞,其包含(a)第一基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:1-3中任一者同源的核糖核酸的质粒或与seq id no:1-3中任一者同源的核糖核酸的组合接触,来编辑b2m基因以减少或消除细胞中b2m表面表达和/或活性;和(b)第二基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:4-6中任一者同源的核糖核酸的质粒或与seq id no:4-6中任一者同源的核糖核酸的组合接触,来编辑icam-1基因以减少或消除细胞中icam-1表面表达和/或活性。
[0292]
一种包含经修饰的基因组的低免疫原性干细胞,其包含(a)第一基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:1-3中任一者同源的核糖核酸的质粒或与seq id no:1-3中任一者同源的核糖核酸的组合接触,来编辑b2m基因以减少或消除细胞中b2m表面表达和/或活性;(b)第二基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:4-6中任一者同源的核糖核酸的质粒或与seq id no:4-6中任一者同源的核糖核酸的组合接触,来编辑icam-1基因以减少或消除细胞中icam-1表面表达和/或活性;和(c)第三基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:7-9中任一者同源的核糖核酸的质粒或与seq id no:7-9中任一者同源的核糖核酸的组合接触,来编辑ceacam1基因以减少或消除细胞中ceacam1表
面表达和/或活性。
[0293]
一种包含经修饰的基因组的多能干细胞,其包含(a)第一基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:1-3中任一者同源的核糖核酸的质粒或与seq id no:1-3中任一者同源的核糖核酸的组合接触,来编辑b2m基因以减少或消除细胞中b2m表面表达和/或活性;和(b)第二基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸同编码与seq id no:4-6中任一者同源的核糖核酸的质粒或与seq id no:4-6中任一者同源的核糖核酸的组合接触,来编辑icam-1基因以减少或消除细胞中icam-1表面表达和/或活性。
[0294]
seq id no:1-9的序列在下表4中提供,并且这些和另外序列在下文中描述。
[0295]
seq id no.1:外显子1,负链。
[0296]
seq id no.2:外显子2,负链。
[0297]
seq id no.3:外显子1,负链。
[0298]
seq id no.4:外显子2,正链。
[0299]
seq id no.5:外显子2,负链。
[0300]
seq id no.6:外显子1,正链。
[0301]
seq id no.7:外显子1,负链。
[0302]
seq id no.8:外显子1,正链。
[0303]
seq id no.9:外显子1,正链。
[0304]
seq id no.10:人icam1的编码序列。
[0305]
seq id no.11:人ceacam1的编码序列。
[0306]
seq id no.12:人b2m的编码序列。
[0307]
seq id no.13:人cadm1的编码序列。
[0308]
seq id no.14:人cd58的编码序列。
[0309]
seq id no.15:人cd155的编码序列。
[0310]
下表提供了用于crispr/cas9切割的靶序列,包括pam(ngg)。
[0311][0312][0313]
一种包含经修饰的基因组的胰腺内胚层(pec)细胞,其包含(a)第一基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸和包含seq id no:1-3中任一者的序列的核糖核酸接触,来编辑b2m基因以减少或消除细胞中b2m表面表达和/或活性;(b)第二基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸和包含seq id no:4-6中任一者的序列的核糖核酸接触,来编辑icam-1基因以减少或消除细胞中icam-1表面表达和/或活性;和(c)第三基因组修饰,其中通过使细胞与cas蛋白或编码cas蛋白的核酸和包含seq id no:7-9中任一者的序列的核糖核酸接触,来编辑ceacam1基因以减少或消除细胞中ceacam1表面表达和/或活性。
[0314]
一种减轻低血糖的方法,其包括:a)向需要移植的受试者施用有效量的包含胰腺内胚层细胞群的移植物,其中至少一种hla-i类细胞表面蛋白和至少一种nk细胞激活配体细胞表面蛋白的功能被破坏,其中胰腺内胚层细胞群在体内成熟并响应于体内的葡萄糖刺激而产生胰岛素,从而减轻患者中的低血糖。
[0315]
一种减少胰岛素依赖性的方法,其包括:a)向需要移植的受试者施用有效量的包含胰腺内胚层细胞群的移植物,其中至少一种hla-i类细胞表面蛋白和至少一种nk细胞激活配体细胞表面蛋白的功能被破坏,其中胰腺内胚层细胞群在体内成熟并响应于体内的葡萄糖刺激而产生胰岛素,从而减少了患者中的胰岛素依赖性。
[0316]
定义
[0317]“低免疫原性”或“通用供体细胞”或“突变细胞”或其等同物意指具有减少或消除的至少一种hla-i类细胞表面蛋白和至少一种nk激活配体的表达的细胞。预期此类细胞不易被移植有此类细胞或移植物的受试者免疫排斥或移植物排斥。例如,相对于未改变的野生型细胞,此类低免疫原性细胞可以约为2.5%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更多地不易被移植有此类细胞的受试者免疫排斥。
[0318]
术语“治疗”或“治愈”或其等同物是指减轻(改善)体征或症状的治疗性干预。
[0319]
术语“患者”或“宿主”或“哺乳动物宿主”或“受试者”或其等同物是指活的脊椎动物生物体,包括人类和非人类哺乳动物两者的一类。在一些实施方案中,受试者是人类受试者。优选的治疗患者是人类。目标患者群体可以随临床使用/经验的时间而变化,其方式独立于组合产品本身而是与免疫抑制方案的性质或免疫抑制方案缺乏有关。例如,该组合产品可用于使用低免疫原性细胞疗法与免疫抑制药物(isd)方案联合的t1d群体,实现手术耐受性或毒性和副作用低。
[0320]
术语“阻断剂”在本文中是指能够与靶细胞表面上的nk激活配体结合的任何药剂,包括但不限于抗体;或者是指预防或抑制nk激活配体表达的药剂,包括但不限于目前已知或以后要开发的蛋白质、酶或化学物质。
[0321]
本文中的术语“抗体”以最广义使用,并且特别涵盖完整的单克隆抗体、多克隆抗体、由至少两种完整抗体形成的多特异性抗体(如双特异性抗体)和抗体片段,只要它们表现出所需的生物阻断活性即可。
[0322]
本文所用的术语“抗体片段”是指完整抗体的一部分,优选包含其抗原结合区或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段,双抗体,线性抗体,单链抗体分子和由抗体片段形成的多特异性抗体。
[0323]
本文所用的术语“阻断抗体”是指当其在体内或体外与靶细胞上的nk细胞激活配体结合时导致预防或降低nk细胞裂解靶细胞的能力的抗体。
[0324]
如本文所用,术语“同基因的”或“同系的”是指与移植接受者在遗传上相同或源自遗传上相同的来源(如同卵双胞胎)的细胞、组织或器官,特别就抗原或免疫反应而言。此类细胞、组织或器官称为同系移植物。如本文所用,术语“同种异体”或“同种异系”是指与移植接受者(例如,非相关供体)在遗传上不相同或来源于非遗传上相同的来源的细胞、组织或器官,特别就抗原或免疫反应而言。此类细胞、组织或器官被称为同种异体移植、同种异系移植物、同种移植物或异体移植物。
[0325]
如本文所用,术语“启动子/调控序列”意指对于可操作地连接至所述启动子/调控
序列的基因产物的表达所必需的核酸序列。在一些情况下,该序列可以是核心启动子序列,以及在其他情况下,该序列也可以包括基因产物表达所需的增强子序列和其他调控元件。启动子/调控序列可以是例如以组织特异性方式表达基因产物的启动子/调节序列。
[0326]
术语“有效量”或“治疗有效量”或其等同物是指足以在所治疗的受试者或细胞中实现所需效果的药剂的量。例如,这可以是抑制或可测量地降低血糖水平并最终实现自我平衡血糖控制所必需的细胞量。它也可以意指有效量的药剂以改变细胞或受试者的功能或结构。治疗有效量的药剂可以单个剂量或数个剂量施用。然而,有效量将取决于所施加的特定药剂,所治疗的受试者、患病的严重程度和类型以及施用方式。
[0327]
术语“减少”、“破坏”、“降低的”、“降低”和“抑制”在本文中都一般地用来意指减少,具体地减少统计上显著的量。然而,为避免疑问,“减少的”、“降低的”、“降低”、“抑制的”包括与参考水平相比减少至少10%,例如与参考水平相比减少至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%或高达并且包括100%降低(即与参考样品相比不存在水平),或在10-100%之间的任何减少,或与参考水平相比至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍减少、或在2倍至10倍或更大之间的任何减少。
[0328]
术语“增加的”、“增加”或“增强”或“激活”在本文中均通常意指增加统计显著量;为避免任何疑问,术语“增加的”、“增加”或“增强”或“激活”意指与参考水平相比增加至少10%,例如与参考水平相比增加至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%或高达并且包括100%增加,或在10-100%之间的任何增加,或与参考水平相比至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍增加,或2倍至10倍或更大之间的任何增加。
[0329]
术语“统计学上显著”或“显著地”是指统计学上的显著性,并且通常意指低于参考的正常浓度或更低浓度的两个标准偏差(2sd)。该术语还可以意指比参考的正常浓度或更高浓度高两个标准偏差(2sd)。该术语是指存在差异的统计学证据。它被定义为当无效假设实际上为真时做出拒绝无效假设的决定的概率。通常使用p值进行决定。
[0330]
如本文所用,“降低的低血糖”或其等同物意指低血糖发作次数减少而血糖控制没有恶化,其被定义为hba1c升高≤0.2%。
[0331]
如本文所用,“降低的胰岛素依赖性”或其等同物意指外源性胰岛素注射剂的数量和/或剂量减少而血糖控制没有恶化,其被定义为hba1c升高≤0.2%。
[0332]
如本文所用,“组织囊”或其等同物意指在植入物或移植物周围形成的异物囊。含有细胞的组合产品和/或装置或带孔装置意在在植入期间保留在囊内。
[0333]“植入”或其等同物是指祖细胞或不成熟细胞群体分化为成熟细胞类型。例如,植入pdx1阳性的胰腺内胚层细胞群成熟为胰腺内分泌细胞群。
[0334]“移植物”是指在本文的装置中包封或递送的分化的细胞群。例如,细胞群包括但不限于:胰腺内胚层、胰腺祖细胞、pdx-1阳性胰腺内胚层、胰腺内分泌前体、胰腺内分泌、单或多激素内分泌、前-β、β和/或胰岛素分泌移植物。
[0335]
术语“实质上”或“基本上”或其等同物意指在任何细胞群或培养物中存在的大部分或最小量或减少量的组分或细胞,如不成熟的β细胞培养物是“表达ins、nkx6.1和pdx1并且实质上或基本上不表达ngn3的实质上或基本上不成熟的β细胞”。其他实例包括但不限于“实质上或基本上hes细胞”,“实质上或基本上定形内胚层细胞”,“实质上或基本上前肠内胚层细胞”,“实质上或基本上pdx1阴性前肠内胚层细胞”,“实质上或基本上pdx1阳性胰腺内胚层细胞”,“实质上或基本上胰腺内分泌前体细胞”,“实质上或基本上胰腺内分泌细胞”等。
[0336]
就细胞培养物中或细胞群中的细胞而言,术语“基本上不含”或其等同物意指细胞培养物或细胞群不含的指定细胞类型的存在量小于细胞培养物或细胞群中存在的细胞总数的约10%、小于约9%、小于约8%、小于约7%、小于约6%、小于约5%、小于约4%、小于约3%、小于约2%或小于约1%。
[0337]
术语“无纺布”或其等同物包括但不限于通过编织或针织以外的方法制造的粘合织物、成形织物或工程织物。
[0338]
应当理解,本文公开的发明在其应用中不限于说明书中阐述的或作为示例的细节。本发明涵盖了其他实施方案,并且能够以各种方式来实践或执行。另外,应当理解,本文采用的措词和术语是出于描述的目的,而不应被认为是限制性的。
[0339]
尽管已经根据某些实施方案特异性地描述了本发明的某些组合物、方法和测定,但是以下实施例仅用于说明本发明的方法和组合物,而无意于限制它们。
[0340]
说明书和权利要求书中的如本文所用的冠词“一”和“一个”,除非明确指出相反,否则应理解为包括复数指代物。如果在给定的产物或过程中存在、使用或在其他方面与之相关的一个、多于一个或所有的组成员,则认为在组的一个或多个成员之间包含“或”的权利要求或说明书是满意的,除非指出相反或另外从上下文显而易见。本发明包括其中给定产物或过程中存在、使用或在其他方面与之相关的恰好一个组成员的实施方案。本发明还包括实施方案,其中给定的产物或过程中存在、使用或在其他方面与之相关的多于一个或所有的组成员。
[0341]
此外,应理解,本发明涵盖所有变型、组合和置换,其中将来自一个或多个所列权利要求的一个或多个限制、要素、从句、描述性术语等引入依赖于相同基础权利要求的另一权利要求(或作为相关的任何其他权利要求)中,除非另外指出或除非对于本领域的普通技术人员而言显而易见的是会出现矛盾或不一致。在要素以列表形式(如,以马库什组或类似格式)呈现的情况下,应当理解,还公开了要素的每个子组,并且可以从该组中除去任何一个或多个要素。应当理解,通常,当本发明或本发明的各方面被称为包括特定要素、特征等时,本发明或本发明各方面的某些实施方案由以下组成或基本上由以下组成:此类要素、特征等。为了简单起见,在任何情况下都没有在本文中用太多的词具体地阐述那些实施方案。还应该理解,本发明的任何实施方案或各方面可以从权利要求中明确地排除,而不管说明书中是否列举了具体的排除。本文所引用的描述本发明背景并提供有关其实践的附加细节的公开和其他参考材料通过引用并入本文。通过以下非限制性实施例说明本公开。
实施例
[0342]
实施例1:生成b2m缺陷hes细胞
[0343]
使用cyt49细胞系生成b2m缺陷hes细胞,然而可使用任何人多能干细胞系。b2m基因靶向破坏生成在其细胞表面上不表达任何hla-i类蛋白的细胞。使用crispr/cas9技术并使用pct公开号wo2016183041a(其整体并入本文)中概述的已知技术,破坏了cyt49hesc系
中b2m基因座的两个等位基因。然而,包括锌指核酸酶(zfn)和转录激活因子类效应物核酸酶(talen)在内的其他核酸酶也可以用于编辑基因,以及传统的同源重组等。b2m公开序列的实例以seq id no:1、2和3提交。nextgen
tm
crispr(transposagen inc.,lexington kentucky)用于编辑该基因,该基因掺入双重引导rna和融合至foki核酸酶的无催化活性的cas9蛋白。将含有引导rna和cas9的质粒电穿孔到cyt49 hesc中,并将细胞接种到组织培养板上。电穿孔后十二天,通过荧光激活细胞分选(facs)分选与b2m抗体(biolegend目录号316306)阴性反应的细胞。将分选的细胞以克隆密度涂铺。挑选单个克隆并在约第25天涂铺。将克隆扩增并冷冻保存。通过g显带显示正常核型并且通过流式细胞术和/或免疫荧光呈b2m蛋白表达和hla-i类蛋白表面表达阴性的扩增的克隆被选择用于进一步实验。
[0344]
在正常和炎性条件下(暴露于干扰素(ifn)-γ后),通过流式细胞术评估野生型(wt)和敲除细胞中的b2m表面表达。参见图2a:正常:未处理的生长培养基(b线);炎症:暴露于100ng/ml的ifn-γ持续18-24小时(a线)。炎性反应发生与组织创伤有关。这释放了促炎细胞因子,其中的一些是il-1-α、il-1-β、tnf-α、il-6、il-8和ifn-γ。尽管wt和b2m-/-esc和pec已经用ifn-γ治疗,但是这些观察结果也可以用其他细胞因子进行扩展。
[0345]
图2a显示了无ifn-γ的情况下的wt hes细胞(b线)中的b2m表达,以及wt hes细胞暴露于ifn-γ后(a线)的b2m表达。与本底(阴影区)相比,未处理的wt hes细胞(b线)的荧光强度发生位移(增加)表明wt hes细胞表达b2m。wt hes细胞暴露于ifn-γ后,荧光强度超出wt b2m表达(b线)的进一步位移(增加)表明暴露于ifn-γ后wt hes细胞中的b2m表达增加(a线)。这样,hla-i类细胞表面蛋白的表达可在细胞应激和炎症(诸如至少由ifn-γ处理引起的)时被上调。
[0346]
图2b显示了b2m敲除hes细胞中的b2m表达,使用crispr/cas系统生成敲除细胞。与有或没有暴露于ifn-γ情况下的本底(阴影区)相比,荧光强度基本没有位移(增加),表明b2m敲除hes细胞已减少或消除b2m表面表达,并且b2m的表达未能通过ifn-γ处理被诱导。在此类b2m敲除中,hla-i类细胞表面蛋白的表达在ifn-γ处理引起的细胞应激和炎症时不上调。
[0347]
该实施例证明了b2m敲除hes细胞已减少或消除b2m表面表达,如使用b2m抗体所显示的。
[0348]
实施例2:分析wt和b2m缺陷细胞中的hla i类细胞表面蛋白表达
[0349]
接下来,使用pan-hla-abc单克隆抗体(bd pharmingen,目录号560169)分析野生型和b2m敲除hes细胞,以确认这些敲除细胞在细胞表面上未表达hla-i类蛋白。pan-hla-abc抗体与人主要组织相容性复合物(mhc)i类蛋白hla-a、-b和-c反应。在正常和炎性状态下,暴露于ifn-γ后,通过流式细胞术评估了pan-hla-abc抗体在野生型和敲除细胞中的表达。正常:无ifn-γ(b线);炎性:暴露于100ng/ml ifn-γ持续18-24小时(a线)。
[0350]
图3a显示了wt hes细胞(b线)中的pan-hla-abc细胞表面蛋白表达,和用ifn-γ处理wt hes细胞后(a线)中的pan-hla-abc细胞表面蛋白表达。与本底(阴影区)相比,未处理的wt hes细胞(b线)中的荧光强度位移(增加)表明wt hes细胞表达pan-hla-abc。暴露于ifn-γ后,荧光强度超过wt hes表达的位移(增加)表明在暴露于ifn-γ之后wt hes细胞中pan-hla-abc表达增加。
[0351]
图3b显示了使用crispr/cas系统,b2m敲除hes细胞中的pan-hla-abc细胞表面蛋
白表达。与有或没有暴露于ifn-γ的本底(阴影区)相比,荧光强度没有位移(增加),表明了敲除减少或消除了hla-i类细胞表面表达并且hla-i类蛋白表达没有被ifn-γ处理诱导。
[0352]
该实施例表明,如使用pan-hla-abc抗体所示,b2m敲除hes细胞已减少或消除了hla-i类细胞表面表达。
[0353]
实施例3:b2m缺陷细胞分化为胰腺谱系细胞
[0354]
将b2m敲除hes细胞在与wt hes细胞相同的条件下培养、传代和增殖,如schulz et al.a scalable system for production of functional pancreatic progenitors from human embryonic stem cells plos one 7:51-17(2012)中所述和如美国专利8,895,300中所述,这两者均通过引用整体并入本文。具体来说,schulz等人描述了贴壁的hesc扩增和基于悬浮物的分化。
[0355]
简而言之,在大约2周(或14天)的过程中,采用四(4)阶段程序,将wt hes细胞和b2m-/-hes细胞在悬浮聚集物中分化,以生成一群胰腺细胞类型,包括胰腺祖细胞、内分泌祖细胞和激素表达细胞,统称为胰腺内胚层细胞(pec)。使用accutase分离人es细胞,并将单个细胞聚集在滚瓶中。为了开始分化,将聚集物汇集到一个或多个锥形管中,并使其通过重力沉降,然后使用没有生长因子的阶段1培养基(rpmi+0.2%vol/vol fbs,含有1:5000稀释的胰岛素-转铁蛋白-硒(its))洗涤。将聚集物重新沉淀,然后重悬于第1天的培养基中(其包含rpmi+0.2%vol/vol fbs,含有1:5000稀释的胰岛素-转铁蛋白-硒(its)、激活素a(100ng/ml)和wnt3a(50ng/ml)),并以2ul/ml的密度分配到滚瓶中。将滚瓶以31rpm的速度放置在flexiroll数字单元滚筒(argos technologies)上。在剩下的分化过程中,将培养物以约31rpm旋转,每日培养基更换为下表2中所述的那些,改编自schulz等人,(2012),同上。hes的生长、传代和增殖基本上如美国专利号7,964,402;8,211,699;8,334,138;8,008,07;和8,153,429所述。下表2提供了用于制备源自人胚胎干细胞的胰腺内胚层细胞(pec)的标准制造方法。
[0356]
表2:用于制备源自hesc的胰腺内胚层细胞(pec)的标准制造方法
[0357][0358]
hesc agg.:hesc聚集物;xf ha:含glutamax的dmem/f12,补充有10%v/v的xeno-free敲除血清替代物、1%v/v非必需氨基酸、1%v/v青霉素/链霉素(所有来自life technologies)、10ng/ml调蛋白-1β(peprotech)和10ng/ml激活素a(r&d systems);sp:hesc sfm(life technologies);r0.2fbs:rpmi 1640(mediatech);0.2%fbs(hyclone)、1x glutamax-1(life technologies)、1%v/v青霉素/链霉素;its:1:5000或1:1000稀释的胰岛素-转铁蛋白-硒(life technologies);a100:100ng/ml重组人激活素a(r&d systems);w50:50ng/ml重组小鼠wnt3a(r&d systems);k25:25ng/ml重组人kgf(r&d systems);iv:2.5μm tgf-βri激酶抑制剂iv(emd bioscience);db:dmem hi葡萄糖(hyclone),补充有0.5x b-27补充物(life technologies)、1x glutamax和1%v/v青霉素/链霉素;ctt3:0.25μm kaad-环巴胺(toronto research chemicals)和3nm ttnpb(sigma-aldrich);n50:50ng/ml重组人头蛋白(r&d systems);k50:50ng/ml重组人kgf(r&d systems);e50:50ng/ml重组人egf(r&d systems)。
[0359]
如表3所示,使用流式细胞仪分析了分化的b2m-/-和wt pec,以确定阶段4群体中
内分泌和胰腺祖细胞的相对量。
[0360]
表3:阶段4胰腺祖细胞组成(总细胞的百分比)
[0361][0362]
在所有3个克隆中,b2m-/-分化细胞中胰腺内分泌细胞、祖细胞、仅pdx-1细胞和三阴性细胞的相对水平与在wt细胞中观察到的相对水平(上排)基本相似。
[0363]
该实施例证明了b2m-/-hes细胞可以与wt hes细胞一样沿胰腺谱系分化。
[0364]
实施例4:分析wt和b2m缺陷胰腺内胚层细胞中的b2m表达
[0365]
接着,使用流式细胞术分析在没有和有ifn-γ处理的情况下,来自实施例3的野生型和b2m敲除胰腺内胚层细胞(pec):没有ifn-γ(b线);暴露于100ng/ml的ifn-γ持续18-24小时(a线)。
[0366]
图4a显示了无ifn-γ处理(b线)和用ifn-γ处理后(a线),wt pec细胞中的b2m表达。与本底(阴影区)相比,未处理的wt pec细胞(b线)的荧光强度位移(增加)表明wt pec细胞表达b2m。在使wt pec暴露于ifn-γ后(a线),荧光强度超过wt表达的位移(增加)表明,在暴露于ifn-γ后,wt pec细胞中b2m表达增加。即,暴露于ifn-γ增加了wt pec中的b2m表达。
[0367]
图4b显示了源自b2m敲除hes细胞的pec细胞中的b2m表达。与有或没有暴露于ifn-γ的本底(阴影区)相比,荧光强度没有变化(增加),这表明b2m敲除的pec减少或消除了b2m细胞表面表达,而b2m的表达不能通过ifn-γ处理在b2m敲除的hes细胞来源的pec中诱导。
[0368]
该实施例显示了其中b2m的表达被调节/消除的源自hes细胞的pec减少或消除了b2m表面表达。
[0369]
实施例5:分析wt和b2m敲除胰腺内胚层细胞中的hla i类细胞表面蛋白表达
[0370]
与实施例2类似,使用pan-hla-abc单克隆抗体(bd pharmingen,目录号560169)分析野生型和b2m敲除pec的hla i类细胞表面表达。通过流式细胞术在两种条件下,即(1)未处理(b线)和(2)用100ng/ml ifn-γ处理18-24小时(a线),在野生型和敲除细胞中评估表达。
[0371]
图5a显示了在未处理条件下(b线)wt pec中hla-i类细胞表面蛋白表达以及在用ifn-γ处理后(a线)的表达。与本底(阴影区)相比,未处理的wt pec(b线)的荧光强度位移(增加)表明wt pec在细胞表面上表达hla-i类。暴露于ifn-γ之后,荧光强度超过wt pec表达的位移(增加)表明暴露于ifn-γ后wt pec细胞中hla i类细胞表面表达增加。
[0372]
图5b显示了源自b2m敲除hes细胞的pec中的hla-i类细胞表面蛋白表达。与有或没
有暴露于ifn-γ的pec细胞中的本底(阴影区)相比,荧光强度没有变化(增加),表明上述敲除已减少或消除了hla表面表达并且b2m-/-pec中的hla i类的表达不能由ifn-γ处理诱导。
[0373]
因此,在其中b2m的表达被调节/消除的那些pec细胞中观察到减少或消除的hla i类细胞表面表达。
[0374]
实施例6:分析wt和b2m敲除hes细胞中的icam-1细胞表面蛋白表达
[0375]
为了进一步限定ifn-γ处理对靶细胞的影响,在以下两种条件下通过流式细胞术评估了wt和b2m敲除hes细胞中的icam-1表达:(1)未处理(b线)和(2)100ng/ml ifn-γ处理18-24小时(a线)。icam-1是包括在靶细胞中呈递抗原在内的几种免疫功能所必需的,并且是已知的nk激活配体。在体内,通过应用特异性单克隆抗体(“mab”)即抗icam-1或抗lfa-1来破坏细胞间icam/lfa结合相互作用,有可能获得免疫学益处。参见isobe等人,specific acceptance of cardiac allograft after treatment with antibodies to icam-1and lfa-1,255science1125-1127(1992年2月)。申请人使用了来自milteney biotec inc.,目录号130-103-909的icam-1抗体。
[0376]
图6a显示了未处理(b线)和用ifn-γ处理后(a线)的wt hes细胞中细胞表面上的icam-1蛋白表达。与本底(阴影区)相比,未处理的wt hes细胞(b线)中的荧光强度的位移(增加)表明wt hes细胞在其细胞表面上表达icam-1蛋白。wt hes细胞暴露于ifn-γ后,荧光强度超过wt表达的位移(增加)表明icam-1表达在暴露于ifn-γ后增加。
[0377]
图6b显示了未处理(b线)和用ifn-γ处理后(a线)的b2m敲除hes细胞中的icam-1细胞表面蛋白表达。图6b显示了b2m敲除的hes细胞中的icam-1细胞表面蛋白表达与wt hes细胞相似。
[0378]
该实施例证明用ifn-γ处理wt和b2m敲除的hes细胞增加了icam-1的细胞表面蛋白表达。
[0379]
实施例7:wt和b2m敲除的胰腺内胚层细胞中icam-1细胞表面蛋白表达的分析
[0380]
与实施例4和5相似,使用针对已知nk激活配体(如icam-1)的抗体分析野生型和b2m敲除的pec。在两种条件下,即(1)未处理和(2)用100ng/ml ifn-γ处理18-24小时,在wt和敲除的pec中,通过流式细胞术评估icam-1的细胞表面蛋白表达。
[0381]
图7a显示了wt pec(b线)中的icam-1细胞表面蛋白表达和用ifn-γ处理wt pec后(a线)的icam-1细胞表面蛋白表达。与本底(阴影区)相比,未处理的wt pec(b线)中的荧光强度的位移(增加)表明wt pec在其细胞表面上表达icam-1蛋白。暴露于ifn-γ之后,荧光强度超出wt pec表达的进一步位移(增加)表明暴露于ifn-γ后wt pec中的icam-1表达增加。这证明了nk激活配体尤其是icam-1可被ifn-γ刺激高度诱导。
[0382]
图7b显示了b2m敲除的pec中的icam-1细胞表面蛋白表达。在有和没有ifn-γ暴露的情况下,b2m敲除的pec中的icam-1细胞表面蛋白表达与wt pec相似,但荧光有少量减少。因此,用ifn-γ处理b2m敲除的pec增加了icam-1细胞表面蛋白表达。
[0383]
图8显示了rna表达阵列数据(affymetrix),表明在mrna水平上,暴露于ifn-γ增加了wthesc、b2m-/-hesc、wt pec和b2m-/-pec.中的icam-1表达。申请人发现,在暴露于ifn-γ后,分化的细胞类型(wt pec和b2m-/-pec)中的nk激活配体icam-1的细胞表面蛋白表达在增加。因此,icam-1在pec中被ifn-γ刺激高度诱导。
[0384]
实施例8:ifn-处理对另外的nk激活配体的影响
[0385]
为了进一步表征ifn-γ处理对靶细胞的作用,在以下两种条件(下,通过流式细胞术评估wt pec,并且分析了其他已知nk激活配体的细胞表面蛋白表达:(1)未处理(b线)和(2)用100ng/ml ifn-γ处理18-24小时。
[0386]
图9显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自biolegend,目录号330909的抗体的cd58(也称为lfa-3)细胞表面蛋白表达。未处理的wt hes细胞(b线)中与本底(c线)相比的荧光强度发生了较大的位移(增加),表明大多数细胞在表面上表达cd58蛋白。暴露于ifn-γ后,荧光强度有一个小的额外的位移(增加)。
[0387]
图10显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自milteneyi biotech inc.,目录号130-105-905的抗体的cd155(也称为pvr、necl-5、hved)细胞表面蛋白表达。未处理的wt pec细胞(b线)中与本底(c线)相比的荧光强度的位移(增加)表明wt pec表达cd155。暴露于ifn-γ后,没有荧光强度超过未处理的条件的额外增加(增加),表明暴露于ifn-γ后wt pec中cd155表达没有增加。
[0388]
图11显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自milteneyi biotech inc.,目录号30-098-858的抗体的ceacam1(也称为cd66a、bgp和bgp1)细胞表面蛋白表达。未处理的wt hes细胞(b线)中与本底(c线)相比的荧光强度的位移(增加)表明wt pec在细胞表面上表达ceacam1蛋白。使wt pec暴露于ifn-γ后,荧光强度超过未处理的条件的位移(增加)表明暴露于ifn-γ后wt pec中细胞表面上的ceacam1蛋白表达增加。
[0389]
图12显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自abcam inc.,目录号ab210838的抗体的bat3(也称为bag6)细胞表面蛋白表达。未处理的pec(b线)中与本底(c线)相比的荧光强度的位移(增加)表明该细胞表达ceacam1。使wt pec暴露于ifn-γ后,没有荧光强度超过未处理的条件的额外位移(增加),表明暴露于ifn-γ后wt pec中bat3表达没有增加。
[0390]
图13显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自mbl international corporation,目录号cm004-4的抗体的cadm1(也称为necl2,tslc1,igsf4,ra175)细胞表面蛋白表达。未处理的条件(b线)中与本底(c线)相比的荧光强度的位移(增加)表明wt pec在细胞表面上表达cadm1蛋白。使pec暴露于ifn-γ后,没有荧光强度超过未处理的条件的额外位移(增加)表明暴露于ifn-γ后cadm1表达没有增加。
[0391]
图14显示了未处理的(b线)和用ifn-γ处理后(a线)的wt pec中,使用来自milteneyi biotech inc.,目录号130-109-056的抗体的cd112(也称为nectin-2、pvrr2、hveb)表达。未处理的条件(b线)下与本底(c线)相比的荧光强度发生位移(增加),表明wt pec在细胞表面上表达cd112蛋白。使pec暴露于ifn-γ后,没有荧光强度超过未处理的条件的额外位移(增加),表明暴露于ifn-γ后cd112表达没有增加。
[0392]
实施例9:mhc-i类缺陷、nk细胞-激活配体缺陷细胞预防nk细胞介导的裂解
[0393]
为了测试减少或消除的hla-i类表达与减少或消除的nk细胞激活配体表达的组合是否足以预防nk介导的细胞裂解,使用浓度为5和10ug/ml的icam-1阻断抗体在靶细胞上阻断icam-i表达。在ifn-γ处理后,向wt或b2m-/-es细胞或pec添加阻断icam-1抗体导致了靶细胞的nk裂解减少(图15)。
[0394]
用钙黄绿素-am对靶细胞染色
[0395]
钙黄绿素释放测定是一种用于研究nk细胞细胞毒性的非放射性替代方法。靶细胞吸收荧光染料(钙黄绿素am)并将其在细胞质转化为活性荧光染料,该荧光染料仅在裂解后才从细胞中释放出来。裂解的细胞将荧光染料释放到上清液中,然后收集上清液,并在荧光计中定量荧光量。根据在存在或不存在nk细胞(效应器)、阻断抗体或两者的情况下孵育后上清液中存在的荧光量计算细胞裂解百分比。
[0396]
靶细胞包含标记前用或不用100ng/ml ifn-γ处理的wt esc、b2m-/-esc、wt pec或b2m-/-pec。为了制备靶细胞,用2μg/ml钙黄绿素am染色培养基(enzo biosciences 1mg/ml储存液(目录号c3100mp))对靶细胞群进行染色。在间歇性混合下,将靶细胞在8%co2孵育箱中于37℃孵育1小时。将靶细胞洗涤两次以除去任何游离的钙黄绿素am,并以1x105个细胞/ml重悬于rpmi完全培养基(rpmi,10%热灭活的fbs和1%的抗生素)中。
[0397]
共培养靶标、nk细胞和阻断抗体
[0398]
然后将钙黄绿素am标记的靶细胞与nk细胞(效应器细胞)以效应器:靶标比(e:t比率)为10:1一起孵育。具体而言,在96孔v底板中每孔添加100μl密度为1x 106个细胞/ml的nk细胞,然后添加100μl钙黄绿素染色的esc或pec细胞(1x 105个细胞/孔)。在指示的地方,将浓度为5和10ug/ml的针对人icam-1表面抗原的阻断抗体(r&d systems,inc.,目录号bba3)添加到孔,以确定是否可以减少nk介导的细胞裂解。
[0399]
将板在8%co2孵育箱中于37℃下孵育4小时。孵育期后,将板以200
×
g离心2分钟。小心地除去100μl上清液,将其转移至黑色的96孔板,并使用molecular device读板仪(激发滤光片:485nm/发射滤光片:530nm)测量荧光。特异性裂解通过使用以下公式计算:裂解%=100
×
[(有抗体的平均荧光-平均自发荧光)/(平均最大荧光-平均自发荧光)]。通过用去污剂(1%triton x-100)孵育的细胞的裂解来确定最大荧光,并且自发裂解是在没有任何抗体或效应器细胞的情况下用靶细胞获得的荧光。
[0400]
结果
[0401]
如图1所示,目标是从情形c(nk细胞攻击靶细胞)转移到情形a(无反应或反应减少)。在图15中,条件4和8中显示了这种情形。在条件4和8中,靶细胞(b2m-/-hes细胞或pec)缺乏功能性hla-i类表面表达,并且暴露于ifn-γ。如上所讨论以及在条件4和8中所见,与不暴露于ifn-γ的hla-i类敲除相比,暴露于ifn-γ导致nk激活配体(icam-1)增加,继而导致更多的细胞裂解(比较条件3vs.4以及条件7vs.8的第一直条)。然而,一旦用用于阻断nk激活信号在靶细胞上的表达的icam-1抑制性抗体处理,nk介导的细胞裂解在b2m-/-hes细胞中从83%下降到73%,并且在用ifn-γ处理的b2m-/-pec中从72%下降到61%。nk介导的细胞裂解百分比未降至零,因为使用阻断抗体可能无法完全阻断icam-1细胞表面蛋白表达,并且如上所讨论的,靶细胞表达多于一种的nk激活配体。当在靶细胞中icam-1表达被进一步抑制并且其他nk激活配体被阻断时,nk介导的细胞裂解的百分比预期将更大程度地下降。因此,icam-1抑制性抗体可以组合另外的nk激活配体抑制性抗体,包括针对表1所列任何配体,优选类别1(已知激活配体)和2(从基因芯片数据鉴定的潜在的激活配体候选物,那些在ifnγ后在pec和/或esc中上调)中的那些的抑制性抗体。在一个实施方案中,icam1基因和其他nk激活配体基因被破坏,以便完全阻断其活性。
[0402]
图15中条件2和6的第一直条中显示了图1中的情形d。在条件2和6中,wt hes细胞
和pec由于暴露于ifn-γ而使hla-i类抗原和nk激活配体两者的细胞表面蛋白表达上调。当将细胞与icam-1抑制性抗体一起孵育时,这表示从图1的情形d转向情形b。与icam1抑制性抗体一起孵育后,wt hes细胞中的细胞死亡从79%减少至60%,以及暴露于ifn-γ的wt pec中细胞死亡从53%减少至27%。确实,当wt pec暴露于ifn-γ并与icam-1抑制性抗体一起孵育时,nk细胞裂解率降低低于未处理的wt pec:对于wt pec,ifn-γ和icam-1抑制性抗体为27%,相比较而言对于wt pec,icam-1抑制性抗体且无ifn-γ为37%。
[0403]
来自图1的情形b由图15中条件1、2、5和6中icam1抗体处理的直条来示例。在那里,靶hes细胞和pec具有hla-i类和nk激活配体,但是当靶细胞不暴露于ifn-γ时,icam-1的细胞表面蛋白表达没有增加。结果,icam-1抑制性抗体的作用较小。因此,细胞裂解保持大致相同:hes细胞中的58%至57%,和pec细胞中的33%至37%。
[0404]
来自图1的情形c与图15中条件3、4、7和8中的第一直条相似。在这些条件下,由于b2m-/-,细胞没有hla-i类细胞表面表达。因此,当nk激活配体未被ifn-γ激活时,使细胞暴露于icam-1抑制性抗体几乎没有作用:hes细胞中71%至70%,和pec中54%至57%。
[0405]
作为一般观察,与未分化细胞群(wt hes和b2m-/-hes)相比,分化细胞群(wt pec和b2m-/-pec)中nk介导的细胞裂解较少。当细胞(wt或b2m-/-敲除,hes或pec)被ifn-γ激活时,nk介导的细胞裂解增加至更大程度。
[0406]
实施例10:生成nk激活配体缺陷b2m-/-敲除的hes细胞
[0407]
实施例9描述了抑制或猝灭icam-1表达保护经ifn-γ处理的b2m-/-pec免于nk介导的细胞杀伤活性。因此,为了保护b2m-/-pec免于移植后nk细胞介导的杀伤,破坏nk细胞激活配体基因是所需的。例如,基于以上实例,icam-1,一种已知的nk激活配体基因可以被破坏或“敲除”。优选地,可以使用crispr/cas9或现在已知或将来应该知道的任何其他基因编辑技术来破坏b2m-/-cyt49 hesc系中icam-1基因座的两个等位基因。参见pct公开号wo2016183041a,其通过引用整体并入本文。icam-1的公开序列的实例以seq id no.:4、5和6提交。例如,在本发明的一个实施方案中,nextgen
tm crispr(transposagen inc.,lexington kentucky),其掺入了双引导rna和与foki核酸酶融合的无催化活性的cas9蛋白,用于对细胞进行基因编辑。
[0408]
可以将含有引导rna和cas9的质粒电穿孔到b2m-/-cyt49 hesc中,并接种到组织培养板上。电穿孔后,可以通过流式细胞术针对其对icam-1抗体的阴性反应,对细胞进行分选。分选的细胞可以以克隆密度铺板。可以挑选单个克隆并重新铺板。可以将克隆扩增和冷冻保存。通过g显带显示正常核型并且通过流式细胞术和/或免疫荧光呈icam-1蛋白表达和icam-1蛋白表面表达阴性的扩增克隆被选择用于进一步实验。
[0409]
如上所述,icam1和b2m缺乏的细胞不能在其细胞表面上表达至少一种nk激活配体和至少一种或所有mhc-i类蛋白,因此不应与nk细胞激活受体结合,并被保护免于nk介导的细胞死亡。
[0410]
实施例11:生成多种nk激活配体缺陷b2m-/-敲除的hes细胞
[0411]
实施例9和10证明,抑制nk细胞激活配体功能性细胞表面表达(抗-nk激活配体)和nk细胞激活配体的基因破坏(如icam1-/-)结合mhc-i类细胞表面表达的破坏(如,b2m-/-)可以为靶细胞提供保护免于nk介导的细胞死亡的保护。可以产生缺乏超过一种nk细胞激活配体的细胞的移植,并提供进一步的保护以免于nk介导的细胞死亡。
[0412]
选择cd58基因作为nk激活配体基因进行敲除。可以使用crispr/cas9技术,使用wo2016183041a中概述的已知技术,在b2m-/-:icam-/-双敲除cyt49 hesc系中破坏cd58基因座的两个等位基因。ceacam1的已公开序列的实例以seq id no.:7、8和9提交。同样,编辑的版本可以是nextgen
tm crispr(transposagen inc.,lexington kentucky)。
[0413]
可以将含有引导rna和cas9的质粒电穿孔到b2m-/-,icam-/-敲除的cyt49 hesc中,并接种到组织培养板上。电穿孔后,可以通过流式细胞术针对对cd58抗体的阴性反应,对细胞进行分选。分选的细胞可以以克隆密度铺板。可以挑选单个克隆并重新铺板。可以将克隆扩增和冷冻保存。通过g显带显示正常核型并且通过流式细胞术和/或免疫荧光呈cd58蛋白表达和cd58蛋白表面表达阴性的扩增克隆被选择用于进一步实验。
[0414]
如上所述,具有被破坏、缺失或修饰的icam1、cd58和b2m的细胞不能在其细胞表面上表达icam1、cd58,也不能表达mhc i类蛋白,因此不应结合nk细胞激活受体,并被保护免受nk介导的细胞死亡。
[0415]
也可以选择cd155(aka pvr)基因作为敲除的nk激活配体基因。除了cd58以外或替代cd58,还可以选择cd155。如上,可以使用crispr/cas9技术破坏cd28基因。也可以选择cd155基因作为敲除的nk激活配体基因。除了cd58以外或替代cd58,还可以选择cd155。也可以选择caecam1基因作为敲除的nk激活配体基因。除了cd58和/或cd155之外,或者替代cd58和/或cd155,还可以选择caecam1。
[0416]
实施例12:nk激活配体icam1和cd58的失活
[0417]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使用阻断靶细胞表面上的icam1和cd58蛋白的icam1和cd58阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。可以预期靶细胞的细胞裂解被减少(类似于图15)。因此,可以通过阻断nk激活配体诸如icam1和cd58来减少nk细胞进行的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断icam1和cd58表达是产生具有3种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),并且具有被抑制的或没有nk激活配体细胞表面蛋白表达(如icam1-/-和cd58-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0418]
实施例13:nk激活配体cadm1和cd58的失活
[0419]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或者现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使
用阻断靶细胞表面上的cadm1和cd58蛋白的cadm1和cd58阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。可以预期靶细胞的细胞裂解减少(类似于图15)。因此,可以通过阻断nk激活配体诸如cadm1和cd58来减少nk细胞进行的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断cadm1和cd58表达是产生具有3种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),并且具有被抑制的或没有nk激活配体细胞表面蛋白表达(如cadm1-/-和cd58-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0420]
实施例14:nk激活配体cd155和cd58的失活
[0421]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或者现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使用阻断靶细胞表面上的cd155和cd58蛋白的cd155和cd58阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。可以预期靶细胞的细胞裂解减少(类似于图15)。因此,可以通过阻断nk激活配体诸如cd155和cd58来减少nk细胞进行的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断cd155和cd58表达是产生具有3种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),并且具有被抑制的或没有nk激活配体细胞表面蛋白表达(如cd155-/-和cd58-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0422]
实施例15:nk激活配体icam1、cd155和cd58的失活
[0423]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或者现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使用阻断靶细胞表面上的icam1、cd155和cd58蛋白的icam1、cd155和cd58阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。可以预期靶细胞的细胞裂解减少(类似于图15)。因此,可以通过阻断nk激活配体诸如icam1、cd58和cd155来减少nk细胞进行的细
胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断icam1、cd58和cd155表达是产生具有4种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),并且具有被抑制的或没有nk激活配体细胞表面蛋白表达(如icam1-/-、cd58-/-和cd155-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0424]
实施例16:nk激活配体icam1、cd155、cd58和cadm1的失活
[0425]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或者现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使用阻断靶细胞表面上的icam1、cd155、cd58和cadm1蛋白的icam1、cd155、cd58和cadm1阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。可以预期靶细胞的细胞裂解减少(类似于图15)。因此,可以通过阻断nk激活配体诸如icam1、cd58、cd155和cadmi来减少nk细胞进行的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断icam1、cd58、cd155和cadmi表达是产生具有5种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),并且具有被抑制的或没有nk激活配体细胞表面蛋白表达(如icam1-/-、cd58-/-、cd155-/-和cadm1-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0426]
实施例17:nk激活配体icam1、cd155和cadm1的失活
[0427]
为了完全消除nk激活,可能需要通过靶细胞中的基因敲除(如hes细胞来源的细胞疗法)或通过使用阻断抗体或现在已知或将来开发的其他策略来消除/减少多个nk激活配体。为了确定是否可以通过抑制nk激活配体对靶细胞的作用来减少nk细胞毒性,可以使用阻断靶细胞表面上的icam1、cd155和cadm1蛋白的icam1、cd155和cadm1阻断抗体,来阻断wt和b2m-/-hes细胞以及pec中的nk激活配体的表达。靶细胞的细胞裂解可预期被减少(类似于图15)。因此,可以通过阻断nk激活配体诸如icam1、cd155和cadmi来减少nk细胞进行的细胞裂解。在b2m-/-细胞中使用针对nk激活配体的抗体阻断icam1、cd155和cadmi表达是产生
具有4种敲除(hla-i类基因敲除和nk激活配体基因敲除)的细胞的概念证明。这样,靶细胞(如hes和/或胰腺谱系细胞)从图1中的情形c转变为a。具体而言,本发明的细胞、组织和器官具有被抑制的或没有hla-i类细胞表面蛋白表达(b2m-/-),以及具有被抑制的或没有nk激活配体细胞表面蛋白表达(如icam1-/-、cd155-/-和cadm1-/-)。可通过敲除基因或使用抗体阻断蛋白质的表达来实现抑制细胞表面蛋白质表达。用于干扰细胞表面蛋白表达的其他策略包括使用反义rna、rna诱饵、核酶、rna适体、sirna、shrna/mirna、反式显性阴性蛋白(tnp)、嵌合/融合蛋白、核酸酶、趋化因子配体、抗感染性细胞蛋白、细胞内抗体(sfvs)、核苷类似物(nrti)、非核苷类似物(nnrti)、整合酶抑制剂(寡核苷酸、二核苷酸和化学剂)和蛋白酶抑制剂。多基因敲除将有效地预防细胞毒性t细胞(ctl)介导的和nk细胞介导的毒性,因为几乎没有hla-i类和几乎没有nk激活配体蛋白在细胞表面上表达以供ctl或nk细胞结合。
[0428]
可用于本发明的阻断抗体如下:cadm1抗体,克隆9d2,creative biolabs,目录号brd-0007mz;cd155抗体,克隆skii.4,biolegend,目录号337602;和cd58抗体,克隆ts2/9,biolegend,目录号330911。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:阿尼迪塔
- 技术所有人:韦尔赛特公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....