一种用于修饰蛋白质赖氨酸残基的探针及其制备方法
1.本发明属于生物化学领域,涉及一种蛋白质赖氨酸探针,具体来说是一种用于修饰蛋白质赖氨酸残基的探针及其制备方法。
背景技术:
2.蛋白质赖氨酸(lys)占人类蛋白质组丰度高达5.9%,在生物体内的酶活性位点和蛋白-蛋白相互作用表面等发挥重要的生理作用。因此赖氨酸残基侧链常作为共价配体和共价药物等研究的靶标。赖氨酸的氨基侧链是一个良好的亲核基团,对其进行化学修饰的研究是现代化学生物学研究的重要研究基础和理论工具,是定向改造蛋白质性质的重要方向,在蛋白质工程和组学研究中有着广泛的应用前景。
3.含杂原子的含氮杂环酯类衍生物被发现具有良好的胺酯交换反应活性。该类化合物相对传统的n羟基琥珀酰亚胺和五氟苯酚酯类衍生物具有更好的生物相容性、更低的生物毒性、更高的内吸性和更高的选择性,可以解决传统蛋白质氨基酸探针的对细胞高毒性的问题,因此含有含氮杂环的蛋白质赖氨酸探针在蛋白质侧链化学修饰上具有重要的非常广阔的应用空间。
技术实现要素:
4.针对现有技术中的上述技术问题,本发明提供了一种用于修饰蛋白质赖氨酸残基的探针及其制备方法,所述的这种用于修饰蛋白质赖氨酸残基的探针及其制备方法要解决现有技术传统蛋白质氨基酸探针反应效率较低的问题。
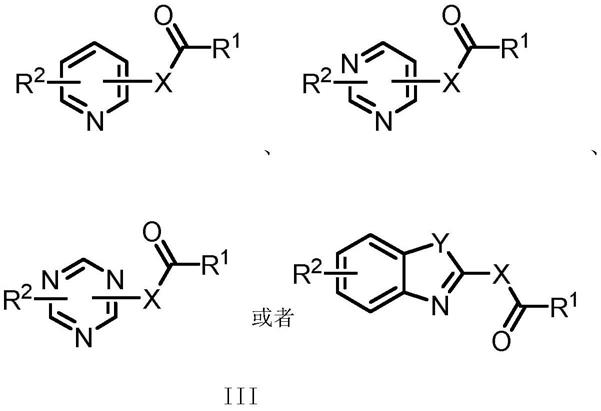
5.本发明提供了一种用于修饰蛋白质赖氨酸残基的探针,其结构式如下所示:
[0006][0007][0008]
其中:r1、r2分别选自:氢、c1-c6烷基、c1-c6卤代烷基、c1-c6烷氧基、c1-c6卤代烷氧基、c2-c6烯基、c2-c6卤代烯基、c2-c6炔基、c2-c6卤代炔基、羟基、c3-c6环烷基、被取代的哌啶-1-基、被取代的吗啉-1-基、被取代的四氢吡咯-1-基、苯基、卤素取代的苯基、c1-c6烷基取代的苯基或c1-c6卤代烷基取代的苯基或c3-c6环烷基取代的苯基、硝基取代的苯
基、c2-c6烯基取代的苯基、c2-c6卤代烯基取代的苯基、c3-c6环烯基取代的苯基、c2-c6炔基取代的苯基或c2-c6卤代炔基取代的苯基或c3-c6环炔基取代的苯基、吡啶基、卤素取代的吡啶基、c1-c6烷基取代的吡啶基、c1-c6卤代烷基取代的吡啶基、c3-c6环烷基取代的吡啶基、硝基取代的吡啶基、c2-c6烯基取代的吡啶基、c2-c6卤代烯基取代的吡啶基、c3-c6环烯基取代的吡啶基、c2-c6炔基取代的吡啶基或c2-c6卤代炔基取代的吡啶基或c3-c6环炔基取代的吡啶基、嘧啶基、卤素取代的嘧啶基、c1-c6烷基取代的嘧啶基、c1-c6卤代烷基取代的嘧啶基、c3-c6环烷基取代的嘧啶基、硝基取代的嘧啶基、c2-c6烯基取代的嘧啶基、c2-c6卤代烯基取代的嘧啶基、c3-c6环烯基取代的嘧啶基、c2-c6炔基取代的嘧啶基或c2-c6卤代炔基取代的嘧啶基或c3-c6环炔基取代的嘧啶基、被取代的含1个或2个n原子的五元或六元杂芳基、含1个或2个s原子的被取代的五元或六元杂芳基、含1个或2个o原子的被取代的五元或六元杂芳基、含1个n原子和1个s原子的被取代的五元或六元杂芳基、含1个n原子和1个o原子的被取代的五元或六元杂芳基、含2个n原子和1个s原子的被取代的五元或六元杂芳基、或者含2个n原子和1个o原子的被取代的五元或六元杂芳基;上述五元或六元杂芳基选自:被取代的呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、噁二唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、四嗪基、吲哚基、苯并噻吩基、苯并呋喃基、苯并咪唑基、吲唑基、苯并三唑基、苯并噻唑基、苯并噻二唑基、苯并噁唑基、异构化的喹啉基、异构化的异喹啉基、酞嗪基、喹喔啉基、喹唑啉基、噌啉基或萘啶基、烷基或烯基取代的硅基;
[0009]
卤素为氟、氯、溴或碘;
[0010]
所述烷基、烯基或炔基为直链的或支链的烷基;烷基本身或作为其它取代基的部分选自甲基、乙基、丙基、丁基、戊基、己基或者其异构体,其异构体选自异丙基、异丁基、仲丁基、叔丁基、异戊基或叔戊基;
[0011]
所述卤代烷基基团选自含一个或多个相同或不同的卤素原子的基团,所述卤代烷基选自ch2cl、chcl2、ccl3、ch2f、chf2、cf3、cf3ch2、ch3cf2、cf3cf2或ccl3ccl2;
[0012]
所述环烷基本身或作为其它取代基的部分选自环丙基、环丁基、环戊基或环己基;
[0013]
所述烯基本身或作为其它取代基的部分选自乙烯基、烯丙基、1-丙烯基、丁烯-2-基、丁烯-3-基、戊烯-1-基、戊烯-3-基、己烯-1-基或4-甲基-3-戊烯基;
[0014]
所述炔基本身或作为其它取代基的部分选自乙炔基、丙炔-1-基、丙炔-2-基、丁炔-1-基、丁炔-2-基、1-甲基-2-丁炔基或者己炔-1-基或1-乙基-2-丁炔基。
[0015]
x选自:氧或者硫。
[0016]
y选自:氧、硫或者氨基。
[0017]
其中,所述r1优选自:苯基、取代苯基或者甲基;r2优选自:氢;x优选自:氧或者硫;y优选自:氧或者硫。
[0018]
本发明还提供了上述用于修饰蛋白质赖氨酸残基的探针的制备方法,包括如下步骤:
[0019]
在一个反应容器中加入化合物i、以及羧酸底物ii和酯化缩合剂,所述的化合物i
的结构式如下所示:所述的羧酸底物ii的结构式如下所示反应溶剂选自:二氯甲烷,甲苯,乙腈,反应完全后,减压浓缩除去多余溶剂,残余物经100~200目硅胶柱层析纯化得化合物iii,洗脱剂为60~90摄氏度的石油醚和乙酸乙酯的混合物,根据产物的不同,所述的石油醚和乙酸乙酯的混合物中,石油醚和乙酸乙酯的体积比为10:1-6:1,收率71-82%;化合物iii制备的量和反应容器的体积按相应比例扩大或缩小。
[0020]
进一步的,所述的化合物i、羧酸底物ii和酯化缩合剂的质量比为2~3:4~6:4~6。
[0021]
进一步的,所述的化合物的i选自:4-羟基吡啶,2-羟基吡啶,4-羟基嘧啶,2-羟基嘧啶,羟基三嗪,三聚氰酸,三聚氯氰,2-氯-4,6-二甲氧基三嗪,2-羟基苯并噻唑或者2-羟基苯并噁唑。
[0022]
本发明还提供了采用上述的一种探针修饰蛋白质赖氨酸残基的方法,加入需要修饰的蛋白质,所述的化学修饰位点为蛋白质赖氨酸残基;蛋白质赖氨酸探针iii投料为蛋白质的0.1当量至200当量。
[0023]
进一步的,所述的反应溶剂为水或极性有机溶剂:所述的极性有机溶剂选自乙腈、甲醇、乙醇、异丙醇、叔丁醇、乙二醇、甘油、三氟乙醇、六氟异丙醇、二甲基亚砜或者n,n-二甲基甲酰胺中的任意一种或者它们任意两种的混合溶剂。
[0024]
进一步的,所述的反应时间为0.1小时至100小时。
[0025]
进一步的,所述的反应温度为-20至50摄氏度。
[0026]
本发明的蛋白质赖氨酸探针iii的合成方法如下:
[0027][0028]
本发明还提供了上述的用于修饰蛋白质赖氨酸残基的探针在修饰蛋白质赖氨酸残基中的用途。
[0029]
本发明针对蛋白质赖氨酸残基的化学选择性修饰技术和应用的需求,提供了一种高效蛋白质赖氨酸化学修饰的方法,所述的修饰方法解决了以含氮杂环为活性官能团的蛋白质赖氨酸残基的高效选择性化学修饰技术问题。
[0030]
本发明可与化学生物学上可接受的探针以及与商品化半胱氨酸探针、酪氨酸探针和赖氨酸探针等组合使用在多肽、蛋白质、细胞水平上的修饰蛋白质组学和生物医药上使用。
[0031]
本发明的有益效果是:对蛋白质赖氨酸探针iii进行了合成研究,并对蛋白质赖氨酸探针iii进行了化学生物学活性的探索,包括蛋白质化学修饰和化学蛋白质组学研究等。对比现有技术(主要包括琥珀酰亚胺活性酯等),在纯蛋白的化学修饰以及细胞裂解液的反应研究等方面具有明显的优势。
附图说明
[0032]
图1显示了蛋白质赖氨酸探针iii与牛血清蛋白和hela细胞裂解液的反应。
具体实施方式
[0033]
本发明通过特定制备和化学生物学实施例更加具体说明蛋白质赖氨酸探针iii的合成与生物应用,所述实施例仅用于具体说明本发明而非限制本发明,尤其是生物应用仅是举例说明,而非限制本专利,具体实施方式如下:
[0034]
实施例1:化合物
ⅲ‑
1的制备:
[0035][0036]
在250毫升双口圆底烧瓶中加入2.4克4-羟基嘧啶i,4.4克4-炔丙氧基苯甲酸和4.8克1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)。加入100毫升反应溶剂二氯甲烷。tlc监测反应完全后,减压浓缩除去多余溶剂,残余物经100~200目硅胶柱层析纯化得化合物iii,洗脱剂为60~90摄氏度的石油醚:乙酸乙酯,体积比为6:1,产物为白色粉末4.2克,收率74%。该化合物的核磁数据如下:1h nmr(400mhz,cdcl3)δ9.13(d,j=1.2hz,1h),8.85(d,j=5.6hz,1h),8.25
–
8.17(m,2h),7.39(dd,j=5.6,1.2hz,1h),7.15
–
7.06(m,2h),4.82(d,j=2.4hz,2h),2.61(t,j=2.4hz,1h).
[0037]
同类的化合物合成及表征数据:
[0038]
无色油状物,收率89%.1h nmr(400mhz,cdcl3)δ8.53
–
8.46(m,1h),8.29
–
8.22(m,2h),7.90
–
7.81(m,1h),7.66(tt,j=7.1,1.3hz,1h),7.56
–
7.50(m,2h),7.32
–
7.21(m,2h).
[0039]
白色粉末,收率74%.1h nmr(500mhz,cdcl3)δ8.41(s,1h),8.15(d,j=8.8hz,2h),7.77(td,j=8.0,1.6hz,1h),7.24
–
7.18(m,1h),7.16(d,j=7.9hz,1h),7.02(d,j=8.8hz,2h),4.73(d,j=2.2hz,2h),2.55(t,j=2.3hz,1h).
[0040]
无色油状物,收率82%.1h nmr(500mhz,cdcl3)δ8.15(dt,j=8.5,1.6hz,2h),7.70
–
7.63(m,1h),7.55
–
7.48(m,2h).
[0041]
白色粉末,收率70%.1h nmr(500mhz,cdcl3)δ8.18
–
8.13(m,2h),7.10(d,j=9.0hz,2h),4.80(d,j=2.4hz,2h),2.59(t,j=2.4hz,1h).
[0042]
白色粉末,收率71%.1h nmr(400mhz,cdcl3)δ8.82(d,j=4.8hz,2h),8.31
–
8.17(m,2h),7.35(t,j=4.8hz,1h),7.18
–
7.06(m,2h),4.82(d,j=2.4hz,2h),2.61(t,j=2.4hz,1h).
[0043]
白色粉末,收率85%.1h nmr(500mhz,cdcl3)δ8.29(d,j=7.4hz,2h),7.93(d,j=8.0hz,1h),7.83(d,j=7.9hz,1h),7.69(t,j=7.4hz,1h),7.54(t,j=7.7hz,2h),7.49(t,j=7.3hz,1h),7.39(t,j=7.6hz,1h).
[0044]
白色粉末,收率82%.1h nmr(500mhz,cdcl3)δ7.90(d,j=8.8hz,2h),7.44(d,j=8.0hz,2h),7.30(t,j=7.8hz,1h),7.23(d,j=7.7hz,1h),7.06(d,j=8.8hz,2h),4.77(d,j=2.2hz,2h),2.56(t,j=2.2hz,1h).
[0045]
白色粉末,收率85%.1h nmr(400mhz,cdcl3)δ7.93
–
7.86(m,2h),7.81(dp,j=4.5,2.8hz,1h),7.31(d,j=1.9hz,3h),7.14
–
7.07(m,2h),4.82(d,j=2.5hz,2h),2.62(t,j=2.4hz,1h).
[0046]
实施例2:化合物
ⅲ‑
2的制备:
[0047][0048]
在250毫升双口圆底烧瓶中加入1.7克2-氯-4,6-二甲氧基三嗪iv,1.2克苯甲酸和1.1克n-甲基吗啡啉(nmm)。加入100毫升反应溶剂二氯甲烷。tlc监测反应完全后,减压浓缩除去多余溶剂,残余物经100~200目硅胶柱层析纯化得化合物iii-2,洗脱剂为60~90摄氏
度的石油醚:乙酸乙酯,体积比为4:1,产物为白色粉末2.4克,收率92%。该化合物的核磁数据如下:1h nmr(400mhz,cdcl3)δ8.12(dt,j=8.5,1.5hz,2h),7.66
–
7.56(m,1h),7.46(td,j=7.8,1.6hz,2h),4.03(s,6h).
[0049]
同类的化合物合成及表征数据:
[0050]
白色粉末,收率94%.1h nmr(400mhz,cdcl3)δ8.19
–
8.11(m,2h),7.12
–
7.04(m,2h),4.80(d,j=2.4hz,2h),4.09(s,6h),2.60(t,j=2.4hz,1h).
[0051]
实施例3:本发明的蛋白质赖氨酸探针iii与离体蛋白质的反应:
[0052]
本发明的蛋白质赖氨酸探针iii与离体蛋白质的反应,具体步骤为:为了验证蛋白质赖氨酸探针与赖氨酸(lys)共价结合在蛋白标记层面的反应性,采用蒸馏水将蛋白溶解并配置成5μm至100μm的蛋白溶液。准确称量蛋白质赖氨酸探针iii用pbs缓冲液或者蒸馏水配置成相应浓度的反应试液。将蛋白溶液与10μm探针在pbs溶液中于37℃钟孵育1小时。然后利用“click”反应给蛋白标记荧光标签,具体做法是在反应体系中加入cuso4,tecp,tbta,5-tamra-n3,于25℃孵育2小时,反应结束。最后跑sds-page蛋白胶,观察胶内荧光。蛋白可以为牛血清蛋白(bsa),马血清蛋白(hsa),碳酸酐酶(ca),肌红蛋白(myoglobin,mb),溶菌酶(lysozyme)等。
[0053]
从图1a,1b牛血清蛋白的标记实验中,我们观察到本发明探针在10μm的浓度下探针对牛血清蛋白的标记,可观察到本发明探针均显示出对蛋白的标记能力,其中hk-1,hk-2,hk-3和hk-4都显示出较强的荧光标记能力,尤其是hk-3高荧光标记能力超出商品化赖氨酸探针nhs-ph和nhs,证明本发明探针对赖氨酸的修饰能力高于商品化探针,用于蛋白质标记尤其是用于赖氨酸残基的修饰具有广阔的前景。
[0054]
实施例4:本发明的蛋白质赖氨酸探针iii与细胞裂解液的反应:
[0055]
本发明的蛋白质赖氨酸探针iii与细胞裂解液的反应,具体步骤为:将收获的细胞通过超声裂解,定浓度。准确称量蛋白质赖氨酸探针iii用pbs缓冲液或者蒸馏水配置成相应浓度的反应试液。将细胞裂解液稀释至适宜浓度与50μm探针在pbs溶液中于37℃钟孵育1小时。然后利用“click”反应给蛋白标记荧光标签,具体做法是在反应体系中加入cuso4,tecp,tbta,5-tamra-n3,于25℃孵育1小时,反应结束。最后跑sds-page蛋白胶,观察胶内荧光。细胞可以为a549,293t,hela,mcf-7等。
[0056]
从图1c本发明探针对hela细胞裂解液标记实验中,本发明探针的使用浓度为10μm时,探针对hela细胞裂解液的标记就可以通过凝胶成像仪观察到明显的荧光,证明本发明探针均显示出对蛋白的赖氨酸的修饰能力,其中hk-1,hk-3和hk-4都显示出较强的荧光标记能力,尤其是hk-3对hela细胞裂解液显示粗高荧光标记能力超出商品化赖氨酸探针nhs-ph和nhs,从细胞裂解液层面证明本发明探针对赖氨酸的修饰能力高于商品化探针,无论是用于纯蛋白质标记还是细胞中的蛋白质标记均具有一定的研究开发探索价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1