一种获得识别空间构象表位抗体的方法与流程
1.本发明属于生物技术领域,具体涉及一种获得识别空间构象表位抗体的方法。
背景技术:
2.治疗性抗体已被证明是对抗人类疾病的强大工具。迄今为止,市场上大多数治疗性抗体都是通过杂交瘤和噬菌体展示方法开发的。然而,通过这些方法产生的高亲和力抗体依旧充满挑战。由于蛋白抗原本身的特性,采用上述方法获得的抗体可能随机识别并结合到抗原不同结构区域(抗体结合表位)。抗体在体内的生物学活性各异。例如抗cd20抗体依照抗体结合表位分为i型抗体(如美罗华单抗)和ii型抗体(如奥比妥珠单抗),ii型抗体引发的补体杀伤作用较i型抗体显著降低但具有更强的抗体依赖的细胞杀伤能力、以及i型抗体所不具有的对靶细胞直接杀伤的能力。在非霍奇金式淋巴瘤的临床数据对比中,与美罗华单抗相比,奥比妥珠单抗显著延长了病人的无进展生存期。又如,抗cd22抗体m971和epratuzumab由于结合表位的不同,仅后者可以引发cd22分子的迅速内化。综上所述,在抗体筛选过程中,保证所构建抗体筛选文库的多样性是获得具有生物学活性抗体的重要前提。抗原自身的性质决定了从上述方法获得抗体的结合表位的偏好性。抗体结合表位可以是由连续排列的氨基酸所构成的短肽(线性表位),也可以是由不连续排列的氨基酸所形成的复杂空间构象(空间表位)。抗原上被抗体所结合的线性表位,例如多肽,主要被t淋巴细胞的组织相容性复合体(mhc)所识别,而抗原上不连续的空间构象表位主要被b细胞识别。
3.产生针对构象表位的抗体是具有挑战性的,因为抗原的空间构象结构必须在动物免疫和体外抗体筛选中得到很好维持。抗原空间构象不稳定性导致候选药物筛选的不一致和不可再现性。一般而言,为了方便蛋白抗原的纯化,需要在抗原表达时预先将纯化标签(如his标签、免疫球蛋白fc部分)与抗原融合,但这种策略有如下局限性:(1)蛋白质标签的引入可能会破坏抗原的空间结构;(2)这些标签在动物免疫中具有免疫原性,需要引入额外的抗体筛选步骤;(3)为了高效收获抗原并在纯化过程中维持其空间构象,通常需要常规纯化程序进行优化,这样的优化工作是繁琐且费力的。
技术实现要素:
4.本发明的目的是获得识别抗原蛋白空间构象表位抗体。
5.本发明首先保护一种获得识别抗原蛋白空间构象表位抗体的方法,可包括如下步骤:
6.(1)构建重组质粒;所述重组质粒表达抗原蛋白和表面锚定蛋白形成的融合蛋白;
7.(2)将步骤(1)构建的重组质粒转入真核细胞,筛选,获得重组真核细胞;
8.所述重组真核细胞表面展示抗原蛋白或抗原蛋白片段;
9.(3)采用步骤(2)获得的重组真核细胞免疫动物,获得杂交瘤细胞;
10.(4)从步骤(3)获得的杂交瘤细胞中分离抗体;该抗体即为识别抗原蛋白空间构象表位的抗体。
11.所述步骤(1)中,表面锚定蛋白可为糖磷脂酰肌醇(glycosylphosphatidylinositol,gpi)。
12.所述步骤(1)中,所述抗原蛋白可为ccn1蛋白(蛋白id为np_001545.2)。
13.所述步骤(1)中,所述重组质粒中含有二氢叶酸还原酶抗性基因。
14.所述步骤(1)中,所述重组质粒可为seq id no:1所示的融合序列和poptivec-topo载体使用ta克隆法连接而成。seq id no:1中,自5’末端起,第1-6位为kozak序列,第7-1149位为编码人ccn1蛋白的dna,第1150-1296位为编码gpi的dna。
15.所述步骤(2)中,真核细胞可为sp2/0-ag14细胞。sp2/0-ag14细胞即野生型sp2/0-ag14细胞(atcc公司的产品,产品目录号为crl-1581)。
16.所述步骤(2)中,所述筛选可为甲氨蝶呤筛选。
17.上述方法中,当抗原蛋白为ccn1蛋白时,所述识别ccn1蛋白空间构象表位的抗体具体可为单克隆抗体15g7。所述单克隆抗体15g7具体由重链和轻链组成。所述重链可变区的氨基酸序列如seq id no:3所示。所述轻链可变区的氨基酸序列如seq id no:5所示。所述单克隆抗体15g7结合ccn1蛋白。
18.采用上述任一所述的方法获得的识别抗原蛋白空间构象表位抗体在筛选药物中的应用也属于本发明的保护范围。
19.上述应用中,所述识别抗原蛋白空间构象表位抗体可为所述单克隆抗体15g7。
20.本发明还保护一种单克隆抗体15g7,具体由重链和轻链组成。所述重链可变区的氨基酸序列如seq id no:3所示。所述轻链可变区的氨基酸序列如seq id no:5所示。所述单克隆抗体15g7结合ccn1蛋白。
21.本发明还保护编码所述单克隆抗体15g7的核酸分子。所述编码所述单克隆抗体15g7的核酸分子可由编码所述重链的核酸分子和编码所述轻链的核酸分子组成。所述重链可变区的核苷酸序列如seq id no:2所示。所述轻链可变区的核苷酸序列如seq id no:4所示。
22.本发明通过对真核细胞的工程化改造,将抗原蛋白或抗原蛋白片段展示在真核细胞表面,之后采用真核细胞免疫动物,获得杂交瘤细胞;从杂交瘤细胞中分离抗体;该抗体即为识别抗原蛋白空间构象表位的抗体。采用该方法获得的识别ccn1蛋白空间构象表位的抗体—单克隆抗体15g7,其仅结合天然ccn1蛋白,不结合变性ccn1蛋白,即只能专一性的识别天然构象的ccn1蛋白。与传统方法相比,本发明提供的方法不仅无需抗原纯化步骤,而且制备获得的抗体为识别空间构象表位的抗体。本发明具有重要的应用价值。
附图说明
23.图1为实施例1中步骤三的检测结果。
24.图2为实施例2的检测结果。
25.图3为实施例3的检测结果。
26.图4为实施例4的检测结果。
具体实施方式
27.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐
明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
28.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
29.ccn1蛋白(蛋白id为np_001545.2)属于早期响应基因编码的产物之一,其表达受到诸多病理和生理环境的调控,如细胞因子、机械拉伸、有害毒素等。ccn1具有四个结构域,分别为胰岛素样生长因子结合蛋白、血管性血友病因子c型结构域(von willebrand factor type c domain,vwc)、类血小板凝集蛋白模块和羧基末端模块。四个结构域可以分别结合到不同的细胞表面的整合素受体上,受体结合的多样性决定了ccn1在生理和病理状态下丰富的生物学功能,如ccn1的vwc结构域与αvβ3整合素受体结合可以促进内皮细胞的黏附、迁移以及增殖;与αvβ5整合素受体的结合可增强巨噬细胞的吞噬作用;与α6β1整合素受体的结合可以导致成纤维细胞的衰老凋亡。此外,ccn1还有促进癌细胞迁移,加重肺组织损伤,参与缺氧反应导致的血管生成等生理和病理过程。因此,针对ccn1不同结构域的单抗具有潜在的临床应用前景。
30.通过真核细胞表达并纯化的ccn1蛋白保存在中性的磷酸缓冲液中或反复冻融时极易发生降解。使用肝素柱可以捕获ccn1蛋白,但肝素也会一并捕获许多杂质蛋白,因此该方法不能够专一性富集ccn1蛋白。ccn1体外天然结构的不稳定性对识别空间构象表位ccn1抗体的筛选造成了极大的困难。
31.实施例1、获得识别空间构象表位ccn1抗体—抗ccn1抗体
32.一、ccn1-sp2/0细胞的构建
33.1、将编码ccn1蛋白的dna序列的3’端和编码糖磷脂酰肌醇(glycosylphosphatidylinositol,gpi)的dna序列通过分子生物学技术融合后构建到含有二氢叶酸还原酶(dhfr)抗性基因的表达载体中,获得重组质粒。具体步骤如下:
34.(1)将编码人ccn1蛋白的dna(nm_001554)和编码gpi的dna进行融合,之后在5’端加入kozak序列gccacc,得到seq id no:1所示的融合序列。
35.seq id no:1中,自5’末端起,第1-6位为kozak序列,第7-1149位为编码人ccn1蛋白的dna,第1150-1296位为编码gpi的dna。
36.(2)按照poptivec
tm-tacloning kit(thermo,货号12744-017)的操作步骤,将步骤(1)得到的融合序列和poptivec-topo载体使用ta克隆法连接,然后转化one top10competent e.coli感受态细胞(thermo,货号c404003),使用qiagen plasmid maxi kit(qiagen,货号12163)富集和提取质粒,得到重组质粒。
37.poptivec-topo载体为poptivec
tm-tacloning kit中的组件。
38.2、将步骤1获得的重组质粒通过电击转入野生型sp2/0-ag14细胞(atcc公司的产品,产品目录号为crl-1581),使用甲氨蝶呤筛选,获得阳性sp2/0细胞克隆(以下简称ccn1-sp2/0细胞)。具体步骤如下:
39.(1)取20μg步骤1获得的重组质粒,加入pvui酶(newenglandbiolabs,货号r0150),37℃消化12h,得到消化液。消化液中含有线性化的重组质粒。
40.(2)完成步骤(1)后,向消化液中加入等体积饱和酚,温和、充分混匀3min,之后
5000g离心10min,收集上层水相至新的离心管中。
41.(3)完成步骤(2)后,向离心管中加入等体积饱和酚,混匀,之后5000g离心10min,收集上层水相至新的离心管中。
42.(4)完成步骤(3)后,向离心管中加入等体积酚/氯仿(酚和氯仿等体积混合),混匀,之后5000g离心10min,收集上层水相至新的离心管中。
43.(5)完成步骤(4)后,向离心管中加入等体积氯仿,混匀,之后5000g离心10min,收集上层水相至新的离心管中。
44.(6)完成步骤(5)后,向离心管中加入1/10体积的ph5.2、3m醋酸钠和2.5倍体积无水乙醇,轻轻倒置混匀,待絮状物出现后,5000g离心5min,收集沉淀。
45.(7)将步骤(6)收集的沉淀用75%(v/v)乙醇水溶液洗涤,之后5000g离心3min,收集沉淀。将该沉淀中乙醇充分挥发,得到线性化的重组质粒。
46.(8)取0.5
×
106个sp2/0-ag14细胞,用250μl hybridoma-sfm培养基(thermo,货号12045076)重悬,得到细胞悬液。
47.(9)将步骤(7)得到的线性化的重组质粒和步骤(8)得到的细胞悬液充分混匀,得到混合液。将混合液小心转移到电转杯中进行电转(设定电压为180伏特,电容为960μf,时间常数为24msec),电转完成后,将混合液小心转移到无菌ep管,并置于冰上静置10min。
48.(10)完成步骤(9)后,将混合液先转移至hybridoma-sfm培养基,37℃培养48h;再转移至含0.05μmol甲氨蝶呤的hybridoma-sfm培养基,37℃培养3-5天;培养期间,每隔3-5天传代一次。
49.(11)将步骤(10)获得的细胞接种至96孔板且每孔中的平均细胞数不超过1个,之后每孔加入含有0.1μmol甲氨蝶呤的hybridoma-sfm培养基,37℃培养21天;挑选孔板中的单克隆转移至培养瓶中,用含有0.1μmol甲氨蝶呤的hybridoma-sfm培养基扩大培养,并用步骤3中的方法确认ccn1的表面展示。
50.(12)将步骤(11)中“步骤(10)获得的细胞”替换为步骤(11)获得的细胞,甲氨蝶呤的浓度提高,其它步骤均不变,获得ccn1-sp2/0细胞(即逐渐提高培养基甲氨蝶呤的筛选浓度,以提高筛选出的细胞的ccn1表达量)。
51.3、使用a10单抗(商业化ccn1单抗,santa cruz biotechnology,inc.公司的产品,产品目录号为sc-374129),确认ccn1在sp2/0-ag14细胞表面展示。具体步骤如下:
52.(1)取含有1
×
106个ccn1-sp2/0细胞的细胞悬液,300g离心,收集细胞沉淀;之后用磷酸缓冲液(ph7.4)清洗沉淀1次。
53.(2)向步骤(1)得到的细胞沉淀中加入0.5mla10单抗稀释液,室温孵育2h,弃上清,用磷酸缓冲液(ph7.4)清洗沉淀3次。
54.用磷酸缓冲液(ph7.4)1:1000稀释a10单抗,得到a10单抗稀释液。
55.(3)完成步骤(2)后,加入鼠二抗稀释液,室温孵育1h,弃上清,用磷酸缓冲液(ph7.4)清洗沉淀3次。
56.用磷酸缓冲液(ph7.4)1:5000稀释鼠二抗(jackson immunoresearch laboratories,inc货号115-035-003),得到鼠二抗稀释液。
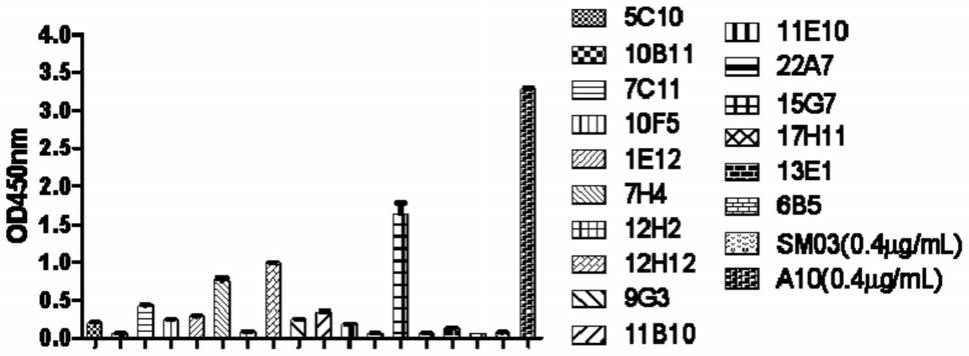
57.(4)完成步骤(3)后,加入tmb反应底物(3,3
′
,5,5
′‑
四甲基联苯胺,sigma-aldrich,货号为t0440),室温反应10min,之后将上清转移至96孔板,读取450nm处的吸光
值。
58.按照上述步骤,将ccn1-sp2/0细胞替换为sp2/0-ag14细胞,其它步骤均不变,作为阴性对照。
59.结果表明,ccn1-sp2/0细胞在450nm处的吸光值显著高于sp2/0-ag14细胞在450nm处的吸光值。
60.二、制备杂交瘤细胞
61.1、取1ml磷酸缓冲液,加入3
×
107个ccn1-sp2/0细胞,充分混匀,得到细胞悬液。
62.2、向步骤1得到的细胞悬液中加入1ml完全弗氏佐剂,振荡并1500rpm转速乳化,得到溶液1。向步骤1得到的细胞悬液中加入1ml不完全弗氏佐剂,得到溶液2。向步骤1得到的细胞悬液中加入1ml磷酸缓冲液,得到溶液3。
63.3、取5只6周龄的balb/c小鼠,每只进行如下操作:实验第1天,腹腔注射200μl溶液1(注射细胞数量为3
×
106个)(第一次免疫);实验第14天,腹腔注射200μl溶液2(注射细胞数量为3
×
106个)(第二次免疫);实验第28天,腹腔注射200μl溶液2(注射细胞数量为3
×
106个)(第三次免疫);实验第42天,尾静脉注射100μl溶液3(注射细胞数量为1.5
×
106个)。
64.4、完成步骤3后的3天后,处死小鼠并取小鼠脾脏,通过杂交瘤制备技术制备杂交瘤细胞克隆。具体步骤如下:
65.(1)5只小鼠分别在第一次免疫前4天、第二次免疫后第7天、以及第三次免疫后第7天收集血清。之后检测血清中抗人ccn1抗体的滴度,选取血清单抗滴度最高的小鼠在第45天时处死,取脾脏。
66.(2)完成步骤(1)后,将小鼠脾脏细胞分离成单细胞并和sp2/0-ag14细胞融合,获得的单克隆在多孔培养板中培养,收集培养基上清并测定抗ccn1抗体的含量。
67.(3)根据测定结果,按照步骤一中2(11)的方法使用hybridoma-sfm培养基培养抗体分泌量的单克隆。重复该步骤2-3次,每次均进行抗ccn1抗体的含量的测定,挑选高分泌量的单克隆直至最终获得基因组稳定的目标克隆。
68.三、从杂交瘤细胞中获得抗ccn1抗体
69.a、使用酶联免疫吸附测定杂交瘤细胞培养上清中抗ccn1单抗的活性。具体步骤依次如下:
70.1、向96孔板中每孔加入50μl ccn1蛋白溶液,室温孵育6h后弃去溶液。
71.通过肝素柱制备新鲜的ccn1蛋白并使用磷酸缓冲液配置成10μg/ml ccn1蛋白溶液。
72.2、使用磷酸缓冲液清洗两遍,之后使用含有3%bsa的磷酸缓冲液封闭,室温孵育2h;之后弃溶液并使用磷酸缓冲液清洗两遍。
73.3、加入杂交瘤细胞的培养上清,室温孵育2h后弃去培养上清,清洗两遍。
74.4、加入抗鼠fc片段-辣根过氧化物酶(jackson immunoresearch laboratories,inc的产品,产品目录号为115-036-003),室温孵育1h后弃去,使用磷酸缓冲液清洗平板。
75.5、加入tmb反应底物,室温反应10min,之后读取450nm处的吸光值。
76.按照上述方法,将杂交瘤细胞的培养上清替换为sm03(抗人cd22单抗,浓度为0.4μg/ml)(中国抗体制药有限公司的产品,产品批号为sm03-202-201701-b003-04-09),其它步骤均不变,作为阴性对照。
77.按照上述方法,将杂交瘤细胞的培养上清替换为a10单抗,其它步骤均不变,作为阳性对照。
78.实验结果见图1。结果表明,杂交瘤克隆15g7的反馈信号最强。因此,挑选杂交瘤克隆15g7进行进一步分析和鉴定。
79.b、获得抗ccn1抗体
80.1、用trizol(thermo,货号15596026)提取杂交瘤克隆15g7的mrna,之后用superscript
tm
iv reverse transcriptase(thermo,货号18090200)进行逆转录,获得cdna。
81.2、以cdna为模板,采用重链引物1:5
’‑
aggtnmakctgcagnagtclgg-3’(n为c或g,m为a或c,k为a或g,l为a或t)和重链引物2:5
’‑
agctgggaaggtgtgcac-3’组成的引物对进行pcr扩增,得到15g7重链的可变区片段。以cdna为模板,采用轻链引物1:5
’‑
gacattcagctgacccagtctcca-3’和轻链引物2:5
’‑
gttagatctccagcttggtccc-3’组成的引物对进行pcr扩增,得到15g7轻链的可变区片段。
82.反应程序为:95℃2min;95℃15s,56℃30s,68℃1min,35个循环;68℃3min;4℃保存。
83.3、分别将15g7重链的可变区片段和15g7轻链的可变区片段克隆至poptivec-topo载体,之后进行dna测序。
84.poptivec-topo载体为poptivec
tm-ta cloning kit(thermo,货号12744-017)中的组件。
85.15g7重链的可变区片段的核苷酸序列为:caggtcaaactgcaggagtctgggcctgagctggtgaggcctggggtctcagtgaagatttcctgcaagggttccggctacacattcactgattatgctatgcactgggtgaagcagagtcatgcaaagagtctagagtggattggagttattagtacttactctggtaatacaaactacaaccagaagtttaagggcaaggccacaatgactgtagacaaatcctccagcacagcctatatggaacttgccagattgacatctgaggattctgccatctattactgtgcaagacagctatggttacgacgcccctactatgctatggactactggggtcaaggaacctcagtcaccgtctcctca(seq id no:2)
86.15g7重链的可变区片段的氨基酸序列为:qvklqesgpelvrpgvsvkisckgsgytftdyamhwvkqshakslewigvistysgntnynqkfkgkatmtvdkssstaymelarltsedsaiyycarqlwlrrpyyamdywgqgtsvtvss(seq id no:3)
87.15g7轻链的可变区片段的核苷酸序列为:gacattcagctgacccagtctccagcttctttggctgtgactctagggcagagagccaccatctcctgcagagccagtgaaagtgttgaacattatggcacaagttttatgcagtggtaccaacagaaaccaggacagtcacccaaactcatcatctatgttgcttccaacgtagaatctggggtccctgccaggtttagtggcagtgggtctgggacagacttcagcctcaacatccatcctgtggaggaggatgatattgcaatatatttctgtcagcaaagtaggaaggttccttccacgttcggaggggggaccaagctggagatcaaa(seq id no:4)
88.15g7轻链的可变区片段的氨基酸序列为:diqltqspaslavtlgqratiscrasesvehygtsfmqwyqqkpgqspkliiyvasnvesgvparfsgsgsgtdfslnihpveeddiaiyfcqqsrkvpstfgggtkleik(seq id no:5)
89.4、将15g7重链的可变区片段和人单抗的恒定区(igg1恒定区)序列相融合,获得15g7嵌合单抗的重链。将15g7轻链的可变区片段和人单抗的恒定区序列(igg1恒定区)相融合,获得15g7嵌合单抗的轻链。
90.5、将pcdna3.1(+)载体(thermo,货号v87020)中限制性内切酶xhoi和noti之间的dna小片段替换为15g7嵌合单抗的重链,限制性内切酶xbai和nhei之间的dna小片段替换为15g7嵌合单抗的轻链,其它序列均不变,得到重组质粒pcdna3.1(+)-15g7。
91.6、将重组质粒pcdna3.1(+)-15g7转染至expicho细胞(thermo,货号为a29133),通过蛋白a亲和吸附纯化获得15g7单抗,即抗ccn1抗体。
92.实施例2、15g7单抗(即实施例1获得的抗ccn1抗体)结合到天然而非变性的ccn1蛋白
93.使用蛋白质印记法检测15g7单抗和ccn1蛋白的结合能力。具体步骤如下:
94.1、取含有3
×
105个ccn1-sp2/0细胞的细胞悬液,300g离心3min,收集细胞沉淀;之后用3ml pbs缓冲液清洗。
95.2、完成步骤1后,加入冰冷的ripa裂解缓冲液,裂解5min,得到裂解液。
96.ripa裂解缓冲液:溶剂及其浓度为150mm nacl(sigma)、5mm edta(sigma)、1%triton x-100(sigma)、1%sodium deoxycholate(sigma)和0.1%sds(sigma),溶剂为ph7.4、50mm tris-hcl缓冲液(sigma);使用时需加入halt
tm
蛋白酶(halt
tm
蛋白酶按照100倍稀释到工作浓度)和磷酸酶抑制剂(thermofisher,货号78446)(halt
tm
磷酸酶抑制剂按照100倍稀释到工作浓度)。
97.3、完成步骤2后,将裂解液和lds样品缓冲液(thermo,货号np0008)等体积混合,得到混合液甲。混合液甲中含有天然构象的ccn1蛋白(简称天然ccn1蛋白)。
98.4、完成步骤2后,将裂解液和预先加入5%β-巯基乙醇(sigma,货号m6250)的lds样品缓冲液等体积混合,得到混合液乙;将混合液乙置于95℃处理10min(目的为ccn1蛋白充分变性),得到混合液甲。混合液丙中含有结构变性的ccn1蛋白(简称变性ccn1蛋白)。
99.5、将步骤3得到的混合液甲或步骤4得到的混合液丙上样至12.5%聚丙烯酰胺凝胶,100伏电压下电泳2h;然后通过电转仪转移到pvdf膜上(恒定电流400ma,1.5h);之后用含有5%牛血清白蛋白的pbs缓冲液(封闭液)封闭pvdf膜,4℃过夜;将浓度为1mg/ml的15g7单抗按照1:1000的体积比用封闭液稀释,然后将室温条件下孵育pvdf膜;用tbst缓冲液(biorad,货号buf028)清洗pvdf膜3次,每次5min;加入1:5000封闭液稀释的抗人fc片段辣根过氧化物酶二抗(jacksonimmunoresearch,货号109-035-098),室温孵育pvdf膜1h;用tbst缓冲液(biorad,货号buf028)清洗pvdf膜1次,每次5min。
100.6、完成步骤5后,加入pierce
tm
eclwestern blotting底物(thermofisher,货号32209),室温孵育1min,用吸水纸吸干多余的底物溶液。
101.7、完成步骤6后,使用暗室显影技术采集化学发光图像。使用imagelab软件(biorad)分析结果。
102.按照上述方法,将15g7单抗替换为sm03,作为阴性对照。
103.检测结果见图2。结果表明,15g7单抗不结合变性ccn1蛋白,仅结合天然ccn1蛋白。
104.实施例3、15g7单抗与ccn1-sp2/0细胞结合且不与sp2/0-ag14细胞结合
105.1、取含有3
×
105个ccn1-sp2/0细胞的细胞悬液,300g离心5min,收集沉淀。
106.2、完成步骤1后,用洗涤液(含1%牛血清白蛋白的磷酸缓冲液)洗涤沉淀2次。每次洗涤的方法为:将沉淀重悬于500μl洗涤液,颠倒混匀,离心,收集沉淀。
107.3、完成步骤2后,将沉淀用4%多聚甲醛固定5min,收集沉淀;用洗涤液洗涤沉淀2次。每次洗涤的方法为:将沉淀重悬于500μl洗涤液,颠倒混匀,离心,收集沉淀。
108.4、完成步骤3后,将沉淀用封闭液(含有3%牛血清白蛋白的磷酸缓冲液)重悬,室温静止20min,离心,收集沉淀;将沉淀重悬于500μl洗涤液,颠倒混匀,离心,收集沉淀。
109.5、完成步骤4后,将沉淀用500μl 15g7单抗稀释液重悬,室温静置30min,离心,收集沉淀;用洗涤液洗涤沉淀2次。每次洗涤的方法为:将沉淀重悬于500μl洗涤液,颠倒混匀,离心,收集沉淀。
110.15g7单抗稀释液:用洗涤液稀释15g7单抗获得;15g7单抗稀释液的浓度为1μg/ml或0.5μg/ml。
111.6、完成步骤5后,向沉淀中加入1:2000倍洗涤液稀释的二抗(jackson immunoresearch,货号609-605-213),室温孵育30min,离心,收集沉淀;用洗涤液洗涤沉淀2次。每次洗涤的方法为:将沉淀重悬于500μl洗涤液,颠倒混匀,离心,收集沉淀。
112.7、完成步骤6后,用磷酸缓冲液重悬沉淀,然后使用滤网将单细胞滤到流式离心管。上机分析10000个细胞的荧光强度分布。
113.按照上述方法,将15g7单抗替换为sm03,其它步骤均不变,作为阴性对照。
114.按照上述方法,将ccn1-sp2/0细胞替换为sp2/0-ag14细胞,其它步骤均不变。
115.检测结果见图3(sp2/0-ccn1-gp1为ccn1-sp2/0细胞,sp2/0为sp2/0-ag14细胞)。结果表明,15g7单抗可以与ccn1-sp2/0细胞结合,但不能与sp2/0-ag14细胞结合。
116.上述结果表明,15g7单抗对ccn1蛋白的结合是特异性的,不与sp2/0-ag14细胞表面的其他蛋白起反应。
117.实施例4、15g7单抗与ccn1-sp2/0细胞表面天然的ccn1蛋白结合
118.1、取含有3
×
105个ccn1-sp2/0细胞的细胞悬液,300g离心5min,收集沉淀;之后用500μl磷酸缓冲液重悬沉淀,得到细胞悬液。
119.2、取10μl步骤1得到的细胞悬液滴加在无菌洁净的玻片上,使用金属浴将玻片用95℃加热5min,蒸干液体,获得变性后的ccn1-sp2/0细胞。
120.3、取10μl步骤1得到的细胞悬液滴加在无菌洁净的玻片上,在超净台中风干液体,获得未变性的ccn1-sp2/0细胞。
121.4、使用4%多聚甲醛固定玻片上的细胞(变性后的ccn1-sp2/0细胞或未变性的ccn1-sp2/0细胞),室温10min,之后用磷酸缓冲液清洗固定后的细胞3次。
122.5、完成步骤4后,将玻片上的细胞置于含有1%牛血清白蛋白的pbst缓冲液,室温孵育2h。
123.pbst缓冲液:含有0.1%吐温20的磷酸缓冲液。
124.6、完成步骤5后,弃溶液,加入浓度为1μg/ml的15g7单抗溶液(用含有1%牛血清白蛋白的pbst缓冲液稀释15g7单抗获得),室温孵育2h;弃溶液,用磷酸缓冲液清洗玻片3次。
125.7、完成步骤6后,弃溶液,加入二抗溶液,室温孵育1h;弃溶液,用磷酸缓冲液清洗玻片3次。
126.二抗溶液:用含有1%牛血清白蛋白的pbst缓冲液按照1:2000倍稀释二抗(jackson immunoresearch,货号609-605-213)获得。
127.8、完成步骤7后,使用dapi(thermofisher,货号d1304)进行染色,室温染色15min
后,弃溶液,用磷酸缓冲液清洗玻片3次。
128.9、使用荧光显微镜观察并拍照。
129.按照上述方法,将15g7单抗替换为sm03,其它步骤均不变,作为阴性对照。
130.检测结果见图4(第一行为未变性的ccn1-sp2/0细胞,第二行为变性后的ccn1-sp2/0细胞,红色为15g7,蓝色为细胞核)。结果表明,加热会破坏ccn1蛋白天然结构,15g7单抗只能够识别未变性的ccn1-sp2/0细胞,不能够识别变性后的ccn1-sp2/0细胞。
131.上述结果表明,15g7单抗只能专一性的识别天然构象的ccn1蛋白。
132.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1