一种副干酪乳杆菌的发酵培养基及其应用的制作方法
1.本发明涉及生物发酵的技术领域,尤其涉及一种副干酪乳杆菌的发酵培养基及其应用。
背景技术:
2.益生菌通常指的是对人类和动物具有有益作用的微生物。益生菌的益生功能研究已经拓展到肠道以外的健康相关的各个方面,是当前基础研究的热点。生活中其应用随处可见,包括食品行业、医药领域、护肤领域。
3.目前国内外对于益生菌的功能特性研究得比较成熟,已知确切功效和潜在功效达十余种之多,其中对益生菌的抗氧化功效也在进行相关研究。2008年,东北农业大学乳品科学教育部重点实验室的孟祥晨教授对40多株益生菌进行抗氧化活性分析,证实大多数益生菌具有抗氧化活性,但种属和菌株差别较大。目前益生菌的抗氧化功效被广泛应用在食品、医药、化妆品领域。
4.专利申请cn103582486a公开了一种具有抗氧化活性的益生菌及其用途。该专利申请涉及一种具有抗氧化活性的组合物,所述组合物包括含至少一种菌株的混合物。研究发现属于选自包含嗜酸乳杆菌、短乳杆菌和乳双歧杆菌种的菌株表现出显著的抗氧化活性,并可应用于医药、食品领域。专利申请cn107058161a公开了一种具有抗氧化功能的高加索酸奶乳杆菌jmcc0101、其筛选方法及应用。此专利申请依次通过样品的采集、富集、分离、纯化、鉴定等实验,最终筛选出高加索酸奶乳杆菌jmcc0101,该菌具有很好的耐酸耐胆盐特性、抗氧化能力、良好的存活性能、弱后酸和发酵风味,因此应用于制备益生菌菌粉或乳酸菌饮料。
5.专利申请cn103937716a公开了一种对慢性酒精肝损伤有保护作用的人源发酵乳杆菌grx07及其应用。此专利申请的发酵乳杆菌grx07具有显著体外抗氧化能力和抑制致病菌能力,并能显著降低慢性酒精性肝损大鼠血脂,血清内毒素水平;降低肝脏炎性因子的表达,缓解肝脏炎症反应;增加肝脏抗氧化特异蛋白nrf2表达量,降低肝细胞凋亡百分数,因而对慢性酒精性肝损伤有显著保护作用。
6.专利申请cn111849836a公开了一种具有抗氧化、延长寿命的鼠李糖乳杆菌及其应用。此专利申请的鼠李糖乳杆菌除具备一般乳酸菌的益生作用,还具有抗氧化活性,能提高动物寿命,可用于健康食品、保健品的生产。
7.专利申请cn111973546a公开了一种抗氧化益生菌面膜及其制备方法,涉及医疗和保健品技术领域,所述面膜包括活性组分、有益组分和水,所述活性组分包括植物乳杆菌“24-7”菌株发酵产物,植物乳杆菌“24-7”发酵原液含有健康肌肤不可或缺的抗氧化酶、游离氨基酸、维生素、有机酸等天然成分,能为帮助皮肤清除剩余自由基,同时还具有保湿、修复、预防衰老之功效。此专利申请未提供有效功效数据,未对使用前后的功效进行对比。
8.专利申请cn112111430a公开了一种抗氧化与抗衰老双效益生菌,该益生菌为植物乳杆菌lactobacillus plantarum h6,能够有效降低体内氧化应激标志物含量,调节抗氧
化相关因子基因表达,治疗、改善或预防氧化引起的组织病变,预防或改善氧化引起的衰老。可应用于食品、药品领域。
9.专利申请cn101333506a公开了一种嗜酸乳杆菌及其抗氧化活性的应用。此专利申请的嗜酸乳杆菌具有较强的抗氧化活性,能够使生物体内的超氧化物歧化酶(sod)、谷胱甘肽过氧化物酶(gsh-px)活力显著提高,并降低生物体内的脂质过氧化物如丙二醛(mda)的含量。此专利申请的嗜酸乳杆菌除了具有一般乳杆菌所具备的对人体健康有益的作用外,还能用于抗氧化功能性产品的生产,可应用于食品领域。
10.专利cn106399162b公开了一种新型副干酪乳杆菌,对大肠杆菌、沙门氏菌和幽门螺旋杆菌均具有明显的抑制作用,尤其对金黄色葡萄球菌的抑制作用更强。所述副干酪乳杆菌对胃酸和胆汁盐的耐受性强,且能在胃酸环境下实现有效增殖。此发明专利的副干酪乳杆菌还具有很强的抗氧化能力,在1.0mmol/l h2o2中仍能保持97.44%的存活率;其发酵上清液和无细胞提取物对羟基自由基的清除率分别高达92.3%和87.1%。可广泛应用于益生菌饮料的制备,能明显增加肠道有益菌的数量,改善胃肠道健康,提高机体免疫力。
11.专利申请cn105853303a公开了一种益生菌芦荟面膜的制备方法,利用库拉索芦荟原汁、葡萄糖、水按照一定配比制备发酵备用液,添加二次活化后的6种益生菌混合制备符合益生菌悬液进行共发酵。6种活性益生菌为长双歧杆菌、短双歧杆菌、青春双歧杆菌、鼠李糖乳杆菌、植物乳杆菌、德氏乳杆菌,比例为1:1:1:1:1:1。本产品采用芦荟益生菌发酵液与化妆品辅助原料按比例混合,加工制作成膏状面膜,经感官指标测试、理化指标测试、皮肤刺激性测试和试用效果测试后,确定本产品的安全性和功能性,实现护肤保健的目的。但抗氧化指标测定结果表明芦荟益生菌发酵液对自由基清除能力较弱;对羟基自由基清除能力、铁离子的螯合能力较强;具有一定的还原力但还原力较弱。
12.专利申请cn111705025公开了一种副干酪乳杆菌的制备及其在衰老方面的应用。所述副干酪乳杆菌菌株分离于百岁老人肠道中,该菌具有较好的耐酸、耐胆盐以及抑菌能力,并且具有较强的dpph自由基、羟自由基清除能力以及较强的fe
2+
螯合能力和抗脂质过氧化能力。本专利申请的副干酪乳杆菌制剂及制备方法,通过抑制有害菌的生成,调节脑肠轴及抗氧化从而延缓机体衰老,主要应用于食品领域。
13.综上所述,目前市场上的抗氧化益生菌产品主要存在以下不足:
14.1.发酵得到的发酵滤液稳定性较差;
15.2.抗氧化益生菌主要应用于食品、医药领域,化妆品领域较少;
16.3.应用于化妆品领域的益生菌缺乏有效功效数据,未对使用前后的功效进行对比;
17.4.一些抗氧化益生菌为多种益生菌的组合。
技术实现要素:
18.为了解决上述问题,本发明提供了一种发酵培养基,并使用所述的发酵培养基发酵生产副干酪乳杆菌发酵滤液,所述的副干酪乳杆菌发酵滤液具有显著的抗氧化功效,可广泛应用于化妆品领域。
19.本发明具体技术方案如下:
20.1.一种副干酪乳杆菌的发酵培养基,其中,所述发酵培养基包含以下成分:麦芽提
取物和氯化钙。
21.2.根据项1所述的发酵培养基,其中,所述麦芽提取物的浓度为0.1-0.9g/l,优选为0.2-0.8g/l,进一步优选为0.5g/l;所述氯化钙的浓度为0.02-0.50g/l,优选为0.05-0.35g/l,进一步优选为0.2g/l。
22.3.根据项1-2任一项所述的发酵培养基,其中,所述发酵培养基还包含如下浓度的各组分:碳源6.00-16.00g/l,优选为8.00-14.00g/l;氮源4-14g/l,优选为6-12g/l;无机盐1.5-12g/l,优选为3-12g/l以及表面活性剂0.10-2.25ml/l,优选为0.30-1.75ml/l;
23.优选的,碳源为葡萄糖;
24.氮源为3.00-9.00g/l的胰蛋白胨和1.00-5.00g/l的酵母粉,优选为4.00-8.00g/l的胰蛋白胨和2.00-4.00g/l的酵母粉;
25.无机盐为0.80-4.00g/l的无水乙酸钠、0.50-4.00g/l的柠檬酸氢二铵、0.10-1.20g/l的七水硫酸镁、0.05-0.85g/l的一水硫酸锰和0.05-0.85g/l的三水合磷酸氢二钾,优选为1.00-3.00g/l的无水乙酸钠、1.00-3.00g/l的柠檬酸氢二铵、0.20-0.87g/l的七水硫酸镁、0.10-0.46g/l的一水硫酸锰和1.00-3.75g/l的三水合磷酸氢二钾;
26.表面活性剂为吐温80。
27.4.项1-3任一项所述的发酵培养基在副干酪乳杆菌发酵中的应用。
28.5.根据项4所述的应用,其中所述副干酪乳杆菌为副干酪乳杆菌(lactobacillus paracasei)ccfm1157,其保藏编号为gdmcc no.61497。
29.6.根据项4-5任一项所述的应用,其中,发酵方法包含下述步骤:
30.将副干酪乳杆菌接种到种子培养基中进行培养,得到种子液;
31.将种子液接种到所述发酵培养基中进行发酵,得到发酵液;
32.将所述发酵液进行离心、过滤处理得到副干酪乳杆菌发酵滤液。
33.7.根据项6所述的应用,其中,种子液的接种量为0.5-5.0%(v/v)。
34.8.根据项6或7所述的应用,其中,发酵温度为25-40℃,优选33-38℃;发酵时间为15-45h,优选20-30h。
35.9.根据项6-8中任一项所述的应用,其中,发酵压力为0.01-0.05mpa。
36.10.根据项6-9中任一项所述的应用,其中,其中,发酵液中的od
600
为2-6,优选为3.0-5.2;发酵液的ph为3-5,优选为3.6-4.2;优选的,发酵液残糖浓度为0-1.0g/l。
37.11.根据项6-10中任一项所述的应用,其中,所述种子液的od
600
在4.0以上,优选为4.3-5.5。
38.12.根据项6-11中任一项所述的应用,其中,在得到种子液的步骤中,其包括将副干酪乳杆菌接种到种子培养基中培养10-20h得到一级种子液,然后将所述一级种子液接种到种子培养基中进行培养得到所述种子液。
39.13.根据项12所述的应用,其中,所述一级种子液的接种量为0.5-5.0%(v/v)。
40.14.根据项6-13中任一项所述的应用,其中,所述种子培养基为mrs培养基。
41.发明的效果
42.利用本发明所述的发酵培养基发酵得到的副干酪乳杆菌发酵滤液具有显著的抗氧化功效,与未添加该产品的空白对照相比,皮肤的角质层含水量提高12%-14%、皮肤弹性提高10%、皮肤棕斑面积显著减少(减少10%-12%),皮肤纹理略有减少,皮肤白度略有
提高,且得到的发酵滤液稳定性好。可应用于化妆品领域,用于皮肤抗氧化产品的研发。
附图说明
43.图1-1是实验例2中不同浓度的实施例2-1所述的发酵滤液的t-aoc抗氧化能力示意图。
44.图1-2是实验例2中不同浓度的实施例2-1所述的发酵滤液的sod酶活性示意图。
45.图1-3是实验例2中实施例2-1所述的发酵滤液和对比例2所述的发酵滤液的t-aoc抗氧化能力的示意图。
46.图1-4是实验例2中实施例2-1所述的发酵滤液和对比例2所述的发酵滤液的sod酶活性的示意图。
47.图2是实验例3中不同浓度的实施例2-1所述的发酵滤液的ros相对荧光强度的示意图。
48.图3是实验例4中不同浓度的实施例2-1所述的发酵滤液的cat活性浓度的示意图。
49.图4-1是实验例5中不同浓度的实施例2-1所述的发酵滤液的nrf2分泌量的示意图。
50.图4-2是实验例5中的实施例2-1所述的发酵滤液和对比例1所述的发酵滤液的nrf2分泌量的示意图。
51.图5是实验例6中人体斑贴实验结果的示意图。
52.图6-1是实验例7中的实施例2-1所述的发酵滤液对皮肤角质层含水量的影响的示意图。
53.图6-2是实验例7中的实施例2-1所述的发酵滤液对皮肤弹性r2值影响的示意图。
54.图6-3是实验例7中的实施例2-1所述的发酵滤液对皮肤棕斑面积影响的示意图。
55.图6-4是实验例7中的实施例2-1所述的发酵滤液对皮肤细纹影响的示意图。
56.图6-5是实验例7中的实施例2-1所述的发酵滤液对肤色白度影响的示意图。
57.图7是实验例8中的稳定性的示意图,其中,a为对比例2所得到的发酵滤液示意图,b为对比例2所得到的发酵滤液在40℃下放置4个月的示意图,c为实施例2-1所得到的发酵滤液的示意图,d为实施例2-1所得到的发酵滤液在40℃下放置4个月的示意图。
58.菌株保藏信息
59.本发明用的菌株副干酪乳杆菌(lactobacillus paracasei)ccfm1157,于2021年2月4日保藏于广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmcc no:61497,保藏地址:广州市先烈中路100号大院59号楼5楼,邮编:510070,电话:020-87137633 37656629。
具体实施方式
60.下面结合附图所描述的实施方式对本发明做以详细说明,其中所有附图中相同的数字表示相同的特征。虽然附图中显示了本发明的具体实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
61.需要说明的是,在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可以理解,技术人员可能会用不同名词来称呼同一个组件。本说明书及权利
要求并不以名词的差异作为区分组件的方式,而是以组件在功能上的差异作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”或“包括”为开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本发明的较佳实施方式,然而所述描述乃以说明书的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
62.本发明提供了一种副干酪乳杆菌的发酵培养基,其中,所述发酵培养基包含以下成分:麦芽提取物和氯化钙。
63.所述麦芽提取物是一种完全源自谷物的天然原料,它含有丰富的麦芽糖、果糖、葡萄糖、蛋白质、小分子肽、人体必须的氨基酸和多种维生素、矿物质,还含有具有保健功能的β-葡聚糖和生育酚,所述麦芽提取物是以精选优质大麦芽(大麦)为原料,经粉碎、酶解后制成麦汁,再经过过滤、真空浓缩,制得液体麦芽提取物,液体麦芽提取物经过带式真空干燥、粉碎后得到固体麦芽提取物。
64.在一个实施方案中,所述麦芽提取物的浓度为0.1-0.9g/l,优选为0.2-0.8g/l,进一步优选为0.5g/l;所述氯化钙的浓度为0.02-0.50g/l,优选为0.05-0.35g/l,进一步优选为0.2g/l。
65.例如,所述麦芽提取物的浓度可以为0.1g/l、0.2g/l、0.3g/l、0.4g/l、0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l等;所述氯化钙的浓度可以为0.02g/l、0.05g/l、0.1g/l、0.15g/l、0.2g/l、0.25g/l、0.3g/l、0.35g/l、0.50g/l等。
66.在一个实施方案中,所述发酵培养基还包含如下浓度的各组分:碳源6.00-16.00g/l,优选为8.00-14.00g/l;氮源4-14g/l,优选为6-12g/l;无机盐1.5-12g/l,优选为3-12g/l以及表面活性剂0.10-2.25ml/l,优选为0.30-1.75ml/l;
67.优选的,碳源为葡萄糖;
68.氮源为3.00-9.00g/l的胰蛋白胨和1.00-5.00g/l的酵母粉,优选为4.00-8.00g/l的胰蛋白胨和2.00-4.00g/l的酵母粉;
69.无机盐为0.80-4.00g/l的无水乙酸钠、0.50-4.00g/l的柠檬酸氢二铵、0.10-1.20g/l的七水硫酸镁、0.05-0.85g/l的一水硫酸锰和0.05-0.85g/l的三水合磷酸氢二钾,优选为1.00-3.00g/l的无水乙酸钠、1.00-3.00g/l的柠檬酸氢二铵、0.20-0.87g/l的七水硫酸镁、0.10-0.46g/l的一水硫酸锰和1.00-3.75g/l的三水合磷酸氢二钾;
70.表面活性剂为吐温80。
71.本发明通过使用上述所述的发酵培养基进行发酵,能够使所得到的发酵滤液比较稳定,从而可以应用于化妆品领域。
72.本发明提供了上述所述的发酵培养基在副干酪乳杆菌发酵中的应用。
73.在一个实施方案中,所述副干酪乳杆菌为副干酪乳杆菌(lactobacillus paracasei)ccfm1157,其保藏编号为gdmcc no.61497。
74.在一个实施方案中,发酵方法包含下述步骤:
75.将副干酪乳杆菌接种到上述所述的发酵培养基中进行发酵,得到发酵液;
76.将所述发酵液进行离心、过滤处理得到副干酪乳杆菌发酵滤液。
77.所述种子培养基指的是供微生物生长和大量繁殖,并使菌体处于分裂繁殖旺盛阶段,成为活力强的“种子”。
78.本发明采用上述所述的发酵培养基,能够使所得的发酵液比较稳定,从而可以应用于化妆品领域。
79.在一个实施方案中,种子液的接种量为0.5-5.0%(v/v)。
80.所述接种量是指移入种子液的体积和接种后培养液体积的比例。例如,种子液的接种量可以为0.5%(v/v)、1%(v/v)、1.5%(v/v)、2%(v/v)、2.5%(v/v)、3%(v/v)、3.5%(v/v)、4%(v/v)、4.5%(v/v)、5%(v/v)等。
81.在一个实施方案中,发酵温度为25-40℃,优选为33-38℃;优选的,发酵时间为15-45h,优选为20-30h。
82.例如,发酵温度可以为25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃等;
83.发酵时间可以为15h、20h、25h、30h、35h、40h、45h等。
84.在一个实施方案中,发酵压力为0.01-0.05mpa。
85.本发明所述的发酵压力指的是在发酵容器中的压力,例如,当使用发酵罐进行发酵时,指的是发酵罐中的压力。
86.所述发酵压力例如可以为0.01mpa、0.02mpa、0.03mpa、0.04mpa、0.05mpa等。
87.在一个实施方案中,发酵液中的od
600
为2.0-6.0,优选为3.0-5.2;优选的,发酵液的ph为3.0-5.0,优选为3.6-4.2;优选的,发酵液残糖浓度为0-1.0g/l。此时,副干酪乳杆菌发酵充分,基本耗尽了培养基中的营养物质,获得的产品功效较为显著。
88.例如,发酵液中的od
600
可以为2.0、3.0、4.0、4.5、5.0、5.2、6.0等;
89.发酵液的ph可以为5.0、4.2、4.0、3.8、3.6、3.0等;
90.发酵液的残糖浓度可以为0.1g/l、0.2g/l、0.5g/l、0.8g/l、1.0g/l等。
91.在一个实施方案中,所述种子液的od
600
在4.0以上,优选为4.3-5.5。此时,种子液处于对数期中后期,活力旺盛且能保证后续的接种量。
92.在一个实施方案中,在得到种子液的步骤中,其包括将副干酪乳杆菌接种到种子培养基中培养10-20h得到一级种子液,然后将所述一级种子液接种到种子培养基中进行培养得到所述种子液。
93.具体地,其是先将单株副干酪乳杆菌接种到种子培养基中进行培养,优选在37℃下培养10-20h得到一级种子液,然后将得到的一级种子液再次接种到新鲜的种子培养基中进行培养,优选在37℃下培养10-20h得到所述的种子液。
94.在一个实施方案中,所述一级种子液的接种量为0.5-5.0%(v/v)。
95.例如,所述一级种子液的接种量可以为0.5%(v/v)、1%(v/v)、1.5%(v/v)、2%(v/v)、2.5%(v/v)、3%(v/v)、3.5%(v/v)、4%(v/v)、4.5%(v/v)、5%(v/v)等。
96.在一个实施方案中,所述种子培养基为mrs培养基,例如包含以下浓度的组分的mrs培养基:葡萄糖20.00g/l、胰蛋白胨10.00g/l、酵母粉5.00g/l,无水乙酸钠2.00g/l、柠檬酸氢二铵2.00g/l、七水硫酸镁0.58g/l、一水硫酸锰0.25g/l、三水合磷酸氢二钾2.60g/l和吐温80 1.00ml/l。
97.在一个实施方案中,所述副干酪乳杆菌发酵滤液包含以下组分:蛋白质、糖、氨基酸、乙酸、乳酸、维生素b6、维生素pp和叶酸。
98.在一个实施方案中,各组分的浓度如下:蛋白质66.00-85.00mg/l、糖1.45-2.80g/
l、氨基酸1.50-2.10g/l、乙酸1.70-2.20g/l、乳酸6.10-8.30g/l、维生素b6 0.60-1.00mg/l、维生素pp 2.50-3.40mg/l和叶酸2.70-3.40μg/l。
99.本发明使用上述所述的发酵培养基制备得到的副干酪乳杆菌发酵滤液具有显著的抗氧化功效,并且所述的发酵滤液比较稳定,其可以用于化妆品领域,并且与未添加本发明所述的发酵滤液的空白对照相比,皮肤的角质层含水量提高12%-14%、皮肤弹性提高10%、皮肤棕斑面积显著减少(减少10%-12%),皮肤纹理略有减少,皮肤白度略有提高。
100.其中,在将副干酪乳杆菌接种到种子培养基之前,需要对种子培养基进行灭菌,灭菌方法是本领域技术人员公知的,例如,所述种子培养基为mrs培养基,例如将种子培养基的各种组分(蛋白胨、酵母粉、七水硫酸镁、一水硫酸锰、吐温80、柠檬酸氢二铵、三水磷酸氢二钾等)加入到水中溶解调ph 6.2~6.4,分装,葡萄糖按照一定浓度配制母液,单独分装,115~121℃灭菌15~25min后,冷却后将葡萄糖按照相应的比例加入培养基中。
101.在一个实施方案中,在将种子液接种到发酵培养基之前,需要将发酵培养基进行灭菌,灭菌方法是本领域技术人员公知的,例如,将发酵培养基的各种组分(葡萄糖单独称量,放入灭菌锅中115~121℃灭菌15~25min,接种前加入发酵罐中)加入到加入发酵罐中,升温至30~40℃,开启搅拌充分溶解培养基。随后通入蒸汽灭菌,培养基灭菌条件为115℃左右,灭菌20min。
102.在一个实施方案中,对于所得到的发酵液进行离心、过滤处理,离心和过滤处理方法对于本领域技术人员来说是已知的,其可以根据需要进行选择。
103.在一个实施方案中,当进行后续人体皮肤功效测试实验时,可以在所得到的副干酪乳杆菌发酵滤液中加入具有防腐作用的成分进行实验。
104.所述具有防腐作用的成分例如可以是丁二醇、戊二醇、乙基己基甘油、苯氧乙醇、山梨酸钾、苯甲酸钠和辛甘醇中的一种或几种的组合物。
105.本发明提供了上述所述的方法制备得到的副干酪乳杆菌发酵滤液在化妆品领域中的应用。
106.本发明提供了一种化妆品组合物,其包含上述所述的方法制备得到的副干酪乳杆菌发酵滤液。
107.在一个实施方案中,所述组合物还包括辅料。
108.所述辅料是本领域技术人员公知的用于化妆品领域的辅料,例如,所述辅料可以为1,3丁二醇、戊二醇、乙基己基甘油、山梨酸钾、苯甲酸钠等。
109.本发明提供了一种副干酪乳杆菌发酵滤液,其包含以下组分:蛋白质、糖、氨基酸、乙酸、乳酸、维生素b6、维生素pp和叶酸。
110.在一个实施方案中,各组分的浓度如下:蛋白质66.00-85.00mg/l、糖1.45-2.80g/l、氨基酸1.50-2.10g/l、乙酸1.70-2.20g/l、乳酸6.10-8.30g/l、维生素b6 0.60-1.00mg/l、维生素pp 2.50-3.40mg/l和叶酸2.70-3.40μg/l。
111.在一个实施方案中,所述发酵滤液由上述所述的方法制备得到。
112.实施例
113.本发明对试验中所用到的材料以及试验方法进行一般性和/或具体的描述,在下面的实施例中,如果无其他特别的说明,%表示wt%,即重量百分数。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
114.实施例1-1发酵培养基的制备
115.碳源为11.00g/l葡萄糖,麦芽提取物0.5g/l,氯化钙0.2g/l
116.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.50g/l,
117.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.5g/l,
118.表面活性剂为吐温80 0.90ml/l,
119.按照上述配方称量培养基(葡萄糖单独称量,放入灭菌锅中118℃灭菌15min,接种前加入发酵罐中),加入发酵罐中,用磷酸/氢氧化钠溶液调ph值为6.8,升温至30℃,开启搅拌充分溶解培养基。随后通入蒸汽灭菌,培养基灭菌条件为115℃左右,灭菌20min。
120.实施例1-2发酵培养基的制备
121.碳源为葡萄糖14.00g/l,
122.麦芽提取物0.8g/l,氯化钙0.35g/l
123.氮源为胰蛋白胨和酵母粉,胰蛋白胨8.00g/l,酵母粉4.00g/l;
124.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠3.00g/l,柠檬酸氢二铵3.00g/l,七水硫酸镁0.87g/l,一水硫酸锰0.46g/l,三水合磷酸氢二钾3.75g/l,
125.表面活性剂为吐温80 1.75ml/l,灭菌方法与实施例1-1相同
126.实施例1-3发酵培养基的制备
127.碳源为葡萄糖8.00g/l,
128.麦芽提取物0.2g/l,氯化钙0.05g/l
129.氮源为胰蛋白胨和酵母粉,胰蛋白胨4.00g/l,酵母粉2.00g/l;
130.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.00g/l,柠檬酸氢二铵1.00g/l,七水硫酸镁0.20g/l,一水硫酸锰0.10g/l,三水合磷酸氢二钾1.00g/l,
131.表面活性剂为吐温80 0.30ml/l,灭菌方法与实施例1-1相同。
132.实施例1-4发酵培养基的制备
133.碳源为11.00g/l葡萄糖,麦芽提取物0.2g/l,氯化钙0.2g/l
134.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.50g/l,
135.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.5g/l,
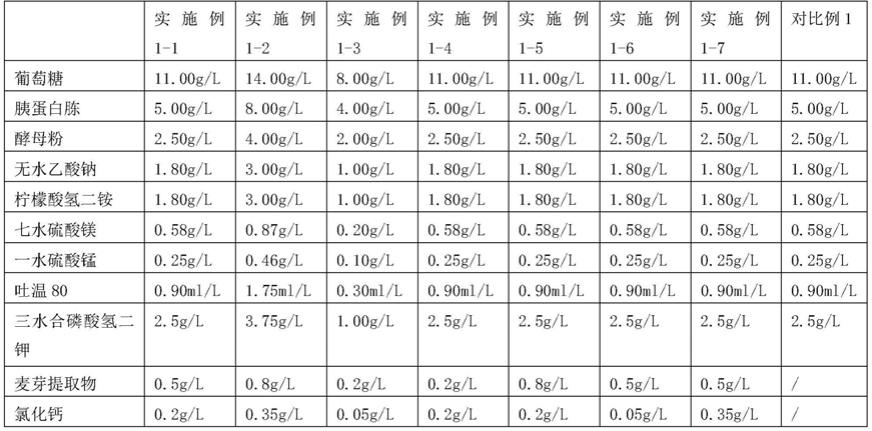
136.表面活性剂为吐温80 0.90ml/l,按照与实施例1-1相同的方法进行灭菌。
137.实施例1-5发酵培养基的制备
138.碳源为11.00g/l葡萄糖,麦芽提取物0.8g/l,氯化钙0.2g/l
139.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.50g/l,
140.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.5g/l,
141.表面活性剂为吐温80 0.90ml/l,灭菌方法与实施例1-1相同。
142.实施例1-6发酵培养基的制备
143.碳源为11.00g/l葡萄糖,麦芽提取物0.5g/l,氯化钙0.05g/l
144.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.50g/l,
145.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.5g/l,
146.表面活性剂为吐温80 0.90ml/l,灭菌方法与实施例1-1相同。
147.实施例1-7发酵培养基的制备
148.碳源为11.00g/l葡萄糖,麦芽提取物0.5g/l,氯化钙0.35g/l
149.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.50g/l,
150.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.5g/l,
151.表面活性剂为吐温80 0.90ml/l,灭菌方法与实施例1-1相同。
152.对比例1发酵培养基的制备
153.碳源为葡萄糖11.00g/l;
154.氮源为胰蛋白胨和酵母粉,胰蛋白胨5.00g/l,酵母粉2.5g/l;
155.无机盐为无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰和三水合磷酸氢二钾,其中,无水乙酸钠1.80g/l,柠檬酸氢二铵1.80g/l,七水硫酸镁0.58g/l,一水硫酸锰0.25g/l,三水合磷酸氢二钾2.50g/l,
156.表面活性剂为吐温80 0.90ml/l,灭菌方法与实施例1-1相同。
157.表1实施例1-1至1-7和对比例1中发酵培养基的组分的比例表
[0158][0159]
实施例2-1副干酪乳杆菌发酵滤液的制备:
[0160]
1.种子液培养:
[0161]
(1)种子液培养基配方如下:葡萄糖20.00g/l、胰蛋白胨10.00g/l,酵母粉5.00g/l、无水乙酸钠2.00g/l、柠檬酸氢二铵2.00g/l、七水硫酸镁0.58g/l、一水硫酸锰0.25g/l、
三水合磷酸氢二钾2.60g/l和吐温80 1.00ml/l。
[0162]
(2)灭菌:按照种子液培养基配方将蛋白胨、酵母粉、七水硫酸镁、一水硫酸锰、吐温80、柠檬酸氢二铵、三水磷酸氢二钾等加入到纯化水中溶解调ph6.2,分装,葡萄糖按照一定浓度配制母液,单独分装,115℃灭菌20min后,冷却后将葡萄糖按照相应的比例加入培养基中。
[0163]
(3)培养:在超净台内,取一支副干酪乳杆菌ccfm1157菌种,接入种子培养基中,37℃下静置培养12h,获得一级种子,按2%接种量将一级种子接种于种子培养基中,35℃静置培养18h,od
600
达到4.5,获得种子液。
[0164]
2.发酵培养:
[0165]
(1)接种:取培养好的副干酪乳杆菌种子液(od
600
为4.5)进行火焰接种,接种到实施例1-1所述的发酵培养基中,接种时,先接入灭菌好的葡萄糖溶液,再将种子液以1.0%(v/v)的接种量接入发酵罐,关闭门窗,保持空气不流动。
[0166]
(2)发酵培养:接种完毕,设置培养温度36℃,发酵罐转速为60rpm左右,通入无菌空气保持罐内压为0.04mpa左右,关闭进气、排气。培养30h,od600达到3.72,ph降至3.82,残糖降至0.06g/l,结束发酵得到发酵液。
[0167]
3.发酵液离心、过滤
[0168]
(1)设备、管道准备:中转料车、离心机、中转罐1#、中转罐2#、缓冲罐等相应设备、管道等提前加碱水灭菌、清洗干净。
[0169]
(2)离心:发酵结束后,打开相应阀门将发酵液打入管式离心机中进行离心,进料速度200l/h,分别收集上清液及菌体,将上清液打入中转罐1#中等待过滤,菌体灭活处理后废弃。
[0170]
(3)试漏、铺板:在板框过滤机上安装好孔径为0.8μm的过滤纸板,纯化水试漏,正常维持在0.13mpa,试漏正常后,用纯水混匀珍珠岩对过滤机进行铺板。
[0171]
(4)过滤:打开进气阀门,升高中转罐1#压力至0.05mpa左右,打开相应阀门,将中转罐1#中发酵液经过过滤机过滤到中转罐2#中。根据过滤速度逐步提升中转罐1#压力。过滤结束之后直接向中转罐2#中加入硅藻土,开启搅拌混匀,用纯划水将中转罐1#清洗干净。中转罐2#通入空气升压,打开相应阀门,将中转罐2#中的发酵液再次过滤到中转罐1#中。过滤结束后,将中转罐1#升压,将其中的发酵清液(此时为淡黄色透亮液体)通过过滤机过滤到缓冲罐中得到副干酪乳杆菌发酵滤液。
[0172]
4.配料
[0173]
用6m氢氧化钠溶液调节发酵滤液ph值,最终ph调至4.90左右。
[0174]
5.除菌灌装
[0175]
将灌装发酵滤液用白桶及桶盖清洗干净,置于消毒间臭氧灭菌。将0.22μm滤芯安装到过滤器上,与缓冲罐连接好。将缓冲罐升压至0.05mpa左右,打开灌装阀门,发酵滤液经0.22μm滤芯过滤除菌后灌装到pp塑料桶中,每桶灌装20l。灌装过程应在d级洁净区的层流罩下进行,得到副干酪乳杆菌发酵滤液,其中,蛋白质含量的测定采用考马斯亮蓝法,
[0176]
糖类含量测定采用苯酚-硫酸法,
[0177]
氨基酸含量测定采用日立la8080超高速全自动氨基酸分析仪、乙酸含量的测定采用高效液相色谱仪检测(冯向东.高效液相色谱法测定白酒中乳酸和乙酸含量[j].酿酒科
技,2009,2009(005):115-116.),
[0178]
乳酸含量的测定采用gb5009.157—2016中的方法,
[0179]
维生素b6含量的测定采用gb 5009.154-2016 1st method第一法,
[0180]
维生素pp含量的测定采用gb 5009.89-2016 2nd method第二法,
[0181]
叶酸含量的测定采用gb 5009.211-2014,测得蛋白质含量71.30mg/l、糖类含量1.78g/l、氨基酸含量2.02g/l、乙酸含量2.10g/l、乳酸含量8.10g/l、维生素b6含量0.91mg/l、维生素pp含量3.23mg/l以及叶酸含量3.33μg/l。
[0182]
实施例2-2副干酪乳杆菌发酵滤液的制备
[0183]
1.种子液培养
[0184]
种子液培养基配方、灭菌和培养与实施例1相同。
[0185]
2.发酵培养:
[0186]
(1)接种:取培养好的副干酪乳杆菌种子液(od
600
为4.5)进行火焰接种,接种到实施例1-2所述的发酵培养基中,接种时,先接入灭菌好的葡萄糖溶液,再将种子液以5%(v/v)的接种量接入发酵罐,关闭门窗,保持空气不流动。
[0187]
(2)发酵培养:接种完毕,设置培养温度38℃,发酵罐转速为60rpm左右,通入无菌空气保持罐内压为0.01mpa左右,关闭进气、排气。培养20h,od
600
达到3.90,ph降至3.65,残糖降至1.0g/l,结束发酵得到发酵液。
[0188]
3.发酵液离心、过滤、配料以及除菌灌装与实施例1相同,所得到的发酵液按照实施例1的方法测定,得到蛋白质含量83.65mg/l、糖类含量2.75g/l、氨基酸含量1.88g/l、乙酸含量1.94g/l、乳酸含量7.53g/l、维生素b6含量0.80mg/l、维生素pp含量2.79mg/l以及叶酸含量3.05μg/l。
[0189]
实施例2-3副干酪乳杆菌发酵滤液的制备
[0190]
1.种子液培养
[0191]
种子液培养基配方、灭菌和培养与实施例1相同。
[0192]
2.发酵培养:
[0193]
(1)接种:取培养好的副干酪乳杆菌种子液(od
600
为4.5)进行火焰接种,接种到实施例1-3所述的发酵培养基中,接种时,先接入灭菌好的葡萄糖溶液,再将种子液以0.5%(v/v)的接种量接入发酵罐,关闭门窗,保持空气不流动。
[0194]
(2)发酵培养:接种完毕,设置培养温度33℃,发酵罐转速为60rpm左右,通入无菌空气保持罐内压为0.05mpa左右,关闭进气、排气。培养30h,od
600
达到3.1,ph降至3.94,残糖降0.05g/l,结束发酵得到发酵液。
[0195]
3.发酵液离心、过滤、配料以及除菌灌装与实施例1相同,所得到的发酵液按照实施例1的方法测定,得到蛋白质含量66.94mg/l、糖类含量1.52g/l、氨基酸含量1.76g/l、乙酸含量1.74g/l、乳酸含量6.80g/l、维生素b6含量0.76mg/l、维生素pp含量2.58mg/l以及叶酸含量2.76μg/l。
[0196]
实施例2-4副干酪乳杆菌发酵滤液的制备
[0197]
使用实施例1-4的发酵培养基进行发酵,发酵方法以及所得到的发酵液的测定按照实施例1的方法进行,得到蛋白质含量69.12mg/l、糖类含量1.63g/l、氨基酸含量1.93g/l、乙酸含量1.87g/l、乳酸含量7.09g/l、维生素b6含量0.83mg/l、维生素pp含量3.12mg/l以
及叶酸含量3.10μg/l。
[0198]
实施例2-5副干酪乳杆菌发酵滤液的制备
[0199]
使用实施例1-5所述的发酵培养基进行发酵,发酵方法以及所得到的发酵液的测定按照实施例1的方法进行,得到蛋白质含量68.54mg/l、糖类含量1.59g/l、氨基酸含量1.80g/l、乙酸含量1.82g/l、乳酸含量7.30g/l、维生素b6含量0.69mg/l、维生素pp含量2.97mg/l以及叶酸含量2.94μg/l。
[0200]
实施例2-6副干酪乳杆菌发酵滤液的制备
[0201]
使用实施例1-6所述的发酵培养基进行发酵,发酵方法以及所得到的发酵液的测定按照实施例1的方法进行,得到蛋白质含量67.93mg/l、糖类含量1.69g/l、氨基酸含量1.58g/l、乙酸含量2.02g/l、乳酸含量7.71g/l、维生素b6含量0.88mg/l、维生素pp含量3.01mg/l以及叶酸含量2.85μg/l。
[0202]
实施例2-7副干酪乳杆菌发酵滤液的制备
[0203]
使用实施例1-7所述的发酵培养基进行发酵,发酵方法以及所得到的发酵液的测定按照实施例1的方法进行,得到蛋白质含量70.52mg/l、糖类含量1.73g/l、氨基酸含量1.67g/l、乙酸含量1.86g/l、乳酸含量7.43g/l、维生素b6含量0.71mg/l、维生素pp含量2.65mg/l以及叶酸含量2.77μg/l。
[0204]
对比例2副干酪乳杆菌发酵滤液的制备
[0205]
1.种子液培养:
[0206]
(1)种子液培养基配方与实施例1相同。
[0207]
(2)灭菌与实施1相同。
[0208]
(3)培养:在超净台内,取一支副干酪乳杆菌ccfm1157菌种,接入种子培养基中,37℃下静置培养12h,获得一级种子,按2%接种量将一级种子接种于种子培养基中,37℃静置培养18h,od
600
达到4.5,获得种子液。
[0209]
2.发酵培养:
[0210]
(1)接种:按照与实施例1相同的方法接种到对比例1所述的发酵培养基中。
[0211]
(2)发酵培养:接种完毕,设置培养温度36℃,发酵罐转速为60rpm左右,通入无菌空气保持罐内压为0.04mpa左右,关闭进气、排气。培养30h,od
600
达到4.24,ph降至3.84,残糖降至0.95g/l,结束发酵得到发酵液。
[0212]
3.发酵液离心、过滤、配料以及除菌灌装与实施例1相同,所得到的发酵液按照实施例1的方法测定,得到蛋白质含量66.31mg/l、糖类含量1.58g/l、氨基酸含量1.44g/l、乙酸含量1.70g/l、乳酸含量5.78g/l、维生素b6含量0.62mg/l、维生素pp含量2.31mg/l以及叶酸含量2.06μg/l。
[0213]
实验例1 mtt法验证其抗氧化功效(采用h2o2诱导损伤):
[0214]
mtt法检测细胞活率:细胞处理后,弃去培养基,添加无血清培养基配置的mtt工作液,37℃孵育2~4h,弃去mtt工作液,每孔添加150μl dmso,震荡5min后,用酶标仪检测570nm处吸光度(od值),根据公式计算细胞存活率。计算公式如下:
[0215]
细胞存活率=(实验组-空白组)/(正常对照组-空白组)
[0216]
细胞处理h2o2模型:将hacat细胞(中国典型培养物保藏中心)接种于96孔板培养24h后,更换含50μm h2o2的完全培养基处理细胞1h,更换含实施例2-1所得到的副干酪乳杆
菌发酵滤液的完全培养基继续培养24h,mtt法检测细胞存活率,其结果如表2所示。
[0217]
表2 mtt法检测的细胞存活率
[0218][0219]
其中,正常对照为纯培养基。
[0220]
从上述可以看出,使用副干酪乳杆菌发酵滤液的完全培养基继续培养细胞后,对h2o2处理细胞造成的氧化损伤具有明显的修复效果,细胞存活率显著提高,并且具有浓度依赖性,发酵滤液浓度越低,细胞存活率越高。
[0221]
实验例2 t-aoc和sod的测定
[0222]
将hacat细胞接种于6孔板(细胞数:105个/孔)培养24h后,除正常对照组外其他各组更换含50μm h2o2的完全培养基处理细胞1h,将不同比例的实施例2-1所述的副干酪乳杆菌发酵上清与完全培养基混合,并各吸取100μl分别培养经h2o2处理过的hacat细胞24h,正常对照组(不使用h2o2处理hacat细胞)及模型组(使用h2o2处理的hacat细胞)添加100μl的完全培养基,阳性对照组将500μg/ml的维生素溶液与完全培养基混合(5%:95%),并吸取100μl分别培养经h2o2处理过的hacat细胞24h。每组设置5个复孔。pbs溶液洗涤细胞两次,然后将细胞刮入4℃pbs溶液中。超声以充分破碎细胞并释放其中氧化物质,4℃12000g离心5min,-80℃保存上清待测。t-aoc、sod使用测定试剂盒(南京森贝伽生物科技有限公司)进行测定,其结果分别如图1-1和图1-2所示,其中,t-aoc法又称abts法。abts+是一种能够相对稳定存在于水溶液中的自由基,其可以通过电子转移被清除。由于不易受外界因素干扰,abts+法能够较为准确地体现样品的抗氧化活性。
[0223]
其中,将实施例2-1和对比例2的t-aoc抗氧化能力和sod酶活性的进行了比较,其结果分别如图1-3和图1-4所示,其中,发酵滤液的浓度为2.5%,正常对照为纯培养基,阳性对照为含25μg/ml 5%的维生素c,优化前的发酵滤液代表的是对比例2所述的发酵滤液,优化后的发酵滤液代表的是实施例2-1所述的发酵滤液。
[0224]
从图1-1可以看出,根据高中低浓度进行定量分析得出,5%的发酵滤液的t-aoc含量最高,与阳性对照组相比,差异具有明显显著性(p《0.01),如图1-1所示,*表示与阳性对照组相比p《0.05,**表示与阳性对照组相比p《0.01。
[0225]
从图1-2可以看出,常规hacat细胞的sod酶活性浓度为275.926u/l。5%、2.5%、0.5%浓度的实施例2-1的发酵滤液处理24h后的sod酶活性浓度分别为987.037u/l、896.914u/l和717.901u/l,说明发酵滤液较正常对照组能够显著提高细胞内sod酶活性,5%、2.5%、0.5%分别提高了257.72%、225.06%、160.18%。与正常对照组相比,差异具有明显显著性,如图1-2所示,**表示与正常对照组相比p《0.01
[0226]
从图1-3可以看出,虽然优化前后的发酵滤液均具有良好的抗氧化功效,同时能以抗氧化的方式来保护hacat细胞,但优化后的发酵滤液比优化前的发酵滤液的抗氧化功效略有增加,但差异不显著。
[0227]
从图1-4可以看出,与正常对照组相比,添加发酵滤液细胞培养后相比常规hacat
细胞均有明显的提高,且优化后的效果更显著。与优化前相比,差异具有明显显著性(p《0.01),如图1-4所示,**表示与优化前相比p《0.01
[0228]
实验例3 ros测定
[0229]
取对数生长期的hacat细胞,消化后调整细胞密度为3
×
106ml-1
,接种培养24h;分别设置正常对照组(不使用h2o2处理hacat细胞),模型组(使用h2o2处理的hacat细胞),阳性对照组以及实验组;除正常对照组外,其他各组均加入50μm h2o2,作用1h;然后洗去双氧水,正常对照组及模型组加入完全培养基,阳性对照组加入终浓度为25μg/ml维生素c,实验组使用实施例2-1所述的发酵滤液给药干预24h后,弃上清,消化细胞,以800r
·
min-1
离心5min,收集细胞沉淀物;重悬细胞后pbs洗3次,用荧光分光光度计检测各组荧光强度(激发波长485nm、发射波长535nm)。细胞内ros水平以dcfh-da相对荧光强度表示,相对荧光强度(%)=实验组荧光强度/正常对照组荧光强度
×
100%,其结果如图2所示。
[0230]
从图2可以看出,与正常对照组比较,氧化损伤阳性对照组细胞内ros的荧光强度显著升高,差异具有明显显著性(p《0.01)。与阳性对照组比较,各实验组的ros荧光强度均显著降低,差异具有明显显著性(p《0.01)。如图2所示,**表示与正常对照组/阳性对照组相比p《0.01。5%、2.5%、0.5%的实施例2-1的发酵滤液能明显改善h2o2诱导的hacat细胞氧化损伤程度,说明本发明所述的发酵滤液能够改善h2o2诱导的hacat细胞氧化损伤程度。
[0231]
实验例4 cat测定
[0232]
选取生长状态良好的hacat细胞,将hacat细胞按照106个/孔接种于10cm培养皿中,每孔8ml,将10cm培养皿置于37℃、气相含5%(v/v)co2的细胞培养箱中培养24h;分别设置正常对照组(不使用h2o2处理hacat细胞),模型组(使用h2o2处理hacat细胞),阳性对照组以及实验组;除正常对照组外其他各组更换含50μm h2o2的完全培养基处理细胞1h;正常对照组及模型组加入完全培养基,阳性对照组加入终浓度为25μg/ml维生素c,实验组加入质量分数5%、2.5%、0.5%的实施例1所述的副干酪乳杆菌发酵滤液再次培养24h。洗涤细胞两次,然后将细胞刮入4℃pbs溶液中。超声以充分破碎细胞并释放其中氧化物质,4℃12000g离心5min,-80℃保存上清待测。cat使用bca蛋白定量试剂盒(碧云天p0009)进行测定,其结果如图3所示。
[0233]
从图3可以看出,与阳性对照组比较,5%的实施例2-1的发酵滤液能够显著提高细胞中的cat活性,差异具有显著性(p《0.05),如图3所示,*表示与阳性对照组相比p《0.05。说明本发明所述的发酵滤液能对抗h2o2诱导的hacat细胞氧化损伤,对h2o2产生的细胞毒性具有一定的保护作用。
[0234]
实验例5 nrf2/ho-1信号通路相关细胞因子分泌量的检测
[0235]
elisa试剂盒法:h2o2处理hacat细胞的具体操作方法同实验例2,洗涤细胞两次,然后将细胞刮入4℃pbs溶液中。通过反复冻融的方法处理细胞悬浮液以破坏细胞。4℃1000
×
g离心5min,-80℃保存上清待测。nrf2/ho-1使用elisa测定试剂盒(南京森贝伽生物科技有限公司)进行测定,其结果如图4-1所示,其中,正常对照及模型组为纯培养基;阳性对照为含25μg/ml的维生素c。
[0236]
将实施例2-1和对比例2的nrf2细胞分泌量进行了比较,其结果如图4-2所示,其中,优化前的代表的是对比例2所述的发酵滤液,优化后的代表的是实施例2-1所述的发酵滤液。
[0237]
从图4-1可以看出,实施例2-1中的发酵滤液的高中低三组浓度能明显促进hacat细胞分泌nrf2的量,与正常对照组和阳性对照组相比,2.5%更能促进细胞分泌nrf2。与阳性对照组相比,差异具有显著性(p《0.01,p《0.05),其中,*表示与阳性对照组相比p《0.05,**表示与阳性对照组相比p《0.01。
[0238]
从图4-2可以看出,实施例2-1和对比例2的发酵滤液均能够激活hacat细胞分泌nrf2的量,也能提高分泌nrf2能力,从而明显缓解和修复h2o2诱导的hacat细胞氧化造成的伤害,但优化前后相比,优化后提高分泌nrf2能力更强,进一步验证了优化后的发酵滤液抗氧化功效有一定的提高。与优化前相比,差异具有明显显著性(p《0.01),其中,**表示与优化前相比p《0.01
[0239]
实验例6人体斑贴实验
[0240]
斑贴测试志愿者:人数54人,年龄20~41岁,4名男性50名女性;
[0241]
受试物:将实施例2-1所得到的发酵滤液用去离子水稀释至10%
[0242]
阴性对照:去离子水
[0243]
斑贴试验流程:
[0244]
1.试验部位:前臂屈侧的正常皮肤。
[0245]
2.去除斑试器(8mm finn chamber)的保护纸、将准备好的实施例1的发酵滤液置于铝制斑试器内,斑试物添加量为0.02ml。
[0246]
3.将加有斑试物的斑试器贴敷于受试者前臂,用手掌轻压以使之均匀地贴敷于皮肤上,并用标记笔标记斑贴部位。
[0247]
4.斑贴试验时间:48小时。
[0248]
5.观察结果时间:贴敷后48小时,首先去除斑试器,为避免斑试器压迫皮肤所可能造成的反应,应在去除斑试器至少30分钟后观察结果,其结果如图5所示。
[0249]
从图5可以看出,浓度10%的发酵滤液斑贴实验结果表明皮肤无任何不良反应,结果表明10%的发酵滤液外用对人体皮肤无伤害。
[0250]
实验例7人体皮肤功效测试
[0251]
采用半脸对照的方法,左右半脸分别使用添加抗氧化产品的精华(实验组,实施例2-1所述的发酵滤液,添加量为2.5%)和空白精华(对照组,添加相同含量蒸馏水),其中,空白精华包含丁二醇、戊二醇、乙基己基甘油、甘油、甜菜碱、卡波u21、黄原胶、水。于使用前后检测受试者面部苹果肌区域的角质层含水量、皮肤弹性、细纹、肤色、棕色斑的变化。
[0252]
招募健康受试者15名,20-45岁,受试者洁面后15分钟,检测左、右半脸苹果肌区域的角质层含水量、皮肤弹性、细纹面积、肤色l值和棕斑面积的初始值,然后分别使用等量的添加抗氧化产品的精华(实验组)和空白精华(对照组),以后早晚各一次,并于初次使用后1周、2周、3周再次检测所有指标,其结果分别如图6-1、6-2、6-3、6-4和6-5所示,其中,*表示与对照组相比p《0.05,**表示与对照组相比p《0.01。
[0253]
从图6-1可以看出,使用前角质层含水量初始值设为100%。与对照组相比,使用含实施例2-1的发酵滤液的精华(实验组)3周时间内,皮肤角质层含水量显著提高(比对照组提高12%-14%),说明本发明所述的发酵滤液能够提供皮肤角质层含水量。
[0254]
从图6-2可以看出,使用前皮肤弹性初始值设为100%。与对照组相比,使用含实施例2-1所述发酵滤液的精华3周时间内,皮肤弹性显著提高,特别是使用1周后,比对照组提
高10%,说明本发明所述的发酵滤液能够提供皮肤弹性。
[0255]
从图6-3可以看出,使用前固定选区中的棕斑面积占比设为100%。与对照组相比,使用含实施例2-1的发酵滤液的精华3周时间内,皮肤棕斑面积显著减少(减少10%-12%),特别是使用后1周至2周,组间差异显著,说明本发明所述的发酵滤液能够显著减少真皮浅层的色素沉着,发挥淡斑功效。
[0256]
从图6-4可以看出,使用前固定选区中的纹理面积占比设为100%。与空白对照组相比,使用含实施例2-1所述的发酵滤液的精华2周以后,皮肤细纹略有减少,说明本发明所述的发酵滤液能够减少皮肤细纹。
[0257]
从图6-5可以看出,使用前肤色l值设为100%。与对照组相比,使用含实施例2-1所述的发酵滤液的精华3周内,皮肤白度略有提高,说明本发明所述的发酵滤液能够提高皮肤白度。
[0258]
实验例8稳定性的研究
[0259]
将实施例2-1至2-7所得到的发酵滤液和对比例2所得到的发酵滤液进行稳定性研究,稳定性数据如表3所示,其中实施例2-1和对比例2的稳定性结果如图7所示,其中,a为对比例2所得到的发酵滤液示意图,b为对比例2所得到的发酵滤液在40℃下放置4个月的示意图,c为实施例2-1所得到的发酵滤液的示意图,d为实施例2-1所得到的发酵滤液在40℃下放置4个月的示意图。
[0260]
表3各培养条件下样品在40℃下的稳定性(470nm下吸光度)对比
[0261]
从表格3可知,优化前的发酵滤液在470nm下吸光度较高,且40℃放置4个月后,吸光度升高较为显著(od
470
增加了0.333)。优化后的发酵滤液在470nm下吸光度处于较低水平,且40℃放置4个月后,吸光度仅有较为轻微的变化(od
470
最高增加了0.063),仍然处于较低水平,并且从图7亦可明显看出优化前后的颜色差异,因此优化后的发酵滤液比优化前的稳定性较好。
[0262]
综上所述,本发明所述的发酵滤液具有抗氧化功效,并且使皮肤角质层含水量显著提高,使皮肤弹性显著提高,使皮肤棕斑面积显著减少,使皮肤细纹减少以及使皮肤白度提高,此外,本发明所述的发酵滤液稳定性较好,在40℃放置4个月仍然比较稳定。
[0263]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1