一种表达人CD19抗原的淋巴瘤细胞株及其构建方法和应用
一种表达人cd19抗原的淋巴瘤细胞株及其构建方法和应用
技术领域
1.本发明属于细胞或动物模型技术领域,具体涉及一种表达人cd19抗原的淋巴瘤细胞株及其构建方法和应用。
背景技术:
2.弥漫大b细胞淋巴瘤(dlbcl)是一组在基因表型、病理形态以及临床症状上表现各异的高异质性大b细胞增生性疾病。cd19在b细胞分化的所有阶段均有表达,并在b细胞恶性转化过程中持续携带。cd19在超过95%的b细胞恶性肿瘤(例如慢性淋巴细胞性白血病(cll),b细胞nhl和b细胞急性淋巴细胞性白血病(all))中表达。尽管cd19在正常的非恶性b细胞上表达,但众所周知,癌症患者在化疗或b细胞定向单克隆抗体后无需正常b细胞也可生存。因此,临床上似乎没有因长期b细胞发育不全而产生的其他并发症。所有这些因素使得cd19成为研究的目标。
3.car
‑
t细胞旨在使患者的自体t细胞转化为对抗其b细胞淋巴瘤的强大杀伤细胞。car
‑
t(chimeric antigen receptor t
‑
cell immunotherapy),即嵌合抗原受体t细胞免疫疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。cart细胞旨在将患者的自体t细胞转化为对抗其b细胞淋巴瘤的强大杀伤细胞。通常通过单采血液分离术收集患者的t细胞,然后用慢病毒或逆转录病毒载体对其进行基因修饰,以表达包含抗体衍生抗原结合结构域、跨膜间隔子、共同刺激结构域(通常为cd28或4
‑
1bb)和细胞内信号传导域(cd3ζ)。这些原件在t细胞上的表达赋予抗体对t细胞的高亲和力抗原识别特性,然后当t细胞以mhc非依赖性方式与肿瘤抗原结合时,可以直接激活该抗体。
4.以往的car
‑
t研究方法都基于免疫缺陷小鼠模型。在免疫缺陷小鼠上种植人来源的肿瘤细胞,荷瘤成功后,再输入体外改造修饰完成的人来源的t细胞,以此来检测car
‑
t细胞的杀伤功效。有研究建立了一种新型的人源化小鼠模型。该模型也是采用免疫缺陷小鼠,但其将nsg小鼠进行亚致死照射之后静脉内移植人cd34
+
胚胎肝细胞,使得人类的造血和免疫系统在小鼠体内得到完全重建。该种模型虽然可以运用于多种人类疾病模型,但其构建方式复杂,死亡率较高,成本较大。并且该小鼠中的非造血组织会干扰抗肿瘤免疫的过程。利妥昔单抗的问世使得dlbcl的生存率得到了显著的提升。但关于cd19或cd20的单抗研究也是基于免疫缺陷小鼠体内完成,尚不能完全模拟正常免疫条件下单克隆抗体对肿瘤细胞的杀伤作用。为此,寻找新的方法来模拟正常小鼠体内免疫环境来探索cart细胞疗法治疗急性淋巴细胞白血病或淋巴瘤是亟待解决的问题。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种表达人cd19抗原的淋巴瘤细胞株a20及其构建方法和应用,所述细胞株可在免疫功能正常的小鼠体内正常成瘤,不影响肿瘤细胞增殖与成瘤性,可用于模型小鼠构建。
6.本发明提供了一种表达人cd19抗原的淋巴瘤细胞株的构建方法,包括以下步骤:
7.1)将人cd19抗原序列插入pwpi载体上,得到重组pwpi载体;
8.2)将重组pwpi载体、pspax2和pmd2c1与转染试剂共同处理真核细胞,得到包装的病毒;
9.3)将所述包装的病毒感染淋巴瘤细胞,培养,得到表达人cd19抗原的淋巴瘤细胞株。
10.优选的,所述人cd19抗原序列的核苷酸序列如seq id no:1。
11.优选的,所述人cd19抗原序列的5'端添加一段kozak序列;
12.所述kozak序列的核苷酸序列如gccacc所示。
13.优选的,所述pwpi载体的克隆位点为paci/pmei。
14.优选的,所述重组pwpi载体、pspax2和pmd2c1的质量比为(4~5):3:(1~3)。
15.优选的,所述重组pwpi载体、pspax2和pmd2c1的总质量和转染试剂总体积的比例为10μg:(15~30)μl。
16.优选的,所述培养后,还包括对淋巴瘤细胞进行鉴定;
17.所述鉴定的方法包括qpcr检测和western检测;
18.所述qpcr检测用引物包括核苷酸序列如seq id no:2所示的正向引物和核苷酸序列如seq id no:3所示的反向引物。
19.本发明提供了所述构建方法得到的表达人cd19抗原的淋巴瘤细胞株,所述淋巴瘤细胞株包含人cd19抗原编码序列。
20.本发明提供了所述表达人cd19抗原的淋巴瘤细胞株在构建肿瘤免疫小鼠模型中的应用。
21.优选的,所述肿瘤免疫小鼠模型包括急性淋巴细胞白血病小鼠模型和淋巴瘤小鼠模型。
22.本发明提供的所述构建方法得到的表达人cd19抗原的淋巴瘤细胞株,所述淋巴瘤细胞株包含人cd19抗原编码序列。本发明实验证明,通过慢病毒包装系统将人cd19抗原编码序列整合至淋巴瘤细胞中,经过qpcr检测,所述人cd19抗原编码序列能够在淋巴瘤细胞中稳定表达,同时采用western blot检测结果表明人cd19抗原能够在淋巴瘤细胞中稳定表达。与以往其他贴壁细胞为研究对象,无法模拟血液系统肿瘤的情况相比,本发明以小鼠淋巴瘤细胞为研究对象,成功构建了表达人cd19抗原的淋巴瘤细胞株。同时与以往人来源细胞仅能在免疫缺陷小鼠体内进行研究相比,本发明构建的表达人cd19抗原的淋巴瘤细胞株可以在免疫功能正常小鼠体内生长,可模拟正常人体内的免疫微环境,为靶向人cd19细胞的小鼠体内免疫疗法提供了新的肿瘤免疫模型,即为后续成功构建小鼠急性淋巴细胞白血病模型及淋巴瘤模型奠定基础。
附图说明
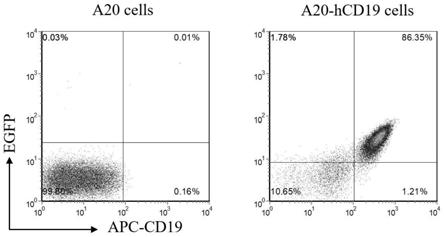
23.图1为本发明实施例中流式细胞术检测a20细胞hcd19及egfp表达情况;
24.图2为采用qpcr检测hcd19
‑
a20细胞内egfp表达量以及hcd19表达结果;
25.图3为本发明实施例中westernblot检测结果;其中,raji是人cd19阳性细胞,作为阳性对照;a20
‑
cd19是转染筛选后的表达人cd19的小鼠淋巴瘤细胞;
26.图4为正常a20细胞与hcd19
‑
a20细胞生长性能的比较结果。
具体实施方式
27.本发明提供了一种表达人cd19抗原的淋巴瘤细胞株的构建方法,包括以下步骤:
28.1)将人cd19抗原序列插入pwpi载体上,得到重组pwpi载体;
29.2)将重组pwpi载体、pspax2和pmd2c1配制三质粒病毒包装系统,与转染试剂共同处理真核细胞,得到包装的病毒;
30.3)将所述包装的病毒感染淋巴瘤细胞,培养,得到表达人cd19抗原的淋巴瘤细胞株。
31.本发明将人cd19抗原序列插入pwpi载体上,得到重组pwpi载体。
32.在本发明中,所述人cd19抗原序列的核苷酸序列优选如seq id no:1(atgccacctcctcgcctcctcttcttcctcctcttcctcacccccatggaagtcaggcccgaggaacctctagtggtgaaggtggaagagggagataacgctgtgctgcagtgcctcaaggggacctcagatggccccactcagcagctgacctggtctcgggagtccccgcttaaacccttcttaaaactcagcctggggctgccaggcctgggaatccacatgaggcccctggccatctggcttttcatcttcaacgtctctcaacagatggggggcttctacctgtgccagccggggcccccctctgagaaggcctggcagcctggctggacagtcaatgtggagggcagcggggagctgttccggtggaatgtttcggacctaggtggcctgggctgtggcctgaagaacaggtcctcagagggccccagctccccttccgggaagctcatgagccccaagctgtatgtgtgggccaaagaccgccctgagatctgggagggagagcctccgtgtctcccaccgagggacagcctgaaccagagcctcagccaggacctcaccatggcccctggctccacactctggctgtcctgtggggtaccccctgactctgtgtccaggggccccctctcctggacccatgtgcaccccaaggggcctaagtcattgctgagcctagagctgaaggacgatcgcccggccagagatatgtgggtaatggagacgggtctgttgttgccccgggccacagctcaagacgctggaaagtattattgtcaccgtggcaacctgaccatgtcattccacctggagatcactgctcggccagtactatggcactggctgctgaggactggtggctggaaggtctcagctgtgactttggcttatctgatcttctgcctgtgttcccttgtgggcattcttcatcttcaaagagccctggtcctgaggaggaaaagaaagcgaatgactgaccccaccaggagattcttcaaagtgacgcctcccccaggaagcgggccccagaaccagtacgggaacgtgctgtctctccccacacccacctcaggcctcggacgcgcccagcgttgggccgcaggcctggggggcactgccccgtcttatggaaacccgagcagcgacgtccaggcggatggagccttggggtcccggagcccgccgggagtgggcccagaagaagaggaaggggagggctatgaggaacctgacagtgaggaggactccgagttctatgagaacgactccaaccttgggcaggaccagctctcccaggatggcagcggctacgagaaccctgaggatgagcccctgggtcctgaggatgaagactccttctccaacgctgagtcttatgagaacgaggatgaagagctgacccagccggtcgccaggacaatggacttcctgagccctcatgggtcagcctgggaccccagccgggaagcaacctccctggcagggtcccagtcctatgaggatatgagaggaatcctgtatgcagccccccagctccgctccattcggggccagcctggacccaatcatgaggaagatgcagactcttatgagaacatggataatcccgatgggccagacccagcctggggaggagggggccgcatgggcacctggagcaccaggtgattaattag)所示。
33.在本发明中,所述人cd19抗原序列的5'端优选添加一段kozak序列。所述kozak序列的核苷酸序列优选如gccacc所示。所述kozak序列的添加有利于增强人cd19抗原序列的翻译效率,提高人cd19抗原蛋白表达量。
34.本发明对所述pwpi载体的来源没有特殊限制,采用本领域所熟知的pwpi载体的来源即可。在本发明实施例中,所述pwpi载体购自addgene公司。所述插入的方法优选包括酶
切、连接和筛选。所述酶切包括酶切人cd19抗原序列和所述pwpi载体。所述pwpi载体的酶切位点优选为paci/pmei。所述人cd19抗原序列通过人工合成方法在两端添加paci、pmei酶切位点。所述酶切的条件优选为37℃,15min。本发明对所述连接的方法没有特殊限制,采用本领域所熟知的连接方法即可。所述连接的体系优选为1
×
dna ligase buffer反应液中,在50μl反应体系下,在23℃条件下连接30min。所述转化的方法优选将连接产物加入感受态细胞中,混匀后冰上静置25min;在42℃下将感受态细胞置于金属浴锅中热休克90s,而后迅速取出置于冰上;冷却2min后,取200μl菌液,加入1800ul lb培养基,用移液器将菌液小心混合均匀,培养。所述培养的条件优选为37℃、120r/min摇床培养40min活化细菌。所述筛选优选包括:将活化后的细菌悬液涂布平板,挑取单菌落,接种到lb培养基中培养;收集菌液送测序,余下菌液加入相应体积甘油置于
‑
80℃冻存。选择测序序列正确的克隆进行后续实验。
35.得到重组pwpi载体后,本发明将重组pwpi载体、pspax2和pmd2c1配制三质粒病毒包装系统,与转染试剂共同处理真核细胞,得到包装的病毒。
36.在本发明中,所述三质粒病毒包装系统中,所述重组pwpi载体、pspax2和pmd2c1的质量比优选为(4~5):3:(1~3),最优选为4:3:1。本发明对所述转染试剂的种类没有特殊限制,采用本领域所熟知的转染试剂即可。在本发明实施例中,所述转染试剂为highgene transfection reagent(rm09014),购自abclonal公司。
37.在本发明中,所述真核细胞优选为293t细胞。所述293t细胞是由293细胞派生,表达sv40大t抗原的人肾上皮细胞系,被广泛应用于瞬时转染以过表达各种目标蛋白或是用以包装病毒。
38.在本发明中,所述共同处理时,优选用dmem培养基稀释三质粒病毒包装系统和转染试剂。优选的,用500μl dmem培养基稀释2μgpwpi
‑
hcd19、1.5μg pspax2和1.5μg pmd2.g;用500μl dmem培养基稀释6μl转染试剂。所述三质粒病毒包装系统和转染试剂的体积比优选为0.8~1.2:1,更优选为1:1。所述共同处理时,将含真核细胞的无血清培养基与质粒和脂质体混合物等体积混合。
39.在本发明中,共同处理8h后,优选移除质粒和转染试剂形成的混合液,用2ml含1%双抗的完全培养基dmem替换进行培养,收集病毒。所述培养的时间优选为48~72h。本发明对收集病毒的方法没有特殊限制,采用本领域所熟知的收集病毒的方法即可。
40.本发明将所述包装的病毒感染淋巴瘤细胞,培养,得到表达人cd19抗原的淋巴瘤细胞株。
41.在本发明中,所述淋巴瘤细胞优选包括b淋巴瘤细胞和t淋巴瘤细胞。本发明以b淋巴瘤细胞株a20为例加以说明,但不能理解为对本发明保护范围的限制。当培养48h时采用荧光显微镜观察荧光。所述重组质粒中包含egfp基因,感染淋巴瘤细胞后被整合到淋巴瘤细胞的基因组中稳定表达。通过观察荧光信号得到病毒的感染情况。本发明还包括稳转系筛选。所述稳转系筛选的方法优选通过流式细胞分选技术将fitc阳性的细胞分选到培养皿中并继续培养。
42.在本发明中,所述培养后,优选还包括对淋巴瘤细胞进行鉴定。所述鉴定的方法优选包括qpcr检测和western检测。所述qpcr检测用hcd19引物优选包括核苷酸序列如seq id no:2(tggagacgggtctgttgttg)所示的正向引物和核苷酸序列如seq id no:3
(aatgcccacaagggaacaca)所示的反向引物。所述qpcr检测的内参基因优选为gapdh,所述内参基因的扩增引物为核苷酸序列如seq id no:6(aggtcggtgtgaacggatttg)所示的正向引物和核苷酸序列如seq id no:7(ggggtcgttgatggcaaca)所示的反向引物。本发明对所述western检测没有特殊限制,采用本领域所熟知的western检测方法即可。
43.本发明提供了所述构建方法得到的表达人cd19抗原的淋巴瘤细胞株,所述淋巴瘤细胞株包含人cd19抗原编码序列。通过检测结果表明,人cd19蛋白表达于b淋巴瘤细胞株a20细胞株表面,且b淋巴瘤细胞株a20表达egfp。该实验证明本发明构建的人源化小鼠淋巴瘤细胞株构建成功。
44.本发明提供了所述表达人cd19抗原的淋巴瘤细胞株在构建肿瘤免疫小鼠模型中的应用。所述肿瘤免疫小鼠模型优选包括急性淋巴细胞白血病小鼠模型和淋巴瘤小鼠模型。本发明实施例中将筛选出的表达人cd19抗原的b淋巴瘤细胞株a20接种到balb/c小鼠体内发现,该b淋巴瘤细胞株a20可以在balb/c小鼠体内正常成瘤。
45.利用流式细胞技术筛选出egfp阳性a20细胞后,将a20细胞置于37℃,5%co2敷箱进行培养,培养基为rpmi1640+10%fbs,待细胞汇合度达到70%~80%,将细胞进行1:3比例穿传代。待细胞生长至对数期,将细胞用胰酶消化,用无血清1640培养基重悬。将细胞浓度调整至1
×
107个/200μl,将细胞置于冰上备用。取6~8周balb/c小鼠,用脱毛膏将小鼠左臀部毛发脱去并用75%酒精消毒。取1ml注射器吸取200ul细胞悬液,将细胞悬液接种至小鼠皮下。一周后重复以上步骤在相同部位进行接种。四周后可见小鼠左侧臀部皮下成瘤。
46.下面结合实施例对本发明提供的一种表达人cd19抗原的淋巴瘤细胞株及其构建方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
47.实施例1
48.一种含人cd19抗原序列的重组质粒的构建方法
49.1)人工合成人cd19抗原的编码序列(seq id no:1),且在5'端添加一段kozak序列(gccacc)增强该基因的翻译效率,同时根据paci和pmei的酶切位点,分别在序列的5'端和3'端合成paci和pmei的酶切位点,得到含酶切位点的人cd19抗原的编码序列。
50.2)将步骤1)合成的含酶切位点的人cd19抗原的编码序列和pwpi分别用paci/pmei进行双酶解(37℃,15min),得到酶切产物和线性载体在t4dna连接酶作用下,在1
×
dna ligase buffer反应液中进行23℃连接30min,得到连接产物,将连接产物转入大肠杆菌中,经菌落扩增目标片段、测序、比对,挑取阳性克隆提取质粒,得到重组pwpi载体,记为pwpi
‑
hcd19。
51.实施例2
52.慢病毒包装方法
53.1)第一天,将293t细胞接种到含无血清培养基的6孔板中,细胞密度控制在80%。
54.2)三质粒包装系统溶液和转染试剂溶液的配制:将2μg pwpi
‑
hcd19、1.5μg pspax2和1.5μg pmd2.g用500μl dmem稀释;同时用500μl dmem稀释6μl转染试剂(highgene transfection reagent,rm09014)。
55.3)稀释5min后,将三质粒包装系统溶液和转染试剂融合混合,室温静止20min。
56.4)从6孔板中吸出1ml步骤1)中无血清培养基,然后滴加入1ml质粒和脂质体混合物。培养8h后,移除培养基,换成2ml完全培养基dmem(含10%fbs+1%双抗)。
57.5)培养24h后,将细胞置于荧光显微镜下观察,egfp阳性细胞达到70%以上。
58.6)在培养48h后以及72h后分别收集转染后293t细胞培养上清,在3000rpm下离心20min,0.45μm滤膜过滤,去除细胞沉淀。在12000rpm转离心浓缩后分装,
‑
80℃贮存。
59.实施例3
60.实施例2制备的慢病毒感染b淋巴瘤细胞株a20的方法
61.1)铺板:将对数生长期的a20细胞重悬后,按1
×
105/l密度接种于12孔板,生长过夜;
62.2)感染:将70%~80%铺满12孔板中的培养液吸除,换新鲜的培养液,同时加入浓度梯度稀释的病毒液,混合均匀后即可放入孵箱培养。
63.3)24h左右可换液,48小时后用荧光显微镜观察荧光。
64.4)稳转系筛选,通过流式细胞分选技术将egfp阳性的细胞分选到培养皿中并进行培养。流式细胞术检测a20细胞hcd19及egfp表达情况见图1,病毒感染后a20细胞hcd19及egfp双阳性细胞占86.35%。选择右上象限细胞进行分选后培养,得到重组细胞株,记为hcd19
‑
a20细胞。
65.实施例4
66.采用qpcr检测hcd19
‑
a20细胞内egfp表达以及hcd19表达,具体步骤如下:
67.1.rna提取
68.取2
×
106hcd19
‑
a20细胞悬液,离心后加1ml trizol,吹打后移至1.5ml无菌的离心管中;加100ul氯仿剧烈振荡30s混匀,12000转15min,可看到明显分层;取上层透明液体至新的1.5ml离心管中,加等体积的异丙醇,混匀静置10min,12000转离心10min,弃上清,加1ml 70%乙醇,12000转,离心10min,弃上清,风干剩余液体,最后加depc
‑
水溶解rna。
69.2.反转录
70.取2μg rna,4μl 5
×
primescript rt mastermix,ddh2o补齐至20μl,置于pcr仪中进行反转录,反转录条件如下:
71.37℃,15min
72.85℃,15s
73.4℃,保存。
74.3.qpcr检测
75.qpcr检测用引物如下:
76.hcd19的正向引物:tggagacgggtctgttgttg(seq id no:2);
77.hcd19的反向引物:aatgcccacaagggaacaca(seq id no:3)。
78.egfp的正向引物:acgacggcaactacaagacc(seq id no:4);
79.egfp的正向引物:ttgtactccagcttgtgccc(seq id no:5)。
80.gapdh作为内参基因,正向引物:aggtcggtgtgaacggatttg
81.(seq id no:6);
82.反向引物:ggggtcgttgatggcaaca(seq id no:7)。
83.qpcr反应条件:
[0084][0085]
溶解曲线反应条件:qpcr反应体系:
[0086][0087]
结果见图2,其中a为qpcr检测不同病毒感染后a20细胞egfp表达情况。结果显示pwpi单一载体病毒感染组egfp表达量显著高于未感染病毒组,pwpi
‑
hcd19病毒感染组egfp表达显著高于未感染病毒组。(*,#p<0.05)。b为qpcr检测不同病毒感染后a20细胞hcd19表达情况。pwpi
‑
hcd19病毒感染组hcd19表达显著高于未感染病毒组。未感染组和pwpi单一载体病毒感染组a20细胞中均无法检出hcd19的表达(*p<0.05)。
[0088]
实施例5
[0089]
采用westernblot检测hcd19
‑
a20细胞中hcd19表达
[0090]
蛋白提取:取2
×
106/ml细胞悬液,离心后加200μl ripa裂解液,冰上裂解30min,12000r/min离心20min,取上清加入相应体积5
×
loading buffer。以cd19阳性细胞raji作为阳性对照提取hcd19蛋白进行westernblot检测。
[0091]
结果见图3。由图3可知,以raji的蛋白条带为参照,hcd19
‑
a20细胞能够稳定表达人cd19抗原。
[0092]
实施例6
[0093]
取正常a20细胞与hcd19
‑
a20细胞分别接种至培养皿中培养,待细胞生长至对数期,用移液枪轻轻吹打细胞至细胞从培养皿上脱落,随后进行细胞计数。调整细胞浓度为104个/ml,用移液枪将细胞平均接种于96孔板中,调整细胞密度为1000个/孔/200μl。将培养板放在培养箱中预培养1h(37℃,5%co2),向每孔加入20μl cck8溶液,分别在培养0h、12h,24h,36h时,用酶标仪对吸光度进行检测,检测波长为450nm。对每种细胞铺设五个重复孔进行实验。
[0094]
结果见图4。cck
‑
8实验证明,正常a20细胞与hcd19
‑
a20细胞生长速度无明显差异。这表明hcd19表达不会对hcd19
‑
a20细胞的生长性能有任何影响。
[0095]
实施例7
[0096]
利用流式细胞技术筛选出egfp阳性a20细胞后,将a20细胞置于37℃,5%co2敷箱进行培养,培养基为rpmi1640+10%fbs,待细胞汇合度达到70%~80%,将细胞进行1:3比
例穿传代。待细胞生长至对数期,将细胞用胰酶消化,用无血清1640培养基重悬。将细胞浓度调整至1
×
107个/200μl,将细胞置于冰上备用。
[0097]
取6~8周balb/c小鼠,用脱毛膏将小鼠左臀部毛发脱去并用75%酒精消毒。取1ml注射器吸取200μl细胞悬液,将细胞悬液接种至小鼠皮下。一周后重复以上步骤在相同部位进行接种。四周后可见小鼠左侧臀部皮下成瘤。
[0098]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1