一种白细胞介素15及其受体-单克隆抗体融合蛋白的纯化贮存方法与流程
一种白细胞介素15及其受体
‑
单克隆抗体融合蛋白的纯化贮存方法
技术领域
1.本发明涉及抗体分离纯化领域,尤其涉及一种白细胞介素15及其受体
‑
单克隆抗体融合蛋白的纯化贮存方法。
背景技术:
2.白细胞介素
‑
15(il
‑
15)是一种具有多种生物学活性的细胞因子,可由活化的单核
‑
巨噬细胞、表皮细胞和成纤维细胞等多种细胞产生。il
‑
15首先被发现是由于它有类似于il
‑
2的功能,能刺激ctll细胞活化增殖。il
‑
15能刺激t细胞产生各种活化抗原,如cd24、cd122、cd95、cd30和cd69等。但后来il
‑
15在其他免疫细胞发育过程中的作用也逐渐被发现,如nk细胞、nk
‑
t细胞和肠上皮内淋巴细胞等。多项研究表明,il
‑
15在减轻机体炎症、抗氧化应激、调节脂质代谢及改善胰岛素抵抗方面发挥重要作用,它还可明显减轻血管内皮细胞炎症反应,抑制动脉粥样硬化斑块形成,稳定斑块,改善心肌细胞能量代谢,减少心肌细胞损伤、凋亡,抑制心肌重构。
3.il
‑
15属于4α螺旋细胞因子家族,il
‑
15的受体包含三个亚单位:il
‑
2rβ,γc和il
‑
15rα。il
‑
15与il
‑
15rα有很高的亲和力,与传统意义上的细胞因子通过直接结合其受体而激活下游信号通路有所不同,目前普遍认为il
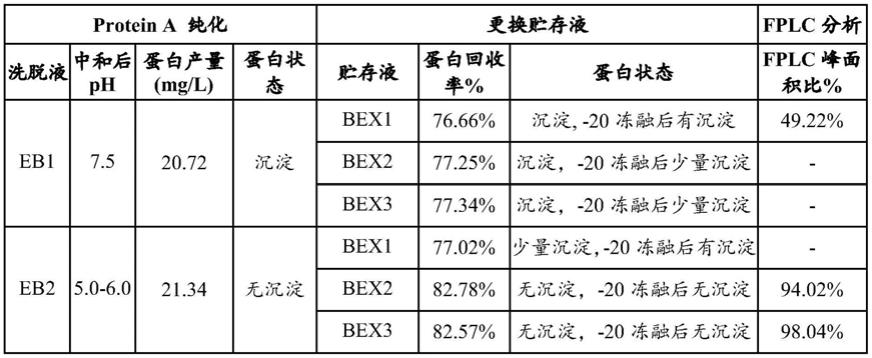
‑
15主要通过一种转提呈的方式发挥作用。il
‑
15首先结合il
‑
15rα阳性的细胞,然后由此il
‑
15rα阳性细胞将il
‑
15进一步提呈给表达il
‑
2rβ和γc的其他细胞。
4.egfr是erbb受体家族中的一种跨膜糖蛋白,当它与egf和转化生长因子
‑
α(tgf
‑
α)结合后,随即egfr本身发生同型二聚体化反应,开始刺激细胞内激酶并引发下游信号传导的级联反应,从而影响细胞增殖、细胞凋亡和细胞周围的血管新生。表皮生长因子受体(egfr)和egfr在细胞表面的结合,阻断了内源性配体与生长因子受体的结合机会,从而抑制受体蛋白酪氨酸激酶的磷酸化,最终抑制下游的信号传导的级联过程。egfr在某些恶性肿瘤细胞处于高表达状态,例如乳腺癌、肺癌、直肠癌等,egfr目前已成为肿瘤靶向治疗的一个主要靶点。
5.抗体融合蛋白是指在基因水平上将目的基因同免疫球蛋白部分片段基因相连,下载并在真核或原核表达系统中表达的重组蛋白。抗体融合蛋白具有抗体的特性及融合功能蛋白的活性,可广泛应用于免疫诊断、免疫治疗、抗体纯化及抗体和抗原的定量分析等,特别可用于免疫导向药物的制备。研究抗体融合蛋白,对于癌症的免疫治疗有着重大的意义。
6.protein a是一种从金黄色葡萄球菌中分离出来的细菌细胞壁蛋白,主要通过fc区域与哺乳动物的igg结合。protein a有五个igg结合结构域。在抗体相关蛋白的纯化过程中,首选protein a resin作为抗体捕获的亲和层析介质。通常情况下,抗体或者含有fc区域的融合蛋白在中性条件下与protein a结合,在酸性条件下进行蛋白洗脱。绝大多是单克隆抗体采用ph2.5
‑
ph3.0的0.1mol/l甘氨酸洗脱溶液,在该条件下,单克隆抗体具有较高的纯度和回收率。但是对于一些性质不稳定的抗体融合蛋白,使用上述溶液进行蛋白洗脱后,
蛋白容易产生沉淀,从而导致蛋白的回收率和纯度下降。因此,本发明针对由人白细胞介素
‑
15、人白细胞介素
‑
15受体以及表皮生长因子受体抗体三种蛋白融合而成的抗体融合蛋白il15
‑
il15rα
‑
aegfr,寻找一种能够使蛋白稳定的纯化方法。
技术实现要素:
7.为解决上述技术问题,本发明公开了一种白细胞介素15及其受体
‑
单克隆抗体融合蛋白的纯化贮存方法,对洗脱液以及贮存液的组分及最适ph进行了改进,以解决抗体融合蛋白在纯化过程中不稳定以及回收率低的问题。
8.本发明公开了一种白细胞介素15及其受体
‑
单克隆抗体融合蛋白的纯化贮存方法,用洗脱液洗脱白细胞介素15及其受体
‑
单克隆抗体融合蛋白,将纯化后的白细胞介素15及其受体
‑
单克隆抗体融合蛋白换液保存于贮存液中,
9.白细胞介素15及其受体
‑
单克隆抗体融合蛋白由人白细胞介素
‑
15、人白细胞介素
‑
15受体以及表皮生长因子受体抗体三种蛋白融合而成;
10.洗脱液的组成为:
11.0.08~0.15m柠檬酸钠、0.1m~0.2m氯化钠和240~260mm蔗糖,ph3.0;
12.贮存液的组成为:
13.0.08~0.15m柠檬酸钠和0.1m~0.2m氯化钠,ph 6.0;
14.或0.08~0.15m柠檬酸钠、0.1m~0.2m氯化钠和240~260mm蔗糖,ph 6.0。
15.优选地,洗脱液的组成为:
16.0.1m柠檬酸钠、0.1m~0.2m氯化钠和250mm蔗糖,ph 3.0。
17.优选地,贮存液的组成为:
18.0.1m柠檬酸钠和0.1m~0.2m氯化钠,ph 6.0;
19.或0.1m柠檬酸钠、0.1m~0.2m氯化钠和250mm蔗糖,ph 6.0。
20.进一步地,本发明以偶联于2
‑
10%琼脂糖的protein a为亲和填料,洗脱液洗脱前,先用磷酸盐缓冲液清洗以除去protein a中的贮存溶液,向亲和填料中加入融合蛋白上清液后,用磷酸盐缓冲液漂洗亲和填料除去结合较弱的杂质,磷酸盐缓冲液为dpbs,ph7.5。
21.进一步地,用洗脱液洗脱时,加入洗脱液于20
‑
30℃孵育5
‑
10min后进行蛋白洗脱。
22.进一步地,洗脱液洗脱白细胞介素15及其受体
‑
单克隆抗体融合蛋白后,用中和液进行中和,中和后蛋白溶液的ph为5.0
‑
6.0,中和液为0.8
‑
1.2mtris
‑
hcl,ph8.9。
23.进一步地,换液保存于贮存液中时,3500
‑
4500rpm离心浓缩。
24.借由上述方案,本发明至少具有以下优点:
25.白细胞介素15及其受体
‑
单克隆抗体融合蛋白il15
‑
il15rα
‑
aegfr在进行传统洗脱过程中,产生了沉淀,并出现了大量明显的二聚体和多聚体。本发明主要针对il15
‑
il15rα
‑
aegfr的洗脱液和贮存液的组分及配比进行了优化,发明人在经过大量试验后发现,只有使用本发明提供的特定组合进行纯化时融合蛋白较为稳定,没有沉淀产生。
26.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
27.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
28.图1为使用eb1洗脱蛋白后fplc检测峰图;
29.图2为使用eb2洗脱蛋白后fplc检测峰图;
30.图3为使用eb1洗脱的蛋白进行fplc纯化后,收集peak2进行浓缩后再次进行fplc检测峰图;
31.图4为使用eb2洗脱的蛋白进行fplc纯化后,收集peak2进行浓缩后再次进行fplc检测峰图;
32.图5为对不同方法纯化后的蛋白进行sds
‑
page检测结果。
具体实施方式
33.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
34.实施例1
35.1.收集白细胞介素15及其受体
‑
单克隆抗体融合蛋白il15
‑
il15rα
‑
aegfr上清液;
36.2.用10倍柱体积磷酸盐缓冲液(dpbs,ph7.5)清洗偶联于4%琼脂糖的protein a亲和填料,重复多次以除去protein a中的贮存溶液;
37.3.向层析柱中缓慢加入离心所得的蛋白上清液,重复添加多次,使融合蛋白与填料结合;
38.4.用10倍柱体积磷酸盐缓冲液(dpbs,ph7.5)漂洗protein a亲和填料,重复多次以除去结合较弱的杂质;
39.5.向层析柱中加入3倍柱体积洗脱液(elution buffer,eb),室温下孵育10min后,洗脱融合蛋白,重复多次至融合蛋白完全洗脱;分别用洗脱液1(eb1)、洗脱液2(eb2)对融合蛋白进行洗脱,具体配置见表1;
40.6.向eb1、eb2洗脱的融合蛋白中分别加入中和液nb(1m tris
‑
hcl,ph8.9),使得融合蛋白溶液的最终ph分别为7.5、5.0~6.0。
41.表1洗脱液的配置
42.缓冲液名称配方eb10.1m甘氨酸,0.1m~0.2m氯化钠,ph2.5eb20.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph3.0
43.测定融合蛋白浓度,计算融合蛋白纯化产量如表3所示。
44.实施例2
45.使用浓缩管进行浓缩,离心转速4000rpm,融合蛋白体积浓缩到小于100μl时,加入待更换的贮存液,相同转速继续离心,重复该步骤3次,使融合蛋白最终处于待更换的贮存液中。贮存液的配置如表2所示。
46.表2贮存液的配置
47.缓冲液名称配方bex1dpbs,ph 6.5
bex20.1m柠檬酸钠,0.1m~0.2m氯化钠,ph 6.0bex30.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 6.0
48.更换贮存液后结果如表3所示。
49.表3纯化回收结果
[0050][0051]
由上表可见:
[0052]
传统洗脱液洗脱的融合蛋白产量为20.72mg/l,洗脱过程中融合蛋白性质不稳定出现沉淀,且在浓缩及换液过程中仍有沉淀产生,经
‑
20℃冻融后融合蛋白依旧产生沉淀,回收率为76.66%。对浓缩换液后的融合蛋白进行fplc纯化分析,融合蛋白单体峰面积占比仅为49.22%左右,融合蛋白大部分为二聚体或者多聚体(图1);将fplc的p2进行回收浓缩后继续进行fplc检测,融合蛋白依旧有二聚体或者多聚体出现,融合蛋白单体峰面积占比为74.32%(图3)。
[0053]
将传统洗脱液eb1洗脱的融合蛋白进行浓缩并更换贮存液为bex1。融合蛋白在浓缩换液为bex1过程中出现不同程度的沉淀。可见,融合蛋白更换为bex1后的回收率比较低。将传统洗脱液eb1洗脱的融合蛋白进行浓缩并更换贮存液为bex2和bex3。在浓缩换液过程中有沉淀产生,换液后经
‑
20℃进行冻融,所有融合蛋白均产生了少量沉淀。
[0054]
本发明改进的洗脱液eb2洗脱的融合蛋白产量为21.34mg/l,洗脱时未出现沉淀,将优化后的洗脱液eb2洗脱的融合蛋白进行浓缩并更换贮存液为bex1、bex2、bex3。由表3可见,贮存液为bex1时出现少量沉淀,经
‑
20℃冻融后融合蛋白产生沉淀。而将贮存液更换为bex2、bex3后,融合蛋白回收率较高(均在80%以上),在浓缩换液过程中,融合蛋白均无沉淀产生经
‑
20℃进行冻融未产生沉淀。贮存液更换为bex2后进行fplc分析融合蛋白单体峰面比例可提高至94.02%左右(图2),贮存液更换为bex3后进行fplc分析融合蛋白单体峰面比例可提高至98.04%左右(图2)。将fplc的p2进行回收浓缩后继续进行fplc检测,没有二聚体和多聚体的存在,融合蛋白单体峰面积占比为100%(图4)。
[0055]
因此,通过以上的融合蛋白纯化和分析结果可以看出,本发明中传统的洗脱液eb1洗脱的il15
‑
il15rα
‑
aegfr蛋白性质不稳定,二聚体和多聚体占50%左右;对洗脱液以及贮存液进行优化以后,融合蛋白的回收率显著提高,二聚体和多聚体所占的比例大大降低。
[0056]
取5ug融合蛋白进行sds
‑
page分析,如图5中所示,非还原状态下,ag127+ag128蛋白在胶图上的大小为250kd。
[0057]
融合蛋白在经过eb1洗脱并更换贮存液为bex1后,在非还原状态(
‑
dtt)下,大于
250kd处出现了明显的二聚体或多聚体;而使用eb2洗脱的蛋白在非还原状态下,并未出现二聚体或多聚体(图5)。
[0058]
实施例3
[0059]
将贮存液更换为0.08m柠檬酸钠、0.1m~0.2m氯化钠和240mm蔗糖,ph6.0,其余步骤同实施例2。
[0060]
实施例4
[0061]
将贮存液更换为0.08m柠檬酸钠、0.1m~0.2m氯化钠和260mm蔗糖,ph6.0,其余步骤同实施例2。
[0062]
实施例5
[0063]
将贮存液更换为0.15m柠檬酸钠、0.1m~0.2m氯化钠和240mm蔗糖,ph6.0,其余步骤同实施例2。
[0064]
实施例6
[0065]
将贮存液更换为0.15m柠檬酸钠、0.1m~0.2m氯化钠和260mm蔗糖,ph6.0,其余步骤同实施例2。
[0066]
实施例7
[0067]
将贮存液更换为0.08m柠檬酸钠和0.1m~0.2m氯化钠,ph6.0,其余步骤同实施例2。
[0068]
实施例8
[0069]
将贮存液更换为0.15m柠檬酸钠和0.1m~0.2m氯化钠,ph6.0,其余步骤同实施例2。
[0070]
实施例9
[0071]
将洗脱液更换为0.15m柠檬酸钠、0.1m~0.2m氯化钠和240mm蔗糖,ph3.0,贮存液为bex3,其余步骤同实施例2。
[0072]
实施例10
[0073]
将洗脱液更换为0.08m柠檬酸钠、0.1m~0.2m氯化钠和260mm蔗糖,ph3.0,贮存液为bex3,其余步骤同实施例2。结果显示实施例3
‑
10均可得到与上述类似的实验结果,具体见表4。
[0074]
表4纯化回收结果
[0075][0076][0077]
对比例1
[0078]
将贮存液更换为0.2m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 6.0,洗脱液为eb2,其余同实施例2。
[0079]
对比例2
[0080]
将贮存液更换为0.05m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 6.0,洗脱液为eb2,其余同实施例2。
[0081]
对比例3
[0082]
将贮存液更换为0.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 5.5,洗脱液为eb2,其余同实施例2。
[0083]
对比例4
[0084]
将贮存液更换为0.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 6.5,洗脱液为eb2,其余同实施例2。
[0085]
对比例5
[0086]
将洗脱液更换为0.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 2.5,贮存液为bex3,其余同实施例2。
[0087]
对比例6
[0088]
将洗脱液更换为0.1m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 3.5,贮存液为bex3,其余同实施例2。
[0089]
对比例7
[0090]
将洗脱液更换为0.05m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 3.0,贮存液为bex3,其余同实施例2。
[0091]
对比例8
[0092]
将洗脱液更换为0.2m柠檬酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 3.0,贮存液为bex3,其余同实施例2。
[0093]
对比例9
[0094]
将洗脱液更换为0.1m柠檬酸钠,0.1m~0.2m氯化钠,ph 3.0,贮存液为bex3,其余同实施例2。
[0095]
对比例10
[0096]
将洗脱液更换为0.1m醋酸钠,0.1m~0.2m氯化钠,ph 3.0,贮存液为bex3,其余同实施例2。
[0097]
对比例11
[0098]
将洗脱液更换为0.1m醋酸钠,0.1m~0.2m氯化钠,250mm蔗糖,ph 3.0,贮存液为bex3,其余同实施例2。
[0099]
对比例12
[0100]
将洗脱液更换为0.1m醋酸钠,0.1m~0.2m氯化钠,250mm甘露醇,ph 3.0,贮存液为bex3,其余同实施例2。
[0101]
对比例13
[0102]
将洗脱液更换为0.1m醋酸钠,0.1m~0.2m氯化钠,ph 3.5,贮存液为bex3,其余同实施例2。
[0103]
对比例14
[0104]
将洗脱液更换为0.1m甘氨酸,0.1m~0.2m氯化钠,250mm蔗糖,ph 3.0,贮存液为bex3,其余同实施例2。
[0105]
结果显示(表5),贮存液的配比及ph变化时蛋白性质不稳定,洗脱液的buffer配比和ph改变后,蛋白的产量下降,洗脱和换液过程中均有沉淀;对比例10
‑
14中分别替换了柠檬酸钠和蔗糖,发现蛋白的产量明显下降,且蛋白在浓缩换液过程中出现沉淀。
[0106]
表5纯化回收结果
[0107]
[0108][0109]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1