一种婴儿配方乳粉中克罗诺杆菌属的CRISPROnePot检测方法及其试剂盒与流程
一种婴儿配方乳粉中克罗诺杆菌属的crispr one pot检测方法及其试剂盒
技术领域
1.本发明属于分子生物学技术crispr诊断技术领域,具体地说,是关于一种婴儿配方乳粉中克罗诺杆菌属的crispr one pot检测方法及其试剂盒。
背景技术:
2.食品安全事关人民群众的健康和安全,事关社会的和谐稳定,已成为全球性的重大战略性问题。其中婴儿配方乳粉是部分婴儿的唯一食物来源,对婴儿健康及生命安全有重要影响。
3.食源性致病微生物是我国食品安全的核心问题,也是影响婴儿配方食品安全性的关键因素。联合国粮农组织和世界卫生组织(fao/who)专家委员会已将克罗诺杆菌(cronobacter spp.)(原阪崎肠杆菌)、伤寒沙门氏菌(salmonella enterica)、金黄色葡萄球菌(staphylococcus aureus)等20种细菌列为婴儿配方食品中可能导致婴儿致病的细菌。从农场到餐桌,婴儿配方食品原料的选择、加工、储藏、运输、销售各个环节都会有食品致病菌存在的风险。但工厂内的加工过程最容易把控。其中,克罗诺杆菌为风险最高的常见致病菌,也是工厂生产过程控制的重要目标。克罗诺杆菌是一种普遍存在于大自然中的条件致病菌,可能会引起对婴幼儿坏死性小肠结肠炎、菌血症和脑膜炎等,死亡率高达50%,是婴儿配方乳粉中重要的防控致病菌。
4.2002年,国际食品微生物标准化委员会(icmsf)将其列为“严重危害特定人群、危害生命或慢性实质性后遗症或长期影响”的一种致病菌。2004年,fao将其列为a类致病微生物,我国gb 10765-2010《食品安全国家标准婴儿配方食品》、gb25596-2010《食品安全国家标准特殊医学用途婴儿配方食品通则》明确规定克罗诺杆菌是婴儿配方食品中必检的食源性致病微生物,要求为不得检出。
5.对于婴儿配方乳粉生产企业,目前对于克罗诺杆菌属的检测需求,还不局限于乳粉产品的质量检测,还应当依据《gb 23790-2010食品安全国家标准粉状婴幼儿配方食品良好生产规范》进行清洁作业区沙门氏菌、阪崎肠杆菌和其他肠杆菌的环境监控,需要对生产环境中克罗诺杆菌属进行快速检测,以稳定实施强制性国标规定的环境监控计划。因此,克罗诺杆菌属的快速精确检测是质量安全保证的重要手段。
6.目前,婴儿配方乳粉及生产环境中克罗诺杆菌属检测方法主要是基于或者参考国标方法gb 4789.40-2016《食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》,该方法通过食品基质中致病菌的复苏增菌、选择性分离、形态特征观察、生理生化鉴定等过程,实现克罗诺杆菌属的定性定量检测,检测时间较长,检测过程至少需要4~7d,操作也比较复杂,检测结果容易受操作者、培养试剂影响等。另外也有基于增菌和pcr扩增结合的行业标准方法如sn/t 1632.2-2013、sn/t1632.3-2013等,是在增菌培养后,提取dna,进行pcr扩增或者荧光定量pcr扩增,再利用琼脂糖电泳或者荧光定量pcr仪器检测特征目的产物。这类技术比培养法在特异性、简便性、速度和价格上有优劣,但是在防控pcr产
物污染、检测灵敏度方面还有提升的空间,而且要求循环升降温过程,不能在现场快速检测,需要pcr仪器、电泳仪器等设备。
7.以上检测方法无法满足目前婴儿配方乳粉企业对克罗诺杆菌属的快速检测要求,由于该菌潜在的污染浓度非常低,建立一种能够快速、高灵敏、现场检测婴儿配方乳粉中克罗诺杆菌属的检测方法具有重要意义。
8.crispr(clustered regularly interspaced short palindromic repeats)是大多数细菌及古细菌中抵御病毒入侵的一种获得性免疫方式。1987年,nakata等首次在大肠杆菌的基因组中发现了串联的间隔重复序列,但在当时并未引起学术界的关注。2002年,jansen等将这一奇特的重复间隔序列正式命名为串联间隔短回文重复序列(crispr)。近几年来,crispr技术在基因组编辑领域表现出了巨大的应用价值。2017年问世的crispr的检测技术被誉为“下一代的分子检测技术”,能做到“快速、灵敏、高特异、简便、低价”的特性,该技术可广泛应用于病原菌检测、癌症突变检测、单核苷酸多态性检测等领域,有巨大的应用潜力。嗜热的cas12b具有反式切割活性,可以和lamp等温扩增系统结合,从而能够实现一锅式核酸快速定性和定量检测。
技术实现要素:
9.本发明拟基于crispr-cas12蛋白,利用团队原创建立的crispr one pot检测技术来建立重要食源性致病菌的分子检测方法,采用该crispr one pot检测方法,可以对婴儿配方食品中致病菌克罗诺杆菌属进行快速定性筛选检测,满足企业在线检测和终产品快速品质检测需要,对提升我国婴幼儿配方食品企业质量控制能力和民众关切的婴幼儿食品安全水平有重要意义。为此,本发明的第一个目的是提供一种婴儿配方乳粉中克罗诺杆菌属的crispr one pot检测方法。本发明的第二个目的是提供一种用于检测婴儿配方乳粉中克罗诺杆菌属的crispr one pot试剂盒。本发明的第三个目的是提供一种用于检测婴儿配方乳粉中克罗诺杆菌属的crispr one pot试剂盒在检测婴儿配方乳粉中是否含有克罗诺杆菌属中的应用。
10.为实现上述目的,本发明采用如下技术方案:
11.作为本发明的第一个方面,一种婴儿配方乳粉中克罗诺杆菌属的crispr one pot检测方法,包括如下步骤:
12.婴儿配方乳粉中克罗诺杆菌属增菌培养,提取增菌液dna,以此dna为模板加入crispr one pot反应体系,同时进行lamp扩增和crispr反应,体系中包括cas12b蛋白、10
×
等温扩增缓冲液、10
×
引物预混液、bst2.0 warmstart dna聚合酶、mgso4、dntp、sgrna、甘氨酸和探针;动态检测crispr反应荧光强度值,根据荧光强度变化曲线判读待检测样品中是否存在克罗诺杆菌属核酸。
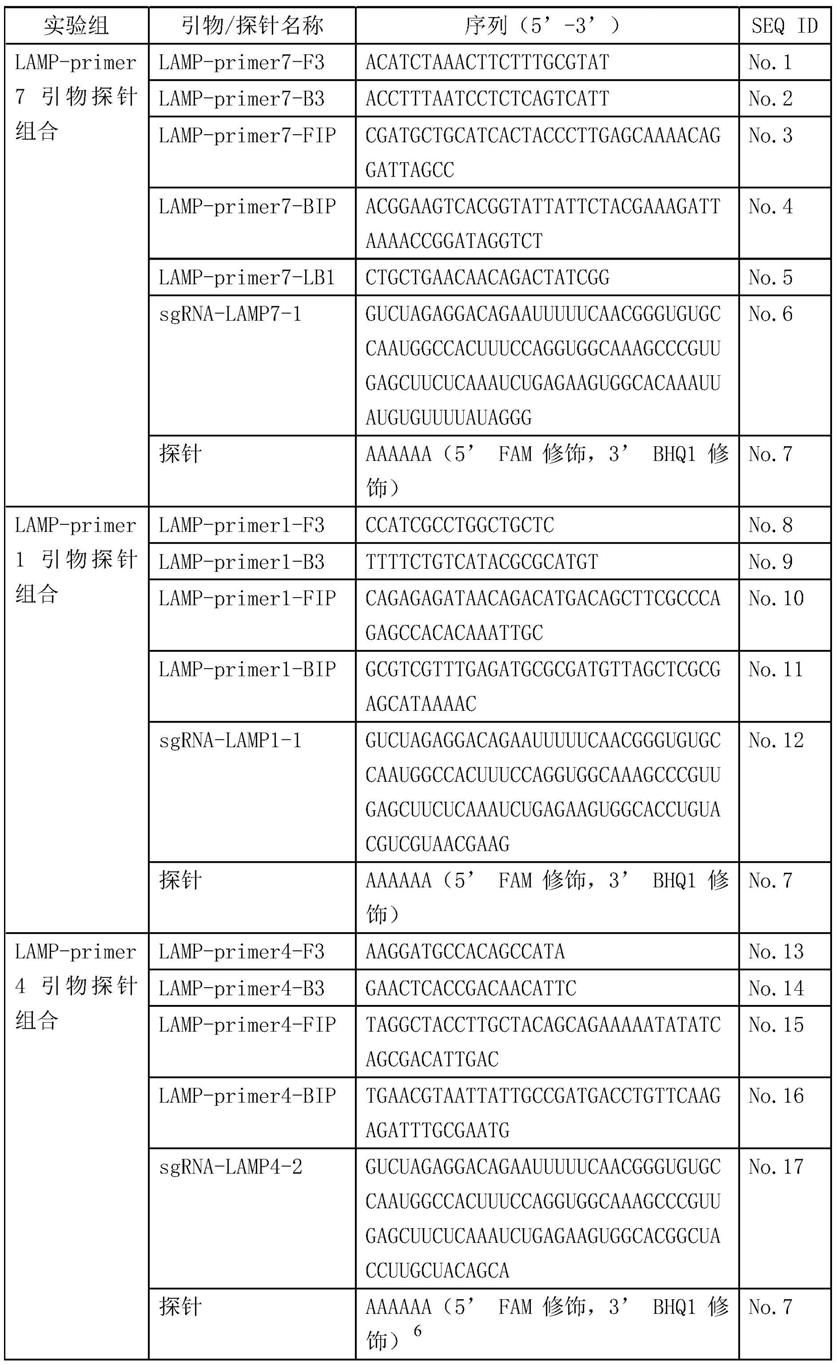
13.根据本发明,扩增克罗诺杆菌属成分的引物预混液中的特异性引物的核苷酸序列分别如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5所示。
14.根据本发明,crispr反应体系为25μl,包括:10
×
等温扩增缓冲液(isothermal amplification buffer)2.5μl,10
×
引物预混液2.5μl,100mm的mgso
4 1.5μl,10mm的dntp 2.5μl,bst2.0 warmstart dna聚合酶1μl,10μm的cas12b蛋白1.25μl,10μm的sgrna 1.25μl和10μm探针1.25μl,目标dna 2μl,2m的甘氨酸5μl,余量为灭菌水。
15.进一步的,所述sgrna和探针的序列分别如seq id no.6和seq id no.7所示。
16.根据本发明,在动态检测crispr反应荧光强度值之前,先57-60℃恒温保持40min-45min。
17.优选的,在动态检测crispr反应荧光强度值之前,先60℃恒温保持40min。
18.作为本发明的第二个方面,一种用于检测食品中克罗诺杆菌属的crispr one pot试剂盒,包括10
×
扩增克罗诺杆菌属成分的引物预混液、cas12b蛋白、10
×
等温扩增缓冲液(isothermal amplification buffer)、bst2.0 warmstart dna聚合酶、mgso4、dntp、sgrna、甘氨酸和探针。
19.进一步的,引物预混液中的特异性引物的核苷酸序列分别如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5所示,所述sgrna和探针的序列分别如seq id no.6、seq id no.7所示。
20.作为本发明的第三个方面,一种上述所述的用于检测婴儿配方乳粉中克罗诺杆菌属的crispr one pot试剂盒在检测婴儿配方乳粉中是否含有克罗诺杆菌属中的应用。
21.本发明的婴儿配方乳粉中克罗诺杆菌属的crispr one pot检测方法,其有益效果是:
22.1、可以提高克罗诺杆菌属检测特异性,lamp等温扩增后,再结合crispr基于特征序列的高特异性识别和检测,极大地增强了克罗诺杆菌属分子检测方法的特异性。
23.2、操作时间短,在一个反应管中,将恒温扩增lamp和crispr检测反应结合成一步法完成实验,比较克罗诺杆菌属pcr-crispr检测技术,避免了在pcr扩增后取出产物进行第二步crispr反应造成的潜在污染,抗污染能力大大提高。
24.3、利用荧光仪直接读取荧光信号及数据,可以实现现场检测,在35min以内完成。
25.4、本发明是crispr one pot检测方法在国际食品安全领域方面的创新性技术开拓和应用探索,是首次将该一步法检测技术在婴儿配方乳粉安全领域进行的创新性研究及应用,将提高我国在食品安全检测领域的国际话语权,具有良好的应用前景。
附图说明
26.图1为引物lamp-primer1特异性扩增图。
27.图2为引物lamp-primer4特异性扩增图。
28.图3为引物lamp-primer7特异性验证。
29.图4为引物lamp-primer7包容性验证。
30.图5为实施例3的crispr one pot检测方法针对克罗诺杆菌属的检测灵敏度。
31.图6为实施例4的crispr one pot检测方法对人工污染环境样品的检测结果。
32.图7为实施例5的crispr one pot检测方法对模拟生产环境样品的检测结果。
具体实施方式
33.以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或厂商提供的条件进行。
34.本发明的实施例的检测过程:乳粉中克罗诺杆菌属通过增菌富集,然后取增菌液
提取dna,以克罗诺杆菌属基因组为阳性对照,以其它细菌dna为阴性对照,无菌水作为空白对照,使用特异性引物进行lamp扩增,同时在一管式体系中进行crispr反应,并同步实时检测荧光。参考方法选用gb 4789.40-2016《食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》。主要开展包容性和排他性、相对准确度、灵敏度和特异性参数测试评价。
35.本发明的cas12b蛋白购自tolo biotech.公司。
36.实施例1
37.(1)引物和探针的设计
38.本实施例通过基因组比较和候选靶点选择,以16s rrna基因保守序列、克罗诺杆菌菌株特异性关键基因序列、编码致病性相关基因序列及其他文献报导可区分菌株的特异性序列候选区域,针对每个区域设计扩增引物和向导rna靶向序列进行生物信息学测试,挑选效率最高和特异性最好的组合,通过ncbi在线工具进行序列分析和比对,利用lamp引物设计网站:http://primerexplorer.jp/lampv5e/index.html设计出3组引物,同时设计向导rna组合,见表1。
39.经过针对阴性菌株的特异性测试,结果见图1-图3。实验发现,lamp-primer1、lamp-primer4针对阴性菌株的非特异性扩增较多(图1,图2),不符合特异性检测克罗诺杆菌属的要求,lamp-primer7引物组合的特异性扩增效果较好(图3)。结合crispr反应结果,最终筛选出一组lamp-primer7,crispr反应的报告探针为aaaaaa(5’fam修饰,3’bhq1修饰),序列见表1。所有引物/探针均由上海生工生物有限公司合成,并采用crispr检测方法对设计合成的引物探针进行初步筛选,进一步验证上述引物、sgrna的有效性和特异性。所有rna序列由南京金斯瑞生物科技有限公司合成。
40.表1引物和探针序列
[0041][0042]
(2)基因组dna提取与核酸蛋白分析仪测定
[0043]
利用bpw缓冲蛋白胨水对克罗诺杆菌属的过夜培养菌悬液进行10倍梯度稀释。取
各稀释度菌液2ml采用细菌基因组dna提取试剂盒提取基因组dna,提取步骤按照试剂盒说明书进行,最终将核酸溶解在50μl te缓冲液中。对提取的核酸用超微量分光光度计进行浓度和纯度的测定,确保提取核酸的a260/a280在1.8~2.0之间。
[0044]
(3)crispr one pot反应
[0045]
采用lamp和crispr方法同时扩增及检测产物荧光。于abi7500荧光pcr仪(美国,abi公司)上进行荧光检测,设置60℃恒温程序,每1分钟检测一次fam荧光,持续40min。反应体系见表2。
[0046]
表2crispr one pot反应体系
[0047][0048]
(5)本发明的平板计数方法
[0049]
对10倍梯度稀释的纯菌液进行平板计数,吸取1ml各稀释度菌悬液分别加于2个无菌平皿内。及时将15~20ml冷却至46℃的营养琼脂培养基倾注平皿,并转动平皿使其混合均匀。待琼脂凝固后,36℃倒置培养24h
±
2h。选取菌落数在30~300cfu之间、无蔓延菌落生长的平板计数菌落总数,每个稀释度菌落数应取两个平板计数结果的平均数。
[0050]
(6)本发明的crispr one pot结果判定
[0051]
ct值≤30为筛选阳性;
[0052]
ct值>35为筛选阴性;
[0053]
ct值30-35之间的重复检测,结果≤35的为筛选阳性,>35为筛选阴性。
[0054]
实施例2特异性、包容性和排他性检测
[0055]
(1)特异性
[0056]
为验证扩增反应的特异性,利用lamp和crispr方法对克罗诺杆菌属(atcc25944)基因组dna、表4中所列其他常见弧菌和食源性致病菌dna进行检测。结果发现克罗诺杆菌属出现阳性扩增信号,而其他常见菌及食源性致病菌检测均没有明显扩增信号(见图3)。发现表1的lamp-primer7引物探针组合能特异扩增克罗诺杆菌属,表1的lamp-primer1引物探针组合和表1的lamp-primer4引物探针组合不能特异扩增克罗诺杆菌属(图1,图2)。
[0057]
结果表明,lamp-primer7引物探针组具有良好的特异性。后续实施例的反应体系采用lamp-primer7引物探针组合进行。
[0058]
(2)包容性
[0059]
包容性是指确定某一检测方法从众多菌中检测到目标菌的能力。采用8株克罗诺杆菌属参比菌株和31株实验室分离株,用克罗诺杆菌属crispr one pot法进行检测,结果均为阳性,表明克罗诺杆菌属crispr one pot法的包容性良好(见图4)。具体结果见表3。
[0060]
表3包容性实验结果
[0061]
[0062][0063]
(3)排他性
[0064]
排他性是指某一检测方法对可能引起交叉反应的相关非目标菌株的抗干扰能力。选择30株非克罗诺杆菌属的纯化标准菌株,用crispr one pot检测方法进行测试,结果如表4所示。30株非克罗诺杆菌属的纯化标准菌株的crispr one pot检测结果均为阴性,表明该方法在排他性上表现良好。
[0065]
表4 crispr one pot检测方法的排他性实验结果
[0066][0067]
实施例3纯菌液检测灵敏度
[0068]
10倍梯度稀释克罗诺杆菌属(atcc 25944)纯菌液,分别吸取2ml提取dna进行检测,结果发现可稳定检测到102(图5,表5)。
[0069]
表5 crispr one pot检测方法针对克罗诺杆菌属的检测灵敏度
[0070]
菌浓度重复1重复2重复3重复4重复5107+++++106+++++105+++++104+++++103+++++102+++++101+-+
‑‑
[0071]
实施例4人工污染样品的检测
[0072]
选择经传统方法和crispr one pot检测方法验证的克罗诺杆菌属的奶粉样品作
为添加基质。
[0073]
取克罗诺杆菌属(atcc 25944)的过夜培养菌悬液分别进行10倍梯度稀释并平板计数。根据添加菌液的平板计数结果,估计污染样品中克罗诺杆菌属含量为《10~104cfu/100g。
[0074]
同时取10~104稀释度菌液各1ml分别添加到盛有100g奶粉样品的均质袋中,各添加浓度分别设5个样品重复,另取1份100g奶粉样品不添加菌液作为空白对照,上述样品中加入900mlbpw缓冲蛋白胨水,用拍击式均质器拍击2min,制成系列含有不同浓度的人工污染样品。本试验将克罗诺杆菌的增菌富集时间缩短至12h。
[0075]
经过12h的增菌,取各样品匀液2ml分别利用试剂盒法提取细菌基因组dna,最终将核酸溶解在50μl te缓冲液中,进行crispr检测。
[0076]
结果见图6和表6。
[0077]
表6 crispr one pot检测方法对人工污染样品的检测结果
[0078][0079]
结果显示:4个不同污染水平的奶粉样品均呈阳性扩增。检出限达到《10cfu/100g。
[0080]
实施例5模拟生产环境样品检测
[0081]
模拟生产环境样品,使用无菌棉签进行环境取样,阳性对照使用棉签涂抹阳性菌(克罗诺杆菌属(atcc 25944))株人工污染的平板,进行dna提取并进行一步法的检测,结果如图7所示,阳性对照检测阳性,生产环境中检测阴性。并同时使用传统方法进行验证,结果与预期相符。
[0082]
以上所述仅是本发明的实施方式的举例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1