头孢克肟的精制方法与流程
1.本发明属于制药技术领域,具体而言,涉及一种头孢克肟的精制方法。
背景技术:
2.头孢克肟又称为氨噻肟烯头孢菌素、世伏素、世福素,属于第三代口服头孢菌素类抗生素,抗菌谱广,对于一些革兰氏阴性菌和革兰氏阳性菌都有一定的抗菌作用。其机制主要是通过抑制细菌细胞壁的合成,可以发挥杀菌作用。临床上用于治疗由链球菌属(肠球菌除外)、肺炎链球菌、淋球菌、大肠杆菌、卡他布兰汉球菌、沙雷杆菌、枸橼酸杆菌、阴沟肠杆菌、产气肠杆菌、流感嗜血杆菌、克雷伯杆菌属、沙雷菌属、变形杆菌属及流感杆菌等引起的细菌感染性疾病。
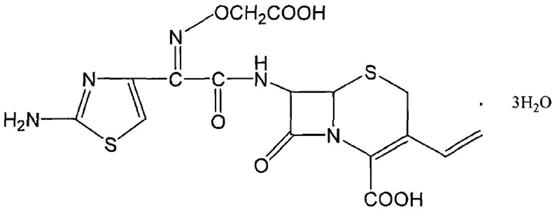
3.头孢克肟的化学名称为:(6r,7r)-7[[(z)-2-(2-氨基-4-噻唑基)-2-[(羧甲氧基)亚氨基]乙酰基]氨基]-3-乙烯基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸三水化合物,分子式为c
16h15
n5o7s2·
3h2o,分子量为507.49,结构式为:
[0004][0005]
中国专利文献cn103980292b公开了一种头孢克肟三水合物的结晶方法,包括以下步骤:(1)将头孢克肟在水中形成悬浮液,然后在其中加入碱使头孢克肟完全溶解,形成碱溶液;(2)配制水和有机溶剂的混合溶剂,所述混合溶剂的体积为步骤(1)中所述头孢克肟重量的10-18倍,水与有机溶剂的体积比为1:1,将上述混合溶剂升温至20℃-45℃,优选30℃-40℃,用2重量%-15重量%,优选8重量%-15重量%的酸调节所述混合溶剂的ph至2-4,优选2.5-3.2;(3)将所述碱溶液滴加至所述混合溶剂中,并且在滴加过程中用2重量%-15重量%,优选8重量%-15重量%的酸控制溶液的ph为2-4,优选2.5-3.2;(4)滴加完成后,降温析晶。该专利文献在有益效果中指出,所得产品流动性好,产品质量高,一般纯度为99.4%-99.5%左右,稳定性好。但是,本发明人重复cn103980292b的实施例1,所得到的头孢克肟的纯度为99.5%左右,但是所得到晶体结晶水活度太高、稳定性不佳,粒径均一性不好、流动性差,且基因毒性杂质(2-巯基苯并噻唑)高。这是因为该发明专利采用的是“对滴加”的结晶方式,即将头孢克肟碱溶解液与酸一起滴加到混合溶剂中,此种方法结晶速度快、晶体结晶度差、水活度高,从而产品稳定性不够好。另外,由于控制结晶终点ph为2-4(头孢克肟等电点为ph=2,等电点附近溶解度最低,析晶量大),例如在实施例1中控制结晶终点为2.70-2.90,致使晶体的析晶量不充分,收率受到影响,不利于产业化。
[0006][0007]
2006年爆发甲磺酸奈非那韦(维拉赛特锭)事件后,欧洲药品管理局(ema)随即颁布了《基因毒性杂质限度指南》,人用药品注册技术要求国际协调会议(ich)与美国食品与药品监督管理局(fda)出台了相应的法规,中国国家食品药品监督管理总局也密切跟踪国际药品质量控制技术要求,不断完善现有药典收载技术指南。2-巯基苯并噻唑(以下简称m)为头孢克肟合成过程中产生的副产物,从结构看属于基因毒性杂质,在头孢克肟粗品中存在一定量的残留,目前国内外对基因毒性杂质残留量要求也越来越低。
[0008]
因此,本发明人致力于研究和改进头孢克肟的精制方法,以寻求得到一种产品品质好,即纯度高、基因毒性杂质m含量低、晶体粒度分布窄(粒度均一性好)、流动性好、结晶度高且稳定性好的头孢克肟。
技术实现要素:
[0009]
技术问题
[0010]
因此,本发明的目的在于提供一种工艺设计合理的头孢克肟的精制方法,所制备的头孢克肟产品品质好,即纯度高、几乎不含基因毒性杂质m、晶体粒度分布窄(粒度均一性好)、流动性好、结晶度高且稳定性好。
[0011]
技术方案
[0012]
根据本发明,本发明提供的头孢克肟的精制方法,包括如下步骤:
[0013]
(1)头孢克肟粗品溶解脱色
[0014]
在0℃~10℃下,将头孢克肟粗品与水混合,而后加入碱使其溶解,得到溶清液;采用酸将该溶清液的ph调至4.5~6.5后,进行活性炭脱色处理;
[0015]
(2)头孢克肟三步骤结晶
[0016]
第一结晶:在25℃~35℃,向活性炭脱色的头孢克肟溶清液加入水和丙酮,在搅拌下,逐渐加入酸使头孢克肟析出至溶液呈雾状,养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟;
[0017]
第二结晶:在25℃~35℃,在养晶之后,在搅拌下,向第一结晶液中逐渐加入酸至ph值为2.5~3.0,然后养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟;
[0018]
第三结晶:在25℃~35℃,在养晶之后,在搅拌下,向第二结晶液中逐渐加入酸至ph值为1.8~2.2,然后养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟;
[0019]
而后,将第三结晶液过滤、洗涤、干燥,得到头孢克肟晶体。
[0020]
有益效果
[0021]
与现有技术相比,本发明的优点在于:
[0022]
(1)头孢克肟在溶解过程采用0℃~10℃的低温条件,大大地降低了在溶解过程中由于使用碱液而造成杂质升高的风险;
[0023]
(2)在得到头孢克肟溶清液后,采用酸将该溶清液的ph调至4.5~6.5后,进行活性炭脱色处理,在4.5~6.5的ph值下进行活性炭脱色,有效地避免在高ph下头孢克肟分解产生杂质,且弱酸性条件下脱色活性炭吸附色素和杂质效果最好;
[0024]
(3)在头孢克肟结晶过程采用三段梯度结晶,出晶速率均匀,晶体生长完全,且在三段梯度结晶中用酸调完ph后补加入一定量的丙酮可以有效改善晶体颗粒,使体系的晶体粒度分布窄、流动性好、堆密度较大,同时可以有效降低产品杂质以及基因毒性杂质m;
[0025]
(4)头孢克肟为含三个结晶水的晶体,不同结晶水的活度体现出晶体的结晶度的高低,水活度测量值越低说明水与头孢克肟晶体结合越紧密、参与结晶过程晶格形成,说明结晶度越好,而结晶度好的头孢克肟具有良好的稳定性,采用本发明工艺生产的头孢克肟产品结晶度高、稳定性好。
附图说明
[0026]
图1至图7示出采用马尔文激光粒度仪对实施例1-5和对比实施例1-2精制的头孢克肟晶体进行粒度分析的结果。
具体实施方式
[0027]
下面更具体地描述本发明的头孢克肟的精制方法。
[0028]
在所述步骤(1)头孢克肟粗品溶解脱色中,在0℃~10℃下,将头孢克肟粗品与水混合,而后加入碱使其溶解,得到溶清液;采用酸将该溶清液的ph调至4.5~6.5后,进行活性炭脱色处理。
[0029]
其中,所述头孢克肟粗品是工业生产中常规的头孢克肟粗品,例如,在合成反应中制备的、未经纯化的头孢克肟粗品,一般纯度低于99%(hplc面积归一法)。
[0030]
首先,将水投入到反应釜中,再投入头孢克肟粗品,头孢克肟粗品与水的比例为1:15~20,开启搅拌,温度控制在0~10℃,分批次将碱投入到反应釜中使得头孢克肟完全溶清,所使用的碱可以为碳酸钠、碳酸氢钠、醋酸钠、磷酸氢二钠、异辛酸钠、氨水等其中一种或两种以上的混合物,且优选为碳酸钠、碳酸氢钠、醋酸钠的一种或两种以上的混合物。其中,所述碱的用量可以为使头孢克肟粗品完全溶解,且优选当所述碱为一元碱时,头孢克肟粗品与一元碱的摩尔比为1:1~1.2;当所述碱为二元碱时,头孢克肟粗品与二元碱的摩尔比为1:0.5~0.6。
[0031]
头孢克肟为四元环内酰胺类抗菌素,其结构特性使其遇到碱性物质容易被破坏开环,所以低温、低酸碱度对稳定其结构具有重要作用。本发明在头孢克肟粗品溶解过程中采用0℃~10℃的低温条件,且均使用弱碱,有效地降低了在溶解过程中造成杂质升高的风险。
[0032]
在头孢克肟粗品经碱溶得到溶清液后,采用酸将该溶清液的ph调至4.5~6.5、优选5.0~6.5后,进行活性炭脱色处理。其中,所使用的酸为硫酸、盐酸、磷酸、醋酸中的一种或多种的混合物,酸的浓度为5wt%~15wt%;在活性炭脱色处理中,活性炭的用量为头孢克肟粗品重量的2wt%~5wt%,脱色处理时间为30~120分钟,而后过滤,用头孢克肟粗品重量2~4倍的水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0033]
在4.5~6.5的ph值下进行活性炭脱色,有效地降低在脱色过程中由于ph偏高而造成杂质升高的风险(通常头孢克肟通过碱液溶清后ph约7.5-8.5),头孢克肟为四元环内酰胺类抗菌素,其结构特性使其在碱性或弱碱性环境下容易被破坏开环,所以控制ph值为4.5~6.5对稳定其结构具有重要作用。
[0034]
在所述步骤(2)头孢克肟三步骤结晶中,在第一结晶中,在25℃~35℃,向活性炭脱色的头孢克肟溶清液加入水和丙酮,在搅拌下,逐渐加入酸使头孢克肟析出至溶液呈雾状态,养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟。其中,所使用的酸为1~2mol/l硫酸、盐酸、醋酸或磷酸,且优选1~2mol/l盐酸。
[0035]
具体地,在第一结晶中,在25℃~35℃,优选30℃~35℃,向活性炭脱色的头孢克肟溶清液加入水和丙酮,水的加入量为2.5~3.5ml/g头孢克肟粗品,丙酮的加入量为0.7~1.2ml/g头孢克肟粗品,优选0.8~1ml/g头孢克肟粗品;控制温度在25℃~35℃,优选30℃~35℃,在搅拌下,搅拌速度控制在250rpm以上,例如,搅拌速度控制在250~400rpm,在30~60分钟内均速滴加酸使头孢克肟析出至溶液呈雾状态,即明显析晶状态,以头孢克肟粗品重量计,约10wt%~20wt%的头孢克肟晶体析出;而后养晶30~240分钟,再向其中补加丙酮,丙酮加入量为0.2~1.0ml/g头孢克肟粗品,优选0.4~0.8ml/g头孢克肟粗品,之后继续养晶30~60分钟。
[0036]
在第二结晶中,在25℃~35℃,在养晶之后,在搅拌下,向第一结晶液中逐渐加入酸至ph值为2.5~3.0,然后养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟;其中,所使用的酸为1~2mol/l硫酸、盐酸、醋酸或磷酸,且优选1~2mol/l盐酸。
[0037]
具体地,在第二结晶中,控制温度在25℃~35℃,优选30℃~35℃,在搅拌下,搅拌速度控制在250rpm以上,例如,搅拌速度控制在250~400rpm,在30~60分钟内向第一结晶液中均速滴加酸至ph值为2.5~3.0,然后养晶30~240分钟;而后,向其中补加丙酮,丙酮的加入量为0.2~1.0ml/g头孢克肟粗品,优选0.4~0.8ml/g头孢克肟粗品,之后继续养晶30~60分钟。
[0038]
在第三结晶中,在25℃~35℃,在养晶之后,在搅拌下,向第二结晶液中逐渐加入酸至ph值为1.8~2.2,然后养晶30~240分钟;而后,向其中补加丙酮,继续养晶30~60分钟;其中,所使用的酸为1~2mol/l硫酸、盐酸、醋酸或磷酸,且优选1~2mol/l盐酸。
[0039]
具体地,在第三结晶中,控制温度在25℃~35℃,优选30℃~35℃,在搅拌下,搅拌速度控制在250rpm以上,例如,搅拌速度控制在250~400rpm,在30~60分钟内向第二结晶液中均速滴加酸至ph值为1.8~2.2,然后养晶30~240分钟;而后,向其中补加丙酮,丙酮的加入量为0.2~1.0ml/g头孢克肟粗品,优选0.4~0.8ml/g头孢克肟粗品,之后继续养晶30~60分钟。
[0040]
然后,将第三结晶液进行过滤,得到的头孢克肟晶体用水洗涤,再用丙酮/水混合液洗涤,其中丙酮与水的体积比可以为1:1~10,最后在真空条件下进行干燥,得到头孢克肟晶体产品。
[0041]
下面通过实施例更具体地说明本发明,但本发明的保护范围不局限于如下实施例中。
[0042]
实施例1
[0043]
(1)头孢克肟粗品溶解脱色
[0044]
首先,将950g水投入到反应釜中,再投入头孢克肟粗品50g(纯度为98.8%,hplc面积归一法),开启搅拌,温度控制0~5℃,分批次将碳酸氢钠9.2g投入到反应釜中使得头孢克肟完全溶清,溶清后用5wt%盐酸将ph调至6.0,加入2g活性炭进行脱色处理30分钟,而后过滤,并用150ml水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0045]
(2)头孢克肟三步骤结晶
[0046]
向活性炭脱色的头孢克肟溶清液中,加入145ml水和40ml丙酮,控制料液温度在30℃,在350rpm搅拌下,在30-35分钟内均速滴加1.0mol/l盐酸至明显出晶状态(雾状),养晶180分钟,养晶结束后向料液中补加入丙酮20ml,继续养晶60分钟;
[0047]
控制料液温度30℃,在350rpm搅拌下,用时30-35分钟向第一结晶液中均速滴加1.0mol/l盐酸至ph为2.5,养晶60分钟,而后向料液中补加入丙酮20ml,继续养晶60分钟;
[0048]
控制料液温度30℃,在350rpm搅拌下,用时30-35分钟向第二结晶液中均速滴加1.0mol/l盐酸至ph为2.0,养晶60分钟,之后向料液中补加入丙酮20ml,继续养晶60分钟;
[0049]
之后,经过滤、水洗涤、丙酮/水(体积比1:1)混合液洗涤、真空干燥,得到头孢克肟晶体产品45.7g。
[0050]
实施例2
[0051]
(1)头孢克肟粗品溶解脱色
[0052]
首先,将950g水投入到反应釜中,再投入头孢克肟粗品50g(纯度为98.8%,hplc面积归一法),开启搅拌,温度控制0~5℃,分批次将碳酸氢钠9.2g投入到反应釜中使得头孢克肟完全溶清,溶清后用5wt%盐酸将ph调至6.0,加入2g活性炭进行脱色处理60分钟,而后过滤,并用150ml水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0053]
(2)头孢克肟三步骤结晶
[0054]
向活性炭脱色的头孢克肟溶清液中,加入125ml水和50ml丙酮,控制料液温度在35℃,在280rpm搅拌下,在50-60分钟内均速滴加1.5mol/l盐酸至明显出晶状态(雾状),养晶180分钟,养晶结束后向料液中补加入丙酮40ml,继续养晶30分钟;
[0055]
控制料液温度35℃,在280rpm搅拌下,用时50-60分钟向第一结晶液中均速滴加1.5mol/l盐酸至ph为2.5,养晶180分钟,而后向料液中补加入丙酮40ml,继续养晶30分钟;
[0056]
控制料液温度35℃,在280rpm搅拌下,用时50-60分钟向第二结晶液中均速滴加1.5mol/l盐酸至ph为2.0,养晶180分钟,之后向料液中补加入丙酮40ml,继续养晶60分钟;
[0057]
之后,经过滤、水洗涤、丙酮/水(体积比1:1)混合液洗涤、真空干燥,得到头孢克肟晶体产品45.2g。
[0058]
实施例3
[0059]
(1)头孢克肟粗品溶解脱色
[0060]
首先,将950g水投入到反应釜中,再投入头孢克肟粗品50g(纯度为98.5%,hplc面积归一法),开启搅拌,温度控制7~10℃,分批次将醋酸钠9.1g投入到反应釜中使得头孢克肟完全溶清,溶清后用5wt%醋酸将ph调至5.0,加入2.5g活性炭进行脱色处理30分钟,而后过滤,并用150ml水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0061]
(2)头孢克肟三步骤结晶
[0062]
向活性炭脱色的头孢克肟溶清液中,加入175ml水和50ml丙酮,控制料液温度在30℃,在350rpm搅拌下,在50-60分钟内均速滴加1.5mol/l盐酸至明显出晶状态(雾状),养晶90分钟,养晶结束后向料液中补加入丙酮20ml,继续养晶60分钟;
[0063]
控制料液温度30℃,在350rpm搅拌下,用时30-40分钟向第一结晶液中均速滴加1.5mol/l盐酸至ph为3.0,养晶90分钟,而后向料液中补加入丙酮20ml,继续养晶60分钟;
[0064]
控制料液温度30℃,在350rpm搅拌下,用时30-40分钟向第二结晶液中均速滴加
1.5mol/l盐酸至ph为2.0,养晶180分钟,之后向料液中补加入丙酮20ml,继续养晶60分钟;
[0065]
之后,经过滤、水洗涤、丙酮/水(体积比1:1)混合液洗涤、真空干燥,得到头孢克肟晶体产品46.1g。
[0066]
实施例4
[0067]
(1)头孢克肟粗品溶解脱色
[0068]
首先,将950g水投入到反应釜中,再投入头孢克肟粗品50g(纯度为98.5%,hplc面积归一法),开启搅拌,温度控制0~5℃,分批次将醋酸钠9.1g投入到反应釜中使得头孢克肟完全溶清,溶清后用5wt%磷酸将ph调至5.0,加入2.5g活性炭进行脱色处理30分钟,而后过滤,并用150ml水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0069]
(2)头孢克肟三步骤结晶
[0070]
向活性炭脱色的头孢克肟溶清液中,加入145ml水和40ml丙酮,控制料液温度在30℃,在300rpm搅拌下,在50-60分钟内均速滴加2.0mol/l盐酸至呈明显出晶状态(雾状),养晶240分钟,养晶结束后向料液中补加入丙酮40ml,继续养晶60分钟;
[0071]
控制料液温度30℃,在300rpm搅拌下,用时30-40分钟向第一结晶液中均速滴加2.0mol/l盐酸至ph为3.0,养晶120分钟,而后向料液中补加入丙酮20ml,继续养晶60分钟;
[0072]
控制料液温度30℃,在300rpm搅拌下,用时30-40分钟向第二结晶液中均速滴加2.0mol/l盐酸至ph为2.0,养晶180分钟,之后向料液中补加入丙酮40ml,继续养晶60分钟;
[0073]
之后,经过滤、水洗涤、丙酮/水(体积比1:1)混合液洗涤、真空干燥,得到头孢克肟晶体产品45.9g。
[0074]
实施例5
[0075]
(1)头孢克肟粗品溶解脱色
[0076]
首先,将950g水投入到反应釜中,再投入头孢克肟粗品50g(纯度为99%,hplc面积归一法),开启搅拌,温度控制8~10℃,分批次将碳酸钠5.9g投入到反应釜中使得头孢克肟完全溶清,溶清后用5wt%硫酸将ph调至6.5,加入1.5g活性炭进行脱色处理30分钟,而后过滤,并用150ml水洗涤活性炭,洗涤液并入活性炭脱色的头孢克肟溶清液中。
[0077]
(2)头孢克肟三步骤结晶
[0078]
向活性炭脱色的头孢克肟溶清液中,加入150ml水和40ml丙酮,控制料液温度在35℃,在300rpm搅拌下,在50-60分钟内均速滴加1.5mol/l盐酸至呈明显出晶状态(雾状),养晶120分钟,养晶结束后向料液中补加入丙酮20ml,继续养晶30分钟;
[0079]
控制料液温度35℃,在300rpm搅拌下,用时30-40分钟向第一结晶液中均速滴加1.5mol/l盐酸至ph为2.5,养晶120分钟,而后向料液中补加入丙酮20ml,继续养晶30分钟;
[0080]
控制料液温度35℃,在300rpm搅拌下,用时30-40分钟向第二结晶液中均速滴加1.5mol/l盐酸至ph为2.0,养晶120分钟,之后向料液中补加入丙酮20ml,继续养晶60分钟;
[0081]
之后,经过滤、水洗涤、丙酮/水(体积比1:1)混合液洗涤、真空干燥,得到头孢克肟晶体产品46.3g。
[0082]
对比实施例1
[0083]
按照cn103980292b实施例1的方法对35g头孢克肟粗品(纯度98.5%,hplc面积归一法)进行精制,得到头孢克肟晶体产品31.5g。
[0084]
对比实施例2
[0085]
按照cn103980292b实施例2的方法对35g头孢克肟粗品(纯度98.5%,hplc面积归一法)进行精制,得到头孢克肟晶体产品31.7g。
[0086]
试验例
[0087]
对本发明实施例1-5制备的头孢克肟晶体和对比实施例1-2制备的头孢克肟晶体进行如下测试:
[0088]
按照2020版中国药典头孢克肟有关物质方法测量所得头孢克肟的纯度;
[0089]
采用高效液相色谱法测量所得头孢克肟中聚合物的含量;
[0090]
采用高效液相色谱法测量所得头孢克肟中基因毒性杂质m的含量;
[0091]
按照2020版中国药典头孢克肟有关物质方法进行60℃5天的稳定性实验;
[0092]
采用瑞士novasina公司水活度测试仪测定了水活度;
[0093]
采用马尔文激光粒度仪进行粒度分析,图1至图7示出采用马尔文激光粒度仪对实施例1-5和对比实施例1-2精制的头孢克肟晶体进行粒度分析的结果,其中包括粒度分布图。
[0094]
实验结果如下:
[0095]
表1:本发明实施例1-5制备的头孢克肟晶体和对比实施例1-2制备的头孢克肟晶体收率、纯度、聚合物含量和稳定性数据
[0096]
表2 基因毒性杂质m检测数据:
[0097]
名称m测试值去除率粗品56.3ppm 实施例1未检出100%实施例2未检出100%实施例30.15ppm99.7%实施例40.25ppm99.5%实施例50.09ppm99.8%对比实施例123.7ppm57.9%对比实施例229.6ppm47.4%
[0098]
表3:水活度测定值:
[0099]
名称水活度测试值实施例10.23%实施例20.20%实施例30.15%实施例40.17%实施例50.19%对比实施例11.26%对比实施例21.63%
[0100]
由此可见,根据本发明的头孢克肟的精制方法得到的头孢克肟晶体纯度高,聚合物含量低,基因毒性杂质2-巯基苯并噻唑去除率甚至可以达到100%(未检测出),结晶度高,且稳定性好。
[0101]
表4 粒径数据:
[0102]
名称径距一致性实施例11.5450.435实施例21.4160.339实施例31.3650.335实施例41.3890.326实施例51.5360.426对比实施例12.4701.520对比实施例22.2500.718
[0103]
在粒径分布图中的主要参数“径距”和“一致性”,“径距”表明颗粒的分布宽度:(d(0.9)-d(0.1))/d(0.5)。径距越大,表明分布宽度越宽,颗粒大小跨度越大,越不均匀。径距越小,表明分布宽度越窄,晶体粒度大小越集中、均匀。“一致性”表示的是粒径分布偏离中间的程度,意义跟数列的标准差一个意思,“一致性”数据越大说明粒径越不均匀,数据越小说明粒径越均匀。另外,从粒径分布图的峰形来看本发明工艺制备的头孢克肟粒度分布图为单峰,而对比对比实施例制备的头孢克肟粒度分布图为多峰,产品粒度不均匀。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1