具有抗线虫活性的thermolides类化合物及其制备方法和应用
1.本发明涉及生物农药领域,具体涉及具有抗线虫活性的thermolides类化合物,还涉及上述化合物的制备方法和应用。
背景技术:
2.线虫是广泛分布于淡水、海水和土壤等环境中的一种无脊椎动物,目前全已报道发现的线虫有23000多种,其种类超过100万种,植物寄生线虫占据其中的10%左右。植物寄生线虫作为一种重要的病原物,对农作物、林木、食用菌等均能造成严重危害,每年因植物寄生线虫引起的农业经济损失占世界主要经济作物年损失率的12.3%,超过了1000亿美元。目前线虫引起的病害已成为超过细菌和病毒,成为世界第二大病害,仅次于真菌病害。我国处于温带和亚热带气候,适宜线虫的生长和繁殖,因此我国也深受线虫的危害,世界性重要线虫病害在我国都有发生。线虫危害严重,一般危害时就能导致某类作物减产10%~40%。严重病害时能导致70~80%的减产,甚至绝收。我国17个省、市、自治区均受到松材线虫的危害,不仅影响了我国的国民经济,也破坏了自然景观和生态环境。植物寄生线虫在国内外危害都较严重,严重影响经济的增长,因此有效防治线虫病是一个亟需解决的重大问题。
3.生物农药因其天然无公害、高效且环境友好型等原因,成为近年农药开发的新趋势。2012 年,牛雪梅课题组从嗜热真菌talaromyces thermophilμs ym3-4中分离到thermolides类化合物。其中thermolidea和b有较好的抗线虫活性,其抗线虫能力和阿维菌素相似,对m.incognita, xylophilμs 5和p.redivivμs等线虫表现出较好的抗性。但因其在原始宿主中产量低,原始菌株培养条件苛刻等原因,一直未能得到较好的应用。zhang jinmei et cl.发表了heterologous andengineered biosynthesis of nematocidal polyketide-nonribosomal peptide hybrid macrolactone fromextreme thermophilic fungi通过在模式微生物中实现了thermolides高效合成。但是合成的 thermolides化合物是否具有生物活性并未见报道。
技术实现要素:
4.有鉴于此,本发明的目的之一在于提供具有抗线虫活性的thermolides类化合物;本发明的目的之二在于含有所述具有抗线虫活性的thermolides类化合物的农药;本发明的目的之三在于提供含有所述具有抗线虫活性的thermolides类化合物的农药。
5.为达到上述目的,本发明提供如下技术方案:
6.1、具有抗线虫活性的thermolides类化合物,所述化合物的通式如下:
[0007][0008]
其中,r1=乙酰基或丁酰基,r2=异丙基或苯乙基,r3=甲基或异丙基。
[0009]
优选的,所述化合物结构式如下:
[0010][0011]
2、所述具有抗线虫活性的thermolides类化合物的在制备防治线虫病的农药中的应用。
[0012]
3、含有所述具有抗线虫活性的thermolides类化合物的农药。
[0013]
优选的,所述农药中thermolides类化合物有效浓度为大于25μg/ml。
[0014]
本发明的有益效果在于:本发明筛选具有抗线虫活性的thermolides类化合物,通过marfey 衍生得到一类l型氨基酸的thermolides产物,不同于已有文献报道的d型氨基酸产物;通过基因组挖掘和组合生物合成方式得到苯丙氨酸参入和非天然氨基酸参入的thermolides类似物;通过代谢工程改造,获得不同酰基化修饰的thermolides衍生物;所得化合物抗线虫活性高于原有化合物,为后期农业生产上线虫的防治提供更多高效、安全的候选药物。
具体实施方式
[0015]
下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0016]
实施例1、化合物的制备
[0017]
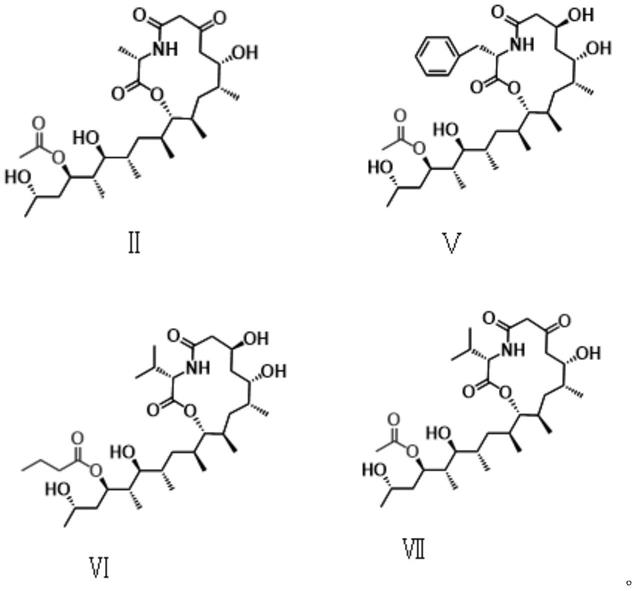
化合物ii和vii制备:将来自talaromyces thermophilus nrrl 2155的基因thmabe (pks,nrps和acetyltransferase)在构巢曲霉里异源表达,大量发酵异源表达菌株,发酵结束后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用mci柱层析进行粗分,溶剂为甲醇-水,洗脱程序为40%,50%,60%,70%,80%,90%,100%甲醇,每个浓度洗脱两个柱体积,合并得到含化合物ii的组分和含化合物vii的组分。随后采用sephadex lh-20 (200mm
×
20mm)再次分离,甲醇为溶剂。所得粗品再次经过制备液相(柱子型号:ymcods-a 5μm 120a(10
×
250mm))分离,73%甲醇水等度洗脱,得到化合物ii纯品2mg,化合物vii纯品14mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表1和表2所示。
[0018]
化合物ii鉴定:无色油状;正离子模式下hr tofms m/z 566.3299[m+na]
+
,c
28h49
no9的计算值为566.3300,表明该化合物的分子为c
28h49
no9,结合表1中核磁数据,确定该化合物的结构,如下所示:
[0019][0020]
表1化合物ii的核磁数据归属
[0021]
[0022][0023]
化合物vii鉴定:无色油状;正离子模式下hr tofms m/z 594.3613[m+na]
+
,c
30h53
no9的计算值为594.3613,表明该化合物的分子式为c
30h53
no9,结合表2中核磁数据,确定该化合物的结构如下:
[0024][0025]
表2化合物vii的核磁数据归属
[0026]
[0027][0028]
化合物iii制备:将来自acremonium chrysogenum的基因acrab(pks,nrps在构巢曲霉里异源表达,大量发酵制备得到化合物x,将化合物x(22mg)喂养到thme(acetyltransferase) 的大肠杆菌表达菌株中,喂养结束后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用中压制备色谱mplc(x2(buchi,inc),柱子型号:80g反向c18柱)进行粗分,45%-80%甲醇-水梯度洗脱40min,收集并浓缩含有化合物iii的组分。经过制备液相 (制备柱型号:ymc ods-a 5μm 120a(10
×
250mm))分离,45%乙腈-水等度洗脱,得到化合物iii纯品1.5mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表3所示。
[0029][0030]
化合物iii鉴定:无色油状;根据表3中核磁数据归属,鉴定该化合物的结构如下。
[0031][0032]
表3、化合物iii的核磁数据归属
[0033][0034][0035]
化合物iv制备:将来自acremonium chrysogenum的基因acrabcd(pks,nrps,sdr和 acetyltransferase)组合在构巢曲霉里共表达,大量发酵异源表达菌株,发酵结束后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用中压制备色谱mplc(x2(buchi, inc),柱子型号:80g反向c18柱)进行粗分,45%-90%甲醇-水梯度洗脱40min,收集并浓缩含有化合物iv的组分。再次经过制备液相(制备柱型号:ymc ods-a 5μm 120a(10
×
250 mm))分离,41%乙腈-水等度洗脱,得到化合物iv纯品6.5mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表4所示。
[0036]
化合物iv鉴定:无色油状;根据表4中核磁数据归属,鉴定该化合物的结构如下:
[0037][0038]
表4、化合物iv的核磁数据归属
[0039]
[0040][0041]
化合物v制备:将来自fusarium catenulatum cgmcc 3.4704的基因fcaab(pks,nrps) 和来自talaromyces thermophilus nrrl 2155的基因thmc和thme(sdr和acetyltransferase) 组合在构巢曲霉里异源表达,大量发酵后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用中压制备色谱mplc(x2(buchi,inc),柱子型号:120g反向c18 柱)进行粗分,40%-90%甲醇-水梯度洗脱50min,收集并浓缩含有化合物v的组分。经过制备液相(制备柱型号:ymc ods-a 5μm 120a(10
×
250mm))进一步纯化,71%甲醇-水等度洗脱,得到化合物v纯品3mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表5所示。
[0042]
化合物v鉴定:无色油状;正离子模式下hr tofms m/z 644.3779[m+na]
+
,c
34h55
no9的计算值为644.3769,表明该化合物的分子式为c
34h55
no9,结合表5中核磁数据,确定该化合物的结构如下:
[0043][0044][0045]
表5、化合物v的核磁数据归属
[0046][0047]
化合物vi制备:将来自talaromyces thermophilus nrrl 2155的基因thmab(pks,nrps 在构巢曲霉里异源表达,大量发酵制备得到化合物ix,ix结构如下,将化合物ix喂养到thmc 和thme的大肠杆菌共表达菌株中,喂养结束后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用mci柱层析进行粗分,溶剂为甲醇-水,洗脱程序为40%,50%,60%,70%, 80%,90%,100%甲醇,每个浓度洗脱两个柱体积,化合物vi主要集中在80%和90%的组份中,合并减压浓缩干。然后使用半制备液相(制备柱型号:ymc ods-a 5μm 120a(10
×
250 mm))进一步纯化,80%甲醇-水等度洗脱得到化合物vi纯品3mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表6所示。
[0048][0049]
化合物vi鉴定:无色油状;正离子模式下hr tofms m/z 624.4085[m+na]
+
,c
32h59
no9的计算值为624.4082,表明该化合物的分子式为c
32h59
no9,结合表6中核磁数据,确定该化合物的结构如下所示:
[0050][0051]
表6、化合物vi的核磁数据归属
[0052]
[0053][0054]
化合物i和化合物viii制备:将来自talaromyces thermophilus nrrl 2155的基因 thmabce(pks,nrps,sdr和acetyltransferase)在构巢曲霉里异源表达,大量发酵异源表达菌株,发酵结束后,用丙酮:乙酸乙酯(1:3)反复萃取三次,减压浓缩干。采用mci柱层析进行粗分,溶剂为甲醇-水,洗脱程序为30%,40%,50%,60%,70%,80%,90%,100%甲醇,每个浓度洗脱两个柱体积,分别合并含化合物i和化合物viii的组分。随后采用 sephadex lh-20(150mm
×
10mm)再次分离,甲醇为溶剂。所得粗品再次经过制备液相 (柱子型号:ymc ods-a 5μm 120a(10
×
250mm))分离,65%甲醇水等度洗脱,得到化合物i纯品2mg,75%甲醇水等度洗脱,得到化合物viii纯品11mg。氘代丙酮溶解,进行核磁鉴定,化合物归属如表7和表8所示。
[0055][0056]
化合物i鉴定:无色油状;根据表7中核磁数据归属,将其与已报道的thermolide a碳谱数据进行比较,确定了该化合物的结构如下。
[0057]
表7、化合物1的核磁数据归属
[0058]
[0059][0060]
化合物viii鉴定:无色油状;正离子模式下hr tofms m/z 596.3773[m+na]
+
,c
30h55
no9的计算值为596.3769,表明该化合物的分子式为c
30h55
no9,结合表8中核磁数据,确定该化合物的结构。
[0061][0062]
表8、化合物viii的核磁数据归属
[0063]
[0064][0065]
实施例2、thermolides类化合物抗线虫效果
[0066]
将实施例1中的化合物ⅰ~
ⅷ
进行抗线虫实验,具体方法如下:分别将上述化合物ⅰ~
ⅷ
制备成浓度为50μg/ml和25μg/ml的溶液,然后分别加入400条线虫,处理30h后统计线虫的死亡情况,统计结果如表1所示。
[0067]
表1、thermolides类化合物抗线虫效果
[0068]
[0069][0070]
结果显示,化合物ⅰ~ⅳ中化合物ⅱ的抗线虫效果更佳,而化合物
ⅴ
、ⅵ、ⅶ在25μg/ml下处理30h线虫死亡率达到100%,因此化合物
ⅴ
、ⅵ、ⅶ效果更优。
[0071]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1