具有催化乙醇醛合成D-赤藓糖功能的酶及其应用
具有催化乙醇醛合成d-赤藓糖功能的酶及其应用
技术领域
1.本发明属于酶的定向进化改造和生物催化应用技术领域,涉及具有催化乙醇醛合成d-赤藓糖功能的酶及其应用。
背景技术:
2.d-赤藓糖一种带有还原性醛基的四碳糖,在常规条件下结构不稳定,可通过加氢反应进一步制备赤藓糖醇,赤藓糖醇是一种天然的健康糖醇,白色结晶体,以低含量的形式广泛存在于水果和发酵食品中。d-赤藓糖醇热量值在所有糖醇中是最低的,不会引起肠胃不适在正常的食用条件下,它不会导致不良的肠胃反应。d-赤藓糖d-赤藓糖目前被认为是一种重要的平台化合物之一,可以通过手性转化和非手性转化得到一系列应用范围广的产品,也可作为精细化工,制药的中间体,具有巨大的经济价值和广阔的应用前景。
3.目前d-赤藓糖有以下几种方法:专利(cn201410854859.9)报道了一种利用生物质糖制备d-赤藓糖的方法,该发明以生物质糖类作为原料,在水相条件碱性环境下催化得到d-赤藓糖。专利(cn97121416.6)公开了选自钴,镍和钌的金属的盐参与下将一种葡糖酸盐的水溶液与过氧化氢相接触制备d-赤藓糖的方法。
4.2-脱氧-d-核糖-5-磷酸醛缩酶是目前发现的可以将2个碳的醛类化合物缩合的醛缩酶。
5.目前,通过酶法合成d-赤藓糖的方法少有报道。以1c化合物如co2,甲酸或甲醛为原料,通过多酶级联合成4碳化合物d-赤藓糖的途径也几乎没有报道。开发一个绿色高效的d-赤藓糖合成途径是当前需要解决的难题。
技术实现要素:
6.本发明所要解决的技术问题是针对制备d-赤藓糖的方法原料复杂,酶法合成d
‑ꢀ
赤藓糖方法少有报道等问题,提供了具有催化乙醇醛合成d-赤藓糖功能的酶,所述酶能够催化乙醇醛快速合成大量的d-赤藓糖。本发明还提供了上述酶在以乙醇醛或甲醛为底物多酶级联反应合成d-赤藓糖途径中的应用,实现了双酶将甲醛转化为d-赤藓糖,甲醛可以通过co2的多酶催化获得,本发明为co2合成高附加值化合物途径提供了新思路,为将1c化合物合成多碳化合物提供了新路径。
7.为此,本发明第一方面提供了一种具有催化乙醇醛合成d-赤藓糖功能的酶,其为 2-脱氧-d-核糖-5-磷酸醛缩酶dera
eco
、2-脱氧-d-核糖-5-磷酸醛缩酶dera
yer
、2-脱氧
ꢀ‑
d-核糖-5-磷酸醛缩酶dera
sa
、2-脱氧-d-核糖-5-磷酸醛缩酶dera
met
和2-脱氧-d-核糖-5-磷酸醛缩酶dera
pyc
中的一种或几种。
8.根据本发明的一些实施方式,所述2-脱氧-d-核糖-5-磷酸醛缩酶dera
eco
为以下 dera
eco
蛋白中的任一种:
9.(a1)氨基酸序列为seq id no.1的蛋白质;
10.(a2)将seq id no.1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或
(staphylococcus)(ncbi登录号:wp_001083318.1),在不改变dera
sa
氨基酸序列的前提下,将其基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后dera
sa
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为 seq id no.8,亦即,经密码子优化的编码氨基酸序列如seq id no.3所示的dera
sa
蛋白(野生2-脱氧-d-核糖-5-磷酸醛缩酶dera
sa
)的基因dera
sa
的核苷酸序列如seqid no.8所示。
26.根据本发明的又一些实施方式,所述2-脱氧-d-核糖-5-磷酸醛缩酶dera
met
为以下dera
met
蛋白质中的任一种:
27.(d1)氨基酸序列为seq id no.4的蛋白质;
28.(d2)将seq id no.4所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
29.(d3)与(d1)或(d2)所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
30.(d4)在(d1)-(d3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
31.本发明中,氨基酸序列如seq id no.4所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
met
为野生2-脱氧-d-核糖-5-磷酸醛缩酶dera
met
,其的基因来源于红色亚栖热菌 (meiothermu sruber)(ncbi登录号:wp_013014483.1),在不改变dera
met
氨基酸序列的前提下,将上述dera
met
基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后dera
met
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.9,亦即,经密码子优化的编码氨基酸序列如seq id no.4所示的dera
met
蛋白(野生2-脱氧-d-核糖-5-磷酸醛缩酶dera
met
)的基因dera
met
的核苷酸序列如seq id no.9所示。
32.根据本发明的又一些实施方式,所述2-脱氧-d-核糖-5-磷酸醛缩酶dera
pyc
为以下 dera
pyc
蛋白质中的任一种:
33.(e1)氨基酸序列为seq id no.5的蛋白质;
34.(e2)将seq id no.5所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
35.(e3)与(e1)或(e2)所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
36.(e4)在(e1)-(e3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
37.本发明中,氨基酸序列如seq id no.5所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
pyc
为野生2-脱氧-d-核糖-5-磷酸醛缩酶dera
pyc
,其基因来源于来源于泉古菌 (pyrobaculum calidifontis)(ncbi登录号:wp_011849470.1),在不改变dera
pyc
氨基酸序列的前提下,将上述dera
pyc
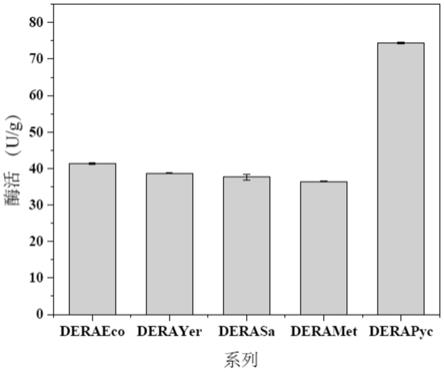
基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后dera
pyc
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.10,亦即,经密码子优化的编码氨基酸序列如seq idno.5所示的dera
pyc
蛋白(野生2-脱氧-d-核糖-5-磷酸醛缩酶dera
pyc
)的基因dera
pyc
的核苷酸序列如seq id no.10所示。
38.本发明第二方面提供了一种如本发明第一方面所述的具有催化乙醇醛合成d-赤藓糖功能的酶的相关生物材料,其为能够表达所述dera
eco
蛋白、dera
yer
蛋白质、 dera
sa
蛋白
质、dera
met
蛋白质或dera
pyc
蛋白质的核酸分子,或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
39.本发明中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna等。
40.所述重组载体可为重组表达载体,也可为重组克隆载体。
41.所述表达盒可由能够启动所述核酸分子转录的启动子,所述核酸分子,以及转录终止序列组成。
42.在本发明的一些实施例中,编码所述dera
eco
蛋白的核酸分子具体地为以下任一所示:
43.(f1)编码区包括如seq id no.6所示的核苷酸序列的dna分子;
44.(f2)核苷酸序列如seq id no.6所示的核苷酸序列的dna分子;
45.(f3)与(f1)或(f2)中所述的核苷酸序列具有75%或75%以上同一性,且编码本发明第一方面中的所述的dera
eco
蛋白质的dna分子;
46.(f4)在严格条件下与(f1)或(f2)中所述的核苷酸序列杂交,且编码第一方面中的所述的dera
eco
蛋白质的dna分子。
47.在本发明的一些实施例中,编码所述dera
yer
蛋白质的核酸分子具体地为以下任一所示:
48.(g1)编码区包括如seq id no.7所示的核苷酸序列的dna分子;
49.(g2)核苷酸序列如seq id no.7所示的核苷酸序列的dna分子;
50.(g3)与(g1)或(g2)中所述的核苷酸序列具有75%或75%以上同一性,且编码本发明第一方面中的所述的dera
yer
蛋白质的dna分子;
51.(g4)在严格条件下与(g1)或(g2)中所述的核苷酸序列杂交,且编码本发明第一方面中的所述的dera
yer
蛋白质的dna分子。
52.在本发明的一些实施例中,编码所述dera
sa
蛋白质的核酸分子具体地为以下任一所示:
53.(h1)编码区包括如seq id no.8所示的核苷酸序列的dna分子;
54.(h2)核苷酸序列如seq id no.8所示的核苷酸序列的dna分子;
55.(h3)与(h1)或(h2)中所述的核苷酸序列具有75%或75%以上同一性,且编码本发明第一方面中的所述的dera
sa
蛋白质的dna分子;
56.(h4)在严格条件下与(h1)或(h2)中所述的核苷酸序列杂交,且编码本发明第一方面中的所述的dera
sa
蛋白质的dna分子。
57.在本发明的一些实施例中,编码所述dera
met
蛋白质的核酸分子具体地为以下任一所示:
58.(i1)编码区包括如seq id no.9所示的核苷酸序列的dna分子;
59.(i2)核苷酸序列如seq id no.9所示的核苷酸序列的dna分子;
60.(i3)与(i1)或(i2)中所述的核苷酸序列具有75%或75%以上同一性,且编码本发明第一方面中的所述的dera
met
蛋白质的dna分子;
61.(i4)在严格条件下与(i1)或(i2)中所述的核苷酸序列杂交,且编码本发明第一方面中的所述的dera
met
蛋白质的dna分子。
62.在本发明的一些实施例中,编码所述dera
pyc
蛋白质的核酸分子具体地为以下任一所示:
63.(j1)编码区包括如seq id no.10所示的核苷酸序列的dna分子;
64.(j2)核苷酸序列如seq id no.10所示的核苷酸序列的dna分子;
65.(j3)与(j1)或(j2)中所述的核苷酸序列具有75%或75%以上同一性,且编码本发明第一方面中的所述的dera
pyc
蛋白质的dna分子;
66.(j4)在严格条件下与(j1)或(j2)中所述的核苷酸序列杂交,且编码本发明第一方面中的所述的dera
pyc
蛋白质的dna分子。
67.本发明第三方面提供了一种以乙醇醛为底物合成d-赤藓糖的方法,其包括利用具有催化乙醇醛合成d-赤藓糖功能的酶或相关生物材料,以乙醇醛为底物,反应产生 d-赤藓糖;
68.所述具有催化乙醇醛合成d-赤藓糖功能的酶,是如本发明第一方面所述的酶;
69.所述具有催化乙醇醛合成d-赤藓糖功能的酶的相关生物材料为如本发明第二方面所述的相关生物材料;
70.优选地,所述合成d-赤藓糖的反应温度为4-80℃。
71.本发明第四方面提供了一种以甲醛为底物多酶级联合成d-赤藓糖的方法,其包括以下步骤:(1)利用乙醇醛合成酶gals将甲醛转化为乙醇醛;(2)利用具有催化乙醇醛合成d-赤藓糖功能的酶或相关生物材料将乙醇醛转化为d-赤藓糖;
72.所述具有催化乙醇醛合成d-赤藓糖功能的酶,是如如本发明第一方面所述的酶;所述具有催化乙醇醛合成d-赤藓糖功能的酶的相关生物材料为如本发明第二方面的相关生物材料;
73.和/或,所述多酶级联合成d-赤藓糖的反应温度为4-80℃。
74.本发明所述用语“tpp”是指焦磷酸硫胺素。
75.本发明中所述用语“酶活力”(enzymeactivity)也称酶活性,是指酶催化一定化学反应的能力;本发明中酶活力以比活力表示,是指每g酶蛋白所具有的酶活力,单位为u/g。
76.本发明中所述“野生型”是指由野生菌发酵培养获得的酶蛋白,以及氨基酸或碱基序列未进行改变的翻译表达得到的酶蛋白。
77.本发明中所述用语“蛋白”与“蛋白质”可以互相使用。
78.本发明中所述用语“野生”与“野生型”可以互相使用。
79.本发明中的检测方法及仪器:
80.(1)采用10ml规格镍琼脂糖凝胶ff亲和层析柱填料预装柱(中国bersee)进行蛋白纯化。
81.(2)采用hplc u3000型高效液相色谱仪(thermo fisher scientific)测定产物。
82.(3)采用870型酶标仪(thermo fisher scientific)进行纯化后蛋白质浓度测定。
83.本发明提供了一种具有催化乙醇醛合成d-赤藓糖功能的酶,其为2-脱氧-d-核糖
ꢀ‑
5-磷酸醛缩酶dera
eco
、2-脱氧-d-核糖-5-磷酸醛缩酶dera
yer
、2-脱氧-d-核糖-5-磷酸醛缩酶dera
sa
、2-脱氧-d-核糖-5-磷酸醛缩酶dera
met
和2-脱氧-d-核糖-5-磷酸醛缩酶dera
pyc
中的一种或几种。本发明还提供了该酶在以乙醇醛或甲醛为底物合成d
‑ꢀ
赤藓糖途径中的应用。与现有技术相比,本发明所提供的具有催化乙醇醛合成d-赤藓糖功能的酶可以快速合
成大量的d-赤藓糖,实现了双酶将甲醛转化为d-赤藓糖,甲醛可以通过co2的多酶催化获得,该发明为co2合成高附加值化合物途径提供了新思路,为将1c化合物合成多碳化合物提供了新路径,为实现碳中和开辟新的生物化学途径,具有潜在的应用前景。
附图说明
84.下面结合附图来对本发明作进一步详细说明:
85.图1为5种酶的蛋白凝胶电泳图。
86.图2示出酶催化反应体系的hplc结果,其中产物d-赤藓糖出峰时间为10.7min 左右。
87.图3示出5种酶催化乙醇醛合成d-赤藓糖的比酶活。
具体实施方式
88.为使本发明容易理解,下面将结合附图和实施例详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。
89.除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。
90.实施例
91.以下通过具体实施例对于本发明进行具体说明。下文所述实验方法,如无特殊说明均为实验室常规方法。下文所述实验材料,如无特别说明均可由商业渠道获得。
92.以下实施例中涉及到的培养基配方如下:
93.lb液体培养基:蛋白胨1%、酵母提取物0.5%、nacl 1%;
94.lb固体培养基:琼脂1.5%、蛋白胨1%、酵母提取物0.5%、nacl 1%;
95.培养基中的单位为%(w/v)。
96.实施例1:酶蛋白的获得
97.本发明中,氨基酸序列如seq id no.1所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
eco
的基因来源于于大肠杆菌(escherichia coli)k-12(genbank登录号: bae78370.1),在不改变dera
eco
氨基酸序列的前提下,将其基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.6。
98.本发明中,氨基酸序列如seq id no.2所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
yer
的基因来源于耶尔森氏菌(yersiniavan loghem)ea015(genbank登录号: fj755924.1),在不改变dera
yer
氨基酸序列的前提下,将其基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.7。
99.本发明中,氨基酸序列如seq id no.3所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
sa
的基因来源于葡萄球菌(staphylococcus)(ncbi登录号:wp_001083318.1),在不改变dera
sa
氨基酸序列的前提下,将其基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,
经密码子优化后,得到优化后dera
sa
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.8。
100.本发明中,氨基酸序列如seq id no.4所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
met
的基因来源于来源于红色亚栖热菌(meiothermus ruber)(ncbi登录号: wp_013014483.1),在不改变dera
met
氨基酸序列的前提下,将上述dera
met
基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后 dera
met
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.9。
101.本发明中,氨基酸序列如seq id no.5所示的2-脱氧-d-核糖-5-磷酸醛缩酶 dera
pyc
的基因来源于泉古菌(pyrobaculum calidifontis)(ncbi登录号: wp_011849470.1),在不改变dera
pyc
氨基酸序列的前提下,将上述dera
pyc
基因的密码子替换为大肠杆菌偏好(高频使用)的密码子,经密码子优化后,得到优化后 dera
pyc
基因序列,具有大肠杆菌偏爱密码子,其核苷酸序列为seq id no.10。
102.实施例2:表达载体的构建
103.将seq id no.6、seq id no.7、seq id no.8、seq id no.9、seq id no.10所示的优化后dera
eco
、dera
yer
、dera
sa
、dera
met
和dera
pyc
基因分别替换pet-22b 载体(novagen,amp)或pet-28a载体(novagen,kana)酶切位点ndei和xhoi之间的 dna片段,得到重组质粒。
104.实施例3:酶蛋白的表达
105.(1)将大肠杆菌表达型重组质粒转入e.coli bl21(de3)(transgen)中,获得重组菌。采用氨苄抗性平板进行阳性克隆筛选(amp,100mg/ml或kana,50mg/ml), 37℃过夜培养;
106.(2)将挑单克隆至4ml lb液体培养基中(amp,100mg/ml或kana,50mg/ml),在37℃、180rpm的恒温培养箱中培养12-16h;
107.(3)将步骤(2)培养的菌液接菌到50ml lb液体培养基中(amp,100mg/ml或kana,50mg/ml),在37℃、150rpm的恒温培养箱中培养至od600为0.6-0.8后,加入iptg诱导剂(终浓度为0.4mm),在30℃、150rpm的恒温培养箱中诱导培养24 h;
108.(4)培养结束,4℃、12000rpm离心10min收集菌体,加入10ml含有10mm 咪唑和100mm nacl的pbs溶液(0.05m,ph=7.5)重悬菌体,超声破碎15min;
109.(5)细胞破碎后4℃、12000rpm离心20min,所得上清为实验所需粗酶液;
110.(6)粗酶液过镍琼脂糖凝胶ff亲和层析柱调料预装柱纯化得到纯化酶;使用30 kda的超滤膜超滤纯化溶液得到最终纯化酶液,使用sds凝胶电泳验证5种蛋白表达正确(见图1);
111.(7)使用g250考马斯亮蓝与酶液进行反应,然后使用870型酶标仪(thermofisher scientific)检测595nm的吸光度,从而计算蛋白浓度。
112.实施例4:酶活测定
113.反应体系:20mm乙醇醛,上述具有催化乙醇醛合成d-赤藓糖的酶100μg,反应体系总体积为1ml,缓冲液为0.05m,ph=8.0的pbs。30~50℃中反应1-6h后,利用hplc检测产物d-赤藓糖的生成量计算酶活。
114.hplc检测d-赤藓糖方法:带有示差检测器的u3000高效液相色谱仪, hpx-87h有机酸柱子(bio-rad,300
×
7.8mm),65℃,0.6ml/min,流动相为5mm 硫酸。
115.1个酶活力单位定义为:在特定条件下,在1min内转化1μmol底物(乙醇醛)生成产物(d-赤藓糖)的产量的酶量,故比酶活的计算公式为:
116.u/g=(c
d-赤藓糖
(μmol)
×
2/(时间(min)))/蛋白质量(g)
117.使用hplc检测产物d-赤藓糖的生成,hplc结果如图2所示,d-赤藓糖的出峰时间为15.4min左右。
118.5种酶在45℃反应3h的比酶活如表1所示(见图3)。
119.表1 5种dera的比活力
120.酶比活力(u/g)dera
eco
41.2520dera
yer
38.6985dera
sa
37.5979dera
met
36.3652dera
pyc
74.4033
121.实施例5:催化乙醇醛合成d-赤藓糖的应用
122.反应体系:20mm乙醇醛,上述具有催化乙醇醛合成d-赤藓糖的酶100μg,反应体系总体积为1ml,缓冲液为0.05m,ph=8.0的pbs。30~50℃中反应1-6h后,利用hplc检测产物d-赤藓糖的生成量计算酶活。
123.反应方程式如式(1)所示
[0124][0125]
在反应体系中加入20mm乙醇醛,100μgdera
eco
蛋白,反应体系总体积为1 ml,缓冲液为0.05m,ph=8.0的pbs,30℃反应6h后,检测得到89.20mg/ld-赤藓糖。
[0126]
实施例6:催化甲醛合成d-赤藓糖的应用
[0127]
反应体系:底物甲醛,无水硫酸镁,tpp,上述具有催化乙醇醛合成d-赤藓糖的酶,乙醇醛合成酶glas,反应体系总体积为1ml,缓冲液为0.05m,ph=8.0的 pbs。4~80℃中反应后,利用hplc检测产物d-赤藓糖的生成量计算酶活。
[0128]
反应方程式如式(2)所示
[0129][0130]
在反应体系中加入50mm甲醛,2mm无水硫酸镁,0.1mm tpp,2mg乙醇醛合成酶glas,0.5mg dera
eco
蛋白,反应体系总体积为1ml,缓冲液为0.05m, ph=8.0的pbs,45℃反应24h后,检测得到9.67mg/l d-赤藓糖。
[0131]
乙醇醛合成酶gals基因由文献(该文献的doi号:10.1038/s41467-019-09095) 获得(基于该文献由华大基因合成获得)。
[0132]
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性
和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明做出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1