一种模拟血浆循环肿瘤游离DNA标准品及其制备方法与应用与流程
一种模拟血浆循环肿瘤游离dna标准品及其制备方法与应用
技术领域
1.本发明涉及循环肿瘤游离dna基因突变检测技术领域,尤其是涉及一种模拟血浆循环肿瘤游离dna标准品及其制备方法与应用,用于循环肿瘤游离dna检测。
背景技术:
2.液体活检是通过捕获和检测体液(如:血液、尿液、唾液、腹水、胸膜积液等)中的生物标记物(如:细胞、dna、rna和蛋白质等)来诊断和监测肿瘤等疾病。相较于组织活检,液体活检的优势在于非介入性、可重复性地获得肿瘤样本,其副作用小、操作简便、成本较低、检测速度快,在减小了肿瘤异质性对诊断造成的偏差的同时,也能及时地反应肿瘤发展的动态变化,其临床适应症也极为广泛,如常见的肺癌、乳腺癌、前列腺癌、结直肠癌、食管癌、胃癌、肝癌、胰腺癌等肿瘤均可用液体活检进行诊断与监测。目前在科研领域有大量的研究发现,液体活检较于传统的组织活检、血清肿瘤标志物以及医学影像学等手段,能够提前发现尚处于早期的肿瘤,进而能对其进行及时的治疗,从而显著改善患者的预后。
3.循环肿瘤游离dna(circulating tumor dna,ctdna)是肿瘤液态活检的经典检测对象之一。肿瘤细胞能通过细胞凋亡、坏死和分泌向血液中释放断裂的、不完整的单链或双链ctdna。由于ctdna本身就来自肿瘤细胞内部的dna,因此天然地携带了肿瘤dna的突变信息。ctdna分布广泛,先后在不同的肿瘤患者血液中被检测到,并且肿瘤越发展到晚期、肿瘤恶性程度越高,ctdna特有突变的频率就越高,因此ctdna能够用于实时监控肿瘤的发展。
4.ctdna的检测主要难度在于灵敏度难以提高,ctdna 含量少,在前期样本提取和处理过程中极易降解,ctdna 半衰期很短,仅仅 0.5-1 小时,这会增加检测的假阴性率;另外,样本处理过程中若操作不当容易导致白细胞破裂,其释放的基因组 dna 混入cfdna、进一步导致 ctdna 所占比例下降,这意味着检测的假阴性率进一步提高。10 ml 来自无症状人体的血液中大约可分离获得 4-5 ml 血浆,理想情况下可得到 15-30ng cfdna,相当于来自 2500-5000 个基因组当量的模板,按照实验过程中 50% 的得率进行计算,最终参与检测的模板数为 1250-2500个,当 ctdna 的占比约为 0.1% 时,理论上现有水平可以检测到所有的变异。但是无症状个体的 cfdna 中只有约万分之一的比例为 ctdna。整体而言,从血液采集、运输、到 ctdna 分离提取、建库测序这一系列的实验操作中都有影响结果正确性的风险存在。
技术实现要素:
5.目前以te为基质的ctdna标准品,不能很好地质控ctdna抽提环节。本发明所要解决的技术问题是模拟血浆循环肿瘤游离dna标准品制备工艺,最大限度接近ctdna在人体存在的自然真实状态,可以对ctdna的检测从血液采集、运输、到 ctdna 分离提取、建库测序这一系列的实验操作进行质控,增强检验结果的可靠性,并且本发明产品稳定,安全性高并且可重复生产。
6.本发明采用如下技术方案:
一种模拟血浆循环肿瘤游离dna标准品,包括模拟血浆、片段化dna混合物;所述片段化dna混合物为背景细胞dna片段化产物,或者所述片段化dna混合物为背景细胞dna片段化产物与肿瘤细胞dna片段化产物;所述片段化产物采用核小体酶切结合柱纯化的方法制备。本发明首次采用核小体酶切结合柱纯化的方法制备多癌种基因突变野生型背景细胞片段化产物、肿瘤细胞片段化产物,将两者混合,得到不同突变频率的片段化dna混合物,突变频率根据标准品需求常规进行梯度设计。
7.本发明中,模拟血浆包括氯化钠、碳酸氢钠、碳酸钠、氯化钾、三水合磷酸氢二钾、六水合氯化镁、氢氧化钠、羟乙基哌嗪乙硫磺酸、氯化钙、硫酸钠、乙二胺四乙酸(edta)、人血白蛋白、超纯水。本发明的模拟血浆,是用细胞培养级试剂,按照一定比例加入各组分,使获得的溶液中的离子浓度,蛋白含量与人真实血浆接近,并加入edta,以模拟用于基因检测的人血浆中的抗凝组分。
8.本发明中,将混合液加入细胞中,震荡后冰孵,再加入非离子表面活性剂溶液,震荡后冰孵,然后离心处理,再弃上清,然后加入微球菌核酸酶缓冲液,吹打后离心处理,再弃上清,然后加入微球菌核酸酶缓冲液重悬,再加入微球菌核酸酶,震荡后水浴处理,再加入乙二胺四乙酸溶液、核糖核酸酶a溶液,震荡后水浴处理,然后加入十二烷基硫酸钠溶液、蛋白酶k溶液,震荡后水浴处理,然后进行纯化回收,得到dna片段;混合液包括4-羟乙基哌嗪乙磺酸溶液、无机镁盐溶液、无机钾盐溶液、有机还原剂溶液以及苯甲基磺酰氟溶液;所述微球菌核酸酶缓冲液包括tris-hcl缓冲液、cacl2、bsa。
9.本发明中,混合液由4-羟乙基哌嗪乙磺酸溶液、无机镁盐溶液、无机钾盐溶液、有机还原剂溶液、苯甲基磺酰氟溶液、水组成;优选的,4-羟乙基哌嗪乙磺酸溶液、无机镁盐溶液、无机钾盐溶液、有机还原剂溶液、苯甲基磺酰氟溶液、水的体积比为(8~12)∶(1~2)∶(8~12)∶(0.3~0.8)∶(8~12)∶(900~1050)。4-羟乙基哌嗪乙磺酸溶液的浓度为0.08~0.12m,ph值为7.5~8,具体为常规试剂;无机镁盐溶液的浓度为0.8~1.2m,无机钾盐溶液的浓度为0.8~1.2m,有机还原剂溶液的浓度为0.8~1.2m,苯甲基磺酰氟溶液的浓度为0.08~0.12m。其中,无机镁盐包括氯化镁,无机钾盐包括氯化钾,有机还原剂为二硫苏糖醇dtt;非离子表面活性剂为ca-630。
10.本发明中,混合液、非离子表面活性剂溶液、乙二胺四乙酸溶液、核糖核酸酶a溶液、十二烷基硫酸钠溶液、蛋白酶k溶液的体积比为1000∶(5~15)∶(30~50)∶(3~18)∶(70~150)∶(10~30),优选为1000∶(8~12)∶(35~45)∶(8~13)∶(90~110)∶(15~25)。
11.本发明中,微球菌核酸酶缓冲液的用量为混合液体积的0.8~1.2倍,优选0.9~1.1倍;两次使用微球菌核酸酶缓冲液的体积可以一样也可以不一样。微球菌核酸酶缓冲液的组分举例如下:50 mm tris-hcl(ph=8.0)、5 mm cacl2、0.1 mg/ml bsa(牛血清白蛋白)、水。
12.本发明中,震荡、冰孵、水浴、离心以及吹打的具体操作为常规技术,其中震荡的时间没有特别限制,目的为常规目的,为了混匀;离心处理的温度为0~5℃,离心力为700~1000g,时间为3~10分钟;冰孵的时间为3~15分钟;吹打为移液器吹打2~5次;水浴处理的温度为35~60℃,时间为5~45分钟。
13.本发明中,细胞的数量为1
×
107~1
×
109个,细胞为多癌种基因突变野生型背景细胞或者肿瘤细胞,肿瘤细胞带有基因突变,可以携带单个基因突变位点,也可以携带多个基
因突变位点,根据需求选择。背景细胞为多癌种基因突变野生型背景细胞,选择gm12878细胞;肿瘤细胞及突变根据需要选择,分别得到多癌种基因突变野生型背景细胞片段化产物与肿瘤细胞片段化产物,根据质控品实际梯度要求,将多癌种基因突变野生型背景细胞片段化产物与肿瘤细胞片段化产物按不同比例加入到模拟血浆中,形成梯度产品。
14.本发明通过核小体酶切法结合柱纯化制备片段化dna,获得的dna片段过程与人体内自然产生的dna片段过程相近,dna大小分布结构比超声打断获得的dna片段更为一致,获得的dna片段末端生物学特征与天然ctdna相似:人体内产生的片段化dna主要由体内酶解过程产生,dna分子末端为5’端磷酸,3’端羟基,本发明获得的片段化dna分子末端为5’端磷酸,3’端羟基,在使用pcr或者ngs测序检测基因突变过程中,人血浆中提取的片段化dna和核小体酶切获得的片段化dna样本操作流程一致;本发明获得的dna片段与天然ctdna序列复杂度相似,dna片段大小分布与天然ctdna高度一致,突变位置随机分布在dna片段上,更能够真实的反映和评估检测设备和检测方法的灵敏度和准确性。
附图说明
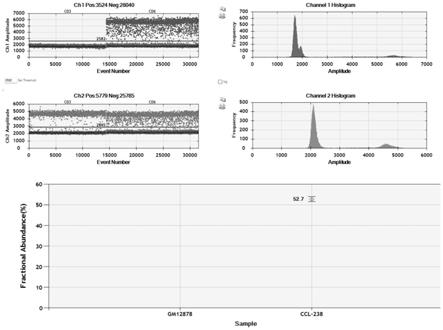
15.图1为ccl-238片段化dna的braf_v600e基因突变频率;图2为抽提获得的dna片段大小分布;图3为抽提获得的ctdna基因突变频率验证。
具体实施方式
16.本发明采用的原料都是本领域常规原料,细胞的前期处理也是本领域常规方法,具体的制备操作方法以及测试方法都是本领域常规方法。本发明的创造性在于采用核小体酶切结合柱纯化的方法制备多癌种基因突变野生型背景细胞片段化产物、肿瘤细胞片段化产物;将两者混合加入模拟血浆中,得到不同突变频率的片段化dna混合物,突变频率根据标准品需求常规进行梯度设计,比如片段化dna混合物中,突变频率为0~50%;根据实际需求,片段化dna混合物投入量可以设计但不限于10ng/ml,50ng/ml,100ng/ml,200ng/ml,300ng/ml,400ng/ml,500ng/ml等梯度产品。
17.从细胞库购买目标细胞系,并在细胞库网站上下载细胞培养说明书,配制适合细胞生长的完全培养基备用;购买的细胞系以冻存形式到达细胞培养间,将细胞投入37℃水浴锅中快速解冻,同时不断轻轻摇动冻存管,待冻存管中细胞悬液融化后,将冻存管喷洒75%酒精消毒,移入生物安全柜内,打开冻存管,吸出细胞悬液加入到5ml的完全培养基内,再移入离心机,1000rpm离心8min,离心完毕后,除去上清,使用1ml完全培养基混匀管底沉淀,取样与台盼蓝以1:1体积混合后,计算细胞数量与活力,根据计数结果,添加完全培养基调整细胞密度至1
×
106/ml,为并移入到细胞培养6孔板中,2ml/孔,将细胞培养板移入37℃,5%co
2 95%湿度的培养箱中培养;每隔48小时取样,计算细胞数量,添加完全培养基使细胞密度维持在0.5~1
×
106/ml。待细胞量大于1
×
108,收集细胞到1.5ml离心管中,1
×
108/管,-20℃保存备用,同时收集一管细胞,细胞量为1
×
106,进行细胞的str鉴定。根据所得的str分型结果与专业的细胞str数据库比对,确认所购买的细胞系正确,并且没有受到其他细胞的污染,可进行细胞的裂解和酶切工作,根据ansi标准,本发明所用细胞匹配度≥80%。
实施例
18.在制备模拟血浆循环肿瘤游离dna标准品时,根据需要可以设计包含一个或多个基因突变位点的标准品,并且根据需要,基因突变频率可以设计但不限于0%,10%,20%,30%,40%,50%等梯度产品,为本领域常识。在本具体实施例中,以背景细胞gm12878细胞为多癌种基因突变野生型背景细胞系,其获得的片段化dna为野生型背景,以ccl-238细胞获得的片段化dna为braf_v600e基因突变,混合制备成突变频率为1%的模拟血浆循环肿瘤游离dna标准品。
19.、模拟血浆的配制,按照下表,混合各组分比例,配制模拟血浆:配制的模拟血浆中电解质浓度,蛋白含量与真实血浆比较:
将上述配制的模拟血浆用0.22μm滤膜过滤,收集至血清瓶中备用。
20.2、细胞片段化产物。从-20℃冰箱取出gm12878细胞置于冰上20min,待其融化;1
×
108细胞中加10μl的0.1m hepes(4-羟乙基哌嗪乙磺酸)水溶液、1.5μl的1m mgcl2水溶液、10μl的1m kcl水溶液、0.5μl的1m dtt水溶液、10μl的0.1m pmsf(苯甲基磺酰氟)水溶液和970μl的水,震荡15s,冰孵10min;再加入10ul 10% igepal
®
ca-630水溶液,震荡10s,冰孵5min;4℃,900g,离心5min,弃上清;然后加1000μl 微球菌核酸酶缓冲液清洗,移液器吹打3次,4℃,900g,离心5min,弃上清,再加1000μl微球菌核酸酶缓冲液重悬细胞核,再加入100ul 微球菌核酸酶(100u/ ul)震荡混匀,42℃水浴10min;然后加入40ul edta(thermo r1021),震荡混匀;加10ul 20mg/ml rnasea(核糖核酸酶a)tris-hcl缓冲液(三(羟甲基)氨基甲烷盐酸盐缓冲液),震荡混匀;37℃水浴30min;再加100ul 10%sds(十二烷基硫酸钠)水溶液,震荡混匀;然后加20ul proteinase k(蛋白酶k,200mg/ml)震荡混匀;56℃水浴30min;最后进行dna片段的纯化与回收,得到片段化dna,上述微球菌核酸酶缓冲液组分为:50 mm tris-hcl(ph=8.0)、5 mm cacl2、0.1 mg/ml bsa与水。使用qiaquick pcr purification kit试剂盒对上述酶切的dna片段进行纯化和回收,根据说明书操作,如下:将样本转移至15ml离心管中,加入qiaquick pcr purification kit试剂盒中5倍样本体积的buffer pb,即v样本:vbuffer pb=1:5,震荡混匀;取qiaquick pcr purification kit试剂盒(货号:28106)提供的吸附柱和收集管10个,将混合好的样本平均转移至10个吸附柱内;每个吸附柱和收集管14000rpm离心30s,丢弃收集管中的液体,重复上述步骤,直至样本转移完毕;
每个吸附柱中加入750μl buffer pe,14000rpm,离心30s,丢弃收集管中的液体;每个吸附柱14000rpm离心2min,将吸附柱放在新的ep管中;每个吸附柱中加入55μl buffer eb,保持3min,14000rpm离心1min;获得产物dna片段。
21.使用qubit dsdna hs assay kits(货号:q32854)试剂盒,按照说明书对上述获得的片段化dna进行定量检测,测得片段化dna溶液浓度为39.4ng/μl,dna总量为:21670ng,通过公式:浓度1
×
体积1=浓度2
×
体积2,计算新加入eb的体积为172.3μl,调节获得的片段化dna溶液浓度至30ng/μl。
22.以ccl-238细胞为提取样本,根据上述方法,得到片段化dna溶液,使用qubit dsdna hs assay kits(货号:q32854)试剂盒,按照说明书对上述获得的片段化dna进行定量检测,测得片段化dna溶液浓度为48.1ng/μl,dna总量为:26455ng,通过公式:浓度1
×
体积1=浓度2
×
体积2,计算新加入eb的体积为331.8μl,调节获得的片段化dna溶液浓度至30ng/μl。
23.使用安捷伦2100 bioanalyzer生物分析仪对获得的dna片段的大小分析,dna片段大小分布与天然cfdna相似。
24.作为对比,上述ccl-238细胞为提取样本方法中,将柱纯化替换为磁珠纯化,其余不变,测得片段化dna溶液浓度为21.8ng/μl,即获得的dna总量为:11990ng。另外,改变微球菌核酸酶缓冲液组分也会降低片段化dna产物收率或者改变dna片段大小分布,具体参见申请人同日提交的另一篇申请:一种高收率dna片段及其制备方法。
25.3、片段化dna的混合。以gm12878细胞制备的片段化dna为野生型背景,以ccl-238细胞制备的片段化dna为基因突变模板,使用ddpcr对两种片段化dna进行检测,测定两种片段化dna的braf_v600e基因突变频率。
26.ddpcr引物探针序列:pcr反应体系配制:
上样量10ng,样本量不足8μl使用无核酸酶水补足,引物终浓度:960nm,探针终浓度:250nm;按照下表在pcr仪中设置反应程序,总反应体系为40μl:得到gm12878片段化dna的braf_v600e基因突变频率为0%,ccl-238片段化dna的braf_v600e基因突变频率为52.7%(图1)。
27.根据公式:(gm12878片段化dna的质量+ccl-238片段化dna的质量)/ccl-238片段化dna的质量=52.7计算,按照下表取样进行混合,获得理论突变频率为1%的braf_v600e突变的片段化dna混合物:4、模拟血浆循环肿瘤游离dna标准品。将片段化dna混合物投入到配制好的模拟血浆中,投入量为100ng/ml,制备理论1%的braf_v600e突变模拟血浆循环肿瘤游离dna标准品。
28.5、验证。
29.按照qiaamp circulating nucleic acid kit(货号:55114)试剂盒说明书对上述理论1%的braf_v600e突变模拟血浆循环肿瘤游离dna标准品进行ctdna抽提,抽提量为4ml,使用qubit3.0测定dna回收率,dna回收量为303.5ng,dna回收率在75.86%。
30.使用安捷伦2100 bioanalyzer生物分析仪对抽提获得的dna片段大小进行检验,结果显示dna片段大小分布满足144bp-176bp≥92%(图2),ddpcr对抽提获得的ctdna进行基
因突变频率验证,结果显示braf_v600e突变频率在0.95-1.05%范围内,符合标准品要求(图3),ddpcr引物探针序列、pcr反应体系、反应程序与上述第3步一致。
31.综上所述,本发明使用肿瘤细胞系获得片段化dna,可以根据需要,与多癌种基因突变野生型背景细胞片段化产物混合,设计预定的突变频率,通过配制模拟血浆,可以获得跟真实人血浆相近的离子浓度,蛋白含量和抗凝环境,将混合的片段化dna投入模拟血浆,得到模拟血浆循环肿瘤游离dna标准品;通过再抽提验证,dna片段大小分布,基因突变位点和基因突变频率表现出良好的稳定性。本发明模拟血浆循环肿瘤游离dna标准品最大限度接近ctdna在人体存在的自然真实状态,可以对ctdna的检测从血液采集、运输、到 ctdna 分离提取、建库测序这一系列的实验操作进行质控,产品稳定可靠性,安全性高并且可重复生产。
32.上述实施实例并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员应当理解:在本发明的实质范围内,作出的组合、变化、改型、添加或替换,也应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1