从非神经元细胞转化制备中型棘突神经元的方法及用途与流程
b,davidson bl,yang xw,yoo as.striatal neurons directly converted from huntington's disease patient fibroblasts recapitulate age-associated disease phenotypes.nat neurosci.2018mar;21(3):341-352.)已能高效地从成年正常人及hd患者成纤维细胞生成特化的中型棘突神经元,还证明了这种技术制备的神经元确实保留了源细胞的年龄特征以及年龄关联的hd病理特征,并成功应用于hd疾病模拟以及发病机制研究。该方法主要基于mir-9/9*-124介导的直接转分化技术,一般需要较长的时间(30天以上)才能获得完全转化的成熟神经元;另外由于其培养条件等原因,转化后的神经细胞很难经过胰蛋白酶消化等常规方法处理,导致消化后细胞存活率低,难以实现冻存复苏利用。所以该技术仅限于少数技术成熟的实验室使用,相当时间内很难实现产业化制备以满足市场需求。鉴于这些局限性,有必要研发新型高效的直接转分化技术以大量制备hd相关的高纯度中型棘突神经元。
技术实现要素:
6.本发明提供一种从非神经元细胞转化制备中型棘突神经元的方法及用途,以至少解决现有技术中存在的以上技术问题。
7.本发明一方面提供一种从非神经元细胞转化制备中型棘突神经元的方法,其特征在于,该方法包括:
8.(1)构建含有细胞转分化基因组合的病毒载体,并通过转染试剂进行病毒包装;
9.(2)培养供体源细胞,并用包装后的病毒感染所述供体源细胞;
10.(3)在诱导分化培养液中将所述供体源细胞转分化为中型棘突神经元,所述诱导分化培养液中包括促进转分化的小分子化合物和生长因子;
11.(4)分离纯化所述中型棘突神经元;
12.其中,所述细胞转分化基因组合包含以下基因的组合:(1)选自ngn2和ascl1中的至少一种基因;(2)选自dlx1,dlx2,lhx6,ctip2中的至少三种基因;以及(3)选自sox4和sox11中的至少一种基因。
13.在一可实施方式中,所述促进转分化的小分子化合物包括福司可林fsk,环磷酸腺苷camp,双丁酰环磷酸腺苷db-camp,ra,ldn-193189,sb431542,chir99021中的至少两种。
14.在一可实施方式中,所述生长因子包括bfgf2,gdnf,nt3,bdnf中的至少一种。
15.在一可实施方式中,所述细胞转分化基因组合中的基因来源于人或小鼠等其它任何种属同源基因。
16.在一可实施方式中,所述病毒为逆转录病毒、慢病毒或aav病毒。
17.在一可实施方式中,所述病毒载体中用于调控表达水平的启动子为cmv,cag,ef1α,pgk,tre tight,tre3g中的至少一种。
18.在一可实施方式中,所述供体源细胞为任何年龄的正常人或患者的非神经元细胞。
19.在一可实施方式中,所述非神经元细胞包括:皮肤成纤维细胞、干细胞、肺成纤维细胞、包皮成纤维细胞或胶质细胞。
20.在一可实施方式中,所述培养供体源细胞包括:采用包被基质预包被培养皿,所述供体源细胞预种于预包被后的培养皿中。
21.在一可实施方式中,所述包被基质包括:层粘连蛋白、明胶、纤维粘连蛋白、基质凝胶中的至少一种。
22.在一可实施方式中,所述供体源细胞在所述培养皿中的接种密度为1.0
×
10
3-5.0
×
104个/cm2。
23.在一可实施方式中,所述分离纯化所述中型棘突神经元,包括:所述供体源细胞在所述诱导分化培养液中转分化得到的中型棘突神经元经过胰蛋白酶消化并重悬成单细胞悬浮液,再用细胞微滤器、流式细胞仪或在明胶包被的培养皿上差异性贴壁的方法分离得到高纯度中型棘突神经元。
24.在一可实施方式中,所述分离纯化所述中型棘突神经元后,该方法还包括:
25.经过分离纯化获得的部分高纯度中型棘突神经元接种在预先包被好的培养皿中,用中型棘突神经细胞培养液继续培养;或
26.经过分离纯化获得的高纯度中型棘突神经元冷冻于冻存液中储存、运输。
27.本发明另一方面提供一种中型棘突神经元在建立用于筛选hd治疗药物的方法中的用途。
28.本发明根据细胞直接转分化的技术原理,在供体源细胞中通过病毒导入决定神经细胞命运及其亚型的关键基因,并在适当的转化培养条件下诱导转化为功能性的亚型中型棘突神经细胞,通过本发明的方法能够制备出高转化效率、高纯度的中型棘突神经元,且转化后的神经细胞容易经过胰蛋白酶消化等常规方法处理,消化后细胞活率高,有利实现冻存复苏利用。
附图说明
29.图1示出了病毒包装时,293t细胞共转染包装质粒以及携带绿色荧光蛋白和目标基因的表达质粒后的转染效率示意图。
30.图2示出了人皮肤成纤维细胞感染病毒后开始诱导分化前的显微示意图。
31.图3示出了幼儿及成年人皮肤成纤维细胞感染病毒并在诱导分化培养液中培养3天期间的细胞形态变化示意图。
32.图4示出了诱导生成的人中型棘突神经元经分离纯化以后的示意图。
33.图5示出了诱导生成的人中型棘突神经元表达一般神经元特征蛋白质tuj1的示意图。
34.图6示出了诱导生成的人中型棘突神经元表达一般神经元特征蛋白质map2的示意图。
35.图7示出了诱导生成的人中型棘突神经元表达神经元突触蛋白syn1的示意图。
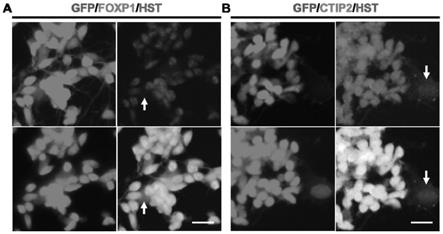
36.图8示出了诱导生成的人中型棘突神经元表达特征性转录因子foxp1及ctip2的示意图。
37.图9示出了诱导生成的人中型棘突神经元产生特征性神经递质gaba的示意图。
38.图10示出了诱导生成的人中型棘突神经元表达特征性蛋白质darpp32及dir的示意图。
39.图11示出了诱导生成的幼儿及成人中型棘突神经元中β-半乳糖苷酶(β-gal)的染色示意图。
40.图12示出了人ngn2基因及蛋白质序列。小鼠或其它种属的ngn2同源基因在本发明直接转分化制备方法中也有与之类似的效果。
41.图13示出了人ascl1基因及蛋白质序列。小鼠或其它种属的ascl1同源基因在本发明直接转分化制备方法中也有与之类似的效果。
42.图14示出了人sox4基因及蛋白质序列。小鼠或其它种属的sox4同源基因在本发明直接转分化制备方法中也有与之类似的效果。
43.图15示出了人sox11基因及蛋白质序列。小鼠或其它种属的sox11同源基因在本发明直接转分化制备方法中也有与之类似的效果。
44.图16示出了人dlx1基因及蛋白质序列。小鼠或其它种属的dlx1同源基因在本发明直接转分化制备方法中也有与之类似的效果。
45.图17示出了人dlx2基因及蛋白质序列。小鼠或其它种属的dlx2同源基因在本发明直接转分化制备方法中也有与之类似的效果。
46.图18示出了人lhx6基因及蛋白质序列。小鼠或其它种属的lhx6同源基因在本发明直接转分化制备方法中也有与之类似的效果。
47.图19示出了人ctip2基因及蛋白质序列。小鼠或其它种属的ctip2同源基因在本发明直接转分化制备方法中也有与之类似的效果。
具体实施方式
48.为使本发明的目的、特征、优点能够更加的明显和易懂,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而非全部实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
49.为了提高中型棘突神经元的转化效率和纯度,并解决中型棘突神经元制备过程中消化后细胞存活率低,难以实现冻存复苏利用的问题,本发明采用直接转分化技术从各种年龄的正常人或hd患者的皮肤成纤维细胞等非神经细胞快速高效地转化为大量高纯度的、具有相应年龄病理特征的中型棘突神经元。
50.本发明提供一种从非神经元细胞转化制备中型棘突神经元的方法,该方法包括:
51.(1)构建含有细胞转分化基因组合的病毒载体,并通过转染试剂进行病毒包装;
52.(2)培养供体源细胞,并用包装后的病毒感染所述供体源细胞;
53.(3)在诱导分化培养液中将所述供体源细胞转分化为中型棘突神经元,所述诱导分化培养液中包括促进转分化的小分子化合物和生长因子;
54.(4)分离纯化所述中型棘突神经元;
55.其中,所述细胞转分化基因组合包含以下基因的组合:(1)选自ngn2和ascl1中的至少一种基因;(2)选自dlx1,dlx2,lhx6,ctip2中的至少三种基因;以及(3)选自sox4和sox11中的至少一种基因。
56.本发明通过选定关键的细胞转分化基因组合:其中ngn2与ascl1两种基因在sox4或sox11协同下对于神经系统发育过程中不同类型神经细胞的分化起决定性的作用,dlx1,dlx2,lhx6,ctip2四种基因对亚型中型棘突神经元的特定转化起决定性的作用,以上各种有效的不同的细胞转分化基因组合可以诱导产生中型棘突神经元。
57.上述各基因及蛋白序列可参见说明书核苷酸和氨基酸序列表以及附图图12-图19。
58.基于上述制备方法,本发明具体制备方法可包括如下步骤:
59.步骤s01、确定细胞转分化基因组合,其中细胞转分化基因组合包含以下基因的组合:(1)选自ngn2和ascl1中的至少一种基因;(2)选自dlx1,dlx2,lhx6,ctip2中的至少三种基因;以及(3)选自sox4和sox11中的至少一种基因;
60.步骤s02、将上述细胞转分化基因组合中的基因以单个、两个、或三个(以2a序列或ires序列连接2个不同基因)构建入商售或自有的一种逆转录病毒载体、慢病毒载体或aav病毒载体,各载体中调控表达水平的启动子可以是cmv,cag,ef1α,pgk,tre tight,tre3g中的任何一种、两种或两种以上的组合,本发明对此不做限制。同时可以通过不同来源的2a序列(t2a,e2a,p2a,f2a)或ires序列引入绿色或红色荧光报告基因,以便于确定病毒包装质量和滴度,观察细胞形态的变化,测定细胞纯度及用于后续各种具体应用分析。
61.步骤s03、把上述基因载体分别包装成相应的逆转录病毒、慢病毒或aav病毒,测定各种病毒的滴度,确定感染供体源细胞的病毒用量,使各种病毒感染率达到50%~100%。
62.步骤s04、供体源细胞按适当密度接种于层粘连蛋白(laminin),明胶(gelatin),纤维粘连蛋白(fibronectin),基质凝胶(matrigel)中的至少一种所预包被的培养皿中。
63.步骤s05、加入适量的病毒进行感染,24小时后换成新鲜的源细胞培养液。
64.s06、确定含有促进转分化的小分子化合物与生长因子的特定诱导分化培养液:在含有质量分数为0.05%-5%b27,0.05%-5%n2的dmem/f12/神经基础培养基neurobasal(质量比为1:1:1或2:2:1)基础液中,加入1-50μm fsk,0.1-10μm ra,0.01-2μm ldn,0.1-20μm sb431542,0.1-10μm chir99021中至少两种或两种以上有效的小分子的组合,以及0.1-50ng/ml bfgf2,gdnf,nt3,bdnf中的任何一种、两种或两种以上的生长因子组合。
65.步骤s07、在供体源细胞感染病毒后第3,5,7,10天或每天更换诱导分化培养液。
66.步骤s08、在10-14天分离纯化带有荧光的中型棘突神经元,用荧光显微镜分别计数总细胞及神经细胞以确定其纯度和收率。
67.步骤s09、将部分纯化后的中型棘突神经元接种在预先包被好的培养皿中用中型棘突神经细胞培养液继续培养以供鉴定,余下冻存于适于神经细胞的冻存液备储存、运输。
68.步骤s10、中型棘突神经元的特征鉴定:
69.一般神经元表达的特征蛋白质:tuj1,map2,neun,tau等;
70.神经元突触蛋白质:突触素1(syn1),突触胺1(syt1)。
71.与ipsc分化制备神经细胞技术比较,本发明技术方案的优势在于不需要采用cmyc等致癌基因,无需经过干细胞增殖阶段,转化得到的神经细胞无瘤化风险,不会被重设至胚龄,因此能保留年龄关联的基因表达特征与病理特征。与已报道的直接转分化技术比较,本发明技术方案将特定的细胞转分化基因组合与小分子组合结合起来,具有以下有益效果:
72.(1)制备方法简单,供体源细胞感染病毒以后,只需更换诱导分化培养液4次即可,没有繁琐操作;
73.(2)快速,仅需10-14天即可获得大量产品;
74.(3)成本低,不需要像ipsc技术一样每天更换昂贵培养液;
75.(4)转化效率高,对感染病毒(gfp阳性)的各种年龄皮肤细胞的转化效率高达90%
以上;
76.(5)收率高,只需1-2个100mm培养皿即可获得1百万个纯化的中型棘突神经细胞;
77.(6)分离纯化简单,产品纯度高,中型棘突神经细胞一般可达90%以上纯度;
78.(7)制备的中型棘突神经元保留年龄特征,符合hd患者的发病年龄与病理特征;
79.(8)可以冻存、复苏,液氮冻存半年以上,复苏存活率90%;
80.(9)可以短期或长期培养,最长可培养3个月以上;
81.(11)适用于作为细胞病理模型,研究发病机制、药物作用机制,筛选研发药物及开发基因疗法;
82.(12)正常中型棘突神经元可以用于化合物毒性测试;
83.(13)可以用于快速建立大样本正常及患者人群的中型棘突神经细胞库,用以支持大数据分析以及精准疗法开发。
84.下面结合具体实施例对本发明做进一步阐述。
85.实施例
86.实施例1
87.一种从非神经元细胞转化制备中型棘突神经元的方法,本实施例制备中型棘突神经元过程中使用的材料、仪器设备与试剂具体如下:
88.1、材料
89.细胞:293t细胞购自美国atcc(crl-3216);人皮肤成纤维细胞购自美国sciencell(货号#2310、#2320)公司。细胞用含10-20%fbs及1
×
p/s双抗的高糖dmem培养液进行培养。
90.2、仪器设备与试剂:
91.(1)co2细胞培养箱(esco clm-170b-8-cn);超净工作台(esco ac2-5s1);荧光显微镜(thermo evos m5000);超低温冰箱(海尔dw-86l388j);液氮罐(海尔yds-175-216-f);高速冷冻离心机(白洋by-r20型);常温高速离心机(湘仪h1650-w);
92.(2)智能高压蒸汽灭菌器(上海申安ldzm-80kcs);美国shellab干燥箱(ce3f-2);电热数显恒温水浴锅(力辰hh-2);
93.(3)bio-rad梯度pcr仪(t100);bio-rad电泳仪(powerpac hc);化学发光成像系统(勤翔chemiscope 6200touch);紫外割胶分析仪(君意jy02);隔水式培养箱(上海一恒ghp-9080);振荡培养箱(知楚仪器,zqty-70n);
94.(4)dmem,f12(sigma);fbs,neurobasal,b27,n2,胰蛋白酶,dmso(invitrogen);明胶,纤连蛋白,层粘连蛋白,matrigel(bd);佛司可林,ra,ldn-193189.hcl,sb431542(selleck);bfgf2,bdnf,gdnf(peprotech);lipofectamine2000(invitrogen);pei(polysciences);系列dna限制性内切酶(neb),qiagen plasmid midi试剂盒(100),zymoclean gel dna回收试剂盒,60mm培养皿,100mm培养皿,24-mtp,48-mtp,96-mtp,细胞冻存管(康宁);其它化学试剂(sigma)等。
95.3、制备方法
96.本实施例的原材料细胞为人皮肤成纤维细胞,因此实施例1提供一种从人皮肤成纤维细胞制备中型棘突神经元的方法,该方法包括:
97.步骤s11、构建质粒:将ascl1、dlx2、lhx6、ctip2、sox11五种基因分别构建入慢病毒载体中,载体中调控基因表达水平的启动子为cmv,同时通过t2a序列引入绿色荧光报告
基因,以便于确定病毒包装质量和滴度,观察细胞形态的变化,测定细胞纯度及用于后续各种具体应用。
98.步骤s12、病毒包装:将携有上述基因的各质粒与pmdl、prev及pvsv-g按摩尔比1:1:1:1与转染试剂磷酸钙混合,加入24小时前预种的293t细胞中转染过夜,然后更换新鲜培养液,24小时后收集含有病毒的上清液并加入新鲜培养液,再24小时后重复收集一次含有病毒的上清液,合并两次收集的含有病毒的上清液后用0.45μm的过滤器过滤以除去死细胞及其碎片,过滤后向滤液中加入聚凝胺至聚凝胺浓度为6μg/ml,取少量含有聚凝胺的滤液测定病毒滴度,其余储存于4℃冰箱备用。
99.如图1所示,在293t细胞中质粒转染42小时后,几乎所有细胞均表达较高水平的绿色荧光报告基因,随机选择5个20x视野,分别统计各视野中的总细胞数以及gfp阳性细胞数,计算各视野gfp阳性细胞比例,然后取5个视野的平均值而获得,经过计算转染效率达到85%。图1中显示比例尺为300μm,缩写含义(下同):gfp为绿色荧光蛋白;bf为明场图像;tfs为转录因子。
100.步骤s13、皮肤成纤维细胞培养及感染:先将层粘连蛋白,明胶,纤维粘连蛋白,基质凝胶混合,然后预包被培养皿过夜。皮肤成纤维细胞按接种密度为1.0
×
104个/cm2预种于培养皿中过夜,在皮肤成纤维细胞培养液中加入携带有基因的病毒,混匀后在培养箱中继续培养过夜,把含病毒的培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁迅速小心加入新鲜的皮肤成纤维细胞培养液。
101.如图2所示为人皮肤成纤维细胞感染病毒后开始诱导分化前的显微示意图。在幼儿及成年正常人的皮肤成纤维细胞中,病毒感染48小时左右,大部分细胞均显示较强的绿色荧光,表明gfp阳性细胞中转化基因表达水平较高,有利于后续高效地转分化为目标神经元。图中白色箭头显示未感染病毒或gfp弱表达的皮肤成纤维细胞,图中显示比例尺为300μm,缩写含义(下同):msn为中型棘突神经元。
102.步骤s14、直接诱导转分化:皮肤成纤维细胞感染48小时后,把培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁小心加入含有促进转分化的小分子化合物与生长因子的特定诱导分化培养液,然后间隔1-2天更换一半培养液。其中诱导分化培养液的组成为:在含有质量分数为0.5%b27,2%n2的dmem/f12/神经基础培养基(质量比为1:1:1)基础液中,向基础液中加入10μm fsk,2.5μm ra,5μm sb431542小分子的组合,以及10ng/ml bfgf2和gdnf两种生长因子组合。
103.如图3所示为幼儿及成年人皮肤成纤维细胞感染病毒并在诱导分化培养液中培养3天期间的细胞形态变化示意图。感染了选定基因组合的gfp阳性的皮肤成纤维细胞在特定的诱导分化培养液中逐渐发生形态变化,在诱导后第1天一些gfp阳性细胞胞体开始缩小、隆圆,诱导后第二天大部分gfp阳性细胞胞体都明显变化,第3天部分细胞已经开始长出神经突起(如红色箭头所示),形成明显的神经元形态,转化效率达90%。白色箭头显示少数未感染病毒或gfp弱表达的未能转化的皮肤成纤维细胞,图中显示比例尺为300μm。
104.步骤s15、中型棘突神经元分离纯化:10天左右即可看到大量转化的中型棘突神经元,在荧光显微镜下观察更为清晰。转分化后细胞经过胰蛋白酶消化并重悬成单细胞悬浮液,用20μm细胞滤器分离得到高纯度中型棘突神经元。将部分纯化后的中型棘突神经元接种在预先包被好的培养皿中用中型棘突神经细胞培养液继续培养以供鉴定。
105.如图4所示为诱导生成的人中型棘突神经元经分离纯化以后的示意图。在感染病毒后第10-14天期间,大部分gfp阳性细胞完全转化为神经元,未转化的皮肤细胞经过分离去除后,中型棘突神经元的纯度达到95%,图中显示比例尺为300μm。
106.步骤s16、冻存及运输:按照常规细胞冻存方法操作,将中型棘突神经元按每管50万个细胞冻存于适于神经细胞的专用冻存液备储存、运输。
107.4、表征
108.中型棘突神经元的分子表达特征鉴定:采用免疫荧光染色法和共聚焦显微镜,分析中型棘突神经元有无表达一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。
109.如图5所示为诱导生成的人中型棘突神经元表达一般神经元特征蛋白质tuj1的示意图,其中99%以上gfp阳性的细胞同时特异性地表达一般神经元特征蛋白质tuj1,图中显示比例尺为150μm。
110.如图6所示为诱导生成的人中型棘突神经元表达一般神经元特征蛋白质map2的示意图,其中99%以上gfp阳性的细胞同时特异性地表达一般神经元特征蛋白质map2,图中显示比例尺为20μm。
111.如图7所示为诱导生成的人中型棘突神经元表达神经元突触蛋白syn1的示意图,gfp阳性细胞为转化生成的人中型棘突神经元,其明显表达了神经突触蛋白syn1。gfp阴性、hst阳性(如白色箭头所示)的细胞中syn1染色为阴性,表明抗体特异性强,图中显示比例尺为20μm。
112.如图8所示为诱导生成的人中型棘突神经元表达特征性转录因子foxp1及ctip2的示意图,gfp阳性细胞为转化生成的人中型棘突神经元,其中:a)转化生成的人中型棘突神经元表达特征性转录因子foxp1;b)转化生成的人中型棘突神经元表达特征性转录因子ctip2,gfp弱或阴性、hst阳性(如白色箭头所示)的细胞中foxp1或ctip2染色为阴性,表明抗体特异性强,图中显示比例尺为20μm。
113.如图9所示为诱导生成的人中型棘突神经元产生特征性神经递质gaba的示意图,gfp阳性细胞为转化生成的人中型棘突神经元,其可特异性产生msn特征性神经递质gaba。gfp阴性、hst阳性(如白色箭头所示)的细胞中gaba染色为阴性,表明抗体特异性强。图中显示比例尺为20μm。
114.如图10所示为诱导生成的人中型棘突神经元表达特征性蛋白质darpp32及dir的示意图,gfp阳性细胞为转化生成的人中型棘突神经元,其中:a)转化生成的人中型棘突神经元表达msn特征性蛋白质darpp32;b)转化生成的人中型棘突神经元表达msn特征性蛋白质dir,gfp弱或阴性、hst阳性(如白色箭头所示)的细胞中darpp32或dir染色为阴性,表明抗体特异性强。图中显示比例尺为20μm。
115.如图11所示为诱导生成的幼儿及成人中型棘突神经元中β-半乳糖苷酶(β-gal)的染色示意图,成年皮肤细胞转化制备的中型棘突神经细胞中衰老标记物β-gal染色阳性细胞更多,且各个阳性细胞染色密度显著增强,图中显示比例尺为50μm。
116.5、中型棘突神经元的应用
117.以新药筛选为例,先将若干96孔培养板按上述方法预包被过夜,取出一管冻存细胞,在水浴中小心快速解冻复苏,按适当密度接种后,把预先准备好的待筛选化合物加入预
先设计好的各孔中(应含溶剂对照、阳性对照等),轻轻混匀后,放回细胞培养箱中,培养适当时间后,按照适宜的方法进行定性、定量分析,确定有效化合物。最优活性化合物可以进一步采用中型棘突神经元来研究其作用机制、明确主要作用靶点、优化结构以改善成药性、并利用作用靶点开发潜在的基因疗法等。
118.实施例2
119.1、材料、仪器设备与试剂
120.人肺成纤维细胞mrc-5(ccl-171)购自美国atcc公司,本实施例制备中型棘突神经元过程中使用的其它材料、仪器设备与试剂同实施例1。
121.2、制备方法
122.一种从非神经元细胞转化制备中型棘突神经元的方法,非神经元细胞为人肺成纤维细胞,因此实施例2提供一种从肺成纤维细胞转化制备中型棘突神经元的方法,该方法包括如下步骤:
123.步骤s21、构建质粒:将ascl1、dlx1、dlx2、lhx6、ctip2、sox4基因分别构建入逆转录病毒载体中,载体中调控基因表达水平的启动子为cag及cmv,同时通过ires序列引入绿色荧光报告基因,以便于确定病毒包装质量和滴度,观察细胞形态的变化,测定细胞纯度及用于后续各种具体应用。
124.步骤s22、病毒包装:将携有上述基因的各质粒与cmv-gp及cmv-vsv-g按摩尔比1:1:1与转染试剂pei混合,加入24小时前预种的293t细胞中转染过夜,然后更换新鲜培养液,24小时后收集含有病毒的上清液并加入新鲜培养液,再24小时后重复收集一次含有病毒的上清液,合并两次收集的含有病毒的上清液后用0.45μm的过滤器过滤以除去死细胞及其碎片,过滤后向滤液中加入聚凝胺至聚凝胺浓度为12μg/ml,取少量含有聚凝胺的滤液测定病毒滴度,其余储存于4℃冰箱备用。在293t细胞中质粒转染42小时后,几乎所有细胞均表达较高水平的绿色荧光报告基因,随机选择5个20x视野,分别统计各视野中的总细胞数以及gfp阳性细胞数,计算各视野gfp阳性细胞比例,然后取5个视野的平均值而获得,经过计算转染效率达到80%。
125.步骤s23、肺成纤维细胞培养及感染:先将层粘连蛋白,纤维粘连蛋白,基质凝胶混合,然后预包被培养皿过夜。肺成纤维细胞按接种密度为2.5
×
104个/cm2预种于培养皿中过夜,在肺成纤维细胞培养液中加入携带有基因的病毒,混匀后在培养箱中继续培养过夜,把含病毒的培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁迅速小心加入新鲜的肺成纤维细胞培养液。
126.步骤s24、直接诱导转分化:肺成纤维细胞感染48小时后,把培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁小心加入含有促进转分化的小分子化合物与生长因子的特定诱导分化培养液,然后间隔1天更换一半培养液。其中诱导分化培养液的组成为:在含有质量分数为2%b27,1%n2的dmem/f12/神经基础培养基(质量比为2:2:1)基础液中,向基础液中加入1μm fsk,1μm ra,1μm ldn,10μm sb431542小分子的组合,以及20ng/ml gdnf,nt3,bdnf三种生长因子组合。感染了选定基因组合的gfp阳性的皮肤成纤维细胞在特定的诱导分化培养液中逐渐发生形态变化,在诱导后第1天一些gfp阳性细胞胞体开始缩小、隆圆,诱导后第二天大部分gfp阳性细胞胞体都明显变化,第3天部分细胞已经开始长出神经突起,形成明显的神经元形态,转化效率达90%。
127.步骤s25、中型棘突神经元分离纯化:10天左右即可看到大量转化的中型棘突神经元,在荧光显微镜下观察更为清晰。转分化后细胞经过胰蛋白酶消化并重悬成单细胞悬浮液,用流式细胞仪分离得到高纯度中型棘突神经元。将部分纯化后的中型棘突神经元接种在预先包被好的培养皿中用中型棘突神经细胞培养液继续培养以供鉴定。在感染病毒后第10-14天期间,大部分gfp阳性细胞完全转化为神经元,未转化的皮肤细胞经过分离去除后,中型棘突神经元的纯度达到95%。
128.步骤s26、冻存及运输:按照常规细胞冻存方法操作,将中型棘突神经元按每管100万个细胞冻存于适于神经细胞的专用冻存液备储存、运输。
129.3、表征
130.中型棘突神经元的分子表达特征鉴定:采用免疫荧光染色法和共聚焦显微镜,分析中型棘突神经元有无表达一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。分析结果表明,采用实施例2从肺成纤维细胞转化制备中型棘突神经元的方法,中型棘突神经元表达了一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。
131.4、中型棘突神经元的应用
132.以新药筛选为例,先将若干96孔培养板按上述方法预包被过夜,取出一管冻存细胞,在水浴中小心快速解冻复苏,按适当密度接种后,把预先准备好的待筛选化合物加入预先设计好的各孔中(应含溶剂对照、阳性对照等),轻轻混匀后,放回细胞培养箱中,培养适当时间后,按照适宜的方法进行定性、定量分析,确定有效化合物。最优活性化合物可以进一步采用中型棘突神经元来研究其作用机制、明确主要作用靶点、优化结构以改善成药性、并利用作用靶点开发潜在的基因疗法等。
133.实施例3
134.1、材料、仪器设备与试剂
135.人包皮成纤维细胞crl-2522购自美国atcc公司,本实施例制备中型棘突神经元过程中使用的材料、仪器设备与试剂同实施例1。
136.2、制备方法
137.一种从非神经元细胞转化制备中型棘突神经元的方法,非神经元细胞为人包皮成纤维细胞,因此实施例3提供一种从包皮成纤维细胞转化制备中型棘突神经元的方法,该方法包括如下步骤:
138.步骤s31、构建质粒:将ascl1、dlx1、dlx2、lhx6、ctip2、sox11基因分别构建入慢病毒载体中,载体中调控基因表达水平的启动子为cmv、ef1α以及pgk,同时通过不同来源的t2a序列引入绿色荧光报告基因,以便于确定病毒包装质量和滴度,观察细胞形态的变化,测定细胞纯度及用于后续各种具体应用。
139.步骤s32、病毒包装:将携有上述基因的各质粒与pmdl、prev及pvsv-g按摩尔比1:1:1:1与转染试剂脂质体2000(lipofectamine2000)混合,加入24小时前预种的293t细胞中转染过夜,然后更换新鲜培养液,24小时后收集含有病毒的上清液并加入新鲜培养液,再24小时后重复收集一次含有病毒的上清液,合并两次收集的含有病毒的上清液后用0.45μm的过滤器过滤以除去死细胞及其碎片,过滤后向滤液中加入聚凝胺至聚凝胺浓度为12μg/ml,取少量含有聚凝胺的滤液测定病毒滴度,其余储存于4℃冰箱备用。在293t细胞中质粒转染
42小时后,几乎所有细胞均表达较高水平的绿色荧光报告基因,随机选择5个20x视野,分别统计各视野中的总细胞数以及gfp阳性细胞数,计算各视野gfp阳性细胞比例,然后取5个视野的平均值而获得,经过计算转染效率达到85%。
140.步骤s33、包皮成纤维细胞培养及感染:先将层粘连蛋白和纤维粘连蛋白混合,然后预包被培养皿过夜。包皮成纤维细胞按接种密度为8.0
×
103个/cm2预种于培养皿中过夜,在包皮成纤维细胞培养液中加入携带有基因的病毒,混匀后在培养箱中继续培养过夜,把含病毒的培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁迅速小心加入新鲜的包皮成纤维细胞培养液。
141.步骤s34、直接诱导转分化:包皮成纤维细胞感染48小时后,把培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁小心加入含有促进转分化的小分子化合物与生长因子的特定诱导分化培养液,然后间隔1天更换一半培养液。其中诱导分化培养液的组成为:在含有质量分数为2%b27,1%n2的dmem/f12/神经基础培养基(质量比为1:1:1)基础液中,向基础液中加入1μm fsk,1μm ra,1μm ldn,10μm sb431542小分子的组合,以及20ng/ml bfgf2,gdnf,nt3,bdnf四种生长因子组合。感染了选定基因组合的gfp阳性的皮肤成纤维细胞在特定的诱导分化培养液中逐渐发生形态变化,在诱导后第1天一些gfp阳性细胞胞体开始缩小、隆圆,诱导后第二天大部分gfp阳性细胞胞体都明显变化,第3天部分细胞已经开始长出神经突起,形成明显的神经元形态,转化效率达90%。
142.步骤s35、中型棘突神经元分离纯化:10天左右即可看到大量转化的中型棘突神经元,在荧光显微镜下观察更为清晰。转分化后细胞经过胰蛋白酶消化并重悬成单细胞悬浮液,用20μm细胞滤器分离得到高纯度中型棘突神经元。将部分纯化后的中型棘突神经元接种在预先包被好的培养皿中用中型棘突神经细胞培养液继续培养以供鉴定。在感染病毒后第10-14天期间,大部分gfp阳性细胞完全转化为神经元,未转化的皮肤细胞经过分离去除后,中型棘突神经元的纯度达到96%。
143.步骤s36、冻存及运输:按照常规细胞冻存方法操作,将中型棘突神经元按每管50万个细胞冻存于适于神经细胞的专用冻存液备储存、运输。
144.3、表征
145.中型棘突神经元的分子表达特征鉴定:采用免疫荧光染色法和共聚焦显微镜,分析中型棘突神经元有无表达一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。分析结果表明,采用实施例3从包皮成纤维细胞转化制备中型棘突神经元的方法,中型棘突神经元表达了一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。
146.4、中型棘突神经元的应用
147.以新药筛选为例,先将若干96孔培养板按上述方法预包被过夜,取出一管冻存细胞,在水浴中小心快速解冻复苏,按适当密度接种后,把预先准备好的待筛选化合物加入预先设计好的各孔中(应含溶剂对照、阳性对照等),轻轻混匀后,放回细胞培养箱中,培养适当时间后,按照适宜的方法进行定性、定量分析,确定有效化合物。最优活性化合物可以进一步采用中型棘突神经元来研究其作用机制、明确主要作用靶点、优化结构以改善成药性、并利用作用靶点开发潜在的基因疗法等。
148.实施例4
149.1、材料、仪器设备与试剂
150.本实施例制备中型棘突神经元过程中使用的材料、仪器设备与试剂同实施例1。
151.2、制备方法
152.本实施例的原材料细胞为人皮肤成纤维细胞,因此实施例1提供一种从人皮肤成纤维细胞制备中型棘突神经元的方法,该方法包括:
153.步骤s41、构建质粒:将ngn2、ascl1、dlx1、dlx2、lhx6、ctip2、sox11、sox4基因分别构建入慢病毒载体中,载体中调控基因表达水平的启动子为cmv及tre3g,同时通过ires序列引入绿色荧光报告基因,以便于确定病毒包装质量和滴度,观察细胞形态的变化,测定细胞纯度及用于后续各种具体应用。
154.步骤s42、病毒包装:将携有上述基因的各质粒与pmdl、prev及pvsv-g按摩尔比1:1:1:1与转染试剂磷酸钙混合,加入24小时前预种的293t细胞中转染过夜,然后更换新鲜培养液,24小时后收集含有病毒的上清液并加入新鲜培养液,再24小时后重复收集一次含有病毒的上清液,合并两次收集的含有病毒的上清液后用0.45μm的过滤器过滤以除去死细胞及其碎片,过滤后向滤液中加入聚凝胺至聚凝胺浓度为2μg/ml,取少量含有聚凝胺的滤液测定病毒滴度,其余储存于4℃冰箱备用。在293t细胞中质粒转染42小时后,几乎所有细胞均表达较高水平的绿色荧光报告基因,随机选择5个20x视野,分别统计各视野中的总细胞数以及gfp阳性细胞数,计算各视野gfp阳性细胞比例,然后取5个视野的平均值而获得,经过计算转染效率达到82%。
155.步骤s43、皮肤成纤维细胞培养及感染:先将层粘连蛋白,明胶,纤维粘连蛋白,基质凝胶混合,然后预包被培养皿过夜。皮肤成纤维细胞按接种密度为2
×
104个/cm2预种于培养皿中过夜,在皮肤成纤维细胞培养液中加入携带有基因的病毒,混匀后在培养箱中继续培养过夜,把含病毒的培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁迅速小心加入新鲜的皮肤成纤维细胞培养液。
156.步骤s44、直接诱导转分化:皮肤成纤维细胞感染48小时后,把培养液直接吸入含有消毒液的废液瓶,在细胞培养皿中沿壁小心加入含有促进转分化的小分子化合物与生长因子的特定诱导分化培养液,然后间隔1-2天更换一半培养液。其中诱导分化培养液的组成为:在含有质量分数为2%b27,1.5%n2的dmem/f12/神经基础培养基(质量比为1:1:1)基础液中,向基础液中加入20μm fsk,2.5μm ra,0.5μmldn,1μm sb431542,5μm chir99021小分子的组合,以及5ng/ml bfgf2生长因子组合。感染了选定基因组合的gfp阳性的皮肤成纤维细胞在特定的诱导分化培养液中逐渐发生形态变化,在诱导后第1天一些gfp阳性细胞胞体开始缩小、隆圆,诱导后第二天大部分gfp阳性细胞胞体都明显变化,第3天部分细胞已经开始长出神经突起(如红色箭头所示),形成明显的神经元形态,转化效率达90%。
157.步骤s45、中型棘突神经元分离纯化:10天左右即可看到大量转化的中型棘突神经元,在荧光显微镜下观察更为清晰。转分化后细胞经过胰蛋白酶消化并重悬成单细胞悬浮液,用20μm细胞滤器分离得到高纯度中型棘突神经元。将部分纯化后的中型棘突神经元接种在预先包被好的培养皿中用中型棘突神经细胞培养液继续培养以供鉴定。在感染病毒后第10-14天期间,大部分gfp阳性细胞完全转化为神经元,未转化的皮肤细胞经过分离去除后,中型棘突神经元的纯度达到95%。
158.步骤s46、冻存及运输:按照常规细胞冻存方法操作,将中型棘突神经元按每管100
万个细胞冻存于适于神经细胞的专用冻存液备储存、运输。
159.3、表征
160.中型棘突神经元的分子表达特征鉴定:采用免疫荧光染色法和共聚焦显微镜,分析中型棘突神经元有无表达一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。分析结果表明,采用实施例3从皮肤成纤维细胞转化制备中型棘突神经元的方法,中型棘突神经元表达了一般神经元特征蛋白质、突触蛋白质以及中型棘突神经元特征蛋白质等。
161.4、中型棘突神经元的应用
162.以新药筛选为例,先将若干96孔培养板按上述方法预包被过夜,取出一管冻存细胞,在水浴中小心快速解冻复苏,按适当密度接种后,把预先准备好的待筛选化合物加入预先设计好的各孔中(应含溶剂对照、阳性对照等),轻轻混匀后,放回细胞培养箱中,培养适当时间后,按照适宜的方法进行定性、定量分析,确定有效化合物。最优活性化合物可以进一步采用中型棘突神经元来研究其作用机制、明确主要作用靶点、优化结构以改善成药性、并利用作用靶点开发潜在的基因疗法等。
163.以上结合具体实施例描述了本技术的基本原理,但是,需要指出的是,在本技术中提及的优点、优势、效果等仅是示例而非限制,不能认为这些优点、优势、效果等是本技术的各个实施例必须具备的。另外,上述公开的具体细节仅是为了示例的作用和便于理解的作用,而非限制,上述细节并不限制本技术为必须采用上述具体的细节来实现。
164.本技术中诸如“包括”、“包含”、“具有”等等的词语是开放性词汇,指“包括但不限于”,且可与其互换使用。这里所使用的词汇“或”和“和”指词汇“和/或”,且可与其互换使用,除非上下文明确指示不是如此。这里所使用的词汇“诸如”指词组“如但不限于”,且可与其互换使用。
165.还需要指出的是,在本技术的方法中,各步骤是可以分解和/或重新组合的。这些分解和/或重新组合应视为本技术的等效方案。
166.提供所公开的方面的以上描述以使本领域的任何技术人员能够做出或者使用本技术。对这些方面的各种修改对于本领域技术人员而言是非常显而易见的,并且在此定义的一般原理可以应用于其他方面而不脱离本技术的范围。因此,本技术不意图被限制到在此示出的方面,而是按照与在此公开的原理和新颖的特征一致的最宽范围。
167.为了例示和描述的目的已经给出了以上描述。此外,此描述不意图将本技术的实施例限制到在此公开的形式。尽管以上已经讨论了多个示例方面和实施例,但是本领域技术人员将认识到其某些变型、修改、改变、添加和子组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1