一种具有高效合成Wzy型胞外多糖特性的鞘氨醇单胞菌株及其构建方法和应用
一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株及其构建方法和应用
技术领域
1.本发明属于功能微生物技术领域,具体涉及一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株及其构建方法和应用。
背景技术:
2.微生物胞外多糖是由好氧微生物合成的一类由单糖或衍生物经过糖苷键聚合形成的高分子聚合物。微生物多糖种类繁多、性能多样、生产周期短且不受气候和地理环境条件的限制,已经广泛应用于食品、石油、化妆品、地矿、医药、环境保护等二十多个行业几百种用途,是一类与人们生活息息相关的生物技术产品。鞘氨醇单胞菌是一类可合成微生物胞外多糖的菌属,目前已经大量发酵并广泛应用的菌株及其产物鞘氨醇胶主要包括:sphingomonas elodea atcc3161及其产物结冷胶,sphingomonas sp.atcc31555及其产物韦兰胶,sphingomonas sp.atcc53159及其产物迪特胶,sphingomonas sp.atcc31961及其产物鼠李胶等。
3.充足的氧气是有效生产多糖并获得高产率的前提条件。然而,在多糖发酵过程中,随着发酵液粘度的增加,溶氧量迅速降低,并形成微氧环境,极大的限制了菌株的活性和多糖的生产。以广泛应用的鞘氨醇胶韦兰胶的粘性发酵为例,在发酵20h左右时,氧气的摄入率最高,溶氧量降至最低,粘度开始显著增加。随着搅拌速率的增加,氧气摄入率、溶氧量以及发酵液粘度均有所上升,由此说明氧气的含量直接影响了多糖的产量。而供氧是一个高电能能耗过程。因此,构建在低溶氧条件下可维持菌株活性并持续高效合成胞外多糖的工程菌株是降低能耗、实现资源可持续性发展的有效方案。
4.现有技术解决微生物多糖的高耗氧问题主要从发酵工艺和菌株优化两方面进行。一方面,发酵工艺方面,常应用能够增加供氧的叶轮系统和结构合适的反应器,包括搅拌塔反应器、外部循环式反应器、鼓泡柱或气升式反应器等,或者在发酵中后期增加搅拌速率和通气量提高多糖的产量,但是设备能耗显著增加。二方面,在发酵菌株改进方面,将具有携氧能力的透明颤血红蛋白基因vgb转入菌株中,可改变菌株在低溶氧条件的代谢流向,从而有限的增加多糖的产量。因此,这两种工艺的改进并不能从根本上解决菌株合成胞外多糖的高耗氧问题。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株及其构建方法和应用,所述菌株不仅能够在好氧发酵条件下高效生产微生物多糖,而且还能在微氧发酵条件下高效生产微生物多糖。
6.本发明提供了一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌(sphingomonas sp.)菌株,在鞘氨醇单胞菌菌株nxdp的基础上,将wzy聚合酶的c端酪氨酸激酶区域的关键活性位点进行突变获得;
7.所述关键活性位点包括但不限于以下一个或多个区域:walker a区域、walker a'区域、walker b区域和c端tyr簇。
8.优选的,walker a区域的氨基酸序列如seq id no:3所示;
9.walker a'区域的氨基酸序列如seq id no:4所示;
10.walker b区域的氨基酸序列如seq id no:5所示;
11.c端tyr簇的氨基酸序列如seq id no:6所示。
12.优选的,wzy聚合酶的c端酪氨酸激酶区域的氨基酸序列如seq id no:1所示;
13.wzy聚合酶的c端酪氨酸激酶区域的核苷酸序列如seq id no:2所示。
14.优选的,所述突变包括以下一种或几种:点突变、碱基缺失和插入突变。
15.优选的,walker a区域发生点突变的菌株为t4,保藏编号为cgmcc no.22948。
16.本发明提供了一种所述具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株的构建方法,包括以下步骤:
17.1)提取鞘氨醇单胞菌菌株nxdp的基因组dna,使用引物对csu/cxl对wzy聚合酶的c端酪氨酸激酶区域进行pcr扩增,得到pcr产物;
18.2)将所述pcr产物克隆至质粒中,得到重组载体;
19.3)针对wzy聚合酶的c端酪氨酸激酶区域的关键活性位点设计突变用引物,以所述重组载体为模板,以所述突变用引物进行pcr扩增,得到的突变的重组载体转化原核生物表达系统中,得到的重组菌1;
20.4)采用同源重组方法构建wzy聚合酶的c端酪氨酸激酶区域基因敲除载体;
21.5)将所述敲除载体转化原核生物表达系统中,得到的重组菌2和菌株nxdp混合进行接合转移,获得缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc);
22.6)将步骤3)中的重组菌1和缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc)混合进行接合转移,获得鞘氨醇单胞菌株;
23.步骤1)~3)和步骤4)~5)之间没有时间顺序的限制。
24.优选的,引物csu的核苷酸序列如seq id no:7所示;
25.引物cxl的核苷酸序列如seq id no:8所示。
26.本发明提供了所述鞘氨醇单胞菌株在发酵生产微生物多糖中的应用。
27.优选的,所述发酵包括好氧发酵和微氧发酵;
28.所述微氧发酵包括浅盘发酵和/深层静置发酵;
29.优选的,所述微生物多糖的质构特性如下:弹性值为0.9~1.1,内聚性值为0.7~0.88,回复性值为0.35~0.67;
30.所述微生物多糖的转变温度包括凝胶温度和溶胶温度;
31.所述凝胶温度为38~45.0℃;
32.所述溶胶温度为34~40℃。
33.本发明提供的具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌菌株,本发明在鞘氨醇单胞菌菌株nxdp的基础上,将wzy聚合酶的c端酪氨酸激酶区域(wzyc)的关键活性位点(walker a区域、walker a'区域、walker b区域和c端tyr簇)进行突变获得。实验证明,通过缺失全部wzy聚合酶的c端酪氨酸激酶区域导致菌株nxdp失去产多糖的性能,而将wzyc中关键活性位点进行点突变、序列缺失或插入等突变处理后,得到的菌株能够有效改善鞘氨
醇单胞菌合成wzy型胞外多糖特性,使其不仅能够在好氧发酵的条件下高效合成微生物多糖,而且还能够使其在微氧发酵条件下实现高效生产微生物多糖的特性,解决了长期以来生产微生物多糖需在好氧条件下发酵的限制问题,有利于降低能耗,更具有广泛的工业应用价值。
34.同时,本发明提供的鞘氨醇单胞菌菌株,通过基因工程改造wzy聚合酶的c端酪氨酸激酶区域,使生产的微生物多糖,不仅在微氧发酵条件下产量有极大提高,而且在多糖质构特性和构象转变温度方面有进一步改善,实验表明,鞘氨醇单胞菌突变菌株产生生物多糖比来源于亲本菌株nxdp产生的生物多糖具有更好的弹性、回复性及内聚性;同时来源于突变菌株的产物多糖比亲本菌株nxdp产生的生物多糖具有更低的构象转变温度,来源于突变菌株的多糖的凝胶温度和溶胶温度分别为38~45.0℃和34~40℃,而亲本菌株合成的多糖凝胶和溶胶温度为53.5℃和50.0℃。由此说明,来源于突变菌株的生物多糖具有与原始多糖明显不同的流变学特性,未来在食品、医疗、化工、建筑、采油等行业将具有广泛的应用前景。
附图说明
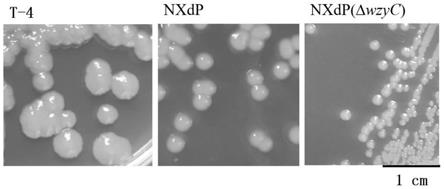
35.图1为鞘氨醇单胞菌菌株t4、nxdp和nxdp(δwzyc)菌株的单菌落形态对比图;
36.图2为鞘氨醇单胞菌菌株t-4(a)和nxdp(b)菌株的的单菌形态对比;其中a图中箭头为分泌至外界培养环境中的胞外多糖,b图中箭头为原始荚膜多糖;
37.图3为以来源于e.coli的etk为模板预测的鞘氨醇单胞菌wzyc关键活性位点;其中wzy-c是wzy聚合酶的c端酪氨酸激酶功能蛋白,etk-e.coli表示e.coli中具有酪氨酸激酶功能的蛋白;
38.图4为鞘氨醇单胞菌菌株t-4的三种微氧培养方式,a,平板浅层培养;b,摇瓶浅层培养;c厌氧瓶深层培养;
39.图5为亲本菌株nxdp浅层发酵状态图;
40.图6为鞘氨醇单胞菌菌株t-4在5l发酵罐中的发酵动力学曲线。
41.生物材料的保藏信息说明
42.鞘氨醇单胞菌(sphingomonas sp.),本发明所述的鞘氨醇单胞菌菌种保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏时间为2021年7月23日。地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,菌株编号为t4,生物保藏编号为cgmcc no.22948。
具体实施方式
43.本发明提供了一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌菌株,在鞘氨醇单胞菌菌株nxdp的基础上,将wzy聚合酶的c端酪氨酸激酶区域(wzyc)的关键活性位点进行突变获得;所述关键活性位点包括以下一个或多个区域:walker a区域、walker a'区域、walker b区域和c端tyr簇(见图3)。
44.在本发明中,walker a区域的氨基酸序列优选如seq id no:3(srpsegkstsatata)所示;walker a'区域的氨基酸序列优选如seq id no:4(allvdad)所示;walker b区域的氨基酸序列优选如seq id no:5(vvvidap)所示;c端tyr簇的氨基酸序列优选如seq id no:6
(gyynynysysy)所示。wzy聚合酶的c端酪氨酸激酶区域的氨基酸序列优选如seq id no:1(enlddairtpddvqrmlnvpalgavpllkagenpfeeisnprsamaeayqsirtalelstahgvprslvftssrpsegkstsatataqnlartgkrallvdadlrlptlhkfldlknnagfvslltgqktvmdvrqptglegfdfissgplppapaellseaslnrflndalahydvvvidappvmgfadapliaaitegtvfvveadvahrgaartairrlvtsranvvgailtkfdapalgyynynysysyeygnranag)所示。wzy聚合酶的c端酪氨酸激酶区域的核苷酸序列优选如seq id no:2(gaaaatctcgacgacgcgatccgcacgcccgacgatgtccagcgcatgctcaacgtgcctgcgctgggcgccgtcccgctgctcaaggccggcgagaacccgttcgaggaaatcagcaacccgcgctcggcgatggcggaagcctatcagtcgatccgcacggcgctggaactctcgaccgcgcacggcgtgccgcgcagcctggtgttcacgtccagccccccgtcggaaggcaagtcgacctcggccaccgccaccgcgcagaacctggcgcggaccggcaagcgcgcgctgctcgtcgatgccgatcttcgtctgccgacgctgcacaagttcctcgacctcaagaacaatgccggcttcgtcagcttgctgaccggccagaagacggtgatggacgtgcgccagccgaccggactggaaggcttcgacttcatctcgtcgggcccgctgccgcctgccccggcggaactgctcagcgaggcgtcgctcaaccgcttcctcaacgatgcgctggcgcattacgacgtggtggtgatcgacgccccgccggtgatgggcttcgccgacgcgccgctgatcgcggcgatcaccgagggcacggtgttcgtggtcgaggccgacgtggcgcaccgtggtgccgcacggaccgcgatccgccgcctggtcaccagccgcgccaatgtggtcggcgccatcctgaccaagttcgacgccccggcgctgggctattacaactacaactacagctacagctacgaatatggaaaccgcgccaacgcgggctga)所示。所述突变优选包括以下一种或几种:点突变、碱基缺失和插入突变。在本发明实施例中,对walker a区域优选分别进行了缺失突变和点突变,对walker a'区域进行缺失突变,对walker b区域进行了缺失突变。其中,walker a区域缺失突变后核苷酸序列为agcaccgccaccgcg,氨基酸序列为stata;walker a区域点突变后核苷酸序列为agcggcccgtcggaaggcaagtcgacctcggccaccgccaccgcg,氨基酸序列为sgpsegkstsatata;walker a'和walker b区域缺失突变后对应功能区域核苷酸序列和氨基酸序列全部缺失。以上述构建的突变菌株为实验对象,分别检测其生产wzy型胞外多糖的情况,结果表明,所述突变菌株在好氧发酵条件下,产量可达21.82
±
0.29g/l,具有与亲本菌株nxdp(21.2
±
0.38g/l)相似的发酵产量,这表明上述基因改造对所述菌株的好氧发酵生产微生物多糖的特性没有任何影响。同时亲本菌株nxdp在微氧发酵条件下,无法合成微生物多糖,而突变菌株在微氧发酵条件能够生产5.3~18.25g/l的多糖,并且发酵容器的底层面积越大,产量越高。对walker a区域进行点突变获得的突变菌株进行生物保藏,保藏编号优选为cgmcc no.22948,菌株编号为t4。
45.本发明提供了一种所述具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株的构建方法,包括以下步骤:
46.1)提取鞘氨醇单胞菌菌株nxdp的基因组dna,使用引物对csu/cxl对wzy聚合酶的c端酪氨酸激酶区域进行pcr扩增,得到pcr产物;
47.2)将所述pcr产物克隆至质粒中,得到重组载体;
48.3)针对wzy聚合酶的c端酪氨酸激酶区域的关键活性位点设计突变用引物,以所述重组载体为模板,以所述突变用引物进行pcr扩增,得到的突变的重组载体转化原核生物表达系统中,得到的重组菌1;
49.4)采用同源重组方法构建wzy聚合酶的c端酪氨酸激酶区域基因敲除载体;
50.5)将所述敲除载体转化原核生物表达系统中,得到的重组菌2和菌株nxdp混合进行接合转移,获得缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc);
51.6)将步骤3)中的重组菌1和缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc)混合进行接合转移,获得鞘氨醇单胞菌株;
52.步骤1)~3)和步骤4)~5)之间没有时间顺序的限制。
53.本发明提取鞘氨醇单胞菌菌株nxdp的基因组dna,使用引物对csu/cxl对wzy聚合酶的c端酪氨酸激酶区域进行pcr扩增,得到pcr产物。
54.本发明对鞘氨醇单胞菌菌株nxdp提取基因组dna的方法没有特殊限制,采用本领域所熟知的提取方法即可,例如dna提取试剂盒完成。所述引物csu的核苷酸序列如seq id no:7(ggatagcgagctctcgcgatgggcgtgaaggt)所示;引物cxl的核苷酸序列如seq id no:8(gatagctctagacgcagcatcggcttcgacgc)所示。
55.得到pcr产物后,本发明将所述pcr产物克隆至质粒中,得到重组载体。
56.本发明对所述克隆的方法没有特殊限制,采用本领域所熟知的克隆方法即可。在本发明实施例中,所述克隆将pcr产物插入plo3质粒中,插入位点包括saci和xbai。
57.得到重组载体后,本发明针对wzy聚合酶的c端酪氨酸激酶区域的关键活性位点设计突变用引物,以所述重组载体为模板,以所述突变用引物进行pcr扩增,得到的突变的重组载体转化原核生物表达系统中,得到的重组菌1。
58.在本发明中,所述突变优选包括以下一种或几种:点突变、碱基缺失和插入突变。在本发明实施例中,对walker a区域优选分别进行了缺失突变和点突变,对walker a'区域进行缺失突变,对walker b区域进行了缺失突变,以上述构建的突变菌株为实验对象,分别检测其生产wzy型胞外多糖的情况。所述walker a区域的缺失突变采用引物as/al完成,walker a区域进行点突变采用das/dal完成,对walker a’区域进行缺失突变采用a’s/a’l完成,各引物具体核苷酸序列见表1。
59.在本发明中,将突变的重组载体转化原核生物表达系统中的方法优选包括氯化钙热激法完成。所述原核生物表达系统以大肠杆菌感受态为例加以说明。
60.本发明采用同源重组方法构建wzy聚合酶的c端酪氨酸激酶区域基因敲除载体。
61.在本发明中,所述同源重组方法包括分别使用引物csu/csl和cxu/cxl引物扩增nxdp基因组的上、下游同源臂,通过重叠pcr将上、下游同源臂连接,连接产物克隆至plo3质粒中,经检测得到所述敲除载体。
62.得到敲除载体后,本发明将所述敲除载体转化原核生物表达系统中,得到的重组菌2和菌株nxdp混合进行接合转移,获得缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc)。
63.本发明对所述接合转移的条件没有特殊限制,采用本领域所熟知的接合转移的条件即可。所述接合转移后,优选使用引物wzyc 1/wzyc 2进行菌落pcr验证,通过与seq id no:1比对,得到预期突变的菌株为缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc)。
64.本发明提供了所述鞘氨醇单胞菌株t4在发酵生产微生物多糖中的应用。
65.在本发明中,所述发酵优选包括好氧发酵和微氧发酵。所述微氧发酵优选包括浅盘发酵和/深层静置发酵。所述浅盘发酵中发酵液的深度优选为0.5~2cm,更优选为1.0cm。所述深层静置发酵中,发酵液的深度优选为3.0~20cm,更优选为5.0cm。所述好氧发酵中空气通气量优选为1~2vvm,搅拌速度优选为500~600rpm。所述发酵用的发酵液优选为葡萄
糖30~50g/l,豆粉0.5~2g/l,k2hpo
4 1~2g/l,mgso
4 0.1~1g/l,nano
3 1~2g/l,ph 7.0,更优选为葡萄糖40g/l,豆粉1.2g/l,k2hpo
4 1.5g/l,mgso
4 0.5g/l,nano
3 1.5g/l,ph 7.0。所述发酵时,菌株的接种量优选为5%~10%,更优选为8%。所述发酵的温度优选为28~32℃,更优选为30℃。所述发酵的时间优选为68~84h,更优选为72h。
66.在本发明中,发酵结束后,从发酵液中提取微生物多糖。所述提取方法优选为用稀盐酸调节ph至3.0得到絮状沉淀,沉淀经naoh调节至ph中性,烘干后粉碎,称重,获得产物多糖。
67.在本发明中,将提取的微生物采用tpa方法测定生物多糖凝胶的内聚性、弹性和恢复性。在本发明实施例中,采用英国sms公司的ta.xt plus质构仪进行测定,数据采集频率为200pps;p/0.5的12.7厘米的柱形探头;tpa测试的程序为:测试前速度:2.00mm/sec;测试速度:1.00mm/sec;测试后速度:1.00mm/sec;目标模式:压缩;压缩率:50%;两次压缩时间间隔:1.00sec;触发类型:自动(力);触发力:5.00g;每项测试重复5次,室温下测定。所述1.0%微生物多糖凝胶的质构特性优选如下:其弹性值为0.9~1.1,内聚性值为0.7~0.88,回复性值为0.35~0.67;相比原始菌株nxdp产物多糖,其弹性增加了11.9%,内聚性提高了86.3%,回复性提高了119.1%。结果表明,鞘氨醇单胞菌菌株产生生物多糖具有比来源于nxdp产物多糖更好的弹性、回复性及内聚性。
68.在本发明中,将提取的微生物采用ta流变仪测定构象转变温度。所述微生物多糖的转变温度优选包括凝胶温度和溶胶温度。ta流变仪的温度扫描条件为:25℃,1hz,升/降温速度为3℃/min。所述凝胶温度优选为38~45℃,更优选为42.0℃。所述溶胶温度优选为34~40℃,更优选为38.5℃,而原始多糖凝胶温度为53.5℃和50.0℃。由此说明,新型多糖具有与原始多糖明显不同的流变学特性,未来在食品、医疗、化工、建筑、采油等行业将具有广泛的应用前景。
69.下面结合实施例对本发明提供的一种具有高效合成wzy型胞外多糖特性的鞘氨醇单胞菌株及其构建方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
70.本发明所涉及的原料、试剂均为常规商品途径购买。
71.本发明所涉及的引物具体信息见表1。
72.表1 引物及序列
73.[0074][0075]
实施例1
[0076]
wzy聚合酶的c端酪氨酸激酶区域(wzyc)基因敲除载体的构建
[0077]
靶基因通过双交换同源重组而失活。使用提取试剂盒提取菌株nxdp的基因组,靶基因的上下游同源臂以nxdp基因组为模板,分别使用引物csu/csl和cxu/cxl(引物序列见表1)及primestar dna聚合酶(takara bio,tokyo,japan)扩增。其中,pcr反应体系为:引物csu/csl或cxu/cxl各0.4μl;primestar dna聚合酶12.5μl;基因组模板1μl;水补足25μl。通过overlap pcr将上下游同源臂连接,overlap pcr反应体系为:引物csu/csl扩增得上游同源臂/引物cxu/cxl扩增得下游同源臂各0.5μl;引物csu/cxl各0.3μl;primestar dna聚合酶12.5μl;水补足25μl。pcr反应程序为:98℃15s,55℃,15s,72℃10s/kb,循环35次,16℃保存。
[0078]
将pcr扩增产物通过电泳检测,并将目的基因条带通过胶回收试剂盒进行纯化回收,获得重组片段。
[0079]
将重组片段及plo3质粒同时使用限制性酶saci和xbai进行酶切,酶切体系为:质粒或重组片段10μl,限制性内切酶saci和xbai各1μl,内切酶buffer 2μl,水补足20μl;酶切
反应条件为37℃,酶切30~120min。酶切后片段使用tianquick midi purification kit试剂盒(天根)进行pcr纯化回收,将两者的回收产物用t4 dna连接酶于16℃过夜连接,连接体系为:质粒1μl,重组片段2μl,t4 dna连接酶1μl,buffer 1μl,水补足10μl。得到重组质粒plo3-δwzyc,并将重组质粒转入e.coli s17感受态细胞中进行重组质粒的扩增,挑取测序正确的单菌落进行甘油保存。
[0080]
实施例2
[0081]
被修饰的wzyc基因敲入载体构建
[0082]
靶基因通过双交换同源重组而敲入。使用提取试剂盒提取菌株nxdp的基因组,靶基因的上下游同源臂以nxdp基因组为模板,分别使用引物csu/cxl(引物序列如表1)及primestar dna聚合酶(takara bio,tokyo,japan)扩增。产物通过电泳检测,并将目的基因条带通过胶回收试剂盒(天根)进行纯化回收,获得目的片段。将目的片段及plo3质粒同时使用限制性酶saci和xbai进行酶切,酶切后片段使用试剂盒进行pcr纯化回收,将两者的回收产物用t4 dna连接酶于16℃过夜连接,得到质粒plo3-wzyc,并将质粒转入e.coli s17感受态细胞中进行重组质粒的扩增,挑取测序正确的单菌落进行甘油保存。具体条件如下。pcr反应体系为:引物各0.4μl;primestar dna聚合酶12.5μl;基因组模板1μl;水补足25μl。pcr反应程序为:98℃15s,55℃,15s,72℃10s/kb,循环35次,16℃保存。酶切体系为:质粒或重组片段10μl,限制性内切酶saci和xbai各1μl,内切酶buffer 2μl,水补足20μl。连接酶体系为:质粒1μl,重组片段2μl,t4 dna连接酶1μl,buffer 1μl,水补足10μl。酶切反应条件为37℃,酶切60min。
[0083]
以来源于e.coli的etk氨基酸序列为模板预测wzyc的功能区,确定酪氨酸激酶wzyc的关键活性位点为:walker a、walker a'、walker b和c端tyr簇的氨基酸区域(图3)。利用定点突变pcr方法对其walker a、walker a'和walker b区域进行修饰(包括定点突变或者碱基缺失)。以质粒plo3-wzyc为模板,分别使用引物as/al(walker a区域缺失为例)、das/dal(walker a区域点突变为例)、a’s/a’l(walker a'区域缺失为例)和bs/bl(walker b区域缺失为例),以primestar dna聚合酶(takarabio,tokyo,japan)扩增。并将目的基因条带通过胶回收试剂盒进行纯化回收,获得目的片段。dpnⅰ内切酶消化后转入e.coli s17感受态细胞中,挑取测序正确的单菌落进行甘油保存。从而获得基因敲入质粒plo3-wzyc-a、plo3-wzyc-da、plo3-wzyc-a’、plo3-wzyc-b。
[0084]
实施例3
[0085]
wzyc缺失工程菌株nxdp(δwzyc)的构建方法
[0086]
在平板培养基挑nxdp单菌落接种至含cmr的5ml种子培养基,30℃恒温摇床中200rpm培养24h,挑取实施例1构建e.coli s17/plo3-δwzyc的单菌落至含有tetr的lb液体培养基中,于37℃恒温摇床中200rpm培养8h,两株菌各取5ml 6000rpm离心5min收集菌体,用10mmol/l的mgso4溶液洗涤两次,离心,再用mgso4溶液重悬菌体,将nxdp和e.coli s17混匀后置于0.22μm的滤膜上,在无抗性平板上培养12h进行接合转移。用mgso4溶液洗涤滤膜上的菌体,梯度稀释后涂布于含有25μg/ml cm和25μg/mltet双抗平板上,于30℃恒温培养箱中培养72h。在双抗平板上挑取单菌落至5ml含双抗的种子液体培养基中,30℃恒温摇床中200rpm培养36h。将单交换重组子接种于无抗性的5ml种子培养基中,30℃恒温摇床中200rpm培养24h,传代两次,然后将其涂布至10%蔗糖平板上于30℃恒温培养箱中培养72h。
挑取单菌落至5ml试管中,在30℃、200rpm培养24h,使用引物wzyc 1/wzyc 2进行菌落pcr验证,获得无痕缺失wzy蛋白c端酪氨酸激酶区域的工程菌株nxdp(δwzyc)。其菌株表现为不产多糖表型,单菌落形态如图1所示。
[0087]
实施例4
[0088]
酪氨酸激酶功能缺陷型工程菌株的构建方法
[0089]
在平板培养基挑nxdp(δwzyc)单菌落接种至含cmr的5ml种子培养基,30℃恒温摇床中200rpm培养24h,分别挑取e.coli s17/plo3-wzyc-a、e.coli s17/plo3-wzyc-da、plo3-wzyc-a’、plo3-wzyc-b的单菌落至含有tetr的lb液体培养基中,于37℃恒温摇床中200rpm培养8h,两株菌各取5ml 6000rpm离心5min收集菌体,用10mmol/l的mgso4溶液洗涤两次,离心,再用mgso4溶液重悬菌体,将nxdp和e.coli s17按照2:1的比例混匀后置于0.22μm的滤膜上,在无抗性平板上培养12h进行接合转移。用mgso4溶液洗涤滤膜上的菌体,梯度稀释后涂布于含有cmr和tetr的双抗平板上,于30℃恒温培养箱中培养72h。在双抗平板上挑取单菌落至5ml含双抗的种子液体培养基中,30℃恒温摇床中200rpm培养36h。将单交换重组子接种于无抗性的5ml种子培养基中,30℃恒温摇床中200rpm培养24h,传代两次,然后将其涂布至10%蔗糖平板上于30℃恒温培养箱中培养72h。挑取单菌落至5ml试管中,30℃,200rpm培养24h,使用引物wzyc1/wzyc2(序列见表1)进行菌落pcr验证,获得酪氨酸激酶功能缺陷型工程菌株nxdp(wzyc-a)、nxdp(wzyc-da)、nxdp(wzyc-a')、nxdp(wzyc-b),其中nxdp(wzyc-a)中walker a区域缺失突变后核苷酸序列为agcaccgccaccgcg(seq id no:21),氨基酸序列为stata(seq id no:22)。nxdp(wzyc-da)菌株中walker a区域点突变后核苷酸序列为agcggcccgtcggaaggcaagtcgacctcggccaccgccaccgcg(seq id no:23),氨基酸序列为sgpsegkstsatata(seq id no:24),其余两株突变株相应的突变位点序列被完全敲除,是没有对应功能区。四株菌具有较为相似的单菌落表型和单菌形态,其中nxdp(wzyc-da)命名为t-4。以t-4为例,其菌株表现为回复多糖表型,单菌落形态如图1所示,单菌形态如图2所示。
[0090]
实施例5
[0091]
鞘氨醇单胞菌的单细胞形态
[0092]
将实施例4构建的4株突变菌株从-80℃冰箱中取甘油管,分别划线至tpg固体培养基(tpg固体培养基为:葡萄糖10g/l,蛋白胨5g/l,酵母粉5g/l,nacl 3g/l,琼脂粉15g/l)中,30℃静置培养72h。
[0093]
4株菌(nxdp(wzyc-a)、nxdp(wzyc-da)(即t-4菌株)、nxdp(wzyc-a’)、nxdp(wzyc-b)具有相同的单菌落形态,菌落比缺失型菌株nxdp(δwzyc)更大、质地粘稠、乳白色,相比原始型菌株nxdp,菌落更大、表面较粗糙。以t-4菌株为例,其单菌形态如图1所示。
[0094]
经投射电镜观察,与nxdp产生多糖为荚膜多糖相比,4株突变菌株产生多糖均可分泌至胞外环境中,且具有相同的单菌形态。以t-4菌株为例,其单菌表型如图2所示。将t4进行保藏,保藏编号为:cgmcc no.22948。
[0095]
实施例6
[0096]
鞘氨醇单胞菌(sphingomonas sp.)突变菌株生产微生物多糖的发酵方法。
[0097]
(1)将上述构建的4株鞘氨醇单胞菌突变单菌落以及亲本菌株nxdp单菌落分别接种至5ml的tpg液体培养基中,30℃振荡培养24小时;
[0098]
(2)将步骤(1)制得的培养液以1%的接种量接种至100或300ml的种子培养基中,30℃振荡培养24小时;
[0099]
(3)以10%的接种量将步骤(2)制得的种子液接种至发酵培养基中,分别进行好氧发酵和微氧发酵,具体如下:
[0100]
好氧发酵:在含3l培养基的5l发酵罐中,于30℃培养72小时,通气量为1vvm,搅拌速度为500rpm;
[0101]
微氧发酵:将已转接种子的发酵液转移至无菌容器中于30℃静置培养7天。
[0102]
其中,无菌容器可指90mm直径的无菌培养皿、250ml的摇瓶或250ml的厌氧瓶(如图4所示)。
[0103]
tpg液体培养基:葡萄糖10g/l,蛋白胨5g/l,酵母粉3g/l,牛肉浸粉3g/l;
[0104]
种子培养基:蔗糖10g/l,蛋白胨2.5g/l,酵母粉1.5g/l,k2hpo
4 2.5g/l,mgso
4 0.1g/l,ph 7.0;
[0105]
发酵培养基:葡萄糖35g/l,豆粉0.5g/l,k2hpo
4 1.0g/l,mgso
4 0.4g/l,nano
3 1.2g/l,ph 7.0。
[0106]
根据以上不同的微氧培养容器,进行发酵。将发酵液ph调节至3.0左右得到絮状沉淀,沉淀经naoh调节至ph中性,烘干后粉碎,称重,可获得不同的微生物多糖产量。
[0107]
四株工程菌株具有相似的浅盘发酵产量,不同培养条件的产量如表2所示。以t-4菌株为例,以90mm直径的无菌培养皿浅层培养4株工程菌株合成多糖的产量为18.25
±
1.06g/l(图4中a),以250ml的摇瓶浅层静置培养可获得16.33
±
1.21g/l多糖(图4中b),而以250ml的厌氧瓶深层静置培养可获得5.3
±
0.56g/l的微生物多糖(图4中c)。而亲本菌株nxdp在上述微氧条件下培养并无明显的胞外多糖产生,如图5所示。
[0108]
经5l发酵罐好氧培养,四株工程菌株具有相似的发酵产量,产量如表2所示。以t-4菌株为例,其动力学曲线如图6所示,产量可达21.82
±
0.29g/l,具有与亲本菌株nxdp(21.2
±
0.38g/l)相似的发酵产量。
[0109]
表2 四株工程菌株及原始菌株nxdp在不同培养条件下的产量
[0110][0111]
实施例7
[0112]
微生物多糖的提取
[0113]
将实施例6得到的发酵液用稀盐酸调节ph至3.0得到絮状沉淀,沉淀经naoh调节至ph中性,烘干后粉碎,称重,获得微生物多糖。
[0114]
实施例8
[0115]
微生物多糖的质构特性
[0116]
以实施例7提取的4种工程菌株和亲本菌株nxdp合成微生物多糖为原料,以好氧发酵获得多糖为例,分别配制1.0%浓度的溶液,涡旋震荡至充分溶解。在80~100℃之间加热10~30分钟,冷却至室温,待形成凝胶后,用tpa方法测定生物多糖凝胶的内聚性、弹性和恢复性。采用英国sms公司的ta.xt plus质构仪进行测定,数据采集频率为200pps;p/0.5的12.7厘米的柱形探头;tpa测试的程序为:
[0117]
测试前速度:2.00mm/sec;
[0118]
测试速度:1.00mm/sec;
[0119]
测试后速度:1.00mm/sec;
[0120]
目标模式:压缩;
[0121]
压缩率:50%;
[0122]
两次压缩时间间隔:1.00sec;
[0123]
触发类型:自动(力);
[0124]
触发力:5.00g;
[0125]
每项测试重复5次,室温下测定。
[0126]
经过分析四株鞘氨醇单胞菌突变株产生生物多糖相比原始菌株nxdp产物多糖,弹性增加了11.9%,内聚性提高了86.3%,回复性提高了119.1%。其弹性值为0.9~1.1,内聚性值为0.7~0.88,回复性值为0.35~0.67;四株工程菌株产生多糖的质构性能参数如表3所示。
[0127]
表3 四株工程菌株及原始菌株nxdp产生多糖的质构性能
[0128][0129]
实施例9
[0130]
微生物多糖的构象转变温度测定方法
[0131]
微生物多糖的构象转变温度通过ta流变仪测定。溶解0.2g来源于上述4组突变菌株和nxdp的产物多糖至100ml超纯水中,室温搅拌30分钟,溶解后备用。温度扫描条件为:25℃,1hz,升/降温速度为3℃/min。
[0132]
测定结果如表4所示。结果显示,4株工程菌株产生多糖的凝胶温度在38~42℃之间,溶胶温度在34~40℃之间,具有比原始多糖更低的构象转变温度。其中,以t-4菌株为例来,其产生多糖的凝胶温度和溶胶温度分别为42.0℃和38.5℃,而亲本菌株合成的多糖凝胶和溶胶温度为53.5℃和50.0℃。
[0133]
由此说明,上述构建的菌株合成的生物多糖与原始多糖相比具有明显不同的流变学特性,未来在食品、医疗、化工、建筑、采油等行业将具有广泛的应用前景。
[0134]
表4 四株工程菌株及原始菌株nxdp产生多糖的构象转变温度
[0135][0136]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1